Thermoplaste
Werbung

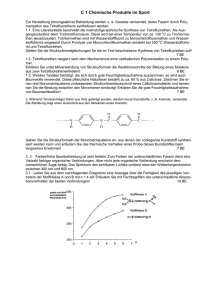
Thermoplaste: Die meisten Kunststoffe, die wir im täglichen Leben benutzen, sind Thermoplaste, ihr wesentliches Merkmal ist, dass sie formbar (= plastisch) sind, je besser, desto mehr man sie erwärmt, allerdings schmelzen sie bei zu großer Hitze, wie z.B. eine Plastikschüssel auf einer heißen Herdplatte. Dieses Verhalten unterscheidet sie wesentlich von den Duroplasten, die beim Erhitzen nicht schmelzen, sondern sich zersetzen. Doch was macht nun einen Thermoplasten aus? Chemisch betrachtet fehlt den Thermoplasten im Gegensatz zu den Duroplasten die Quervernetzung, die einzelnen Molekülketten sind also nicht durch chemische Bindungen, sondern nur durch zwischenmolekulare Kräfte (Van der Waals Kräfte) miteinander verbunden (vgl. hierzu die folgende schematische Darstellung). Wird genug Energie zugeführt, z.B. Wärme, so können sich bei einem unvernetzten Thermoplasten die einzelnen Ketten leicht gegeneinander verschieben, wodurch der Kunststoff leichter verformbar wird und schließlich schmilzt. Auch wenn man Zug auf einen Thermoplasten, z.B. auf eine Plastiktüte, ausübt, gleiten die einzelnen Ketten aneinander entlang, die Plastiktüte wird gedehnt, bis das Plastik irgendwann reißt, wenn die zwischenmolekularen Kräfte nicht mehr ausreichen, um die Plastikfolie zusammenzuhalten. An dem letzten Beispiel mit dem Zug an der (thermoplastischen) Plastiktüte wird auch der Unterschied zwischen einem Thermoplasten und einem Elastomeren deutlich: Ein Thermoplast lässt sich durch Ziehen recht schwer verformen und bleibt, wenn man aufhört zu ziehen im verformten Zustand (probiert es an einem Stück Plastikfolie aus). Ein Elastomer hingegen, z.B. ein Gummiband, lässt sich mit deutlich geringerem Widerstand dehnen und kehrt außerdem beim Loslassen in den Ausgangszustand zurück (wenn man nicht so stark daran gezogen hat, dass es gerissen ist, natürlich). Aber nicht alle Thermoplaste lassen sich so leicht verformen wie eine Plastiktüte, und es gibt auch ziemlich harte Thermoplaste. So bestehen z.B. Computer- und Monitorgehäuse aus Thermoplasten und auch die Plastik-Küchenschüssel, die auf der heißen Herdplatte schmilzt, ist mechanisch nicht so leicht zu verformen. Ob ein Thermoplast bei Raumtemperatur hart oder weich ist, hängt von seiner Glasübergangstemperatur ab: Oberhalb dieser Temperatur ist er weich und verformbar, unterhalb fest und unformbar. Abgesehen davon fügt man manchen Kunststoffen auch Weichmacher zu, die sie - wie der Name sagt - weich und formbar machen. Wichtige Thermoplaste sind: Polyethen (PE) Polypropen (PP) Polystyrol (PS) Polyvinylchlorid (PVC) Polyacrylnitril (PAN) Polyamide (PA) Polyester (PES) Polyacrylate Duroplaste Duroplaste (auch Duromere genannt) sind in mancher Hinsicht das Gegenteil von Thermoplasten: Sie werden beim Erhitzen nicht weich und schmelzen nicht, sondern zersetzen sich, da ihre Schmelztemperatur über der Zersetzungstemperatur liegt. Weiterhin verformen sie sich nicht, wenn man Zug auf sie ausübt, eher brechen sie. Insgesamt sind sie deutlich härter und spröder als Thermoplaste, will man sie bearbeiten, so muss man dies - wie z.B. bei Holz - mechanisch tun, also z.B. durch Sägen, Feilen oder Raspeln (das wird in der Praxis jedoch dadurch vermieden, dass man sie gleich in der gewünschten Form herstellt). Chemisch betrachtet sind Duroplaste stark quervernetzte Kunststoffe, wie in dem folgenden Schema zu sehen ist. Ein Stück Duroplast wie z.B. ein Stück Gießharz (die durchsichtigen Plastikblöcke, in denen Urlaubssouvenirs wie Seepferdchen und Muscheln konserviert werden) ist also im Prinzip ein einziges Riesenmolekül: kein Wunder, dass es nicht schmilzt! Duroplaste entstehen, wenn trifunktionelle Monomere (mit drei reagierenden funktionellen Gruppen) miteinander reagieren, also z.B. Glycerin (Trihydroxypropan) und eine Dicarbonsäure zu einem Polyester oder Glycerin und ein Diisocyanat zu einem Polyurethan. Duroplaste entstehen aber auch, wenn man z.B. unter Verwendung einer ungesättigten Dicarbonsäure (z.B. Malein- oder Fumarsäure = cis- oder trans-Butendisäure) einen ungesättigten Polyester herstellt und diesen anschließend an den ungesättigten Bindungen in einer Polymerisationsreaktion vernetzt. Wichtige Duroplaste: Polyester (PES) Formaldehydharze Epoxidharze Polyurethane Elastomere Das wesentliche Merkmal von Elastomeren ist, dass sie sich auf mindestens das Doppelte ihrer Länge dehnen lassen und beim Loslassen in ihren Ausgangszustand zurückkehren (Fachwort dafür: Gummielastizität). Doch wieso funktioniert das? Diese Frage lässt sich mit dem Wirken der Entropie beantworten. Die Entropie ist (vereinfacht gesagt) ein Maß für die Unordnung. Alle Dinge streben nach Entropiezunahme, also nach mehr Unordnung, so verteilen sich z.B. Gasmoleküle gleichmäßig in einem Raum, obwohl sie sich eigentlich auch "ordentlich" in einer Ecke sammeln könnten. Für Makromoleküle wie z.B. Kunststoffe bedeutet das, dass sie am liebsten in einem ungeordneten, verknäulten Zustand vorliegen, weil das, was die Entropie angeht, besonders günstig ist: Wenn man nun an dem Elastomer zieht, werden die Molekülketten gezwungen, ihren entropiereichen Zustand aufzugeben, sie müssen sich in Richtung des Zuges anordnen, wodurch die Entropie abnimmt. Zieht man lange genug, können sich unter Umständen sogar Kristalle bilden, was einen sehr geordneten, entropiearmen Zustand darstellt. Beim Loslassen haben die Molekülketten wieder die Möglichkeit, in ihren früheren Zustand zurückzugehen, und weil dieser Zustand soviel entropiereicher ist und sie nach möglichst viel Entropie streben, nehmen sie ihren Ausgangszustand wieder ein. Dies kann man Kunststoffen noch erleichtern, indem man sie locker quervernetzt, denn auf diese Weise sind sie zwar schwerer dehnbar, aber sie ziehen sich beim Loslassen umso besser wieder zusammen. Der Trick dabei ist die lose, weitmaschige Quervernetzung, wird sie zu fest und zu engmaschig, erhält man einen Duroplasten, der sich nicht mehr bewegt. Quervernetzte Elastomere sind - genau wie Duroplaste - nicht schmelzbar, auch sie bestehen praktisch aus einem einzigen riesigen Molekül. Glasübergangstemperatur Die Glasübergangstemperatur ist die Temperatur, bei der Polymere (allerdings nur ganz oder teilweise amorphe Polymere) vom flüssigen oder gummielastischen, flexiblen Zustand in den glasigen oder hartelastischen, spröden Zustand übergehen, sie wird daher auch "Erweichungstemperatur" genannt. Sie ist für jeden Kunststoff spezifisch, das heißt, dass man Kunststoffe anhand ihrer Glasübergangstemperatur unterscheiden kann. Thermoplaste Eigenschaften werden bei Erwärmung weich und verfestigen sich bei Abkühlung wieder sind formbar (plastisch) können sich unter Zug verformen (z.B. PVCPlastiktüte) zersetzen sich bei zu großer Hitze ihnen fehlt die Quervernetzung Aufbau / innere Struktur Verarbeitung / Bearbeitung werden beim Erhitzen nicht weich und schmelzen nicht, sondern zersetzen sich verformen sich nicht, wenn man Zug auf sie ausübt, eher brechen sie sind deutlich härter und spröder als Thermoplaste unlöslich und meist nicht quellbar stark quervernetzt (vergleichbar mit einem Fischernetz) Elastomere lassen sich mindestens auf das Doppelte ihrer Länge dehnen und beim Loslassen kehren sie in ihren Ausgangszustand zurück (Gummielastizität) sind nicht thermoplastisch locker quervernetzt wichtige Vertreter Duroplaste die einzelnen Molekülketten sind nicht durch chemische Bindungen, sondern nur durch zwischenmolekulare Kräfte (Van der Waals Kräfte, Dipol-Dipol-Bindungen, Wasserstoffbrücken) miteinander verbunden Polyethen (PE) Polystyrol (PS) Polyvinylchlorid (PVC) Polyamide (PA) Polyester (PES) Polyacrylate (z.B. PMMA Polymethylmethacrylat; “Plexiglas” im festen Zustand: Bohren, Sägen, Fräsen, Feilen, Kleben im plastischen Zustand: Biegen, Ziehen, Blasen, im weichen Zustand: Spritzen, Pressen, Walzen, Verschäumen, Schweißen, gestreckt Phenolharz (PF) Harnstoffharz (UF) Melaminharz (MF) Epoxidharz (EP) Polyurethanharz (PUR) Styrolbutadien-Kautschuk (SBR) Butyl-Kautschuk (IIR: Isobuten-IsoprenKautschuk) Silikon-Kautschuk (Q) Polychloropren-Kautschuck (CR) Bohren, Sägen, Fräsen, Feilen, Kleben Spritzgießen Herstellung von Kunststoffen: Polymerisation Es gibt verschiedene Möglichkeiten, eine Polymerisationsreaktion zur Herstellung von Kunststoffen in Gang zu setzen, es lassen sich daher verschiedene Arten der Polymerisation unterscheiden, je nachdem, wie die Reaktion eingeleitet wird und welche Art von Teilchen miteinander reagieren. Die häufigsten Polymerisationsarten, die auf eigenen Seiten besprochen werden, sind: Radikalische Polymerisation Ionische Polymerisation: o Anionische Polymerisation o Kationische Polymerisation Abgesehen davon gibt es auch noch die Ziegler-Natta-Polymerisation, die zur Synthese von Kunststoffen mit bestimmter Taktizität, d.h. von Kunststoffen mit bestimmtem räumlichem Aufbau dient, und die Ringöffnungspolymerisation, bei der ringförmige Moleküle miteinander zu Molekülketten reagieren. Polymerisationen lassen sich, abhängig von Art der Monomeren, außerdem einleiten durch Bestrahlung mit sichtbarem und/oder ultraviolettem Licht (Photopolymerisation) oder durch Erwärmen (thermische Polymerisation). Das Reaktionsprinzip ist bei all diesen Polymerisationsarten immer dasselbe: Bei der Polymerisation entstehen aus Monomeren, die Doppelbindungen enthalten, in einer Kettenreaktion, die ohne erkennbare Stufen abläuft, lange Polymerketten. Es finden dabei keinerlei Umlagerungen oder Abspaltung von Molekülbestandteilen statt. Schematisch kann man sich eine Polymerisation ungefähr folgendermaßen vorstellen: Eines der einfachsten Beispiele für eine Polymerisationsreaktion ist die Herstellung von Polyethen (auch Polyethylen genannt), das durch die Polymerisation von Ethenmolekülen entsteht: Eine solche Kettenreaktion lässt sich in folgende Abschnitte unterteilen: Initiation (auch als Kettenstart oder Primärreaktion bezeichnet): Die Reaktion(en), die die Kettenreaktion und damit die Entstehung von Polymeren in Gang bringen Wachstumsreaktion (auch Aufbau- oder Fortpflanzungsreaktion oder Propagation genannt): Hier werden die Molekülketten länger und länger Kettenübertragung: Diese führt zur Verzweigung der Molekülketten Kettenabbruch (Termination): Reaktionen, die zum Abbruch der Kettenreaktion führen Diese Abschnitte sollen hier nicht näher erläutert werden, denn das geht besser an einem Beispiel. Ihr findet eine ausführliche Erklärung auf der Seite über die Radikalische Polymerisation mit dem Beispiel Polyethen. Polykondensation Polykondensationen sind Reaktionen, bei denen Polykondensate entstehen. Sie verlaufen in Stufen und unter Abspaltung von Nebenprodukten (normalerweise Wasser, H2O). Schematisch kann man sie sich ungefähr folgendermaßen vorstellen: Anhand der schematischen Zeichnung ist sicherlich klargeworden, dass bei der Reaktion der Monomere miteinander ein Nebenprodukt abgespalten wird, doch was bedeutet es, wenn eine Reaktion in Stufen verläuft? Hierzu muss man den Vergleich sehen zu den Polymerisationsreaktionen, die stufenlos verlaufen: Hier werden bei der Wachstumsreaktion (Propagation) jeweils einzelne Monomere an die immer länger werdende Kette addiert, wenn zwei Ketten miteinander reagieren, bildet sich eine längere Kette, die allerdings nicht weiterreagieren kann (vgl. Kettenabbruch durch Rekombination). Bei der Polykondensation hingegen gibt es mehr Möglichkeiten für das Kettenwachstum, denn hier können einzelne Monomere an eine bestehende Kette angebaut werden, es können aber auch zwei beliebig lange bzw. kurze Ketten miteinander zu einer längeren reagieren, ohne dass die Wachstumsreaktion dabei beendet wird, denn die funktionellen Gruppen, die zur Reaktion notwendig sind, gibt es schließlich an beiden Enden. Doch durch welche Reaktionen werden Polykondensate gebildet? Hier gibt es im Wesentlichen die folgenden beiden Reaktionsmöglichkeiten: Esterbildung (Veresterung): Hierbei entstehen Polyester und Polycarbonate Carbonsäureamidbildung: Hierbei entstehen Polyamide Veresterung - Polyesterbildung Ein Ester bildet sich, wenn ein Alkohol und eine Carbonsäure unter Abspaltung von Wasser miteinander reagieren, wobei die Reaktion nur säurekatalysiert ablaufen kann, d.h. es müssen Protonen (H+) vorhanden sein. Die Reaktion ist eine Gleichgewichtsreaktion, der Ablauf ist folgender: Hier die genauere Erläuterung der einzelnen Teilschritte: 1. Ein Proton (H+) lagert sich an das negativ polarisierte Carbonyl-Sauerstoffatom der Carbonsäure an, die positive Ladung wird auf das Carbonyl-Kohlenstoffatom verschoben, es bildet sich ein Carbokation, das leicht von Nucleophilen angegriffen werden kann. 2. Ein Alkohol lagert sich an die Carbonsäure an, dabei wird eine kovalente Bindung zwischen dem negativ polarisierten, nucleophilen Sauerstoffatom der Hydroxylgruppe des Alkohols und dem positiv geladenen, elektrophilen Kohlenstoffatom der Carbonsäure gebildet, und die positive Ladung verschiebt sich auf das Sauerstoffatom des Alkohols (was dem stark elektronegativen, elektronenziehendem Sauerstoff nicht gefällt und das Molekül sehr instabil macht). 3. Das positiv geladene Sauerstoffatom will die positive Ladung loswerden und gibt daher ein Proton (H+) ab, dieses lagert sich an das nächstliegende Sauerstoffatom an, woraufhin dieses die positive Ladung bekommt (was natürlich auch nicht ideal ist). 4. An das nun positiv geladene Sauerstoffatom sind bereits zwei Wasserstoffatome gebunden, für den Sauerstoff ist es also kein Problem, sich das Elektronenpaar zu schnappen, mit dem er an das Kohlenstoffatom gebunden ist und sich so als (ungeladenes) Wassermolekül (H2O) vom Rest des Moleküls abzuspalten. Die positive Ladung ist nun wieder am Kohlenstoffatom, wo sie zu Beginn schon einmal war. 5. Das Molekül ist auch mit der positiven Ladung am Kohlenstoff nicht wirklich stabil, daher wird ein Proton (H+) von der noch vorhandenen Hydroxylgruppe abgespalten (die Umkehrreaktion von Schritt 1): Wir haben einen Ester erhalten! Polyester sind Stoffe, bei denen viele Monomere durch Esterbindungen miteinander verknüpft sind, sodass Polymere entstanden sind. Hierfür reicht es natürlich nicht aus, Monomere mit jeweils nur einer funktionellen Gruppe zu haben, denn diese könnten ja nur eine Esterbindung ausbilden und keine weitere. Um einen Polyester zu erhalten, benötigt man also Monomere mit (mindestens) zwei funktionellen Gruppen pro Monomer, und hier gibt es zwei verschiedene Möglichkeiten, nach denen zwei Typen von Polyestern unterschieden werden: Die Monomere von Polyester-Typ I sind Hydroxycarbonsäuren, Polyester des Typ II werden aus Dicarbonsäuren und Dialkoholen hergestellt. Haben wir nun Monomere wie die oben gezeigten, also Monomere mit zwei (gleichen oder unterschiedlichen) funktionellen Gruppen, so gibt es nach jeder Veresterung immer noch "unverbrauchte" funktionelle Gruppen, die weitere Esterbindungen ausbilden können, sodass schließlich Polyester entstehen. Polyamidbildung Die Polyamidbildung hat, was den Reaktionsmechanismus angeht, große Ähnlichkeit mit der Polyesterbildung: Bei beiden Reaktionen wird ein Nucleophil an das CarbonylKohlenstoffatom einer Carbonsäure addiert, der erste Reaktionsschritt (Addition eines Protons an den Carbonyl-Sauerstoff und Bildung eines Carbokations) ist sogar derselbe. Der Unterschied ist, dass das Carbokation nicht mit einem Alkohol reagiert wie bei der Esterbildung, sondern mit einem Amin, und dass dementsprechend ein Carbonsäureamid entsteht und kein Ester. 1. Bildung eines Carbokations, indem sich ein Proton (H+) an das negativ polarisierte CarbonylSauerstoffatom anlagert. 2. An das Carbokation lagert sich ein Amin an, indem es mit seinem freien Elektronenpaar eine kovalente Bindung zum positiv polarisierten Kohlenstoffatom bildet, die positive Ladung verschiebt sich auf das Stickstoffatom. 3. Das jetzt positiv geladene Stickstoffatom gibt ein Proton (H+) und damit die positive Ladung ab, das Proton lagert sich an das nächstliegende Sauerstoffatom an, woraufhin dieses die positive Ladung bekommt (was dem stark elektronegativen Sauerstoff nicht gefällt). 4. An das nun positiv geladene Sauerstoffatom sind jetzt zwei Wasserstoffatome kovalent gebunden, er kann also leicht mitsamt beiden Wasserstoffatomen und dem Elektronenpaar, mit dem er an den Rest des Moleküls gebunden ist, als (ungeladenes) Wassermolekül (H2O) vom Rest des Moleküls abgespalten werden. Die positive Ladung ist nun wieder am Kohlenstoffatom, wo sie zu Beginn schon einmal war. 5. Das Molekül ist auch mit der positiven Ladung am Kohlenstoff nicht wirklich stabil, daher wird ein Proton (H+) von der noch vorhandenen Hydroxylgruppe abgespalten: Es ist ein Carbonsäureamid entstanden! Für die Polyamidbildung gilt ebenfalls das, was oben zur Polyesterbildung gesagt wurde: Als Monomere müssen Moleküle verwendet werden, die mindestens zwei funktionelle Gruppen besitzen, damit die Reaktion an beiden Enden der Monomere stattfinden und sich eine Polymerkette bilden kann. Entsprechend den beiden Polyestertypen gibt es hier also auch zwei Typen von Polyamiden: Zum einen gibt es den AS-Typ, bei dem die Monomere Aminosäuren (abgekürzt AS) sind, also Stoffe, die als funktionelle Gruppen sowohl eine Amino- als auch eine Carboxylgruppe besitzen, zum anderen gibt es den AA-SS-Typ, der aus zwei unterschiedlichen Monomeren gebildet wird, nämlich aus einem Diamin (AA) und einer Dicarbonsäure (SS). Ansonsten verläuft die Wachstumsreaktion, d.h. die Kettenverlängerung, wie oben beschrieben in Stufen: Mit beiden Enden einer bestehenden Kette können einzelne Monomere reagieren und so die Kette verlängern, es können aber auch zwei beliebig lange (oder kurze) Ketten miteinander reagieren und eine längere Kette bilden, ohne dass die Wachstumsreaktion dadurch beendet wird. Polykondensation von Formaldehyd und Phenol Bei dieser Reaktion wird zunächst das Formaldehyd durch Zusatz starker Säure protoniert. Das Ergebnis ist resonanzstabilisiert, die Elektrophilie wird erhöht. Diese Spezies führt nun die elektrophile Substitutionsreaktion am Phenol durch. Das Kondensationsprodukt ist Wasser. Mit weiterem Phenol kann nun unter Austritt des H+ wie Bindung geknüpft und mit weiterem aktivierten Formaldehyd das Polymernetzwerk erstellt werden. Polyaddition Die Polyaddition verläuft wie die Polykondensation in Stufen, d.h. die Monomere können an beiden Enden reagieren, und so entstehen zunächst kurze Molekülketten aus wenigen Monomeren (Oligomere), die miteinander oder auch mit längeren Ketten reagieren können. Der wesentliche Unterschied zur Polykondensation ist, dass hierbei keine Nebenprodukte abgespalten werden, sondern dass die Monomere miteinander reagieren, indem sich Atome und Elektronenpaare verschieben. Schematisch kann man sich das ungefähr so vorstellen: Die wichtigsten Polyadditionen ist die Herstellung von Polyurethanen, von Polyharnstoffen und von Epoxidharzen. Im Folgenden soll stellvertretend für alle Polyadditionen die wichtigste Polyaddition, nämlich die Herstellung von Polyurethanen, ausführlich beschrieben werden. Herstellung von Polyurethanen Polyurethane werden aus Dialkoholen und Diisocyanaten synthetisiert (s.o.), und damit die Reaktion in Gang kommt, benötigt man Katalysatoren, z.B. Diazobicyclo[2.2.2]octan (abgekürzt DABCO): Initiation DABCO besitzt zwei freie Elektronenpaare und ist ein Nucleophil, d.h. es wird von positiv polarisierten oder geladenen Atomen angezogen. Ein solches positiv polarisiertes Atom ist das Wasserstoffatom, das zur Hydroxylgruppe des Dialkohols gehört. DABCO bildet eine Wasserstoffbrückenbindung zu dem Wasserstoffatom der Hydroxylgruppe aus, die positive Polarisierung verschiebt sich auf das Stickstoffatom, die Polarisierung des Komplexes wird größer, weil der Abstand der polarisierten Atome größer geworden ist. Aufgrund der stärkeren Polarisierung ist das Sauerstoffatom reaktiver als vorhin, es sucht sich daher einen Reaktionspartner, mit dem es seinen Elektronenüberschuss teilen kann, also ein elektronenarmes, elektrophiles Atom. Ein solches ist das Kohlenstoffatom in der Isocyanatgruppe des Diisocyanats: Es ist umgeben von zwei elektronegativeren Atomen, einem Sauerstoffatom und einem Stickstoffatom und daher stark positiv polarisiert und gut von unserem negativ polarisierten Sauerstoffatom angreifbar. Das Sauerstoffatom bildet mit einer seiner freien Elektronenpaare eine Bindung zum elektrophilen Kohlenstoffatom aus, wobei sich eines seiner Bindungselektronenpaare zum Stickstoffatom verschiebt: Schließlich besitzt das Sauerstoffatom eine negative und das Stickstoffatom eine positive Teilladung. Das Stickstoffatom ist mit seiner negativen Teilladung nicht glücklich und will sie gerne loswerden, und das Sauerstoffatom fühlt sich mit seiner positiven Teilladung auch nicht wohl. Wie lässt sich das ändern? Die Lösung ist einfach: Das Stickstoff bindet mit einer seiner freien Elektronenpaare das Wasserstoffatom, das am positiv geladenen Sauerstoff hängt, und das Elektronenpaar, das Wasserstoff und Sauerstoff verbindet, bleibt beim Sauerstoff, d.h. das Wasserstoff geht als Proton (H+) an das Stickstoffatom, nimmt also die positive Ladung mit. Die entstehende Gruppierung, die die beiden Monomere verbindet, heißt "Urethanbindung". Unser Katalysator DABCO löst dabei die Wasserstoff-Brückenbindung und ist frei, um eine Wasserstoff-Brückenbindung mit der nächsten Hydroxylgruppe auszubilden. Wachstumsreaktion Die Wachstumsreaktion verläuft wie bei der Polykondensation in Stufen. Betrachtet man das im ersten Reaktionsschritt entstandene Produkt, so sieht man, dass aus den beiden Monomeren ein bifunktionelles Molekül entstanden ist: An einem Ende befindet sich eine Isocyanatgruppe, am anderen Ende eine Hydroxylgruppe, und erstere kann mit einem weiteren Dialkohol reagieren, letztere mit einem weiteren Diisocyanat, sodass die Molekülkette länger wird. Allerdings gibt es auch weitere Reaktionsmöglichkeiten: Da jedes Produkt, egal aus wie vielen Monomeren es besteht, an jedem Ende je eine funktionelle Gruppe hat, können auch Kettenstücke verschiedener Länge miteinander reagieren und so längere Molekülketten bilden, solange bis schließlich Polyurethane entstehen.