Flagellenstruktur & Sensitivity / Robustness in e coli
Werbung

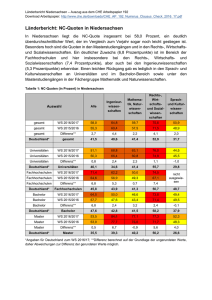
FLAGELLENSTRUKTUR & SENSITIVITY / ROBUSTNESS IN E COLI von Andrea Ebert Chemotaxis Chemotaxis: Bewegung entlang chemischem Gradient Positive Negative in Richtung steigender Lockstoffkonzentration in Richtung sinkender Schreckstoffkonzentration Fortbewegung von E Coli Bakterielle Bewegung ähnelt einem „Random Walk“: Gerade Schwimmperioden werden unterbrochen durch kurzes Taumeln, das die Schwimmrichtung ändert. Fortbewegung von E coli durch rotierende Flagellen CCW – Bewegung Flagellen lagern sich zu Bündel zusammen gerades Schwimmen (bis zu v = 30 µm/s) CW – Bewegung Flagellen stehen radial ab Taumeln, Richtungswechsel Modulation der Taumelfrequenz ermöglicht Chemotaxis A B Keine Konzentrationsänderung (A) hohe Taumelfrequenz häufige Richtungswechsel Steigende Lockstoffkonzentration (B) niedrigere Taumelfrequenz längere Schwimmphasen Resultat: In Summe bewegt sich E coli in Richtung steigender Lockstoffkonzentration Flagellenstruktur von E coli Lange, dünne Proteinfäden Mehrere Flagellen sind über die gesamte Zelloberfläche verteilt („peritrich“ begeißelt) Sie dienen der Fortbewegung Struktur des Flagellenapparats Flagellen sind in drei funktionelle Abschnitte gegliedert: Filament Haken Basalkörper Struktur des Flagellenapparats Filament: c.a 10µm lang Besteht aus Protein Flagellin Hohler, helikal gewendelter Proteinfaden Stabilität Wirkt wie ein „Propellor“ Struktur des Flagellenapparats Haken: Flexibles Gelenk Ähnliche Struktur wie Filament, nur von anderem Protein gebildet Struktur des Flagellenapparats Basalkörper: Verankerungskomplex für das Filament Motor für Rotationsbewegung ( ca. 50 Hz) Aufbau des Flagellenapparats Beim Aufbau der Filamente werden die Proteinmoleküle durch den Hohlkanal der Flagellen bis zum äußersten Ende transportiert und dort angebaut a Verlängerung a Beschädigte Flagellen regenerierbar Proteinnetzwerk der Chemotaxis Che A B R W Y Z Funktion Histidinkinase Methylesterase Methyltransferase Kinaseregulator Antwortregulatorprotein Phosphatase Proteinnetzwerk der Chemotaxis Signalprozess: Schreckstoff bindet an Rezeptor Che A wird aktiviert aChe A-P Phosphoryliert Che Y aChe Y-P Diffundiert zu Motor ahöhere Taumelfrequenz Proteinnetzwerk der Chemotaxis Adaption: Zugabe eines Lockstoffs zur Zeit t=0 aTaumeln wird schlagartig unterdrückt aTaumelfrequenz steigt langsam wieder und passt sich der Taumelfrequenz der unstimmulierten Zelle an Proteinnetzwerk der Chemotaxis Adaptionsprozess: Lockstoff bindet an Rezeptor aChe A-P wird deaktiviert aChe Y, Che B werden nicht aktiviert aMethylisierungsgrad steigt aAktivität von Che A wird wieder normalisiert aChe Y wird wieder aktiviert Eigenschaften des Proteinnetzwerks Empfindlichkeit: Signal der Rezeptoren um Faktor 100 verstärkt Reize verschiedensten Ursprungs werden zu einem Signal kombiniert Exakte Adaption ermöglicht Bewegung entlang zeitlichem Konzentrationsgradienten Empfindlich auch für kleine Konzentrationsänderungen (<1%) in extremen Konzentrationen (nM-mM Bereich) Robustness in bacterial Chemotaxis Experiment von Alon, Surette, Barkai & Leibler: Wie reagieren Response und Adaption auf systematische Konzentrationsveränderungen der Chemotaxis-Proteine? Robustness in bacterial Chemotaxis Untersuchte Eigenschaften: Steady-State Taumelfrequenz Adaptionszeit Adaptionsprezision P Variation von [Che R] Methode: Bei Klonen wird Che R vollständig entfernt Unter Kontrolle eines Lac-Operons wird [Che R] wiederhergestellt und erhöht (bis 50fach) Lac Operon wird durch IPTG (Isopropyl-β-D-thiogalactopyranosid) reguliert Variation von [Che R] Ergebnis: Adaptionspräzison unabhängig von [Che R] a„robuste“ Größe Adaptionszeit sinkt mit zunehmender [Che R] Steady-State Taumelfrequenz steigt mit [Che R] a„sensitive“ Größen Variation verschiedener chemotaktischer Protein Variation von [Che Z] Messung der Motor Signalübertragung Experiment von Leibler, Cluzel, Surette Messung des Motor Outputs als Funktion der Che Y-P Konzentration Versuchsaufbau Messmethoden 2 simultane Messungen: Dunkelfeldmikroskopie: aCW Bias Fluoreszenz-KorrelationsSpektroskopie: aChe Y-P Konzentration Dunkelfeldmikroskopie Licht wird am Objektiv vorbei geleitet Dunkelfeldmikroskopie Licht wird am Objektiv vorbei geleitet Nur Licht, das durch das Präparat im Strahlengang gestreut wird, gelangt in das Objektiv aBild mit hellen Strukturen auf dunklem Untergrund Bestimmung des CW-Bias mit Dunkelfeldmikroskopie Flagellen werden mit Latex Kügelchen markiert Beleuchtung mit rotem Licht Beobachtungen werden mit Kamera aufgenommen Videoaufnahmen werden durch Computerprogramm analysiert aCW-Bias Fluoreszenz-KorrelationsSpektroskopie (FCS) Anregungslicht wird auf Probe fokussiert (möglichst kleines Anregungsvolumen) Fluoreszenzaktive Teilchen, die in das Anregungsvolumen diffundieren, werden zu Fluoreszenz angeregt Emittierte Photonen werden mit Photodiode detektiert aFluoreszenzintensität I(t) Fusion von Che Y-P mit Grün-fluoreszierendem Protein (GFP) Unter Kontrolle eines Lac-Operons wird Che Y-P zu Che Y-P-GFP fusioniert GFP dient als Marker, ermöglicht Untersuchung der zeitlichen und räumlichen Verteilung in vivo Wie funktioniert Autokorrelation? Fluoreszenzintensität als Funktion der Zeit: Jede Intensitätsspitze steht für ein Teilchen, das gerade durch das Anregungsvolumen V diffundiert Wie funktioniert Autokorrelation? Autokorrelation: Intensität wird gegen sich selbst aufgetragen Ziel: Informationsgewinn aus Fluktuationen in der Fluoreszenzintensität Wie funktioniert Autokorrelation? Autokorrelation: Intensität I(t) wird gegen Intensität I(t+∆t) zu einem späteren Zeitpunkt aufgetragen Wie funktioniert Autokorrelation? Wie funktioniert Autokorrelation? Autokorrelationsfunktion Korrelationskoeffizient R(∆t) Normierung: aAutokorrelationsfunktion G(∆t) Wobei: ∆t = mτ 0≤m≤M Autokorrelationsfunktion zur Bestimmung von [Che Y-P-GFP] Für zweidimensionale Translationsdiffusion gilt: G(∆t)=1/N*[1+(4Dt/ω²)] Wobei: D = Diffusionskonstante 2ω= Durchmesser des Detektionsvolumens N = Teilchenzahl Eichung auf absolute Konzentration durch Korrelationsfunktion Wegen: G(∆t)=1/N*[1+(4Dt/ω²)] Gilt: G(0)=1/N Mit: C=N/V aKonzentration C von Che Y-P in Abhängigkeit der Photonenzählrate Ultra-Sensitivität des Motors Kleine Konzentrationsänderungen [Che Y-P] führen zu großer Änderung im Motor bias aMotor als Verstärker Hillkoeffizient 10,3±1,1 Zusammenfassung Extrazellulare Reize werden durch ein Proteinnetzwerk in Motor Output übersetzt Motor ist ultrasensitiv Exakte Adaption ist eine „robuste“ Größe und ermöglicht Bewegung entlang zeitlichem Gradient a Kritisch für Chemotaxis