Gesamtpräsentation zum Öffnen/Download
Werbung

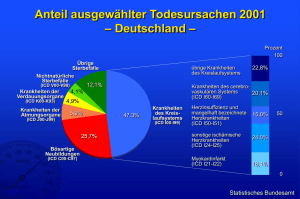
Eprosartan – chemische Struktur N NH N N Olmesartan Biphenyleinheit N Losartan O O O CH N N Valsartan O CH N Eprosartan O CH3 COOH N N N O H N C H3C H3 H C 3 N N N N O N N N H O N N COOH Irbesartan N O N N N HOOC N Candesartan Telmisartan O O N O N O O O N O N N N S O N N N O Pharmakologie der AT1-Blocker (1/2) Substanz Eprosartan Losartan/EXP Valsartan Irbesartan Candesartan Telmisartan Olmesartan Prodrug (akt. Metabolit) Nein Nein Nein Ja Nein Ja Rezeptoraffinität (nM) 1,5 19/3,7 2,4 1,2-4,1 0,7-7,4 1,2 n.b. Inhibition des Rezeptors Kompetitiv Kompetitiv/ NichtNicht -kompetitiv kompetitiv NichtNichtkompetitiv kompetitiv Nichtkompetitiv Kompetitiv Bioverfügbarkeit (%) 13 33 25 60-80 42 43 26 Verringerte Resorption durch Nahrungsaufnahme Nein Minimal Bis 40-50% Nein Nein Nein Minimal Zeitpunkt der Maximalkonzentration (h) 1-2 1-3 1-2 2 3-4 1-5 2-6 Ja (14%) Pharmakologie der AT1-Blocker (2/2) Substanz Eprosartan Losartan/EXP Valsartan Irbesartan Candesartan Telmisartan Olmesartan Halbwertszeit (h) 5-9 2/6-9 6-7 11-15 4/9-29 9-17 15 Proteinbindung (%) 98 98,7/99,8 95 90 99,8 99 >99 Distributionsvolumen (L) 13 34/12 16-17 53-93 9,1 500 15-20 Interaktion mit Cytochrom P450 Nein Ja Nein Ja Ja Nein Ja 61/37 50/43 70/30 80/20 67/33 98/2 60/40 600 50-100 80-160 150-300 8-16 40-80 10-140 Exkretion (% hep./renal) Erhaltungsdosis (mg) Blockade des AT1-Rezeptors durch Eprosartan Hemmung der Aorta-Kontraktion (%) 100 Kontrolle (n=23) Eprosartan (0,3 nmol, n=9) Eprosartan (3 nmol, n=14) Eprosartan (10 nmol, n=6) Eprosartan (30 nmol, n=7) 80 60 40 20 Eprosartan 0 -10 -8 -6 Angiotensin II, log mol Edwards et al. J Pharmacol Exp Ther 1992 AT1-Blocker – kompetitiver und nicht-kompetitiver Antagonismus Eprosartan Irbesartan 100 % Kontraktion 60 40 20 0,1 80 60 40 20 0 10 1000 A II (nM) EXP 3174 (Metabolit des Losartan) 0,1 10 1000 A II (nM) Valsartan 100 120 % Kontraktion 0 % Kontraktion % Kontraktion 80 80 60 40 20 100 80 60 40 0 0 0,1 10 1000 A II (nM) 0,1 10 1000 A II (nM) Bioverfügbarkeit und Exkretion von Eprosartan oral i.v. 13% bioverfügbar 100% bioverfügbar 90% Fäzes 7% Urin 61% Fäzes 37% Urin Tenero et al. Biopharm Drug Disps 1998 Cox et al. Exp Toxic Pathol 1996 Eprosartan – Pharmakologie Einziger Vertreter der nicht-biphenylischen AT1-Blocker Hohe Affinität zum AT1-Rezeptor Dosisbezogene AT1-Blockade über gesamten Wirkbereich Positive Effekte auf ERPF, GFR und Proteinurie Exzellentes Sicherheitsprofil und Verträglichkeit Keine relvanten Wechselwirkungen mit anderen Medikamenten Keine Beeinflussung des Cytochrom P450-Systems Kein urikosurischer Effekt Hemmung der Angiotensin II-stimulierten Freisetzung von Noradrenalin Pharmakologie in speziellen Subgruppen Patienten über 65 Jahre – Erhöhung der Cmax und der AUC – Tmax wird später erreicht, HWZ ist verlängert – keine Unterschiede in Wirksamkeit und Verträglichkeit gegenüber jüngeren Hypertonikern Patienten mit eingeschränkter Nierenfunktion – Erhöhung von Cmax und AUC – Clearance durch Hämodialyse gering – keine Dosisreduktion bei geringer und mittelschwerer Funktionsstörung notwendig – nicht empfohlen bei schwerer Funktionseinschränkung der Niere Patienten mit eingeschränkter Leberfunktion – Cmax unverändert, AUC erhöht Tenero et al. Br J Clin Pharmacol 1998 Martin D E et al. J Clin Pharmacol 1998 Tenero D et al. Pharmacother 1998 Trough To Peak-Ratio für Eprosartan 1 x täglich Trough To Peak-Ratio Diastolischer Blutdruck (mmHg) peak = Plasmakonzentration nach 3h 1,0 trough = Plasmakonzentration nach 24h 0,75 0,5 0,67 0,25 0 (n=63) Hedner et al. J Hypertens 1999 Eprosartan – Metabolische Auswirkungen Inzidenz von Hyper- und Hypokaliämie sehr gering Kein Einfluss auf sonstige Elektrolyte Ohne Beeinflussung der Harnsäurexkretion Keine klinisch relevanten Auswirkungen auf hämatologische und sonstige Laborparameter Ohne relevante Auswirkungen auf Cholesterine und Triglyceride im Plasma Kein spezifischer Einfluss auf Herzfrequenz und -funktion Medikamentöse Wechselwirkungen Keine Metabolisierung durch das hepatische Cytochrom P450-Enzymsystem Keine bekannten klinisch relevanten Wechselwirkungen – Kein Einfluss auf die Pharmakodynamik von Warfarin oder Glibenclamid – Kein Einfluss auf die Pharmakokinetik von Digoxin – Kein Einfluss von Ranitidin auf die Pharmakokinetik von Eprosartan – Kein Einfluss von Ketoconazol und Fluconazol auf die Pharmakokinetik von Eprosartan Keine Interaktionen mit Lipidsenkern (Statine, Fibrate, Nicotinsäure) Cytochrom P450 lipophiles Xenobiotikum Cytochrom P450 H hydrophiles Xenobiotikum OH Hydroxilierung Gewebeeinlagerung Exkretion Das Geschehen an der Schnittstelle von sympathischem Neuron und Blutgefäß SNS Noradrenalin (NA) (-) (+) a2 AT1 NA a1 Blutgefäß A II Eprosartan AT1 Vasokonstriktion Brooks et al. Am Heart J 1999 Hemmung der sympathikusgesteuerten Blutdrucksteigerung durch Eprosartan Diastolischer Blutdruck (mmHg) n=4 Kontrolle Eprosartan (0,3 mg/kg i.v.) 80 60 * 40 20 * * p<0,05 0 0,1 1 10 Stimulationsfrequenz (Hz) Ohlstein et al. Pharmacology 1997 Diastolischer Blutdruck (mmHg) Hemmung der sympathikusgesteuerten Blutdrucksteigerung durch AT1-Blocker n=4 n=4 n=4 100 100 100 80 80 80 60 60 60 40 40 40 Kontrolle Losartan 20 0 0,1 1 Kontrolle Valsartan 20 10 0 0,1 1 Kontrolle Irbesartan 20 0 10 0,1 1 10 Stimulationsfrequenz (Hz) Ohlstein et al. Pharmacology 1997 Änderung des diastolischen Blutdrucks (%) Hemmung der sympathikusgesteuerten Blutdrucksteigerung durch AT1-Blocker 40 Eprosartan (0,3 mg/kg) 30 Losartan (0,3 mg/kg) 20 Valsartan (0,3 mg/kg) 10 Irbesartan (0,3 mg/kg) 0 i.v. 10 Min vor Stimulation -10 -20 -30 -40 * * p < 0,05 -50 Stimulationsfrequenz 1 Hz Ohlstein et al. Pharmacology 1997 Blockade prä- und postsynaptischer AT1-Rezeptoren durch AT1-Blocker 200 Ratio ED20/A2 150 100 50 0 Valsartan Candesartan Eprosartan Embusartan Balt et al. J Hypertension 2001 Wirkweise von Eprosartan Eprosartan wirkt auf zwei Stellmechanismen des Blutdruckes: 1. Renin-Angiotensin-Aldosteron-System (RAS) 2. Sympathikus durch Blockade der AT1-Rezeptoren Dies führt zu 1. Blockade der vasokonstriktorischen und volumensteigernden Wirkung von Angiotensin II 2. Reduktion der vasokonstriktorischen Wirkung von Noradrenalin Renaler Plasmafluss unter Eprosartan bei Gesunden 900 PAH + Placebo PAH + A ll + Placebo PAH + Eprosartan PAH + A ll + Eprosartan ClPAH (ml/min) 800 700 600 500 400 300 0 1 2 3 4 5 6 Zeit (h) Solvay, Studie HP-1006 Wirkung von Eprosartan und Captopril auf den renalen Plasmafluss ClPAH (ml/min/1,73 m2) 760 Eprosartan, 400 mg (n=13) 720 Captopril, 25 mg (n=13) 680 640 Placebo (n=14) 600 560 520 480 440 Medikamenteneinnahme Beginn A II Infusion Ende A II Infusion 400 0 45 90 135 180 225 Zeit (Min) Sica & Hollenberg, Pharmacotherapy 1999 400 1000 300 800 Veränderung des RPF unter Eprosartan (ml/min) Veränderung des RPF unter Enalapril (ml/min) Endotheliale NO-Produktion in der Niere mit Eprosartan 200 100 0 -100 -200 600 400 200 0 -300 -200 -400 -400 -300 -200 -100 -400 0 100 RPF unter L-NMMA (ml/min) 200 -600 -400 -200 0 200 RPF unter L-NMMA (ml/min) Delles C. et al. Kidney Intl 2002 Eprosartan bei Hyperglykämie Veränderungen im renalen Plasmafluss (ml/min/1,73 m-2) 180 160 *p < 0,05 #p < 0,05 # Placebo Eprosartan 140 120 * 100 80 60 40 20 0 Normoglykämie Hyperglykämie Osei, Hypertension 2000 Exkretion von Harnsäure unter Eprosartan und Losartan p < 0,01 n.s. 500 Harnsäure im Blut (µmol/l) Verhältnis Harnsäure/Kreatinin 0,6 0,5 0,4 0,3 0,2 0,1 0 Tag 1 Tag 28 Eprosartan Tag 1 Tag 28 Losartan 400 300 200 100 0 Tag 1 Tag 28 Eprosartan Tag 1 Tag 28 Losartan Puig et al. J Hypertens 1999 Einfluss von Eprosartan auf oxidative und inflammatorische Marker Studienanfang Studienende p<0,05 Eprosartan p<0,05 HCTZ 0 50 100 150 LDL oxidation lag time (min) Rahman et al. Am J Cardiol 2002 8 8 3,5 7 7 3,0 2,5 2,0 1,5 1,0 Angiotensin II (ng/ml) 4,0 Aldosteron (ng/dl) Plasma Reninaktivität (ng/ml/h) Wirkung von Eprosartan und Enalapril auf die Spiegel von Renin, AT-II und Aldosteron im Plasma 6 5 4 3 2 6 5 4 3 2 0,5 1 1 0 0 0 1 12 1 12 Woche 1 12 1 12 Woche Eprosartan, Studienbeginn Eprosartan, 200-300 mg, zweimal täglich 1 12 1 12 Woche Enalapril, Studienbeginn Enalapril, 5-20 mg, einmal täglich Gavras & Gavras, Curr Med Res Opin 1999 Hyperkalorische Nahrungsaufnahme und Hypertonie Herzfrequenz (Schläge/min) 360 *p < 0,05 vs Tag 21 und 24 spontan hypertensive (SHR) Ratten, n=4 340 320 * Eprosartan 30 mg/kg 300 * 90 mg/kg Fett + Saccharose Systolischer Blutdruck (mmHg) 0 15 10 20 30 40 50 60 Zeit (Tage) 60 Zeit (Tage) *p < 0,05 vs Tag 6-10 #p < 0,05 vs Tag 15-31 * * * * 10 5 0 -5 # -10 -15 # 0 10 20 30 # ## 40 ** 50 * Rupp, J Clin Basic Cardiol 2001 Überlebensrate bei Schlaganfall-sensitiven Ratten mit Eprosartan 100 Eprosartan (60 mg/kg/Tag) Placebo Überlebende (%) 80 60 40 20 0 0 2 4 6 8 10 12 Zeit (Wochen) Barone, Cardiovasc Res 2001 Reduktion des diastolischen Blutdrucks (mmHg) Eprosartan – Wirksamkeit bei 1 x täglicher Dosierung 0 Placebo (n=80) Eprosartan 1x täglich (n=78) Eprosartan 2x täglich (n=79) -9,0 -9,0 p < 0,0001 p < 0,0001 -2 -4 -6 -8 -10 Hedner et al. J Hypertens 1999 Blutdrucksenkung durch Eprosartan Mittlere Blutdrucksenkung vs Placebo (mmHg) 400 mg 600 mg 800 mg 1200 mg 0 Diastolisch Systolisch -1,9 -2 -2,7 -3,2 -4 -4,1 Werte < 4h nach Einnahme -4,3 -4,9 -6 -7,5 -8 -9,5 -10 n=86 n=90 n=85 n=90 351 Hypertoniker (DBD 95 145 mmHg), Studiendauer 8 Wochen Weber, Pharmacotherapy 1999 Eprosartan versus Enalapril Diastolisch Systolisch p < 0,05 -3 -6 -9 -12 -15 -12,9 -11,9 -15,5 -14,7 -18 Anteil Responser (%) Reduktion des Blutdrucks (mmHg) 0 80 81,7 73,4 60 40 20 0 Eprosartan Enalapril 528 Hypertoniker (DBD > 95 < 114 mmHg), Studiendauer 26 Wochen Gavras & Gavras, Curr Med Res Opin 1999 0 -5 -10 -15 -20 -16,2 -20,1 -25 Eprosartan (n=59) Enalapril (n=59) Mittlere Reduktion des systolischen Blutdrucks (mmHg) Mittlere Reduktion des diastolischen Blutdrucks (mmHg) Eprosartan versus Enalapril bei schwerer Hypertonie – Blutdrucksenkung -5 -10 -15 -21,2 -20 -25 -29,1 -30 Eprosartan (n=59) p < 0,05 Enalapril (n=59) 118 Hypertoniker (DBD 115 125 mmHg), Studiendauer 10 Wochen Sega, Blood Pressure 1999 Eprosartan versus Enalapril bei schwerer Hypertonie – Responder-Rate Anteil Responder (%) 80 70 60 69,5 % 54,2 % 50 40 30 20 10 0 Eprosartan (n=59) Enalapril (n=59) 118 Hypertoniker (DBD 115 125 mmHg), Studiendauer 10 Wochen Sega, Blood Pressure 1999 Eprosartan versus Losartan Systolisch 0 -3 -6 -9,6 -9 -12 -12,4 -10,9 -12,7 -15 -18 Anteil Responder (%) Mittlere Blutdruckreduktion (mmHg) Diastolisch 80 60 73 53 40 20 0 Eprosartan (600 mg/Tag) Losartan (50 mg/Tag) 60 Hypertoniker (DBD > 95 < 114 mmHg), Studiendauer 4 Wochen Puig et al. J Hypertens 1999 Geschlechtsspezifische Wirksamkeit Männer (n=149) Frauen (n=114) -2 -4 -6 -8 -10 -12 -14 -16 -18 Frauen (n=114) -17,0 -16,8 0 -13,1 -15,5 Mittlere Reduktion des systolischen Blutdrucks (mmHg) Mittlere Reduktion des diastolischen Blutdrucks (mmHg) 0 Männer (n=149) -2 -4 -6 -8 -10 -12 -14 -16 -18 Hedner, J Hypertens 1999 -0 -2 -4 -6 -8 -10 -12 -14 -16 -18 -20 -22 -24 Patienten insgesamt Patienten schwarzer Hautfarbe Patienten insgesamt (n=263) (n=263) (n=21) (n=19) (n=263) (n=263) -12,9 -11,9 -13,3 -12,4 Eprosartan Reduktion des systolischen Blutdrucks (mmHg) Reduktion des diastolischen Blutdrucks (mmHg) Wirksamkeit bei Patienten schwarzer Hautfarbe -0 -2 -4 -6 -8 -10 -12 -14 -16 -18 -20 -22 -24 Patienten schwarzer Hautfarbe (n=21) (n=19) -13,2 -15,5 -14,7 -23,1 Enalapril Hedner, J Hypertens 1999 Responder-Rate bei Hypertonikern schwarzer und weißer Hautfarbe 90 70 Eprosartan Enalapril 80 83,9% 73,4% 60 50 40 30 20 10 0 Anteil Responder (%) Anteil Responder (%) 80 90 70 60 66,7% 50 40 42,1% 30 20 10 0 (n=225) (n=231) Patienten weißer Hautfarbe (n=21) (n=19) Patienten schwarzer Hautfarbe Levine, Curr Med Res Opin 1999 Wirksamkeit von Eprosartan bei Hypertonikern < 65 Jahren und 65 Jahren < 65 (n=200) -2 -2 -4 -4 -6 -8 -10 -12 -14 -16 -13,2 -13,9 65 (n=63) 0 Reduktion systolischer Blutdruckwert (mmHg) Reduktion diastolischer Blutdruckwert (mmHg) 0 < 65 (n=200) 65 (n=63) -6 -8 -10 -12 -14 -16 -18 -18 -20 -20 -16,2 -18,9 Argenziano & Trimarco, Curr Med Res Opin 1999 Patienten > 65 Jahre – Blutdrucksenkung Mittlere Reduktion systolischer Blutdruck (mmHg) Woche 3 Woche 6 Woche 9 Woche 12 0 -5 -10 -15 -20 -25 Eprosartan Enalapril 334 Hypertoniker (DBD 90-114 mmHg, SBD 160 mmHg), Studiendauer 12 Wochen Ruilope, Blood Pressure 2001 Eprosartan versus Placebo – unerwünschte Ereignisse 60 50 Placebo Eprosartan 54,4% 52,8% Patienten (%) 6 Studien, n=1554 40 30 20 10 3,2% 4,0% 0 Gesamthäufigkeit Einstufung "schwer" 4,1% 6,5% Therapieabbrüche durch unerwünschte Ereignisse Solvay, data on file Unerwünschte Nebenwirkungen unter Eprosartan ( 2%) Brustschmerzen Placebo (n=352) Virusinfektion Eprosartan (n=1202) Verletzung Diarrhoe Benommenheit Sinusitis Husten Pharyngitis Rhinitis Myalgie Infektion der oberen Atemwege Kopfschmerz 0 1 2 3 4 5 6 7 8 9 10 11 12 Anteil Patienten, die unerwünschte Ereignisse berichteten (%) Gavras & Gavras, Pharmacotherapy 1999 Häufigkeit (%) Unerwünschte Ereignisse unter Eprosartan und Nifedipin 60 Eprosartan (n=103) 50 Nifedipin retard (n=102) 40 30 20 10 0 Gesamt Ödeme Kopfschmerz Husten Solvay, Studie 041 Unerwünschte Ereignisse ( > 3%): Eprosartan versus Enalapril (1/2) Placebo (n=45) Eprosartan (n=46) Enalapril (n=45) n % n % n % 22 48,9 26 56,5 29 64,4 Husten 9 20,0 9 19,6 20 44,4 Pharyngitis 6 13,3 5 10,9 9 20,0 Rhinitis 3 6,7 5 10,9 6 13,3 Dyspnoe 1 2,2 3 6,5 1 2,2 Sinusitis 1 2,2 1 2,2 3 6,7 Atmungserkrankung 0 0 1 2,2 3 6,7 Häufigkeit von 1 unerwünschtem Ereignis Oparil, Curr Ther Res 1999 Gavras & Gavras, Pharmacotherapy 1999 Unerwünschte Ereignisse ( > 3%): Eprosartan versus Enalapril (2/2) Placebo (n=45) Eprosartan (n=46) Enalapril (n=45) n % n % n % Asthma 0 0 1 2,2 2 4,4 Kopfschmerzen 5 11,1 3 6,5 2 4,4 Brustschmerzen 2 4,4 1 2,2 1 2,2 Infektion der oberen Atemwege 5 11,1 3 6,5 5 11,1 Virusinfektion 2 4,4 2 4,3 0 0 Myalgie 2 4,4 2 4,3 2 4,4 Arthralgie 0 0 0 0 2 4,4 Oparil, Curr Ther Res 1999 Gavras & Gavras, Pharmacotherapy 1999 Eprosartan – Verträglichkeit Inzidenz von Nebenwirkungen auf Placeboniveau bei Dosierung bis 1200 mg Bei Kombination mit Diuretika oder DihydropyridinKalziumantagonisten Nebenwirkungsrate wie unter Monotherapie des Kombinationspartners Volle antihypertensive Wirksamkeit nach 2-3 Wochen, daher geringe Gefahr orthostatischer Dysregulation Keine negative Beeinflussung der Lipid-, Glukoseoder Harnsäurespiegel Eprosartan – Verträglichkeit Studienabbrüche Eprosartan Placebo (n=1202) (n=352) Studie beendet 87,1% 74,4% Studie abgebrochen 12,9% 25,6% fehlende Wirksamkeit 6,5% 14,2% unerwünschte Ereignisse 4,1% 6,5% andere Gründe 2,3% 4,8% Gründe für Studienabbruch 1202 Hypertoniker, 6 placebokontrollierte Studien Solvay, data on file Patienten > 65 Jahre – Verträglichkeit Eprosartan vs Enalapril – unerwünschte Ereignisse ( 2%) Kopfschmerz Müdigkeit Eprosartan (n=171) Diarrhoe Enalapril (n=163) Verletzung Unterleibsschmerzen Benommenheit Virusinfektion Husten Harnwegsinfektionen 0 2 4 6 8 anteilige Häufigkeit (%) 334 Hypertoniker (DBD 90-114 mmHg, SBD 160 mmHg), Studiendauer 12 Wochen Ruilope, Blood Pressure 2001 Eprosartan – Langzeitsicherheit Unerwünschtes Ereignis Infektion der oberen Atemwege Kopfschmerzen Verletzung Sinusitis Myalgie Schwindel Bronchitis Virale Infektion Husten Arthralgie Müdigkeit Rückenschmerzen Rhinitis Diarrhoe Pharyngitis Schmerzen Brustschmerzen Alle Patienten (n=706) n % 171 24,2 107 15,2 102 14,4 89 12,6 83 11,8 67 9,5 59 8,4 56 7,9 53 7,5 53 7,5 48 6,8 42 5,9 42 5,9 41 5,8 38 5,4 38 5,4 35 5,0 Levine, Curr Med Res Opin 2001 Demographische Daten aller in klinischen Studien mit Eprosartan behandelten Patienten Anzahl Patienten (%) Gesamt Mittleres Alter < 65 65 75 2334 56,8 ± 11,6 1653 (71%) 681 (29%) 124 (5%) Männlich Weiblich 1412 922 (60%) (40%) Kaukasisch Schwarze Andere 1904 255 175 (82%) (11%) (7%) Zusammenfassung: Eprosartan bei essentieller Hypertonie 600 mg einmal täglich von Beginn der Therapie an Antihypertensive Wirksamkeit über mindestens 24 Stunden nach einmaliger Einnahme (through to peak-ratio 67-88%) Verträglichkeit auf Placeboniveau Sichere Langzeit-Wirksamkeit (keine Tachyphylaxie) Additive Erhöhung der antihypertensiven Wirkung durch Kombination mit anderen Antihypertensiva Kein Rebound bei abruptem Absetzen Eprosartan – Wirkweise Hohe Affinität und Selektivität von Eprosartan für prä- und postsynaptische AT1-Rezeptoren – Vasodilatation durch Hemmung der präsynaptischen AT1Rezeptoren und Reduktion des Sympathikotonus – Blockade der AT1-Rezeptoren hemmt Wirkung von Angiotensin II bei der Entstehung und Vergrößerung cerebraler Läsionen Antihypertensiv wirksam unabhängig von Geschlecht, Alter oder Hautfarbe Nebenwirkungsrate auf Placeboniveau, daher Gewährleistung einer hohen Patientencompliance Signifikante Reduktion des wichtigsten Risikofaktors für den Schlaganfall: Systolischer Bluthochdruck Eprosartan und HCTZ – Wirksamkeit Zeit (Wochen) 2 -4 4 8 Eprosartan 600 mg Eprosartan 600 mg + HCTZ 12,5 mg Reduktion SBD (mmHg) -6 -8 -10 -12 -14 309 Hypertoniker (DBD 98 114 mmHg), Studiendauer 8 Wochen Sachse et al. J Hum Hypertens 2002 Eprosartan und HCTZ – Wirksamkeit Eprosartan (n=156) Eprosartan + HCTZ (n=149) Mittlere Reduktion diastolischer Blutdruck (mmHg) 0 -2 -4 -6 -7,9 -8 -10,7 -10 -12 p = 0,001 -14 309 Hypertoniker (DBD 98 114 mmHg), Studiendauer 8 Wochen Sachse, J Hum Hypertens 2002 Langzeitblutdrucksenkung mit Eprosartan und HCTZ Mittlerer Blutdruckwert (mmHg) 160 140 145,9 139,5 136 120 136,7 100 80 94,9 86,9 88,7 86,4 60 40 20 0 Studienbeginn (n=591) Abschluss der Titrationsphase nach 12 Monaten nach 24 Monaten (n=571) (n=300) (n=577) Mittlerer systolischer Blutdruck Mittlerer diastolischer Blutdruck 706 Hypertoniker (DBD 95 114 mmHg), Studiendauer 24 Monate Levine, Curr Med Res Opin 2001 Eprosartan und HCTZ – unerwünschte Ereignisse Unerwünschte Ereignisse, n (%) Benommenheit Schlaflosigkeit Schwindel Kopfschmerz Depression Anämie Eprosartan 600 mg OD (n=157) Eprosartan 600 mg + HCTZ 12,5 mg OD (n=152) 19 (12,1) 25 (16,4) 1 (0,6) 0 (0) 5 (3,3) 3 (2,0) 0 (0) 2 (1,3) 0 (0) 2 (1,3) 2 (1,3) 2 (1,3) 2 (1,3) 1 (0,7) 309 Hypertoniker (DBD 98 114 mmHg), Studiendauer 8 Wochen Sachse et al. J Hum Hypertens 2002 Eprosartan und HCTZ – Langzeitdaten zu unerwünschten Ereignissen Patienten mit unerwünschten Ereignissen (%) 20 18 Eprosartan 600 mg/HCTZ 12,5 mg Eprosartan > 600 mg/HCTZ 12,5 mg 16 14 6 offene Langzeitstudien, n=890 12 10 8 6 4 2 0 Böhm & Sachse, Drug Safety 2002 Langzeitsicherheit mit Eprosartan und HCTZ Dosis bei Auftreten unerwünschter Ereignisse Unerwünschte Ereignisse Aufgrund Studienmedikation Möglicherweise aufgrund Studienmedikation Wahrscheinlich nicht aufgrund Studienmedikation Nicht aufgrund Studienmedikation Gesamt 600 mg + 600 mg + HCTZ HCTZ 12,5 mg 25 mg (n=141) (n=100) 800 mg + HCTZ 12,5 mg (n=237) 800 mg + HCTZ 25 mg (n=208) 400 mg (n=705) 600 mg (n=568) 800 mg (n=292) % % % % % % % 1,4 1,2 0,0 1,4 1,0 1,7 1,0 8,8 8,6 8,6 11,3 10,0 4,2 13,5 13,2 13,0 13,4 11,3 23,0 13,9 23,6 30,2 30,8 30,8 39,0 55,0 38,4 63,9 41,8 41,0 38,0 47,5 65,0 45,1 69,2 706 Hypertoniker (DBD 95 114 mmHg), Studiendauer 24 Monate Levine, Curr Med Res Opin 2001 Zusammenfassung der Studien mit Eprosartan und HCTZ Eprosartan/HCTZ Dosierung Fixkombinationen, kontrollierte Studien (4 Studien) Offene Langzeitstudien (6 Studien) Vergleichsstudien mit Enalapril (2 Studien) Studien bei Gesunden (3 Studien) n Kontrollierte Studien bei systolischer Hypertonie (2 Studien) n n n n 600/12,5 268 30 23a 29 72 < 600/12,5 128 > 600/12,5 75 60a 600/25 263 mg/Tag < 600/25 232 > 600/25 Gesamt 628 46 232 290 94b 23 34 890 177 98 106 a = Patienten mit isolierter systolischer Hypertonie; b = Patienten mit schwerer systolischer Hypertonie Böhm & Sachse, Drug Safety 2002 Kombinationstherapie mit Eprosartan Die Kombination mit HCTZ erhöht gegenüber Monotherapie den Anteil der Patienten, die Zielblutdruckwerte erreichen Mit Eprosartan und HCTZ werden höhere ResponderRaten erreicht als mit Enalapril und HCTZ Die Kombination von Eprosartan mit Nifedipin erhöht die Responder-Rate gegenüber den Monotherapien Kombinationstherapien mit Eprosartan sind sicher und werden gut toleriert Anteil ausgewählter Todesursachen 2001 – Deutschland – Prozent 100 Übrige Sterbefälle Nichtnatürliche Sterbefälle 12,1% (ICD V00-V98) Krankheiten der Verdauungsorgane (ICD K00-K93) Krankheiten der Atmungsorgane übrige Krankheiten des Kreislaufsystems Krankheiten des cerebrovaskulären Systems 20,1% (ICD I60-I69) 4,1% 4,9% 5,9% (ICD J00-J99) Bösartige Neubildungen (ICD C00-C97) 47,3% Krankheiten des Kreislaufsystems (ICD I00-I99) 25,7% 22,8% Herzinsuffizienz und mangelhaft bezeichnete Herzkrankheiten (ICD I50-I51) sonstige ischämische Herzkrankheiten (ICD I24-I25) Myokardinfarkt (ICD I21-I22) 15,0% 50 24,0% 18,1% 0 Statistisches Bundesamt Definition der Hypertonie Systolischer Blutdruck von mindestens 140 mmHg und/oder Diastolischer Blutdruck von mindestens 90 mmHg leichte Hypertonie: 140-159 mmHg systolisch / 90-99 mmHg diastolisch Grenzwerthypertonie: 140-149 mmHg systolisch / 90-94 mmHg diastolisch mittelschwere Hypertonie: 160-179 mmHg systolisch / 100-109 mmHg diastolisch schwere Hypertonie: über 179 mmHg systolisch / über 109 mmHg diastolisch Deutsche Hochdruckliga 2001 Hypertonie – Risikostratifizierung 1/2 Risikofaktoren zur Risikostratifizierung: positive Familienanamnese Alter (Männer > 55 Jahre, Frauen > 65 Jahre) Schweregrad der Hypertonie – leicht (140-159 bzw. 90-99 mmHg) – mittelschwer (160-179 bzw. 100-109 mmHg) – schwer ( 180 bzw. 110 mmHg) Rauchen Hypercholesterinämie (> 6,5 mmol/l bzw. 250 mg/dl) Diabetes mellitus Hochdruckliga 2001 Hypertonie – Risikostratifizierung 2/2 Blutdruck (mmHg) Andere Risikofaktoren (RF) und Erkrankungen Schweregrad 1 (Leichte Hypertonie) SBD 140-159 o. DBD 90-99 Schweregrad 2 Schweregrad 3 (Mittelschwere Hypertonie) (Schwere Hypertonie) SBD 160-179 o. DBD 100-109 SBD 180 o. DBD 110 I Keine anderen Risikofaktoren niedriges Risiko mittleres Risiko hohes Risiko II 1-2 Risikofaktoren mittleres Risiko mittleres Risiko sehr hohes Risiko III 3 oder mehr RF oder Diabetes oder Endorganschäden hohes Risiko hohes Risiko sehr hohes Risiko IV Folge- und Begleitkrankheiten sehr hohes Risiko sehr hohes Risiko sehr hohes Risiko Hochdruckliga 2001 Hypertonie in Deutschland über 27 Mio. Hypertoniker knapp 14 Mio. therapiert etwa 4,5 Mio. kontrolliert Thamm, Gesundheitswesen 1999 Hypertonieprävalenz in Deutschland 1998 Frauen 100 100 80 80 Anteil (%) Anteil (%) Männer 60 40 60 40 20 20 0 0 1819 20- 30- 40- 50- 60- 7029 39 49 59 69 79 Jahre normoton grenzwertig hyperton kontrolliert hyperton 1819 20- 30- 40- 50- 60- 7029 39 49 59 69 79 Jahre Robert-Koch-Institut, Gesundheitssurvey 1998 Epidemiologie und Behandlungssituation der arteriellen Hypertonie in Deutschland Männer Frauen 80 80 60 60 kontrolliert behandelt entdeckt % 100 % 100 40 40 20 20 0 1984/85 1989/90 1994/95 0 1984/85 1989/90 1994/95 Hense, DMW 2000 Blutdruck und Alter Mittlerer Blutdruck (mmHg) 160 Männer Frauen 150 140 systolischer Blutdruck 130 120 110 100 Pulsamplitude 90 80 diastolischer Blutdruck 70 60 50 25-29 30-34 35-39 40-44 45-49 50-54 55-59 60-64 65-69 70-74 Alter (Jahre) Löwel et al. Herzmedizin 2001 Hypertonie – Subtypenverteilung Subtypenverteilung (%) 100 isolierte systolische Hypertonie 80 systolische-diastolische Hypertonie 60 isolierte diastolische Hypertonie 40 20 0 < 40 40-49 50-59 60-69 70-79 80 Alter (Jahre) Franklin et al. Hypertension 2001 Arterielle Hypertonie als zentraler kardiovaskulärer Risikofaktor Diabetes Genetische Disposition Alter Männer > 55 Frauen > 65 Inaktivität Hypertonie Stress übermäßiger Alkoholkonsum Übergewicht übermäßiger Kochsalzkonsum Blutdruckregulation durch das SNS – SNS Nebennierenmark Freisetzung von Adrenalin u. Noradrenalin Gefäße Herz Widerstandsgefäße Herzfrequenz Kontraktion Große Arterien Barorezeptoren Hypertonie - Pathomechanismen RAS SNS Volumenretention Vasokonstriktion Inotropie Endothel Blut Endotheldysfunktion Thrombogenese & Inflammation Hypertonie Arteriosklerose Hypertonieentstehung Erhöhtes Herzzeitvolumen SNS Stimulation Druckanstieg in peripheren Gefäßen Druck Strukturelle Änderungen Sklerose Kontraktion der glatten Muskulatur Mediahypertrophie Renin-Angiotensin-Aldosteron-System und ACE-Hemmer Bradykinin, Substanz P ACE Renin ACE-Hemmer Angiotensin I Angiotensinogen Angiotensin II Abbau durch Angiotensinasen Wechselwirkungen zwischen RAS und SNS Gehirn Angiotensin II Aktivierung SNS ACE Ausschüttung Angiotensin I Noradrenalin Aktivierung Renin RAS Angiotensinogen Angiotensin II-Rezeptoren AT1-vermittelte Wirkungen AT2-vermittelte Wirkungen Gefäße: Vasokonstriktion, Hypertrophie Niere: Renin-Sekretion, Natriumretention Nebenniere: Aldosteron-, Katecholamin-Freisetzung Sympathikus: Noradrenalin-Freisetzung Herz: Hypertrophie, Inotropie, Chronotropie Gehirn: Durst, Verstellung der RR-Regulation, synaptische Transmission Hypophyse: ADH-, ACTH-, LH-, u.a.- Freisetzung Wachstumshemmung, Zelldifferenzierung, Hemmung der Neointimabildung Antihypertensiva-Klassen – Einnahme nach 1 Jahr Therapietreue nach 1 Jahr 70 64%* 60 58% 50 50% 40 43% 38% 30 20 10 0 Diuretika p<0,007 vs ACE-Hemmer Betablocker Calciumantagonisten ACEHemmer AT1Blocker Bloom, Clin Ther 1998 ISH als Risikofaktor im Alter Kardiovaskuläre Ereignisse/1000 Pat. Männer Frauen 100 100 80 80 60 60 40 40 20 20 0 74119 140159 180300 0 65-94 Jahre 35-64 Jahre 74119 140159 180300 systolischer Blutdruck Trenkwalder, Der Internist 2000 Isolierte systolische Hypertonie – Entstehung Herz und Aorta ohne Funktionsstörung Aorta dehnt sich Herz und Aorta bei ISH Reflektion Druck Druck Aorta dehnt sich kaum Zeit Zeit Hypertonierisiko in Abhängigkeit vom Körpergewicht Relatives Risiko für Hypertonie 7 6 5 4 3 2 1 0 < 20 20,0 20,9 21,0 21,9 22,0 22,9 23,0 23,9 24,0 24,9 25,0 25,9 26,0 27,9 28,0 30,9 31 BMI (kg/m2) Huang et al. Annals Internal Med 1998 Hypertonierisiko und körperliche Fitness Follow-up 6-12 Jahre Relatives Risiko der Hypertonieentstehung 5 4 3 2 Follow-up 1-5 Jahre 1 0 Hoch Niedrig Hoch Niedrig Körperliche Fitness Blair et al. JAMA 1984 Hypertonierisiko und Job Strain Bodymass-Index 1,33 Regelmäßiger Alkoholkonsum 2,76 Hoher "Job strain" 3,09 0 1 2 3 4 Relatives Risiko für Hypertonie Schnall et al. J Am Med Assoc 1990 Risiko der Hypertonieentstehung (%) Hypertonieentstehung bei normotonen 55- bzw. 65-jährigen Männern 100 1970 - 1998 1952 - 1975 80 60 40 20 0 0 2 4 6 8 10 12 14 16 18 20 Follow-up (Jahre) Vasan R S et al. JAMA 2002 Hypertonie, Adipositas und LVH Frauen 120 100 110 90 LVMI (g/m2) LVMI (g/m2) Männer 100 70 80 60 140-159/ 90-94 < 140/90 Männer u. Frauen, 25-74 J. MONICA-Projekt Augsburg 1994/1995 BMI 25-30 BMI > 30 80 90 160/90 Bodymass-Index (BMI) < 25 160/90 140-159/ 90-94 < 140/90 Hense, DMW 2000 Kardiovaskuläre Risikofaktoren und relatives Infarktrisiko Männer 40 Inzidenzrate (pro 1000 und Jahr) 11,1 30 8,3 20 10 6,5 2,7 2,8 4,2 RR= 1,0 1,5 Hypertonie 160/95/Rx - - + - + + - + TC/HDL·C 5,5 - - - + + - + + Rauchen ( 1 Zig./Tag) - + - - - + + + 0 RR = relatives Risiko Hense, DMW 2000 Vorerkrankungen bei Herzinfarkt-Patienten Männer Frauen 80 58 60 55 50 46 40 34 27 24 20 20 0 Vorerkrankungen bei Patienten mit Herzinfarkt (%) Vorerkrankungen bei Patienten mit Herzinfarkt (%) 80 1985/87 1995/97 67 68 60 60 59 40 34 34 27 22 20 0 Hypertonie KHK Angina Diabetes pectoris mellitus Hypertonie KHK Angina Diabetes pectoris mellitus Stat. Bundesamt Hypertonie und Herzinsuffizienz aktiviertes RAS arterielle Hypertonie gesteigerte Nachlast Herzinsuffizienz KHK Myokardhypertrophie Prävalenz der Mikroalbuminurie bei Hypertonikern 25 Männer Frauen < 140/90 140-159/90-94 Prävalenz (%) 20 160/95 Antihypertensiva 15 10 5 0 Männer u. Frauen, 25-74 J. MONICA-Projekt Augsburg 1994/1995 Hense, DMW 2000 Renoprotektive Effekte der AT1-Blocker bei Typ-2-Diabetes – RENAAL, IDNT, IRMA Verringerte Progression von Mikroalbuminurie zu diabetischer Nephropathie Reduktion des Fortschreitens zur terminalen Niereninsuffizienz Renoprotektive Effekte der AT1-Blocker bei Hypertonikern – LIFE Geringere Inzidenz neu auftretender Diabetes mellitus Brenner et al. NEJM 2002, Lewis E J et al. NEJM 2001, Parving H H et al. NEJM 2001, Dahlöf et al. Lancet 2002 Therapieschema bei arterieller Hypertonie Monotherapie Betablocker Diuretikum Zweifachkombinationen Kalziumantagonist* ACE-Hemmer AT1-Blocker z.B. Eprosartan Diuretikum plus Betablocker Kalziumantagonist* ACE-Hemmer AT1-Blocker z.B. Eprosartan oder Kalziumantagonist* plus Betablocker *Untergruppen beachten! ACE-Hemmer AT1-Blocker z.B. Eprosartan Nach Hochdruckliga Nutzen konsequenter antihypertensiver Therapie Reduktion durch Behandlung (Odds ratio, %) 40 30 20 10 0 Schlaganfall KHK vaskuläre Todesfälle sonstige Todesfälle Hochdruckliga 2001 Anforderungen an eine optimierte HypertonieTherapie „Dauerhaft effektive und erfolgreiche Therapie!“ Blutdrucknormalisierung Positive Beeinflussung von Begleiterkrankungen Weitgehende Nebenwirkungsfreiheit Einmal tägliche Dosierung Breite Anwendbarkeit (unabh. von z.B. Alter, Begleittherapien) Reduktion des Auftretens von Schlaganfällen und kardiovaskulären Folgeschäden STARLET – Rationale Rationale – Ermittlung der Inzidenz arbeitsbedingter Hypertonie – Vergleich der Einstellbarkeit und cerebrovaskulären Ereignisrate bei arbeitsbedingter und nichtarbeitsbedingter Hypertonie Primärer Endpunkt Mittlere Blutdrucksenkung Sekundärer Endpunkt Kardiovaskuläre Ereignisse STARLET – Patientenkollektiv 4.500 Berufstätige zwischen 35 - 60 Jahren; Rekrutierung durch werksärztlichen Dienst oder Hausarzt Normotone (n = 1.500), Hypertoniker mit erhöhten Blutdruckwerten während der Arbeitszeit (n = 1.500), Hypertoniker mit gleichen Blutdruckwerten während Arbeit und Freizeit (n = 1.500) Obligatorische ABDM während eines Arbeitstages, Fragebogen zur mentalen Belastung Schlaganfall – Die Situation Über 250.000 Schlaganfälle pro Jahr in Deutschland Frühletalität 26 - 45% Über 1 Mio. Menschen leben mit den Folgen eines Schlaganfalls Geschätzte Kosten pro Jahr: 7,5 Mrd. EUR 70% aller Schlaganfall-Patienten sind Hypertoniker Senkung erhöhter Blutdruckwerte reduziert die Schlaganfallinzidenz um bis zu 47% Relatives Risiko (%) Schlaganfall-Mortalität 10 systolischer Druck 8 diastolischer Druck 6 4 2 0 1 2 (niedrigste 10 %) RR < 112/71 3 4 5 Dezile 6 7 8 9 10 (höchste 10 %) RR > 151/98 Stamler et al. Arch Intern Med 1993 LIFE – Blutdrucksenkung Atenolol Losartan 180 Systolisch 160 mmHg 140 120 Mittel 100 Diastolisch 80 60 40 0 6 12 18 24 30 36 42 48 54 Zeit (Monate) Dahlöf et al. Lancet 2002 LIFE – Endpunkte Schlaganfälle Primärer Komposit-Endpunkt Atenolol Losartan 14 12 10 8 6 4 Adjustierte Risikoreduktion: 13,0%; p=0,021 2 0 0 Anzahl Patienten 7 6 5 4 3 2 Adjustierte Risikoreduktion: 24,9%; p=0,0010 1 0 6 12 18 24 30 36 42 48 54 60 66 Zeit (Monate) (tödlich und nicht-tödlich) 8 Patienten mit Erstereignis (%) Patienten mit Erstereignis (%) 16 0 Anzahl Patienten Losartan Losartan Atenolol Atenolol 6 12 18 24 30 36 42 48 54 60 66 Zeit (Monate) Dahlöf et al. Lancet 2002 ALLHAT – Reduktion der Schlaganfall-Inzidenz Kumulierte Ereignisrate (%) 10 Chlortalidon Amlodipin Lisinopril 8 6 4 2 0 0 1 15.255 9.048 9.054 3 4 5 6 7 3.217 1.813 1.828 567 506 949 Zeit bis Ereignis (Jahre) Anzahl Patienten Chlortalidon Amlodipin Lisinopril 2 14.515 8.517 8.543 13.934 8.271 8.172 13.309 7.949 7.784 11.570 6.937 6.765 6.385 3.845 3.891 ALLHAT, JAMA 2002 ANBP 2 – Blutdrucksenkung 170 ACE-Hemmer Diuretika 160 Systolisch Blutdruck (mmHg) 150 140 130 95 90 Diastolisch 85 80 75 0 Anz. Patienten mit Blutdruckmessung Systolisch 6.083 Diastolisch 6.083 1 2 3 4 5 5.487 5.487 4.323 4.320 1.183 1.183 Jahre 6.035 6.035 5.585 5.583 Wing et al. NEJM 2003 ANBP2 – Endpunkte Primäre Endpunkte Gesamtmortalität + kardiovaskuläres Ereignis Gesamtmortalität + erstes kardiovaskuläres Ereignis Gesamtmortalität Männer Gesamtmortalität + kardiovaskuläres Ereignis Gesamtmortalität + erstes kardiovaskuläres Ereignis Gesamtmortalität Frauen Gesamtmortalität + kardiovaskuläres Ereignis Gesamtmortalität + erstes kardiovaskuläres Ereignis Gesamtmortalität Hazard ratio (95% KI) p-Wert 0,89 (0,79-1,00) 0,05 0,89 (0,79-1,01) 0,06 0,90 (0,75-1,09) 0,27 0,83 (0,71-0,97) 0,02 0,83 (0,71-0,97) 0,02 0,83 (0,66-1,06) 0,14 1,00 (0,83-1,21) 0,98 1,00 (0,83-1,20) 0,98 1,01 (0,76-1,35) 0,94 ACE-Hemmer besser 0,2 Diuretika besser 1,0 5,0 Wing et al. NEJM 2003 Hypertonie und Demenz Abnahme Bei mittlerer Senkung des diastol. Blutdruck Placebo Nitrendipin 0 Zunahme Demenzsymptome (MMSE-Punktezahl) 0,3 Bei mittlerer Senkung des syst. Blutdruck -0,3 p=0,03 p=0,002 Forette et al. Lancet 1998 PROGRESS – Reduktion der Schlaganfall-Inzidenz Schlaganfall-Inzidenz (%) 20 Placebo Perindopril/ Indapamid 15 10 5 p<0,0001 0 0 1 3 4 2.634 2.551 1.595 1.533 Follow-up (Jahre) Anzahl Patienten Perindopril/Indapamid 3.051 Placebo 3.054 2 2.902 2.880 2.765 2.707 PROGRESS, Lancet 2001 PROGRESS – Subgruppenanalyse Schlaganfall Ereignisse/Patienten Verum Placebo Kombinationstherapie Monotherapie Hypertensiv Normotensiv Gesamt 150/1770 157/1281 163/1464 144/1587 307/3051 Schlaganfall-Subtypen Tödl. oder schwerbehindert Nicht tödl. oder schwerbehindert Ischämischer Schlaganfall Cerebrale Blutungen Subtyp nicht bekannt Gesamt Relative Hazard ratio Risikoreduktion Verum Placebo (95% KI) besser besser 255/1774 165/1280 235/1452 185/1602 420/3054 43% (30 - 54) 5% (-19 - 23) 32% (17 - 44) 27% (8 - 42) 28% (17 - 38) Anzahl Ereignisse Verum Placebo (n=3051) (n=3054) 123 201 246 37 42 307 181 262 319 74 51 420 33% (15 - 46) 24% (9 - 37) 24% (10 - 35) 50% (26 - 67) 18% (-24 - 45) 28% (17 - 38) 0,5 1,0 2,0 PROGRESS, Lancet 2001 Eprosartan zur Schlaganfallprophylaxe Reduziert zuverlässig den wichtigsten Risikofaktor für den Schlaganfall Sicherung einer guten Compliance durch Nebenwirkungsrate auf Placeboniveau Senkt besonders den systolischen Blutdruck, der bei Hypertonikern über 60 Jahren nahezu immer erhöht ist Blockiert cerebrale AT1-Rezeptoren und kann so den Effekt von Angiotensin II bei der Entstehung cerebraler Läsionen reduzieren MOSES – Rationale Rationale Überprüfung des Nutzens einer antihypertensiven Therapie bei Hypertonikern nach cerebraler Ischämie Primärer Endpunkt Beurteilung der Gesamtmortalität und der Gesamtzahl kardiovaskulärer und cerebrovaskulärer Ereignisse Sekundäre Endpunkte – Mortalität und Morbidität aufgrund rezidivierender cerebrovaskulärer Ereignisse – funktionelle Leistungsfähigkeit (Barthel-Index, Rankin Scale) – mentale Leistungsfähigkeit (Mini Mental Score) MOSES – Patientenkollektiv 1.405 Patienten Hypertoniker (Bluthochdruck > 140 und/oder > 90 mmHg) mit maximal 24 Monate zurückliegender cerebraler Ischämie obligatorische ABDM, Tagesmittelwert > 135 und/oder > 85 mmHg Ausschlusskriterien u.a. – hochgradige Carotisstenose – schwere Herzfunktionsstörungen – Alter über 85 Jahre – Quincke-Ödem MOSES – Studienablauf MOSES-Studie (Morbidity and Mortality after Stroke – Eprosartan vs Nitrendipine for Secondary Prevention) Essentielle Hypertonie nach cerebraler Ischämie (Apoplex/TIA in den letzten 24 Monaten, Ausschluss: relevante Carotis-Stenose) 1.405 Patienten Randomisierung 710 695 Eprosartan Nitrendipin 600 mg/d ggf. additive Medikation 10-20 mg/d ggf. additive Medikation Zielgrößen primäre Endpunkte: sekundäre Endpunkte: Mortalität, Hospitalisierung neurologische Defizite, Blutdrucksenkung