Das Gravitationsgesetz
Werbung

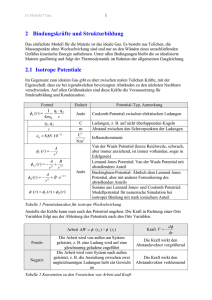
Aufbau der Materie: Die kovalente Bindung Inhalt Anisotrope Wechselwirkung: Kovalente Bindung • Voraussetzung: Verfeinerung des Bohrschen Atommodells • Symmetrie der Orbitale Quantenmechanik für die an einen Kern gebundenen Elektronen in drei Dimensionen • Die Schrödingergleichung wird für Potential und Wellenfunktion in drei Dimensionen aufgestellt • Es ergeben sich vier Quantenzahlen: – – – – Hauptquantenzahl n, Energie ~1/n2 Drehimpuls- oder Orbitalquantenzahl l, Magnetische Quantenzahl m und die Spin-Quantenzahl ±1/2 • Analog zu den Eigenschwingungen gekoppelter, identischer Oszillatoren unterscheiden sich die Auslenkungsmuster in ihren Symmetrieeigenschaften – vergleiche mit den beiden Eigenschwingung des „gekoppelten Pendels“ in einer Dimension Die kovalente Bindung • Durch die Form der Orbitale ergeben sich bevorzugte Richtungen: – Im Gegensatz zur reinen Ionenbindung, wo das Ion als kugelförmiger Ladungsträger erscheint, gibt es gerichtete Ladungsbrücken zwischen den Teilchen • erzeugt durch ein Elektronenpaar, das zur Ladungswolke von beiden Partnern gehört Orbitalformen (1) l 1 Symmetrie m0 m 1 t1 g m 1 Orbitalformen (2) l 2 Symmetrie m 2 m 1 t2 g m 1 Orbitalformen (3) l 2 Symmetrie m 2 eg m0 Folge: Anisotrope Bindung Bindung in Richtung des Abstandsvektors Eine Bindung senkrecht zum Abstandsvektor: in Cl2 und eine Bindung gibt es z. B. in N2 Beispiel: Orbitale im Neon HauptDrehimpuls- oder quantenzahl Nebenquantenzahl OrientierungsMax. Zahl Quanten- der Zustände zahl Schale, Orbital l m l Spin Typ N Schale 0 l N 1 1 K 0 s 0 0 s 0 2 L -1 1 p 0 1 2 2 6 Form der Orbitale Beispiele für kovalente Bindung • Der Kohlenstoff in Diamant, Graphit und Fulleren unterscheidet sich auf atomarer Ebene nur der Form der seiner Orbitale • Es resultieren unterschiedliche Arten der Bindung – unterschiedliche Strukturen – mit unterschiedlichen physikalischen Eigenschaften Diamant Gittertyp Aufbau Substanzen Diamant, C, (sp3 Hybridisierung) A4 Diamant (C)-Typ Si Ge Sn (α) : Grauer Zinn • Hybridisierung: Im Diamant mischen sich ein kugelsymmetrisches s-Orbital und 3 p Orbitale zu einem einzigen Orbital mit Tetraeder Form. Auf diese Weise entsteht aus dem Kohlenstoff das Diamant Gitter, indem die Tetraeder über die Ecken miteinander verknüpft sind Graphit sp 32 Gittertyp GraphitGitter Aufbau Substanzen Graphit, C, (sp2 Hybridisierung) • Graphit mit kovalenter Bindung innerhalb der Schichten und van der Waals Bindung zwischen den Schichten Fulleren Gittertyp FullerenMolekül C60 Aufbau Substanzen Durchmesser ungefähr 10 Å, Hohlraum etwa 7 Å Durchmesser • Im Fulleren Molekül gibt es zwei einfache- und eine Doppelbindung zu den Nachbarn Zusammenfassung Anisotrope Wechselwirkung entsteht durch anisotrope Orbitale: – Folge der Quantenmechanik, jenseits des Bohrschen Atommodells • Folge: kovalente Bindung • Die meisten Bindungen zeigen Mischungen von ionischen und kovalenten Anteilen • Beispiel: Kohlenstoff als Diamant, Graphit und Fulleren. Diese Stoffe unterscheiden sich in der Form der Orbitale und deshalb in – Art der Bindung – Struktur – physikalischen Eigenschaften Finis

![AllgChemieOCTeil1 [Kompatibilitätsmodus]](http://s1.studylibde.com/store/data/010817604_1-7f9ee8df4cd1924f9069f5acbb3c9bd3-300x300.png)