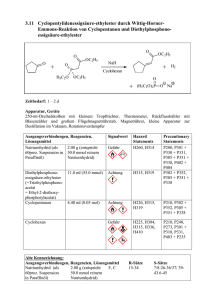
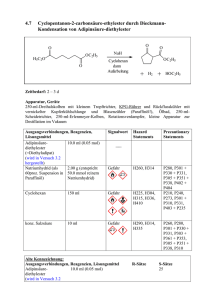
Siedepunktserhöhung
Werbung

Gefrierpunktserniedrigung & Siedepunktserhöhung Ein Referat von Jessica Büschgens und Oliver Flock Bergische Universität Wuppertal Fachbereich C Physikalische Chemie WS 05/06 Gliederung: Das Phänomen Anwendung im Alltag Theoretische Grundlagen Die Gesetze und deren Herleitung Der Praktikumsversuch und seine Auswertung Methoden zur Molmassenbestimmung Das Phänomen Meerwasser gefriert erst bei wesentlich niedrigeren Temperaturen als Süßwasser. Mit gelösten Stoffen muss mehr Energie aufgewendet werden um Wasser zum sieden zu bringen. Es kocht erst bei einer höheren Temperatur Anwendung im Alltag: Gerade zu dieser kalten Jahreszeit kennt jeder das Problem: Eis und Schnee. Damit verbunden ist immer die Eisglätte. Deshalb wird , wie jeder weiß in den meisten Städten Salz gestreut. Theoretische Grundlagen: Die treibende Kraft für die Siedepunktserhöhung und die Gefrierpunktserniedrigung ist die Entropie! Sie strebt einem Maximum zu, wodurch der Stabilitätsbereich der flüssigen Phase vergrößert wird. Phasengleichgewicht eines Zweikomponentensystems Wir nehmen an: Das System besteht aus einer Lösung und einer Dampfphase Die gelöste Substanz ist nicht flüchtig und trägt nicht zum Dampfdruck der Lösung bei Es finden keine chemischen Reaktionen zwischen den Komponenten statt. Die Gesetze und deren Herleitung Im Phasengleichgewicht gilt: 1 1 Für das chemische Potential einer Mischphase gilt: * 1 1 ( p, T ) ( p, T ) RT ln a1 Abhängigkeit des chemischen Potentials in Mischphasen vom Molenbruch i ( p , T ) ( pi , T ) * i G i ni p ,T ,ni i ? p T Wenn partielle molare Größen verwendet werden, kann mit dμ genauso wie G behandelt werden: v p T mit R T v p R T p p T R T p p T Nach Variablenauftrennung RT d dp p dp * d RT p p und Integration pi i RT ln p * i pi bzw. i RT ln i * i Da χ < 1 ist, ist das chemische Potential in der Mischphase erniedrigt. Nach Plank gilt dies auch für die Kondensierte Phase. * 1 * 1 RT ln a1 Änderung der Temperatur mit der Menge des gelösten Stoffes * 1 d * 1 d ( RT ln a1 ) d G i ni p ,T ,ni i d dT dp T p p T mit dp = 0 d s dT s dT RT d ln a1 s dT RT dlna 1 s T ln a1 ps * 1 s s * 1 RT 2 * 1 dT * 1 s T ln a1 RT ps s * 1 2 s * 1 T ln a1 s s S RT ps s * 1 Änderung der Entropie beim Übergang von der Kondensierten Phase in die Gasphase Definitionsgleichung der Entropie: mit p = konst. s * 1 2 dQrev S T H Q dH S T T ln a1 2 ps RT V H ΔVH = Verdampfungsenthalpie Um nun die Siedepunktserhöhung als Funktion der gelösten Stoffmenge zu erhalten, muß man in den Grenzen TS* - TS und a=1 – a1 integrieren. V H dT d ln a1 RT ² 1 T* TS s a1 H R V Im Mathebuch steht: 1 TS 1 * TS ln a1 ln a1 ln 1 a2 Man kann nun folgende Reihe entwickeln: 1 2 1 3 ln 1 a2 a2 a 2 a3 ... 2 3 Wobei für sehr kleine a2, nach dem ersten Term abgebrochen wird: ln 1 a2 a2 V H R TS* TS * a2 TS TS 2 mit T S* . T S ≈ TS2 TS T S T * S RT a2 VH Da alle Faktoren positiv sind, kommt es zu einer Siedepunktserhöhung! T 0 Gefrierpunktserniedrigung: T ln a1 si*β – si* = ΔmH T ln a1 RT ps s * 1 2 s * 1 Schmelzenthalpie 2 ps RT mH Man integriert analog zur Siedepunktserhöhung in die Grenzen TS* - TS und a=1 – a1. 2 Tm Tm T * m RT a2 mH Da Tm*2 und ΔmV positive Werte sind, wird der rechte Term negativ: T 0 Es kommt also zu einer Gefrierpunktserniedrigung! Der Praktikumsversuch: Das Ziel Aufbau Die Durchführung Die Auswertung Das Ziel: Ziel des Versuches ist es die Molmasse einer Unbekannten Substanz zu Bestimmen Aufbau: Die Durchführung: Es wird eine bekannte Menge eines unbekannten Stoffes in eine bekannte Menge Cyclohexan gegeben. Das Ganze wird in ein Eiswasserbad (mit gelöstem Salz) gestellt Somit wird die Cyclohexan/Salz-Mischung bis unter den Gefrierpunkt abgekühlt Die Temperatur wird alle 30 Sekunden gemessen Alle 2 Sekunden sollte das Cyclohexangemisch durchmischt werden Zur Temperaturmessung wird ein Beckmannthermometer benutzt EXKURS: Das Beckmannthermometer Das Beckmannthermometer wird bei niedrigen Temperaturdifferenzen benutzt Skala umfasst in der Regel nur 5K mit 100stel Gradteilung Quecksilbermenge ist variabel -> für unterschiedliche TemperaturBereiche verwendbar (-20°C - 120°C) Das Beckmann Thermometer muss vorher geeicht werden Hierbei muss der Gefrierpunkt des reinen Cyclohexans auf dem Skalenteil auf 5 geeicht werden. (Wird vom Dozenten gemacht!!!!) Auswertung: Man trägt Die Temperatur gegen die Zeit auf Man erstellt 2 Regressionsgeraden für den oberen und den unteren Ast Berechnung des Schnittpunktes (ΔTF) Berechnung von KF Und kann nun die Molmasse errechnen Berechnung der Schnittpunkte: Gleichsetzten der beiden Geradengleichungen: 0,0137x + 0,0926 = 0,0003x + 3,0622 0,0134x = 2,9696 X = 221,6119 Einsetzten in eine Geradengleichung: y = 0,0137 * 221,6119 + 0,0926 y = 3,1287 ΔTF ist also 3,173° Die Berechnung von KF nach der Formel: M0 RT 2 KF * 1000 H S ,m mit M0: Molmasse des Lsg.mittels Cyclohexans (84,16 g/mol) R: 8,3143 KJ/mol*K ΔHs,m: Molare Schmelzwärme Cyclohexan (2,63) Mit KF und ΔTF sowie den eingesetzten Massen kann man die Molmasse bestimmen: Einsatz: Cyclohexan: mLsgm (Bsp.: 11,4454g) Einsatz Stoff: mStoff (Bsp.: 0,0643g) mStoff KF M 1000 * * mLsgm TF 0,0643g 74,419 g * K M 1000 * * 11,4454 g 3,173K 131,76 g Methoden zur Bestimmung der Molmasse: Gefrierpunktserniedrigung Siedepunktserhöhung Osmometrie Osmometrie: Osmotischer Druck ist besonders für den Flüssigkeitstransport tierischer und pflanzlicher Zellen wichtig Osmolarität gibt die Anzahl des osmotisch aktiven Teilchen pro Liter Lösungsmittel bzw. Untersuchungsmaterial an Im Labor wird die Bestimmung mit Osmometer bestimmt Osmometrie: Die Methode wird besonders zur Charakterisierung von Makromolekülen verbreitet Osmometrie ist eine wichtige Methode zur Bestimmung der Molmassen von Polymeren