ppt - ChidS
Werbung

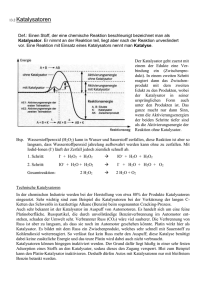
Experimentalvortrag AC Wasserstoffperoxid H2O2 Andrea Ost Gliederung 1. Sicherheitshinweise 2. Herstellung 2.1 Nachweise 3. Eigenschaften 3.1 Physikalische 3.2 Chemische 4. Anwendungsgebiete 5. Vorkommen in der Natur 6. Physiologisches 7. Schulrelevanz 1. Sicherheitshinweise • Gefahrensymbole: O Brandfördernd C Ätzend • Sicherheitshinweise: • Beim Erwärmen explosionsfähig • Verursacht schwere Verätzungen • geeignete Schutzkleidung, Schutzhandschuhe, Gesichtsschutz tragen 1. Sicherheitshinweise 2. Herstellung 2.1 Nachweise 3. Eigenschaften 3.1 Physikalische 3.2 Chemische 4. Anwendungsgebiete 5. Vorkommen in der Natur 6. Physiologisches 7. Schulrelevanz 2. Herstellung Historisches zur Herstellung • 1818: Entdeckung von H2O2 durch Louis Jacques Thénard (Erfinder des Thénards-Blau) Er stellte diese Chemikalie durch Zersetzen von Bariumperoxid her! 2. Herstellung Versuch 1 Herstellung von H2O2 2. Herstellung Versuch 1 Herstellung von H2O2 BaO2 (s) + 2 HNO3 (aq) Ba2+(aq) + NO3-(aq) + H2O2 (aq) O22-(aq) + 2 H3O+(aq) H2O2 (aq) + 2 H2O 2. Herstellung 2.1 Nachweis -2 -1 [TiOSO4] . n H2O (aq) + H2O2 -1 [Ti(O2)SO4] . n H2O (aq) -2 + 2 H2O gelb-orange Nebenreaktion: Ba2+(aq) + SO42-(aq) BaSO4 (s) ↓ weiß schwerlöslich 2. Herstellung Großtechnische Herstellung • Früher: elektrolytische Oxidation von Schwefelsäure/ Sulfat-Lösungen • Heute: Anthrachinon-Verfahren H2O2 fällt im Produktionsprozess als wässrige Lösung an (15-40%) Reinigung und anschließende Destillation (50-70%) Stabilisierung und Lagerung oder weiteres Aufkonzentrieren, z.B. durch erneute Destillation oder Gefrierkristallisation 2. Herstellung Crystallized H2O2 100% 2. Herstellung Das Anthrachinonverfahren H2 Katalysator (Pt) 40°C; 5 bar OH O R R O Anthrachinon H2O2 30-80°C; 5 bar OH Anthrahydrochinon O2 1. Sicherheitshinweise 2. Herstellung 2.1 Nachweise 3. Eigenschaften 3.1 Physikalische 3.2 Chemische 4. Anwendungsgebiete 5. Vorkommen in der Natur 6. Physiologisches 7. Schulrelevanz 3. Eigenschaften von H2O2 3.1 Physikalische Eigenschaften von H2O2 • Fast farblose Flüssigkeit, in dicker Schicht bläulich • Hoch konzentriertes H2O2 ist sirupös (Wasserstoffbrückenbindungen) H2O2 rein -0,4 °C • M(H2O2) = 34,02 g/mol • Dichte: 1,45 g/cm3 • Im Handel (Labor): 30%-Lsg. H2O2 rein + 150 °C 3. Eigenschaften von H2O2 3.2 Chemische Eigenschaften von H2O2 • Sehr schwache Säure • H2O2 hat die Strukturformel ---- ---- H-O-O-H ---- ---- • Die Kette ist allerdings nicht linear, sondern verdrillt 3. Eigenschaften von H2O2 • Die BE beträgt 144 kJ/mol Abstoßung immer noch vorhanden O-O-Bindung schwach! H2O2 = metastabile Verbindung Starkes Zerfallsbestreben! 3. Eigenschaften von H2O2 Zersetzung: -1 2 H2O2 -2 0 2 H2O + O2 (g) ∆H = - 98 kJ/mol Initiierung durch OH - Radikale: H2O2 2 OH(aq) H2O2 + OH(aq) HO2 (aq) + H2O2 ∆H = 211 kJ/mol H2O + HO2 (aq) H2O + O2 (g) + OH(aq) 3. Eigenschaften von H2O2 Bedingungen für Zersetzung: • Erhöhte Temperatur • Spuren von Schwermetallionen (z.B. Fe3+, Mn2+) • Alkalisch reagierende Stoffe (z.B. Alkalimetalle) Evtl. plötzliche Explosion! Gegenmaßnahmen: • Zugabe von Stabilisatoren (Phosphate und Stannate = Chelatbildner) 3. Eigenschaften von H2O2 Redoxamphoterie – H2O2 wirkt häufig oxidierend (in saurer + alkal. Lsg.) – Gegenüber starken Oxidationsmitteln wirkt es jedoch reduzierend H2O2 kann sowohl als Oxidations- als auch als Reduktionsmittel fungieren! 3. Eigenschaften von H2O2 Versuch 2 Wasserstoffperoxid als Oxidationsmittel 3. Eigenschaften von H2O2 Versuch 2 Wasserstoffperoxid als Oxidationsmittel MnSO4 (s) + 2 OH-(aq) Mn(OH)2 (aq) + SO42-(aq) Redoxgleichung +2 -1 Mn(OH)2 (aq) + H2O2 (aq) +4 -2 -2 MnO(OH)2 (s) + H2O braunschwarz 3. Eigenschaften von H2O2 Versuch 3 Wasserstoffperoxid als Reduktionsmittel 3. Eigenschaften von H2O2 Versuch 3 Wasserstoffperoxid als Reduktionsmittel -1 Oxidation 5 H2O2 (aq) 0 5 O2 (g) + 10 H+(aq) + 10 e- +7 Reduktion 2 MnO4-(aq) + 10 e- +2 2 Mn2+(aq) + 8 O2-(aq) Redoxgleichung +7 2 MnO4-(aq) violett -2 +6 H3O+(aq) -1 + 5 H2O2 (aq) +2 -2 2 Mn2+(aq) + 14 H2O blassrosa 0 + 5 O2 (g) 1. Sicherheitshinweise 2. Herstellung 2.1 Nachweise 3. Eigenschaften 3.1 Physikalische 3.2 Chemische 4. Anwendungsgebiete 5. Vorkommen in der Natur 6. Physiologisches 7. Schulrelevanz 4. Anwendungsgebiete Chem. Industrie Papierindustrie Waschmittelzusätze Textilindustrie H2O2 Antriebssysteme Wasserbehandlung Kosmetik Desinfektion 4. Anwendungsgebiete Von Degussa produziertes H2O2 Eigener Captive Use Verbrauch 14% 14% Verschiedenes Verschiedene 9% 9% Umweltschutz Umweltschutz 3%3% Textil 9% Textil 9% Chem. Industrie Chem. Industrie 10% 10% Papierindustrie Papierindustrie 55% 55% 4. Anwendungsgebiete Demo 1 Deinking/ Chlorfreie Bleiche 4. Anwendungsgebiete Demo 1 Deinking/ Chlorfreie Bleiche -1 H2O2 + -2 OH-(aq) -1 HO2-(aq) -2 -1 H2O + HO2-(aq) -2 0 OH-(aq) + [O](g) nascierender Sauerstoff 4. Anwendungsgebiete Demo 2 Blondierung mit H2O2 4. Anwendungsgebiete Demo 2 Blondierung mit H2O2 Melanozyten MelaninKörner • Basen quellen das Haar auf • H2O2 kann eindringen und Melanin oxidieren 4. Anwendungsgebiete Beispiel Eumelanin R O • Durch Angriff der Hydroperoxidanionen: Ringöffnung N H O R Delokalisation der Elektronen eingeschränkt Haarfarbe wird aufgehellt 4. Anwendungsgebiete Versuch 4 „Elefantenzahnpasta“ 4. Anwendungsgebiete Versuch 4 „Elefantenzahnpasta“ -1 -1 I-(aq) + H2O2 +1-2 -1 IO-(aq) + H2O2 +1-2 -2 IO-(aq) + H2O -1 I-(aq) + H2O (g) ↑ + O2 (g)↑ -2 0 4. Anwendungsgebiete Verwendung von H2O2 für Raketenantriebe Degussa ist der weltweit zweitgrößte H2O2-Produzent (600.000 t/a) Auftrag von russischer Weltraumbehörde: 50 t H2O2 (82,5%) bis 2009 für Sojus-Raketen Lieferung nach Kourou (Französisch-Guayana) in Spezial-Behältern (gebeizt, passiviert) mit Temperatur- und GPS-Überwachung 4. Anwendungsgebiete „Das flüssige H2O2 zersetzt sich an einem Schwermetallkatalysator unter großer Hitzeentwicklung. Es entstehen gasförmiger Sauerstoff und Wasserdampf. Gemeinsam treiben diese die Turbopumpen an, die mit 20.000 bis 30.000 Umdrehungen pro Minute durch Schaufelräder das Kerosin und den flüssigen Sauerstoff als Oxidator in die Raketentriebwerke drücken.“ Dr. Norbert Nimmerfroh, Leiter Anwendungstechnik 4. Anwendungsgebiete 4. Anwendungsgebiete Versuch 5 „Raketenstart“ 4. Anwendungsgebiete Versuch 5 „Raketenstart“ +4 -2 -1 +6 -2 MnO2 (s) + H2O2 +6 -2 -1 "MnO3"(s) + H2O2 -2 "MnO3"(s) + H2O +4 -2 -2 0 MnO2 (s) + H2O + O2 (g) ↑ Gesamt -1 [MnO2 (s)] 2 H2O2 -2 0 2 H2O + O2 (g)↑ Katalytische Zersetzung 4. Anwendungsgebiete Versuch 6 Nachweis von H2O2 in Waschmitteln durch Chemolumineszens 4. Anwendungsgebiete Versuch 6 Nachweis von H2O2 in Waschmitteln Viele Waschmittel enthalten Natriumperborat HO 2 Na+ -2 O B HO -1 O OH B O -2 Na2[B2(O2)2(OH)4](s) + 2 H2O O 6 H2O OH -1 + 2 H2O2 + 2 Na -2 + 2 H BO (aq) 2 3 (aq) 4. Anwendungsgebiete Gesamtreaktion NH2 O NH NH O Luminol + 2 H2O2 + 2 Na+(aq) + 2 OH-(aq) - hv NH2 O O Na O Na + 4 H2O + N2 (g) O Aminophtalsäuredianion 4. Anwendungsgebiete Reaktionsmechanismus der Luminol - Reaktion NH2 O NH2 C C NH NH NH2 O OH-(aq) +2 - 2 H2O C C O O O NH2 C N + O22-(aq) + H2O2 N - 2 OH-(aq) O O O C N N N C C O O Diazachinon N - N2 (g) 4. Anwendungsgebiete NH2 O NH2 O O C C O O O C C O O Triplett Dianion (T1) (angeregter Zustand) NH2 NH2 O O C C O O O - hv O C C O O Singulett Dianion (S1) (angeregter Zustand) Singulett Dianion (S0) (Grundzustand) Aminophtalsäuredianion 1. Sicherheitshinweise 2. Herstellung 2.1 Nachweise 3. Eigenschaften 3.1 Physikalische 3.2 Chemische 4. Anwendungsgebiete 5. Vorkommen in der Natur 6. Physiologisches 7. Schulrelevanz 5. Vorkommen in der Natur Wo findet man Wasserstoffperoxid? Medium Wasser Luft Lebewesen Meßpunkt H2O2 - Werte Grundwasser 2 µg / L Meerwasser 10 µg / L Flußwasser 100 µg / L Umgebungsluft 6 µg / L Blaualgen 50 µg / L Gemüse 3000 µg / L Bombardierkäfer 28,5 % (!!) 5. Vorkommen in der Natur Der afrikanische Bombadierkäfer • ca. 1 cm groß • besitzt ein effektives „Waffensystem“: – Sammelblase: Hydrochinon und 28,5% H2O2 – Explosionskammer: Peroxidasen Bei Bedrohung: Produktion + Ausstoß eines 100°C heißen Gas-/ChinonGemisches 1. Sicherheitshinweise 2. Herstellung 2.1 Nachweise 3. Eigenschaften 3.1 Physikalische 3.2 Chemische 4. Anwendungsgebiete 5. Vorkommen in der Natur 6. Physiologisches 7. Schulrelevanz 6. Physiologisches Wasserstoffperoxid und der Organismus Zellgift (oxidiert Zellbestandteile) Antibakterielle Wirkung Verwendung als Desinfektionsmittel Aber: H2O2 wird im Körper gebildet! Hyperoxidanionen (O2- ) entstehen als Nebenprodukt des Stoffwechsels/ Atmungskette bei deren Abbau wird H2O2 freigesetzt - 1/2 2 O2-(aq) +2 H+(aq) -1 0 H2O2 (aq) + O2 (aq) 6. Physiologisches Versuch 7 und 8 Der H2O2 Killer 6. Physiologisches Versuch 7 und 8 Der H2O2 Killer N N Fe N O Katalase OH N O Reaktives Zentrum OH 6. Physiologisches Versuch 7 und 8 Der H2O2 Killer +3 III Por Fe +4 -1 + H2O2 -2 Por -1 Por + FeIV=O + H2O2 + +4 -2 IV -2 Fe =O + H2O +3 III Por Fe 0 -2 + O2 (g) ↑ + H2O 1. Sicherheitshinweise 2. Herstellung 2.1 Nachweise 3. Eigenschaften 3.1 Physikalische 3.2 Chemische 4. Anwendungsgebiete 5. Vorkommen in der Natur 6. Physiologisches 7. Schulrelevanz Schulrelevanz Hessischer Lehrplan G8 • 10 G Redoxreaktionen + Oxidationszahlen • LK 11 G2 fakultativ: modifizierte Naturstoffe (Papier) • GK 12 G1 fakultativ: Nachweisreaktionen • LK 12 G1 Aktivierungsenergie + Katalyse/Katalysatoren fakultativ: Enzymkinetik (im Stoffwechsel) fakultativ: Nachweisreaktionen • LK 12 G2 Waschmittel (Inhaltsstoffe) Umweltchemie (Abwasserreinigung) • GK/LK 12 Großtechnische Verfahren