ppt - ChidS
Werbung

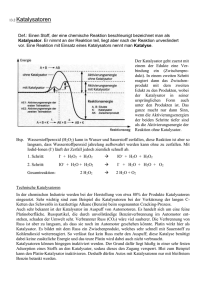
SS 2002 Experimentalvortrag Wasserstoffperoxid 19.06.02 Gliederung 1. Allgemeine Eigenschaften 2. Vorkommen 3. Physiologische Wirkung 4. Historie 5. Darstellung 6. Verwendung 1. Allgemeine Eigenschaften • Summenformel H2O2 • farb- und geruchlose Flüssigkeit • im wasserfreiem Zustand: sirupartig • mit Wasser in allen Mengenverhältnissen mischbar • 30%iges H2O2 kommt als „Perhydrol“ in den Handel • sehr schwache Säure H2O2 (aq) + H2O HO2- (aq) + H3O+ (aq) Molekülgeometrie • verdrilltes Molekül ⇨ Verringerung der Abstoßung der freien Elektronenpaare der Sauerstoffatome • geschwächte Bindung (O-O), weil Abstoßung noch vorhanden ⇨ metastabile Verbindung ⇨ starkes Bestreben zum Zerfall Allgemeine Eigenschaften • hohes Zerfallsbestreben unter großer Wärmeentwicklung: -1 -2 0 2 H2O2 (aq) → 2 H2O + O2 (g) ↑ ∆H° = - 98 kJ/mol • Zerfall wird initiiert durch Bildung von OH-Radikalen: HOOH → 2 HO∙ ∆H° = 211 kJ/mol HO∙ + H2O2 → H2O + HO2∙ HO2∙ + H2O2 → H2O + O2 + HO∙ • jedoch sehr langsam bei Zimmertemperatur Allgemeine Eigenschaften • Erhöhung der Zersetzungsgeschwindigkeit durch Katalysatoren (z. B. Schwermetalle, Alkalien oder andere Verunreinigungen) ⇨ Versuch 1 • Deshalb: Zugabe geringer Mengen (ca. 100 - 1000 ppm) an Stabilisatoren z. B. Chelatbildner, Stannate oder Phosphate, die Metallionen komplexieren Versuch 1 – Katalytische Zersetzung • Reagenzglas 1: Beispiel für homogene Katalyse ⇨ katalytische Wirksamkeit der Eisenionen beruht auf wechselseitigen Redoxübergang Fe(III) ⇄ Fe(V) Kremer-Stein-Mechanismus: +3 -1 +3 -1 Fe3+(aq) + H2O2 (aq) FeOOH2+(aq) + H+(aq) +3 +5 -2 -1 FeOOH2+(aq) + H+(aq) +5 -2 -1 FeO3+(aq) + H2O2 (aq) -2 FeO3+(aq) + H2O +3 0 -2 Fe3+(aq) + O2 (g) ↑ + H2O Versuch 1 – Katalytische Zersetzung • Reagenzglas 2: Beispiel für heterogene Katalyse ⇨ Bildung und Zersetzung eines höheren instabilen Manganoxids MnO2 (s) + H2O2 (aq) “MnO3“(s) + H2O “MnO3“(s) + H2O2 (aq) MnO2 (s) + H2O + O2 (g) ↑ • Reagenzglas 3: Auswertung in Kapitel 3 2. Vorkommen In sehr niedrigen Konzentrationen natürlich vorkommende Substanz: • im Wasser (1 – 30 μg/L) • in der Atmosphäre (0,1 – 1 ppm) • in allen aerob lebenden Zellen (z. B. menschliche Atemluft 300 - 1000 μg/m3) • Kuriosität: Bombardierkäfer (Brachinus crepitans / Brachinus explodens) Bombardierkäfer • Käfer produziert mit seinen Drüsen Hydrochinon und Wasserstoffperoxid (bis zu einer Konzentration von 28,5 %) • Substanzen dienen als Abwehrstoffe gegen Freßfeinde 3. Physiologische Wirkung Wie kommt H2O2 in den Organismus? • Endreaktion der Atmungskette ⇨ aus Sauerstoff kann das toxische Superoxid-Ion O2- gebildet werden: 2 O2-(aq) + 2 H+(aq) SuperoxidDismutase H2O2 (aq) + O2 (g) Folgen? • in höheren Konzentrationen: Zellgift Deshalb: Schutzmechanismen, in Form von H2O2-zersetzenden Enzymen (Katalase / H2O2-Oxidoreduktase) ⇨ Versuch 2 Versuch 2 – Physiologische Wirkung H2O2 als Zellgift: Reagenzglas 1 (ohne H2O2): NH2 NH2 O C + H 2O NH2 Harnstoff Urease O C + NH3 (aq) OH Carbamidsäure spontan CO2 (g) + NH3 (aq) NH3 (aq) + H2O NH4+(aq) + OH-(aq) ↳ pH > 8,3 → Umschlag des farblosen Phenolphthalein nach rot Versuch 2 – Physiologische Wirkung Reagenzglas 2 (mit H2O2): Urease wird durch H2O2 irreversibel geschädigt, deshalb kein Umschlag des farblosen Phenolphthaleins NH2 O C + H 2O NH2 Physiologische Wirkung Schutzmechanismen: Reagenzglas 3 (von Versuch 1): Katalysator im Blut ist das Enzym Katalase, welches in der Lage ist H2O2 sehr schnell zu zersetzen Katalase: ∙ eines der effektivsten Enzyme (ein Katalasemolekül zerlegt in einer Sekunde 3·1011 H2O2-Moleküle) ∙ enthält 4 Hämgruppen mit Fe(III) ∙ Hauptaufgabe ist Zerstörung des Zellgifts H2O2 4. Historie • 1818 erstmalige Darstellung durch Thenard mit Bariumperoxid als Ausgangssubstanz ⇨Versuch 3 Versuch 3a – Darstellung Reaktion ist mit einem Fällungsvorgang und einer Säure-Base-Reaktion nach Brønsted verknüpft: BaO2 (s) + H2SO4 (aq) BaSO4 (s) ↓ + H2O2 (aq) O22-(aq) + 2 H3O+(aq) H2O2 (aq) + 2 H2O weiß Abstumpfen des Reaktionsmilieus: BaCO3 (s) + 2 H3O+(aq) + SO42-(aq) BaSO4 (s) ↓ + CO2 (g) ↑ + 3 H2O weiß Versuch 3b – Nachweis mit Titanoxidsulfat Reaktion ist mit einer Ligandenaustauschreaktion verknüpft: formal: -2 -1 [TiO]SO4 (aq) + H2O2 (aq) H3O+ -1 -1 -2 [TiO-O]SO4 (aq) + H2O gelb genauer: -2 -1 [Ti(OH)2(H2O)4]2+(aq) + H2O2 (aq) -1 -2 [Ti(O2) · aq]2+(aq) + 6 H2O gelb Historie • 1818 erstmalige Darstellung durch Thenard mit Bariumperoxid als Ausgangssubstanz • bleichende und desinfizierende Wirkung wurde erkannt • 1873 erste Anlage zur fabrikmäßigen Herstellung von 3%igen H2O2 aus BaO2 bei Schering in Berlin • 1896 technische Produktion von 3-8%igen H2O2 bei Merck in Darmstadt • 1905 industrieller Durchbruch mit einem Deutschen Reichspatent zur Herstellung auf elektrolytischem Weg über die Peroxodischwefelsäure (ca. 28%ige Lösungen) • 1953 erste großtechnische Anthrachinon-Autoxidations-Anlage in Memphis/Tennessee 5. Großtechnische Darstellung heute O R Edukt 1 O2 + H2O2 Produkt O 2-Alkyl-anthrachinon H2O2 (30-40%) (in H2O) OH O R R → OH O 2-Alkyl-anthrahydrochinon 2-Alkyl-anthrachinon H2 (Pd) Edukt 2 H2O2-Bedarf (Weltmarkt) • Bedarf steigt weltweit jährlich um mehr als 10% 2.500 t in Tsd 2.000 1.500 1.000 500 0 1950 1960 1970 1980 Jahr 1990 2000 6. Verwendung 1831 Publikation von Heinrich Wilhelm Kurrer: „ Diese Flüssigkeit [...] wird, wenn man es erst in großem wohlfeil zubereiten gelernt hat, zur Vervollkommnung der Bleichkunst wesentlich beitragen.“ Verwendung • Lösung als Bleichmittel in der Papier- und Zellstoffindustrie und in der Textilindustrie • 3-8%ige Lösung für medizinische und kosmetische Zwecke ⇨Versuch 4 • in gebundener Form als Waschmittelkomponente (“festes“ H2O2) ⇨Versuch 5 • chemische Abwasserbehandlung • in der chemischen Industrie zur Synthese von organischen Peroxiden und Epoxyverbindungen • 85-90%ige Lösung für militärische Anwendungen und als Treibstoff für Satellitenantriebe Verwendung Verwendung als Desinfektionsmittel • antimikrobielle Wirksamkeit von H2O2 seit etwa 100 Jahren bekannt • abtötende Wirkung beruht auf oxidativen Zerstörung wichtiger Zellkomponenten durch hochaktiven Sauerstoff • Sauerstoff in statu nascendi entsteht beim Zerfall • Vorteil: Verzicht auf Konservierungsstoffe ⇨ Versuch 4 Versuch 4a – Nachweis von H2O2 in Desinfektionsmitteln durch Chemolumineszenz Durchführung: Lösung 2 75 10 0 Luminol in verd. Natronlauge gelöst 0m 10 L 50 0 10 10 0m L 75 50 Lösung 1 verd. K3[Fe(CN)6]-Lösung + Desinfektionsmittel Katalysator K3[Fe(CN)6] Versuch 4a – Nachweis von H2O2 in Desinfektionsmitteln durch Chemolumineszenz Gesamtreaktion: NH2 O C NH +2 NH Na+(aq) +2 OH-(aq) + 2 H2O2 (aq) K3[Fe(CN)6](s) -hν C O Luminol (3-Aminophthalsäurehydrazid) NH2 O C O O C O + 2 Na+(aq) + N2 (g) + 4 H2O Versuch 4a – Nachweis von H2O2 in Desinfektionsmitteln durch Chemolumineszenz Mechanismus: NH2 O NH2 C O C N NH C H + OH- + OH-(aq) N (aq) N - H2O H C O - H2O O Luminol (3-Aminophthalsäurehydrazid) NH2 O NH2 C C O N + H2O2 (aq) N - 2 OH-(aq) O C N N C O Diazachinon + O22-(aq) Versuch 4a – Nachweis von H2O2 in Desinfektionsmitteln durch Chemolumineszenz Mechanismus (Fortsetzung): NH2 O NH2 O O C O O C N O N - N2 (g) C C O NH2 O O NH2 C C O O C O O * O -hν (λ = 450 nm, O C ca. 250 kJ/mol) O Versuch 4b – Quantitative Bestimmung von H2O2 in Desinfektionsmitteln Bestimmung mit Hilfe der Permanganometrie: Durchführung: • • • • Einwaage: 5 g Desinfektionslösung Maßlösung: KMnO4-Lösung (c = 0,02 mol/L) Milieu: schwefelsauer Endpunktsbestimmung: bleibende blaßrosa Färbung der Lösung (mind. ½ Minute) Reaktionsgleichung: +7 - -1 2 MnO4 (aq) + 5 H2O2 (aq) + 6 H3 violett O+ (aq) 2 +2 Mn2+ blaßrosa 0 (aq) + 5 O2 (g)↑ + 14 H2O Versuch 4b – Quantitative Bestimmung von H2O2 in Desinfektionsmitteln Berechnung: 1 mL KMnO4-Lösung (c = 0,02 mol/L) enthält 3,16 mg KMnO4 (M(KMnO4) = 158 g/mol) Somit ergibt sich: m(H2O2) = 3,16 mg · 5 mol · 34 g/mol 2 mol · 158 g/mol = 1,7 mg Also entsprechen ........ mL KMnO4-Lösung ......... mg H2O2. Für den Massenanteil ergibt sich somit: w(H2O2) = m(H2O2) m(Desinfektionsmittel) = ...........g = 5g Literaturwert (Kontaktlinsendesinfektionsmittel): w = 0,6% .......% Verwendung in Waschmitteln • z. B. im Fleckensalz 15-30% Bleichmittel in Form von Natriumcarbonat-Peroxohydrat 2 Na2CO3 · 3 H2O2 oder als Natriumperoxoborat “NaBO2 · H2O2 · 3 H2O” • freigesetztes H2O2 zerstört Schmutz durch Oxidation → farbige Anschmutzungen werden in nicht farbige Verbindungen überführt • Bleichwirkung geht von atomaren Sauerstoff aus (statu nascendi) ⇨ Versuch 5 Versuch 5 – Bleichende Wirkung Verdeutlichung des Reaktionsverlaufes am Beispiel von Natriumperoxoborat (Natrium-metaborat-peroxid-hydrat): • Struktur: 2 “NaBO2 · H2O2 · 3 H2O” ≙ Na2[(HO)2B(O2)2B(OH)2] · 6 H2O HO 2 Na+ O O B HO OH 2- • 6 H 2O B O O OH sechsgliedriger, sesselförmiger B2(O2)2-Ring Versuch 5 – Bleichende Wirkung (1) Freisetzung von H2O2: Na2[B2(O2)2(OH)4] (s) + 2 H2O 2 H2BO3- (aq) + 2 H2O ∆ 2 H2O2 (aq) + 2 Na+(aq) + 2 H2BO3-(aq) 2 H3BO3 (aq) + 2 OH-(aq) (2) Zerfall von H2O2 mit Bleichwirkung: H2O2 (aq) + OH-(aq) H2O + HO2-(aq) HO2-(aq) OH-(aq) + [O] ↓ statu nascendi → Bleichwirkung unerwünschte Reaktion: 2 H2O2 (aq) ∆ 2 H2O + O2 (g) ↑ Versuch 6 - Brennstoffzelle e- e- M Anode Kathode 2 e- • Elektrolytlösung: KOH (aq) • Elektroden: Pd auf Ni • theoretische Spannung: U = 1,23 V • erreichte Spannung: 0,8 – 0,9 V Ethanol in KOH 2 e- H2O2 in KOH Versuch 6 - Brennstoffzelle Kohlenstoffoxidation an der Anode: -3 -1 +4 H3C―CH2―OH (aq) + 12 OH-(aq) 2 CO2 (g) + 9 H2O + 12 e- Sauerstoffreduktion an der Kathode: -1 direkte Reaktion: 6 H2O2 (aq) + 12 e- -2 12 OH-(aq) oder Zersetzung unter katalytischen Einfluß des Elektrodenmaterials: -1 6 H2O2 (aq) Pd -2 0 6 H2O + 3 O2 (g) 0 3 O2 (g) + 6 H2O + 12 e- -2 12 OH-(aq) Also: Pro Mol H2O2 werden 2 Mol Elektronen verbraucht. Schlussbetrachtung ⇨ ideales Oxidationsmittel, da es keine belastenden Nebenprodukte bildet ⇨ keine Anreicherung in der Natur (weder durch natürliche, noch durch industrielle Prozesse) ⇨ immer mehr Anwendungen als umweltfreundliche Alternative zu Chlor und dessen Derivaten