1. Pathobiologie der allergischen Erkrankung bei Hunden 2
Werbung

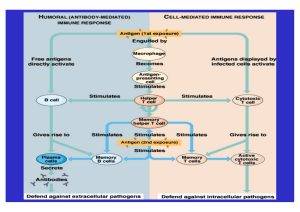
Pathobiologie der allergischen Erkrankung bei Hunden Für weitere Informationen gehen Sie bitte zu: www.juckreiz-info.de 1. Pathobiologie der allergischen Erkrankung bei Hunden Progression: Neurologische und immunologische Komponenten der chronischen allergischen Dermatitis des Hundes Sensibilisierung Allergene inkl. Staphylokokken und Malassezia Kratzen Haar Langerhans-Zelle Epidermis Langerhans-Zellen Dendritische Zelle Dermis Zytokine z. B. TSLP Zytokine z. B. IL-1, TNF-α Allergenpräsentation Naive T-Helferzelle Allergenpräsentation T-Helferzelle Zytokine z. B. IL-4 Plasmazelle Lymphknoten Zytokine z. B. IL-31 Entzündungsprozess Neuronale Stimulation des Juckreizes Zytokine z. B. IFN-γ B-Zelle Eosinophiler Mastzelle T2Helferzelle Antikörper T1-Helferzelle T2-Helferzelle Neutrophiler Sensorischer Nerv Blutgefäß Blutgefäß Monozyt 1. Pathobiologie der allergischen Erkrankung bei Hunden Abbildung 1. Pathobiologie der caninen allergischen Erkrankung. Wie Forschungsarbeiten zur atopischen Dermatitis bei Hunden und Menschen belegen, beginnt die Pathobiologie der Krankheit nach heutiger Auffassung mit der perkutanen Exposition und Absorption von Allergenen durch eine in ihrer Barrierefunktion möglicherweise gestörte Epidermis. A (links), Sensibilisierung. Die naive Langerhans-Zelle (LC) phagozytiert die Allergene. Die Allergene werden danach verarbeitet, in die größeren Moleküle des Histokompatibilitätskomplexes auf der Oberfläche der Langerhans-Zellen gepackt und den naiven T-Helferzellen (Th0) im entsorgenden Lymphknoten präsentiert. Spezifische Signale aus dem Mikromilieu versetzen die dendritischen Zellen in die Lage, die T-Helferzellen zu aktivieren und polarisieren diese in Richtung des T2Helferzellen (Th2)-Phänotyps, wo sie Zytokine wie IL-4 und IL-13 produzieren. Diese Zytokine können die B-Zellen dazu stimulieren, sich zu Plasmazellen zu entwickeln, die mit der Produktion von allergenspezifischem IgE (ASIgE) beginnen. Aktivierte T2-Helferzellen wandern mithilfe der von verschiedenen Zellen in der Haut produzierten Chemokine wie dem Thymus- und aktivierungsregulierten Chemokin (TARC) in die Haut ein. Auch die allergenspezifische IgE (ASIgE) gelangt in den Blutkreislauf und in andere Gewebe und bindet an Zellen, die an ihrer Oberfläche hoch- oder niedrig-affine Fcε-Rezeptoren exprimieren. B (rechts), Progression. Bei erneuter Exposition gegenüber demselben Allergen binden die epidermalen Langerhans-Zellen (LC) mit an der Oberfläche gebundenem ASIgE effizient das Allergen und migrieren zur Dermis (Lederhaut). Dort angelangt, „präsentieren“ ASIgE+ LC das Allergen den T-Helferzellen und polarisieren diese weiter in Richtung Th2-Phänotyp. Zusätzliche Th2-Zytokine wie IL-31 können freigesetzt werden und aktivieren das sensorische Neuron, um den Juckreiz zu induzieren. Allergene können auch mit dem an der Oberfläche von dermalen Mastzellen gebundenen ASIgE eine Querverbindung eingehen und stimulieren so die Freisetzung präformierter Entzündungsmediatoren wie Histamin, Serotonin und Substanz P sowie von Zytokinen wie dem chemotaktischen Faktor für Eosinophile (ECF). Durch Kratzen herbeigeführte Hautverletzungen, mikrobielle Toxine von Staphylokokken und Malassezia oder Umweltallergene bewirken eine Aktivierung der Keratinozyten und anderer Zellen des angeborenen Immunsystems, die ihrerseits proinflammatorische Zytokine (z. B. IL-12) und Chemokine freisetzen, die T-Helferzellen in Richtung des Th1-Phänotyps polarisieren, wo sie Zytokine wie IFN-γ produzieren. IFN-γ seinerseits fördert wieder die Aktivierung von Monozyten/Makrophagen. Aktivierte Keratinozyten, Monozyten und Mastzellen produzieren zusätzliche proinflammatorische Zytokine wie TNF-α, wodurch es zur Heraufregulierung der Expression von PSelektin und E-Selektin in der Zellmembran von Endothelzellen kommt. Dies bewirkt, dass mehr Leukozyten aus dem Blut rekrutiert werden. Die Epidermis verdickt sich, ebenso das Stratum corneum; die Barrierefunktion der Haut verschlechtert sich weiter und ermöglicht das Eindringen des Allergens. Damit kommt es zur Perpetuierung des Zyklus. 2. Rolle der kutanen Juckreiz-selektiven Neuronen in der Haut Allergene inkl. Staphylokokken und Malassezia Kratzen Gehirn Langerhans-Zelle Pruritus, Schmerz Zytokine z. B. TSLP Spinalganglion Allergenpräsentation T-Helferzelle Zytokine z. B. IL 31 Dendritische Zelle Zytokine z. B. IL-1, TNF-α Neuronale Stimulation des Juckreizes Entzündungsprozess Zytokine z. B. IFN-γ T1-Helferzelle Eosinophiler Mastzelle Rückenmark T2-Helferzelle Sensorischer Nerv Neutrophiler Blutgefäß Monozyt 2. Rolle der kutanen Juckreiz-selektiven Neuronen in der Haut Abbildung 2. Rolle der kutanen Juckreiz-selektiven Neuronen in der Haut Während der Entzündung wird eine Vielfalt von Juckreizmediatoren wie Zytokine, Chemokine und Neuropeptide von den Immunzellen, die sich in unmittelbarer Nähe der primären afferenten Nerven in Epidermis und Dermis befinden, in das Mikromilieu freigesetzt. Die Juckreizmediatoren werden von entsprechenden „Juckreiz“-Rezeptoren an den kutanen juckreizselektiven sensorischen Nerven detektiert. Die Signale wandern dann entlang unmyelinisierter C-Nervenfasern zu den Spinalganglien und zur Lamina-1-Region im dorsalen Horn des Rückenmarks. Das Juckreizsignal gelangt schließlich über Neuronen des spinothalamischen Traktes ins Gehirn und wirkt dort auf die am Pruritus beteiligten Regionen ein. Zusätzlich können periphere Nervenendigungen Immunzellen und benachbarte afferente Nerven durch Freisetzung von Neuropeptiden (z. B. Substanz P, Calcitonin-Gen-bezogenes Peptid/CGRP) und Neurotropinen (z. B. NGF) stimulieren. Dieser Prozess wird als Axonreflex bezeichnet. Diese Mediatoren können Immunzellen und deren Reaktionen während der Entzündung modulieren und vaskuläre Reaktionen in der Haut direkt triggern. Angemessene Verwendung • Diese Bilder können für Ausbildungszwecke verwendet werden. • Weitere Dias und Bilder zu Ihrer Verwendung finden Sie auf der Webseite www.juckreiz-info.de.