pH-Wert und elektrische Leitfähigkeit von Glycin
Werbung

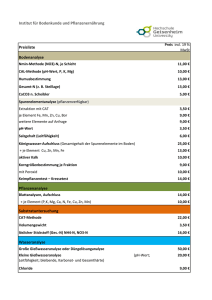
pH-Wert und elektrische Leitfähigkeit von Glycin Maximilian Kormann pH-Wert und elektrische Leitfähigkeit von Glycin 1. Versuchsaufbau und -durchführung Jeweils gleichkonzentrierte Lösungen (c = 0,1 mol/l) von Glycin und Essigsäure werden hergestellt und anschließend ihr pH-Wert und ihre elektrische Leitfähigkeit gemessen. 2. Beobachtung Es ergeben sich folgende Messwerte: elektrische Leitfähigkeit: pH-Wert: Glycinsäure Essigsäure Glycinsäure Essigsäure 6,05 µS 0,48 mS 5,5 2,66 3. Auswertung Dadurch dass Glycin die selbe Säuregruppe wie Essigsäure hat, würde man erwarten dass der pH-Wert fast gleich sein müsste. Allerdings ist der pH-Wert von Glycin weit höher als der von Essigsäure. Dies lässt sich durch die Strukturformel erklären: Carboxylgruppe O O H C N H H H C H Aminogruppe Weil Glycin sowohl eine Corboxyl- als auch eine Aminogruppe besitze, kann es sowohl Protonen aufnehmen als auch abgeben. Es ist also ein Ampholyt. Beide Gruppen streben danach, Protonen aufzunehmen, bzw. abzugeben. Es entsteht ein Zwitterion: - O O C H H C N H H + H Somit ist Glycin ein Zwitterion, da es an 2 Stellen unterschiedlich geladen ist: Das erklärt die schwache elektrische Leitfähigkeit trotz salzartiger Struktur. Bei einer salzartigen Struktur würde man auch eine hohe elektrische Leitfähigkeit erwarten, doch genau das Gegenteil tritt ein. Die Ladungen der Glycinionen können nicht getrennt werden, da sie durch Atombindungen verbunden sind. Daher richten sie sich in einem elektrischen Feld nur aus und bewegen sich nicht.