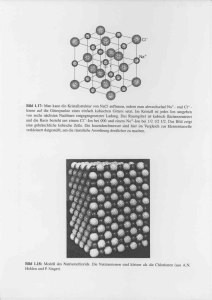
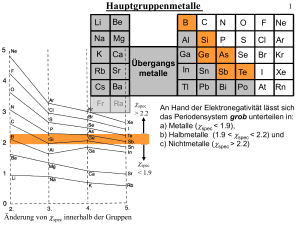
Aufgabe 1: Bestimmen sie die Punktgruppen (Schoenfliess und H
Werbung

Aufgabe 1: Bestimmen sie die Punktgruppen (Schoenfliess und H.-M.) von a) PF5 b) C2H6 c) [Ni(CN)4]2d) Biphenyl in der Gasphase e) [Co(en)3]3+ Welche dieser Punktgruppen sind für chirale Molekuele geeignet? Aufgabe 2: Wie lautet die dritte Pauling-Regel und warum ist sie relativ zuverlässig? Warum ist ZrI3 eine Ausnahme? Aufgabe 3: Kristalle von GeS sind orthorhombisch mit a = 10.47, b = 3.64, c = 4.30 Å. In der Zelle befinden sich vier Ge Atome auf ±(0.622 0.250 0.627; 0.122 0.250 0.873) und vier S Atome auf ±(0.349 0.250 0.001; 0.849 0.250 0.499). a) Berechnen Sie das Volumen der Elementarzelle und die Dichte des Kristalls. b) Zeichnen Sie die Projektion der Struktur mit c senkrecht zur Papierebene. c) Beschreiben Sie die Koordinationsgeometrie von Ge und S. d) Wie lang sind die zwei kuerzesten unabhaengigen GeS Abstaende. Aufgabe 4: a) Definieren Sie den Begriff dichteste Packung. b) Welche Luecken und wie viele findet man in einer kubisch-flaechenzentrierten Elementarzelle? c) Welche Koordinationszahlen und -polyeder findet man in ccp-Strukturen? d) Beschreiben Sie die NaCl-Struktur als Variante der dichtesten Packung. e) Definieren Sie den Begriff Raumerfuellung und berechnen Sie selbige fuer den ccpFall. Aufgabe 5: a) Entscheiden Sie mit Hilfe der erweiterten 8-N Regel, ob folgende Verbindungen polyanionisch, polykationisch oder einfach ionisch sind: Be2C, Mg2C3, ThC2, Li2Si, In4Se3, KSb, Nb3Cl8 b) c) Wie ist die VEK definiert? Wie kann man die Struktur von polyanionischen Verbindungen (innerhalb gewisser Grenzen) vorhersagen?