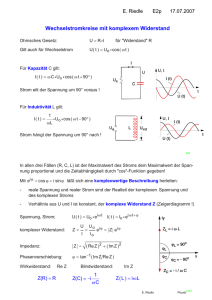
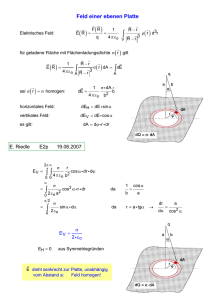
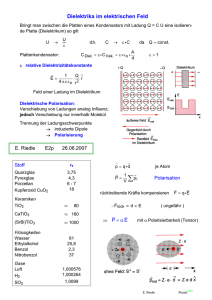
Thermodynamik, Carnot
Werbung

Was ist Thermodynamik ? • Theorie der Gleichgewichtszustände (Thermostatistik) • phänomelogische Rahmentheorie – Beschreibung makroskopischer Körper durch wenige Größen – gibt Relationen zwischen makroskopischen Größen ohne quantitative Spezifizierung – quantitatve Aussagen durch statistische Physik • als Rahmentheorie extrem robust: hat alle Revolutionen überlebt, Quantenmechanik vorausgeahnt (Planck) • im Rahmen empirisch gewonnener Axiome (Hauptsätze) logisch abgeschlossene Theorie • wird in der statistischen Physik begründet – mikroskopisch: viele Freiheitsgrade – Mechanik (Quantenmechanik, relativistische Mechanik) – Elektrodynamik (Quantenelektrodynamik) • makroskopisch: wenige Freiheitsgrade Æ Thermodynamik E2p E. Riedle E. Riedle PhysikLMU E. Riedle PhysikLMU 2007-05-11 System ÅÆ Umgebung Thermodynamik reversibler Prozesse • Thermodynamisches Gleichgewicht – stabiler [makroskopisch zeitlich konstanter] Zustand eines Systems unter entsprechendenden Nebewnbedingungen – nicht mikroskopisch konstant !!!! • Erfahrungstatsache: – ein isoliertes System geht nach mehr oder wenig langer Zeit in einen Zustand über, in dem sich die Zustandsgrößen nicht mehr ändern • Zustandsgrößen (thermodynamische Variablen) – makroskopisch messbare Grössen im thermodynamischen Gleichgewicht E. Riedle PhysikLMU Beispiele für Zustandsgrößen = Variablen E. Riedle PhysikLMU extensive und intensive Variablen E. Riedle PhysikLMU Quasistatische und reversible Zustandsänderung E. Riedle PhysikLMU irreversibler Prozess E. Riedle PhysikLMU Die Hauptsätze der Thermodynamik • Der "Nulllte" Hauptsatz: – Wärme fließt vom wärmeren System zum kälteren. Damit gleicht sich die Temperatur bei "Kontakt" aus. – Wenn sich das System A im thermischen Gleichgwicht mit System B befindet, und B auch mit C, dann befindet sich auch A mit C im Gleichgewicht. Alle drei haben die gleiche Temperatur. E. Riedle PhysikLMU Der erste Hauptsatz der Thermodynamik 1. Die Energie eines isolierten Systems ist konstant 2. Ein Perpetuum-Mobile 1. Art ist unmöglich P-M 1: Maschine, die einen Wirkungsgrad über 100 % hat 3. Wärme ist Energieform Wenn ein System vom Zustand 1 in den Zustand 2 überführt wird, ist die Summe der zugeführten Wärme ∆Q und der zugeführten Arbeit ∆W unabhängig vom Weg der Veränderung, also allein bestimmt durch die beiden Zustände 1 und 2. ∆U = ∆Q + ∆W Durch den Prozess ergibt sich entsprechend eine Änderung der inneren Energie U. E. Riedle PhysikLMU E. Riedle PhysikLMU perpetuum mobile 1) Isochore Prozesse (V = const) Für ideale Gase ist die Arbeit, die das System bei infinitesimaler Expansion um dV gegen den äußeren Druck p leistet gleich dW = −p i dV Damit gilt dU = dQ − p i dV Für den isochoren Prozess gilt dV=0 und damit: dQ = dU = CV i dT dW = 0 Für die spezifische Wärme gilt damit ⎛ ∂U ⎞ CV = ⎜ ⎟ ⎝ ∂T ⎠ V E. Riedle PhysikLMU 2) Isobare Prozesse (p = const) Es gilt (1. HS): dQ = dU + p i dV = Cp i dT und mit der Enthalpie H=U+piV gilt dH = dU + p i dV + V i dp = dQ + V i dp und damit dH = dU + p i dV = dQ ⎛ ∂H ⎞ Cp = ⎜ ⎟ ⎝ ∂T ⎠p Für die geleistete Arbeit gilt ∆W = −p ( V2 − V1 ) E. Riedle PhysikLMU 3) Isotherme Prozesse (T= const) Die innere Energie eines idealen Gases hängt nur von der Temperatur ab, nicht vom Druck p oder dem Volumen V. Es gilt also dU = 0 Damit gilt für 1 Mol: dQ = p i dV Die dem System zugeführte Wärme wird vollständig in Arbeit umgewandelt. Bei Ausdehnung von V1 auf V2 wird geleistet: W = −∫ V2 V1 p i V = −R i T i = −R i T i ln V2 V1 V2 dV ∫V1 = R i T i ln E. Riedle V = V1 V2 PhysikLMU 4) Adiabatische Prozesse (dQ = 0) Das System tauscht keine Wärme mit seiner Umgebung aus ! Dies tritt häufig bei schnellen Zustandänderungen auf. dU = dQ − p i dV = −p i dV Aus dem 1. HS und dQ = 0 folgt: Die innere Energie U ist vollständig als Funktion von T und V beschrieben. U = U(T, V) Damit gilt für das vollständige Differential ⎛ ∂U ⎞ ⎛ ∂U ⎞ dU = ⎜ dT i + ⎟ ⎜ ⎟ i dV = C V i dT ⎝ ∂T ⎠ V ⎝ ∂V ⎠T da die innere Energie als extensive Variable nicht von V abhängt. Also: C V i dT = −p i dV E. Riedle PhysikLMU Adiabatengleichungen C V i dT = −p i dV = −RT i Mit pV = RT folgt CV i also Integration: T = −R i TCV i V ( CV T CV i V V dV C V i ln T = − R i ln V + const. R=Cp-CV: κ = Cp/CV: dT dV Cp − CV ) V ⇒ ( ) ln TCV i VR = const. = const. Cp − CV CV = T i V κ−1 = const. p i V κ = const. T=pV/R: E. Riedle PhysikLMU E. Riedle PhysikLMU Vergleich Adiabten vs. Isothermen Wegen κ > 1 kühlt sich ein Gas bei adiabatischer Expansion ab Æ Clément-Desormes Der Carnot'scheKreisprozess Bei einem Kreisprozess wird das thermodynamische System wieder zu seinem Ausgangszustand zurückgeführt. E. Riedle Effizienz des Carnot-Prozesses I PhysikLMU (quasi-stationär) Isotherme Zuführung von Wärme aus dem heißen Reservoir mit T1 Wegen ∆T = 0 folgt dU = 0 und damit ∆Q1 = − ∆W12 = dQ = p i dV ⎛ V2 ⎞ p i dV = R i T1 i ln ⎜ ⎟ 1 ⎝ V1 ⎠ ∫ 2 Adiabatische Expansion dQ = 0 ⇒ dU = −p i dV = ∆W23 Die nach außen abgegeben Ausdehnungsarbeit ist gleich der Abnahme der inneren Energie. E. Riedle PhysikLMU Effizienz des Carnot-Prozesses II Isotherme Kompression mit Abführung von Wärme zum kalten Reservoir mit T2 ⎛ V3 ⎞ ∆W34 = R i T2 i ln ⎜ ⎟ = − ∆Q 2 > 0 ⎝ V4 ⎠ Adiabatische Kompression ∆W41 = ∆U = U ( T1 ) − U ( T2 ) = = − p i ( V1 − V2 ) E. Riedle PhysikLMU Effizienz des Carnot-Prozesses III Wirkungsgrad der Wärmekraftmaschine: η= geleistete Arbeit aufgenommene Wärme = ∆W12 + ∆W23 + ∆W34 + ∆W41 ∆Q1 Arbeit bei 2Æ3 ist gleich der bei 4Æ1 η= ⎛ ∆W = ∆W12 + ∆W34 = R i T1 i ln ⎜ ⎝ T1 i V2κ−1 = T2 i V3κ−1 V2 V1 = V3 V4 ⇒ und ⎛ ln ⎜ ⎝ ⎛ ∆W = R i ( T1 − T2 ) i ln ⎜ ⎝ ∆W12 + ∆W34 ∆Q1 V1 ⎞ ⎛ ⎟ + R i T2 i ln ⎜ V2 ⎠ ⎝ V3 ⎞ ⎟ V4 ⎠ T1 i V1κ−1 = T2 i V4κ−1 V3 ⎞ ⎛ V1 ⎞ ⎟ = − ln ⎜ ⎟ V4 ⎠ ⎝ V2 ⎠ V1 ⎞ ⎟ V2 ⎠ E. Riedle PhysikLMU Effizienz des Carnot-Prozesses IV ⎛ V2 ⎞ R i ( T1 − T2 ) i ln ⎜ ⎟ ∆W V1 ⎠ T1 − T2 ⎝ η= = = ⎛ V2 ⎞ ∆Q1 T1 R i T1 i ln ⎜ ⎟ ⎝ V1 ⎠ T −T η= 1 2 <1 T1 Der Wirkungsgrad der Carnot-Maschine ist nur durch die Temperatur der beiden Reserviors gegeben. Er ist immer kleiner als 1 !!!! Mit steigendem T1 und fallendem T2 steigt der Wirkungsgrad. Die nicht in Arbeit verwandelte Wärme geht als Abwärme verloren. Reale Maschinen haben einen schlechteren Wirkungsgrad. E. Riedle PhysikLMU gibt es eine effizientere Maschine ???? Nein - es gibt keine periodisch arbeitende Wärmekraftmaschine, deren Wirkungsgrad höher ist als der der Carnot-Maschine CM. "Beweis": Eine hypothetische Wundermaschine WM könnte mit einer in Rückwärtsrichtung laufenden CM zusammengeschaltet werden und die WM so dimensioniert werden, dass sie genau die Arbeitsleistung der CM, die als Wärmepumpe läuft, liefert. Die CM transportiert dann ∆Q1 = ∆Q2 + ∆W in das wärmere Resorvoir. Die WM benötigt aber, weniger Wärme für den Betrieb. Das kombinierte System transportiert also ohne Energiezufuhr Wärme vom kalten zum warmen Reservoir. Das wiederspricht aller Erfahrung (2. Hauptsatz) und daher kann es die WM nicht geben. E. Riedle PhysikLMU