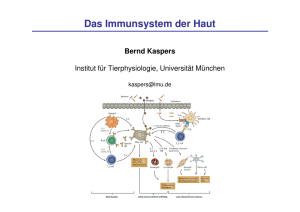
Dokument_15.
Werbung

Aus der Hautklinik Universitätsklinikum Erlangen Friedrich-Alexander-Universität Erlangen-Nürnberg Direktor: Prof. Dr. G. Schuler Ex vivo Isolation und Charakterisierung von CD4+CD25+ regulatorischen T-Zellen unter spezifischer Immuntherapie bei Typ I-Allergie auf Inhalationsallergene Inaugural-Dissertation zur Erlangung der Doktorwürde der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg vorgelegt von Andreas Maronna aus Bayreuth Gedruckt mit Erlaubnis der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Dekan: Herr Prof. Dr. med. Dr. h. c. J. Schüttler Referent: Frau Prof. Dr. med. V. Mahler Korreferent: Herr Prof. Dr. med. G. Schuler Tag der mündlichen Prüfung: 30.06.2011 Meinen Eltern gewidmet Inhaltsverzeichnis 1. Zusammenfassung ................................................................................... 1 1.1. Hintergrund und Ziele .................................................................. 1 1.2. Methoden (Patienten, Material, Untersuchungsmethoden) ......... 1 1.3. Ergebnisse und Beobachtungen ................................................. 1 1.4. Praktische Schlussfolgerungen ................................................... 2 2. Summary................................................................................................... 3 2.1. Background and aims.................................................................. 3 2.2. Methods (patients, material, methods of examination) ................ 3 2.3. Results and observations ............................................................ 3 2.4. Practical conclusion..................................................................... 4 3. Einleitung .................................................................................................. 5 4. Materialien und Methoden........................................................................20 4.1. Inklusionskriterien zur Studienteilnahme ....................................20 4.2. Puffer und Medien ......................................................................21 4.3. Protein-Extraktion aus Birkenpollen............................................24 4.4. Gel-Herstellung ..........................................................................25 4.5. SDS-PAGE (Polyacrylamid-Gelelektrophorese) .........................25 4.6. Blotten der Gele auf Nitrocellulose .............................................26 4.7. IgE-Immunoblot mit Patientenserum ..........................................27 4.8. Lymphoprep™-Gradient aus Heparin-Vollblut............................28 4.9. PBMC-FACS ..............................................................................29 4.10. CD4-Negativ-Selektions-MACS® ................................................30 4.11. CD25-Positiv-Selektions-MACS®................................................31 4.12. CD4+CD25+/- FACS ....................................................................32 4.13. Züchtung dendritischer Zellen ....................................................33 4.14. Proliferations-Assay....................................................................35 4.15. Auswertung der Proliferations-Assays mit 3H-Thymidin .............37 4.16. Zytokin-ELISA der Überstände und der Serumproben ...............38 4.17. TGF-β-ELISA..............................................................................39 4.18. Bestimmung von Allergen-spezifischen IgE-, IgG- und IgG4Werten gegen Birkenpollenallergene (Gesamtextrakt) und rekombinante Birkenpollenallergene (rBet v 1, rBet v 2, rBet v 4) im Serum im Verlauf der SIT ......................................42 5. Ergebnisse ...............................................................................................43 5.1. Charakterisierung der Patienten.................................................43 5.2. Ergebnisse der PBMC-FACS-Auswertung .................................46 5.3. Ergebnisse der Proliferations-Assays mit unspezifischer Stimulation (anti-CD3/CD28-Antikörper) ...................................52 5.4. Ergebnisse der Proliferations-Assays mit spezifischer Stimulation (reife dendritische Zellen – unbeladen und mit rBet v 1 beladen) ......................................................................56 5.5. Ergebnisse der Zytokin-Bestimmungen aus dem Serum und aus den Überständen der Zellkulturansätze .............................71 5.6. Ergebnisse der Allergen-spezifischen IgE-, IgG- und IgG4Bestimmungen gegen Birkenpollenallergene (Gesamtextrakt) und rekombinante Birkenpollenallergene (rBet v 1, rBet v 2, rBet v 4) im Serum im Verlauf der SIT ......................................80 6. Diskussion..............................................................................................109 7. Literaturverzeichnis................................................................................122 8. Abkürzungsverzeichnis ..........................................................................137 9. Ethikkommission ....................................................................................141 10. Danksagung...........................................................................................142 11. Lebenslauf .............................................................................................143 1 1. Zusammenfassung 1.1. Hintergrund und Ziele Ziel der vorliegenden Arbeit war, Methoden und Versuchsansatz zur ex vivo Untersuchung der Rolle CD4+CD25+ regulatorischer T-Zellen bei der Induktion Allergen-spezifischer Toleranz durch spezifische Immuntherapie (SIT) zu etablieren. Es handelte sich um eine experimentelle Studie, bei der der klinische Verlauf der SIT ex vivo bei Birkenpollenallergikern verfolgt wurde. 1.2. Methoden (Patienten, Material, Untersuchungsmethoden) Als Impfstoff wurden tyrosin-adsorbierte, chemisch modifizierte Allergenextrakte der Birke verwendet, wobei als Adjuvans MPL®, Monophosphoryl Lipid A®, ein detoxifiziertes Lipid aus dem Endotoxin von Salmonella minnesota eingesetzt wird. Das komponentenspezifische Sensibilisierungprofil eines jeden Patienten wurde im IgE-Immunoblot auf aufgetrennten natürlichen Pollenextrakten bestimmt. Zu definierten Zeitpunkten während der SIT wurden den Patienten Blutproben entnommen, um PBMC zu isolieren und mittels MACS® weiter aufzutrennen. Aus diesen Proben wurde das Allergen-spezifische (Stimulation durch rBet v 1 beladenen dendritischen Zellen) und unspezifische (Stimulation durch anti-CD3/CD28-Antikörper) proliferative Potential von CD4+ bulk T-Zellen, CD4+CD25+ und CD4+CD25- T-Zellen, sowie das inhibitorische Potential von CD4+CD25+ T-Zellen und die Zytokinsekretionsmuster der Subsets der CD4+ bulk T-Zellen, CD4+CD25+ und CD4+CD25- T-Zellen analysiert. Der Anteil der CD4+CD25+ T-Zellen an den PBMC wurde mittels FACS-Analysen bestimmt. Das Allergen-spezifische Immunglobulin-Muster (IgE, IgG und IgG4) gegen natürlichen Birkenpollenextrakt und rekombinante Einzelallergene der Birke (rBet v 1, rBet v 2, rBet v 4) wurde bestimmt. 1.3. Ergebnisse und Beobachtungen Es konnte gezeigt werden, dass die Zellpopulationen CD4+ bulk, CD4+CD25+, CD4+CD25- T-Zellen eine stärkere Proliferation bei Antigen-spezifischer Stimulation mit rBet v 1-beladenen reifen dendritischen Zellen (mature dendritic cells, mDC) zeigen im Vergleich zu unbeladenen reifen dendritischen Zellen. Dies 2 kann als Antigen-spezifischer Effekt von rBet v 1 auf die Populationen CD4+ bulk, CD4+CD25+, CD4+CD25- T-Zellen und deren Proliferationsfähigkeit interpretiert werden. Es konnte ebenso aufgezeigt werden, dass bei der Stimulation mittels reifer dendritischer Zellen (unbeladen oder mit rBet v 1 beladen) die Population der CD4+CD25- T-Zellen durchweg deutlich stärker proliferiert als die CD4+ T-Zellen, die den natürlichen Anteil CD4+CD25+ T-Zellen besitzen. Diese reduzierte Proliferationsrate der CD4+ Zellen bestätigt die Fähigkeit der CD4+CD25+ Zellen zur Proliferationsinhibition, die selbst kaum proliferieren, was sie ebenfalls als regulatorische CD4+CD25+ T-Zellen charakterisiert. Des Weiteren kam es zu einem Anstieg des Anteils der CD4+CD25+ T-Zellen an den Gesamt-PBMC im Verlauf der SIT, wobei dies nur bei den Patienten auftrat, die ausschließlich auf das Hauptallergen der Birke Bet v 1 sensibilisiert waren („Mono-Sensibilisierte“), nicht bei den Patienten, die zusätzlich auf weitere Minorallergene der Birke sensibilisiert waren („Poly-Sensibilisierte“). Die Fähigkeit der CD4+CD25+ T-Zellen zur Proliferationsinhibition der CD4+CD25- T-Zellen zeigte sich in den Ansätzen mit unspezifischer Stimulation im Verlauf der SIT bei beiden Patientengruppen konstant. Darüber hinaus zeigte sich, wie in der Literatur vorbeschrieben, ein kurzfristiger Anstieg der IL-10-Werte in den unspezifisch stimulierten Regulationsansätzen aus gleichen Teilen CD4+CD25und CD4+CD25+ T-Zellen im Verlauf der SIT bei den „Mono-Sensibilisierten“. Neusensibilisierungen (de novo Allergen-spezifische IgE-Antikörper) auf im Gesamtextrakt enthaltene Allergene, auf die ein Individuum vor Behandlung nicht allergisch war, traten unter SIT nicht auf. 1.4. Praktische Schlussfolgerungen Die Ergebnisse bezüglich des Anstiegs, der Eigenschaften und der Effekte der CD4+CD25+ regulatorischen T-Zellen deuten auf deren zentrale Bedeutung bei der Entwicklung und der Behandlung allergischer Krankheiten hin, die in Anschlussuntersuchungen weiter verfolgt werden sollen. Da derzeit in kommerziell erhältlichen Impfstoffen lediglich die Konzentration von Hauptallergenen, bei Birke Bet v 1, standardisiert ist, lässt dies erwarten, dass Patienten, deren individuelles Sensibilisierungsprofil ausschließlich das/die in der Allergie-Vakzine standardisiert vorliegende(n) Allergen(e) umfasst, in höherem Maße von der SIT profitieren. Zukünftige Allergievakzine, die auf rekombinanten Allergenen basieren, bieten die Möglichkeit, standardisiert auch Minorallergene zur peripheren Toleranzentwicklung in Vakzinen einzusetzen. 3 2. Summary 2.1. Background and aims Aim of this paper was to establish ex vivo methods to examine the role of CD4+CD25+ regulatory T cells in induction of allergen-specific tolerance by immunotherapy. This was an experimental study following the clinical course during immunotherapy ex vivo in birch pollen allergic patients. 2.2. Methods (patients, material, methods of examination) Tyrosine-adsorbed, chemically modified allergen extracts of birch pollen were used as vaccines. MPL®, Monophosphoryl Lipid A®, a detoxified lipopolysaccharide produced from the endotoxin of Salmonella minnesota was used as an adjuvant. The component-specific profile of senzitization of each patient was determined by IgE-immunoblot on blotted natural pollen extracts. At defined points in time during immunotherapy blood was taken to isolate PBMC and sort by MACS®. From these specimens the allergen-specific (stimulation with rBet v 1 loaded dendritic cells) and nonspecific (stimulation with anti-CD3/CD28antibody) proliferative potential of CD4+ bulk T cells, CD4+CD25+, and CD4+CD25- T cells, as well as the inhibitory potential of CD4+CD25+ T cells and the released cytokine pattern of the subsets of CD4+ bulk T cells, CD4+CD25+, and CD4+CD25- T cells were analysed. The fraction of CD4+CD25+ T cells in PBMC was obtained by FACS. Serum was examined for allergen-specific IgE, IgG und IgG4 against the allergens contained in natural birch pollen extract and recombinant single allergens of birch (rBet v 1, rBet v 2, rBet v 4) during immunotherapy. 2.3. Results and observations CD4+ bulk, CD4+CD25+, and CD4+CD25- T cells were more proliferative during antigen-specific stimulation with rBet v 1-loaded mature dendritic cells (mDC) than during antigen-nonspecific stimulation with unloaded mDC. This indicates an antigen-specific effect of Bet v 1 on CD4+ bulk, CD4+CD25+, and CD4+CD25- T cells and their ability to proliferate. By stimulation with mDC 4 (unloaded or loaded with rBet v 1) the CD4+CD25- T cells proliferated stronger than the CD4+ bulk T cells still owning the natural fraction of CD4+CD25+ T cells. The finding of reduced proliferation of CD4+ bulk T cells supports the ability of CD4+CD25+ T cells to inhibit proliferation. The low proliferative activity of CD4+CD25- T cells characterizes them as regulatory T cells. The fraction of CD4+CD25+ T cells in PBMC increased during immunotherapy occurring only in patients mono-sensitized against Bet v 1 (major allergen of birch) and not in patients also sensitized against minor allergens of birch (poly-sensitized). The ability of CD4+CD25+ T cells to inhibit proliferation of CD4+CD25- T cells was shown to be constant in nonspecifically stimulated approaches during immunotherapy in mono- and poly-sensitized patients. A short-term increase of IL-10 was seen in nonspecifically stimulated approaches of coculturing CD4+CD25- and CD4+CD25+ T cells (1:1) during immunotherapy in mono-sensitized patients. De novo sensitization (allergen-specific IgE) against allergens in natural birch pollen extract which had not been recognized by the respective individual at the beginning of the treatment were not observed during SIT. 2.4. Practical conclusion The results on increase, characteristics and effect of CD4+CD25+ regulatory T cells emphasize their pivotal meaning in development and treatment of allergic diseases which must be further studied. In commercially available vaccines so far only the concentration of major allergens is standardized. In consequence, patients who are exclusively sensitized against major allergens may have a greater benefit from immunotherapy. Future allergen vaccines based on recombinant allergens will allow the use of standardized minor allergens of clinical relevance in allergen vaccines to induce peripheral tolerance. 5 3. Einleitung Allergien vom Typ I nach Coombs und Gell (1963) haben in den letzten Jahrzehnten v.a. in Ländern mit so genanntem westlichem Lebensstil deutlich zugenommen [von Mutius et al. 1992]. Sie basieren nach heutigem Verständnis zumindest teilweise auf einer Störung des immunologischen Gleichgewichts. Typ I-allergische Patienten überreagieren auf an sich harmlose Proteine, die eigentlich vom Immunsystem toleriert werden könnten, da sie keine Bedrohung für den Organismus darstellen [Casolaro et al. 1996, Kay 1997]. In der Effektorphase bei klinisch manifesten Allergien vom Soforttyp dringt ein Allergen in den Körper ein und bindet an membranständiges Allergen-spezifisches IgE, das an den hoch-affinen IgE-Rezeptor von Mastzellen und basophilen Granulozyten gebunden ist. Auf eine Querverbindung der hoch-affinen IgE-Rezeptoren infolge der Bindung an das Allergen hin sezernieren diese Zellen inflammatorische Mediatoren (Histamin, Leukotriene, Prostaglandine), was eine klinisch manifeste allergische Sofortreaktion zur Folge hat [van Neerven 1999b, Segal et al. 1977]. Die spezifische Immuntherapie (SIT) ist die einzige kausal wirksame Therapie bei Typ I-allergischen Erkrankungen. Sie wurde 1911 erstmalig von Freeman und Noon vorgestellt, wobei diese damals von einer Giftwirkung der verwendeten Präparate ausgegangen waren [Freeman et al. 1911]. Durch repetitive Applikation eines Allergens in zumeist ansteigender Dosierung wird eine Allergenspezifische Toleranz mit Reduktion der allergischen Symptome (z.B. Rhinokonjunktivitis allergica, Asthma bronchiale allergicum, orales Allergiesyndrom, anaphylaktischer Schock) erzielt. In vielen doppel-blind placebo-kontrollierten Studien konnte die klinische Wirksamkeit gezeigt werden [Bohle 2008, Akdis M et al. 2007, Kleine-Tebbe et al. 2006, Bousquet et al. 1998, Ortolani et al. 1984, Reid et al. 1986, Frankland et al. 1954, McAllen 1969]. Auch die World Health Organisation (WHO) weist auf den Nutzen der Immuntherapie gegen allergische Erkrankungen bei ausgewählten Patienten hin, die spezifische IgEAntikörper gegen klinisch relevante Allergene aufweisen [Keine Autoren aufgeführt: „Allergen immunotherapy: therapeutic vaccines for allergic diseases“ (Kongress in Genf, 27.-29. Januar 1997)]. Nach Empfehlungen der Deutschen 6 Gesellschaft Allergologie und klinische Immunologie bestehen folgende Indikationen zur Hyposensibilisierung (SIT) mit Allergenen [Kleine-Tebbe et al. 2006]: Nachweis einer IgE-vermittelten Sensibilisierung (mit Hauttest oder Invitro-Diagnostik) und eindeutiger Zusammenhang mit klinischer Symptomatik (ggf. Provokationstestung) Verfügbarkeit von standardisierten bzw. qualitativ hochwertigen Allergenextrakten Wirksamkeitsnachweis der geplanten SIT für die jeweilige Indikation Allergenkarenz nicht oder schwer möglich Des Weiteren bestehen folgende Kontraindikationen: Persistierendes bzw. unzureichend behandeltes Asthma und/oder irreversible Atemwegsobstruktion, d.h. FEV1 trotz adäquater Pharmakotherapie unter 70% Sollwert (außer bei Insektengiftallergie) Kardiovaskuläre Erkrankung mit erhöhtem Risiko von Nebenwirkungen nach Adrenalingabe (außer bei Insektengiftallergie) Behandlung mit Beta-Blockern (lokal, systemisch) und/oder ACEHemmern (bei Insektengiftallergie) Schwere Erkrankung des Immunsystems (Autoimmunerkrankungen, Immundefizienzen) Maligne Tumorerkrankungen mit aktuellem Krankheitswert Unzureichende Compliance Schwangerschaft (relative Kontraindikation) Neben der Besserung der Symptomatik der vorliegenden allergischen Erkrankung wird mit der „Allergie-Vakzinierung“ auch das Ziel verfolgt, einer Verschlimmerung der Erkrankung vorzubeugen. Hierbei soll beispielsweise der so genannte Etagenwechsel verhindert werden, bei dem sich die allergische Erkrankung der oberen Atemwege in Form von Rhinokonjunktivitis allergica in die „tiefere Etage“ der tieferen Atemwege in Form von Asthma bronchiale allergicum ausweitet und unabhängig von der Allergenexposition chronifiziert. Auch gibt es Studien dazu, dass durch die Behandlung einer allergischen Erkrankung der Neusensibilisierung auf weitere Allergene vorgebeugt werden kann [Bohle 2008, Akdis M et al. 2007, Kleine-Tebbe et al. 2006, Des Roches et al. 1997], wodurch ein so genannter allergischer Flächenbrand verhindert wird. 7 Trotz Jahrzehnte langer Anwendung bei Typ I-allergischen Patienten sind die zugrunde liegenden Wirkmechanismen der SIT nicht vollständig aufgeklärt. Die Aufklärungsbedingungen sind erschwert durch die bisher verabreichten auf Extrakten der natürlichen Allergenquellen basierenden, relativ schlecht definierten Allergengemische, die ausschließlich die Allergenquelle und den Anteil an Hauptallergen(en), nicht aber den Gehalt an Minorallergenen und das Sensibilisierungsprofil der Patienten gegen die einzelnen allergenen Komponenten einer Allergenquelle berücksichtigt [Valenta et al. 1999], wodurch ein Monitoring der kausalen Mechanismen nur bedingt umgesetzt werden kann. Unter der SIT mit subcutaner Injektion oben genannter Allergengemische beschreiben unterschiedliche Arbeitsgruppen teilweise gegensätzliche immunologische Veränderungen. Neben einer Verringerung der Eosinophilen-Zahl während der Pollenflugsaison [Rak et al. 1991, Till et al. 1997] wurden eine reduzierte Mastzellen- und Eosinophilen-Migration beobachtet [Otsuka et al. 1991, Furin et al. 1991, Durham et al. 1996]. Diese Studien zeigen, dass die Anwesenheit der Zellen, die die verzögerte allergische Reaktion bewirken, im Zielgewebe nach einer SIT verringert ist, was die abgemilderten verzögerten Reaktionen bei behandelten Patienten erklären könnte. Des Weiteren kam es zu einer reduzierten Mediatorfreisetzung [Creticos et al. 1985] bei Allergen-Provokation und einer vermehrten Anzahl IgE-modulierender CD8+ Suppressor-T-Zellen im peripheren Blut von Patienten unter einer SIT [Rocklin et al. 1980, Tamir et al. 1987]. Eine erniedrigte IL 4-Produktion Allergen-spezifischer CD4+ T-Zellen konnte bei unveränderter IFN-γ1- und IL-2Produktion [Secrist et al. 1993, Ebner et al. 1997, Ebner 1999] bzw. bei zeitgleich ansteigender IFN-γ-Produktion [Jutel et al. 1995] beobachtet werden, wobei parallel dazu in vitro die Allergen-spezifische T-Zell-Proliferation abnahm [Ebner et al. 1997, Jutel et al. 1995]. Allergen-Stimulation von LymphozytenKulturen aus dem peripheren Blut SIT-behandelter Bienengift-Allergiker führte zu einer reduzierten Produktion aller Th-Zytokine (IL-4, IL-5, IL-13 und IFN-γ) mit Ausnahme von IL-10 [Akdis CA et al. 1998, Bellinghausen et al. 1997]. Wei- 1 IFN-γ induziert Zellen vom Th1-Typ, antagonisiert IL-4 [van Neerven 1999b], unterdrückt IgE, bewirkt die Produktion von IgG4-Antikörpern durch B-Gedächtniszellen [Jutel 2003] 8 terhin ist die IL-102- und IL-123-Produktion Antigen-präsentierender Zellen erhöht [Bohle et al. 2007, Blaser et al. 2004, Durham et al. 1998, Ebner 1999]. Die Effekte der SIT auf die Zytokinkonstellation lassen sich mit dem Ausdruck des Th2/Th1-Shifts zusammenfassend beschreiben. Hierbei kommt es im Verlauf der Allergenexposition zu einer Verschiebung vom Zytokinsekretionsmuster der Allergen-spezifischen Zellen weg vom Th2-Typ, die große Mengen an IL-4 (IgE-heavy-chain-switching in B-Zellen mit nachfolgender Produktion von Antikörpern) und IL-5 (selektive Differenzierung, Lebensverlängerung und Aktivierung von Eosinophilen [Lopez et al. 1988]) produzieren, hin zu einer Immunantwort vom Th1-Typ, wobei vor allem große Mengen an IFN-γ produziert werden. (Zellen vom Th1-Typ führen auch zu zellvermittelter Immunität, indem sie Makrophagen oder CD8+ zytotoxische Lymphozyten aktivieren [Sakaguchi 2000].) Diese Beobachtungen wurden sowohl unter konventioneller Pollen- Immuntherapie über mehrere Monate hinweg [Durham et al. 1998, Secrist et al. 1993, Varney et al. 1993, Durham et al. 1996, Iliopoulos et al. 1991, van Neerven 1999b, Till et al. 1997] als auch unter schnellen und ultra-schnellen Regimen [Jutel et al. 1995, McHugh SM et al. 1995, Akdis CA et al. 1998] gemacht. IgG4-Antikörper werden induziert, die die Rezeptor (CD23 und Fcε-RI)gebundene Serum-IgE-vermittelte Allergen-Präsentation Antigen-präsentierender Zellen (APC) um Faktor > 100 reduzieren und damit die Aktivierung von CD4+ T-Zellen inhibieren [van Neerven et al. 1999a]. Zu Beginn wird im Rahmen der SIT die Produktion von IL-12 und IL-10 durch Antigen-präsentierende Zellen induziert. Hierdurch kommt es zum vermehrten Auftreten von CD4+ TZellen, die ein Th0-Zytokin-Milieu produzieren. Diese Konstellation induziert die Produktion von allen Subklassen von Allergen-spezifischem IgG inklusive IgG4. Wenn diese Antikörper eine relevante Konzentration erreichen, konkurrieren sie mit IgE darum, Allergene zu binden. Hierdurch wird eine IgE-vermittelte Allergen-Präsentation an CD4+ T-Zellen bei niedrigen Allergen-Konzentrationen verhindert bzw. beeinträchtigt. Es resultiert eine höhere Allergen-Schwelle zur TZell-Aktivierung bei unveränderten Konzentrationen an Allergen-spezifischem 2 IL-10 wirkt immunsuppressiv, senkt die IgE- und erhöht die IgG4-Produktion in B-Zellen [Akdis CA 1998, Jeannin 1998, Jutel 2003] 3 IL-12 induziert Zellen vom Th1-Typ [van Neerven 1999b] 9 IgE im Serum der Patienten, die sich einer SIT unterziehen [van Neerven et al. 1999a]. Man spricht in diesem Zusammenhang von der „blocking-antibody“-Theorie [Witteman et al. 1996, Golden et al. 1982]. Allerdings stellte es sich als schwierig heraus, die durch die SIT hervorgerufenen Besserungen des klinischen Befundes mit den beobachteten Veränderungen (Abfall des spezifischen IgE nach anfänglichem Anstieg und vermehrte Synthese von spezifischen IgG und IgG4) zeitlich in Einklang zu bringen [Durham et al. 1998, Reid et al. 1986, Lichtenstein et al. 1973, Djurup et al. 1984, Bousquet et al. 1988], zumal sich diese Beobachtungen nicht durchgehend bei allen hyposensibilisierten Patienten einstellen [Heiss et al. 1999]. Inwieweit die unterschiedlichen Mechanismen für unterschiedliche Allergenquellen von Relevanz sind, ist nicht bekannt [Ebner et al. 1997]. Im Thymus exprimieren unreife T-Zellen eine immense Zahl an T-Zell-AntigenRezeptoren (TCR), die durch die zufällige Neuanordnung der Gensegmente erreicht wird, die für die α- und die β-Kette kodieren. Aber nur jene T-Zellen, die T-Zell-Rezeptoren exprimieren, die den major histocompatibility complex (MHC) mit assoziierten körpereigenen Peptiden mit mäßiger Affinität erkennen, werden vor dem programmierten Zelltod bewahrt, wobei sowohl die T-Zellen, die eine hohe Affinität aufweisen, als auch die mit niedriger Affinität in verschiedenen Entwicklungsschritten eliminiert werden. Diese positive Selektion innerhalb des Thymus stellt das erste Standbein dar, mit dem das Immunsystem autoreaktive Zellen unter Kontrolle hält. Als zweites Standbein ist die negative Selektion im Thymus zu nennen, bei der T-Zellen, deren T-Zell-Rezeptor entweder nicht in der Lage ist, den Komplex aus MHC und körpereigenen Peptiden zu binden, oder diesen zu stark bindet, ebenfalls nicht vor dem programmierten Zelltod bewahrt werden. Es scheint nun aber, dass die negative Selektion im Thymus allein die autoreaktiven T-Zellen nicht ausreichend zu kontrollieren und dadurch Autoimmunerkrankungen vorzubeugen vermag, weshalb autoreaktive T-Zellen, die der negativen Selektion auf irgendeine Weise entkommen sind, weiteren Kontrollen in der Peripherie unterworfen sind, was das dritte Standbein darstellt. Nach der Begegnung mit körpereigenen Antigenen in der Peripherie können die autoreaktiven T-Zellen in einen anergen Zustand versetzt werden, was bedeutet, dass sie funktionell inaktiv sind, ohne dass es zum programmierten Zelltod kommt. Neben diesen drei eher passiven Mechanismen existiert zusätzlich 10 noch ein vierter, eher dominanter Kontrollmechanismus: bestimmte T-Zellen sind in der Lage, die Aktivierung und die Proliferation von autoreaktiven T-Zellen aktiv zu unterdrücken [Sakaguchi 2001, Sakaguchi et al. 2008, Sakaguchi et al. 2009, Wing et al. 2006, Akdis CA et al. 2009]. Diese Vorstellung von einer natürlich vorkommenden T-Zell-Fraktion, die durch ihre supprimierenden Fähigkeiten das Auftreten von autoimmunen Vorgängen, also Vorgängen, die gegen den eigenen Körper gerichtet sind, verhindert beziehungsweise stark limitiert, wurde erstmalig 1975 veröffentlicht [Gershon 1975]. Aufgrund von initialen Ungereimtheiten und Widersprüchen in der anfänglichen Forschung in diesem Gebiet wurde ihre Existenz aber lange Zeit noch weiterhin in Frage gestellt. Dass diese regulatorischen Zellen eine wichtige Rolle in der Aufrechterhaltung der Immunhomöostase des Organismus spielen, konnte im Mausmodell vor einiger Zeit überzeugend demonstriert werden. Sie sind in der Lage, aktiv und dominant die Aktivierung und Effektorfunktion anderer T-Zellen zu unterdrücken. Sie stellen einen Teil der peripheren T-Zellen dar, wobei ihre Zahl in der Peripherie im Erwachsenenalter relativ stabil bleibt [Suri-Payer et al. 1999]. Die Existenz der Zellen wird durch kontinuierliche Stimulation über ihr spezifisches (Auto)antigen in der Peripherie aufrechterhalten [Kuniyasu et al. 2000]. Der Beweis dafür, dass die Erhaltung der regulatorischen T-Zellen durch die Gegenwart der Zielorgane gesteuert wird, die sie regulieren, resultiert aus Untersuchungen, in denen periphere CD4+ T-Zellen, die von athyreoiden Ratten stammen, die Entwicklung von Thyreoiditis in TxX-Ratten, die die Zellen erhalten haben, nicht verhindern können, obwohl die Zellen noch in der Lage waren, die Entwicklung von Diabetes zu verhindern [Seddon et al. 1999a]. Der Begriff der regulatorischen T-Zellen stellt hierbei nur eine Art Überbegriff dar, da es einen spezifischen Marker für diese Zellen in ihrer Gesamtheit nicht gibt. Vielmehr existieren einige – bereits mehr oder weniger gut beschriebene – Untergruppen dieser heterogenen Population der regulatorischen T-Zellen, die sich durch spezifische Merkmale charakterisieren lassen [Sakaguchi et al. 2008, Sakaguchi et al. 2009, Wing et al. 2006, Akdis CA et al. 2009, Shevach 2001] (siehe auch Tabelle 1 [modifiziert aus Taylor A et al. 2004]). 11 TReg cells Suppressor mechanism CD4+CD25+ nTReg TGF-β, CTLA-4, PD-1, GITR (naturally occuring) (zellkontaktabhängig) CD4+CD25+ aTReg TGF-β, CTLA-4, PD-1, GITR (IL-10) (adaptive) (zellkontaktabhängig) Tr1 IL-10, TGF-β Th3 TGF-β CD8+CD25+CD28- TReg IL-10, TGF-β, CTLA-4, PD-1, GITR Qa-1-dependent CD8+ Qa-1-specific TCR CD4-CD8- TReg Induction of apoptosis TCR γδ TReg IL-10, TGF-β NKT cells IL-10, IFN-γ Tabelle 1: Regulatorische T-Zellen Zu nennen sind hier einerseits die induzierten (sekundären) regulatorischen T-Zellen, nämlich Th3-Zellen und die regulatorischen T-Zellen Typ 1 (= Tr1-Zellen), die beide ihre Fähigkeit zur Suppression nicht kontaktabhängig, sondern über die Sekretion löslicher Zytokine vermitteln, wobei die Tr1-Zellen v.a. IL-10 und die Th3-Zellen v.a. TGF-β4 produzieren [Jonuleit et al. 2003, Wing et al. 2006, Akdis CA et al. 2009, Bohle et al. 2007, Blaser et al. 2004]. Bemerkenswerterweise spielen IL-10 und TGF-β ihrerseits offensichtlich – im Zusammenspiel mit weiteren Zytokinen wie IFN-α und IL-4 – eine entscheidende Rolle bei der Differenzierung und Expansion der Th3- und Tr1-Zellen. Die immunsuppressiven Eigenschaften von IL-10 und TGF-β können höchstwahrscheinlich durch ihre Fähigkeit erklärt werden, die Funktion von Antigen-präsentierenden Zellen zu inhibieren [Ding et al. 1992, Fiorentino et al. 1991, Takeuchi et al. 1998, Kitani et al. 2000, Sakaguchi et al. 2008, Sakaguchi et al. 2009] und direkt anti-proliferative Effekte auf T-Zellen zu vermitteln [Letterio et al. 1998, 4 TGF-β (= transforming growth factor β) wirkt immunsuppressiv auf Th1- und Th2-Zellen, führt zur B-Zell-Aktivierung, ist „switch factor“ zur IgA-Produktion, bewirkt Expansion und Überleben der differenzierten CD4+CD25+ T-Zellen 12 Moore KW et al. 2001, Gorelik et al. 2000]. Es spricht vieles dafür, dass diese beiden Zelltypen lediglich einen veränderten Differenzierungszustand ihrer Vorläuferzellen und keine eigene Zelllinie darstellen, wobei als Vorläuferzellen naive natürlich vorkommende CD4+CD25- T-Zellen in der Peripherie gesehen werden [Jonuleit et al. 2003, Sakaguchi et al. 2008, Sakaguchi et al. 2009]. Des Weiteren scheinen dendritische Zellen in ihrer Eigenschaft als professionelle Antigen-präsentierende Zellen die Differenzierung der naiven CD4+ T-Zellen zu diesen induzierten regulatorischen T-Zellen zu kontrollieren [Jonuleit et al. 2001b]. Inflammatorische Stimuli induzieren die Ausreifung dendritischer Zellen und stellen somit den Schlüsselprozess bei der Differenzierung von naiven CD4+ T-Zellen in Effektor-T-Zellen (Th1 oder Th2) dar. Im Gegensatz dazu scheinen unreife dendritische Zellen im steady state wesentlich tolerogener zu sein und die Entwicklung von regulatorischen T-Zellen zu begünstigen. Dies geschieht möglicherweise als Strategie, um die immunologische Toleranz aufrecht zu erhalten [Sakaguchi et al. 2008, Sakaguchi et al. 2009, Jonuleit et al. 2001b, Jonuleit et al. 2000]. Nach dem derzeitigen Wissensstand besteht somit folgender Zusammenhang zwischen dendritischen Zellen und regulatorischen Tr1- und Th3-Zellen: Aktivierte Tr1- und Th3-Zellen unterdrücken die T-Zell-stimulatorischen Eigenschaften der dendritischen Zellen und induzieren dadurch tolerogene dendritische Zellen, die dann die Differenzierung von naiven CD4+ T-Zellen in Tr1-Zellen fördern [Wing et al. 2006, Akdis CA et al. 2009, Jonuleit et al. 2003]. Am besten charakterisiert sind allerdings andererseits die natürlich vorkommenden CD4+CD25+ regulatorischen T-Zellen (CD25 = α-Kette des IL-2Rezeptors), die im Gegensatz zu den oben erwähnten Zellen eine eigenständige Untergruppe darstellen und sich aus Vorläuferzellen der CD4+ T-Zellen direkt entwickeln [Jonuleit et al. 2003, Wing et al. 2006, Akdis CA et al. 2009, Akdis M et al. 2007]. Eine direkte in vivo Relevanz wurde nachgewiesen, weil die Depletion der CD4+CD25+ regulatorischen T-Zellen im Tiermodell spontane Autoimmunität (z.B. Thyreoiditis, Gastritis und insulin-abhängiger Diabetes), sowie verstärkt Reaktivität gegen Tumoren und Alloantigene bewirkt. Eine Rekonstitution der entfernten Zellpopulation führte wiederum zu einem Schutz vor der Entwicklung von Autoimmunerkrankungen [Sakaguchi 2000, Jutel et al. 2003, Suri-Payer et al. 1998]. 13 Beim Menschen konnten kürzlich CD4+CD25+ T-Zellen nachgewiesen werden, die analog zu murinen Ergebnissen eine immunregulatorische bzw. suppressive Rolle spielen und nicht, wie zuvor angenommen, konventionelle Gedächtniszellen darstellen [Shevach 2001, Taylor PA et al. 2001, Dieckmann et al. 2001, Jonuleit et al. 2001a, Stephens et al. 2001]. Sie stellen durchschnittlich etwa 6 % der CD4+ T-Zell-Population bei gesunden Erwachsenen [Dieckmann et al. 2001]. Sie zeigen einen anergen Phänotyp, d.h. durch Stimulation über ihren T-Zellrezeptor können sie in vitro nur in sehr geringem Ausmaß zur Proliferation gebracht werden, wobei es keine Rolle spielt, ob diese Stimulation durch plattengebundenes Anti-CD3-Antikörper in Kombination mit frei im Medium gelösten Anti-CD28-Antikörper oder durch reife dendritische Zellen hervorgerufen werden sollte; letztere stellen die potentesten natürlich vorkommenden immunstimulatorischen Zellen dar [Dieckmann et al. 2001]. Durch IL-2, IL-4 und IL-15 (allein oder auch in Kombination) kann dieser anerge Zustand (teilweise) wieder aufgehoben werden [Shevach 2001, Dieckmann et al. 2001, Jonuleit et al. 2001a, Thornton et al. 1998]. Durch die Zugabe von neutralisierenden monoklonalen Anti-IL-10-Antikörpern konnte keine Proliferation der CD4+CD25+ regulatorischen T-Zellen hervorgerufen werden, was den Schluss zulässt, dass es nicht das IL-10 ist, das auf einem autokrinen Weg den anergen Zustand der CD4+CD25+ T-Zellen bewirkt [Dieckmann et al. 2001, Bohle et al. 2007, Blaser et al. 2004]. Sie entstammen dem Thymus, wo sie sich sehr wahrscheinlich vergleichbar mit konventionellen CD4+ T-Zellen entwickelt haben. Ausschließlich nach Aktivierung über ihren eigenen T-Zell-Rezeptor sind sie dazu in der Lage, Proliferation von CD4+ und CD8+ T-Zellen zu unterdrücken [Shevach 2002] und tun dies in vitro durch einen dosis- und zellkontaktabhängigen, jedoch APC- und zytokinunabhängigen Mechanismus [Shevach 2001, Dieckmann et al. 2001, Jonuleit et al. 2001a], wobei es wahrscheinlich ist, dass sich die immunsuppressiven Eigenschaften der CD4+CD25+ regulatorischen T-Zellen in vivo komplexer darstellen und auf mehreren Mechanismen basieren [Sakaguchi et al. 2008, Sakaguchi et al. 2009, Wing et al. 2006, Akdis CA et al. 2009, Asseman et al. 1999, McHugh RS et al. 2001]. Um aktiviert zu werden und diese Suppressorfunktion auszuüben, reicht ihnen eine wesentlich geringere Antigenkonzentration aus als die, die nötig ist, um naive T-Zellen zu aktivieren. Sind die CD4+CD25+ regulatorischen T-Zellen einmal aktiviert, üben sie ihre Suppressorfunktion gänzlich antigen-unspezifisch aus, das heißt, die Sup- 14 pression ist unabhängig von der Antigen-Spezifität der zu unterdrückenden T-Zell-Population [Shevach 2000, Thornton et al. 1998], in der es letztlich als Ergebnis der „erlittenen“ Suppression zur Inhibition der IL-2-Transkription kommt [Thornton et al. 1998]. Sie bedürfen, um im aktivierten Zustand zu bleiben, keiner wiederholten Aktivierung über ihren T-Zell-Rezeptor, der sich durch eine mittelmäßig starke Affinität gegenüber körpereigenen Peptiden auszeichnet [Shevach 2001]. Allerdings benötigen die CD4+CD25+ regulatorischen T-Zellen einen stetigen Stimulus, um nicht abzusterben und somit ein „steady state“ aufrecht zu erhalten [Akdis CA et al. 1998, Akdis CA et al. 2009]. Die CD4+CD25+ regulatorischen T-Zellen produzieren hauptsächlich IL-10 und wenig IL-2, IL-4 und INF-γ [Shevach 2001, Asseman et al. 1999, Bohle et al. 2007, Blaser et al. 2004]. Durch in vitro Versuche, bei denen die Zytokinaktivität neutralisiert wurde, konnte gezeigt werden, dass die Suppression der induzierten regulatorischen T-Zellen im Verlauf der spezifischen Immuntherapie durch IL-10 und TGF-β vermittelt wird. Zusätzlich kam es aber auch zu einer antigen-spezifischen Suppressoraktivität der CD4+CD25+ T-Zellen der Allergiker [Jutel et al. 2003, Bohle et al. 2007, Blaser et al. 2004]. Es konnte bis jetzt nicht gezeigt werden, dass IL-4, IL-10 oder TGF-β tatsächlich von CD4+CD25+ regulatorischen T-Zellen in vivo produziert werden, womit schwer zu sagen ist, ob diese Zytokine wirklich für die supprimierenden Effekte der regulatorischen T-Zellen verantwortlich sind oder ob sie eine Rolle bei der Differenzierung der regulatorischen T-Zellen spielen [Shevach 2001]. Der genaue Mechanismus der Suppressorwirkung durch die CD4+CD25+ regulatorischen T-Zellen ist bislang noch nicht vollständig aufgeklärt, wobei aber Einigkeit darüber besteht, dass die AntigenErkennung durch die CD4+CD25+ regulatorischen T-Zellen die Expression eines zellmembrangebundenen Moleküls induziert, das an Rezeptoren auf den Zielzellen binden kann und eine Unterbrechung des Zellzyklus induziert [Shevach 2001]. Einige in vivo Studien legen nahe, dass die Funktion der CD4+CD25+ T-Zellen in entscheidendem Maße, aber nicht ausschließlich von einer Signalvermittlung über das CD152-/CTLA (cytotoxic T lymphocyte-associated antigen)-4-Molekül abhängt, das nur auf CD4+CD25+ T-Zellen konstitutiv exprimiert wird [Read et al. 2000, Salomon et al. 2000, Takahashi et al. 2000, Shevach 2001] und ein co-stimulatorisch wirkendes Molekül bei der T-Zellaktivierung darstellt, wobei intrazellulär eine noch höhere Konzentration dieses Moleküls 15 erreicht wird als auf der Zelloberfläche. Es wird inzwischen angenommen, dass eine Bindung von Liganden an CTLA-4 zu einer Down-Regulation der T-ZellAktivität führt, wobei aber auch einige spezielle T-Zell-Funktionen möglicherweise aktiviert werden. In diesem Punkt widersprechen sich die Ergebnisse der verschiedenen Untersuchungen [Shevach 2001, Takahashi et al. 2000, Chai et al. 2002]. T-Zellen, die über diesen CTLA-4-Rezeptor stimuliert wurden, produzieren vornehmlich TGF-β [Chen et al. 1998, Salomon et al. 2000]. Diese Erkenntnis legt nahe, dass CD4+ regulatorische T-Zellen, die über CTLA-4 aktiviert wurden, andere T-Zellen supprimieren könnten, indem sie TGF-β sezernieren [Sakaguchi 2000] bzw. auf ihrer Zelloberfläche membrangebunden exprimieren [Nakamura et al. 2001]. Dass TGF-β vor der Entwicklung von Autoimmunkrankheiten schützt, hat sich in murinen Experimenten gezeigt, bei denen TGF-β-defiziente oder TGF-β-Rezeptor-inaktivierte Mäuse verschiedene Autoimmunerkrankungen entwickelten [Gorelik et al. 2000]. Diese Erkenntnisse legen die Möglichkeit nahe, dass CD4+CD25+ regulatorische T-Zellen im Rahmen der natürlichen T-Zell-vermittelten Selbsttoleranz ihre Suppressoraktivität möglicherweise auch dadurch vermitteln, indem sie IL-4, IL-10 oder TGF-β sezernieren. Denn in der Tat hat die Verabreichung von neutralisierenden Antikörpern gegen IL-4 oder TGF-β zur Folge, dass in vivo die autoimmun-präventive und toleranz-induzierende Aktivität der regulatorischen T-Zellen in einigen Untersuchungen aufgehoben werden konnte [Seddon et al. 1999b, Zhai et al. 1999]. Eine andere Arbeit weist auf ein Zusammenwirken von IL-10 und TGF-β bei der Unterdrückung der Immunantwort hin, wobei diese Antigen-spezifische Suppressoraktivität, die sich nach der spezifischen Immuntherapie eingestellt hatte, auf die CD4+CD25+ regulatorischen T-Zellen begrenzt war. Hierbei kam es zu einem Anstieg von IgA und IgG4 und einer Abnahme der T-Zell-Proliferation und der Th2-Zytokine [Jutel et al. 2003]. Es existieren einige weitere Marker (OX40, L-Selectin, GITR), die mehr oder weniger spezifisch für die Fraktion der CD4+CD25+ immunoregulatorischen T-Zellen sind, deren unmittelbare Bedeutung für die supprimierende Funktion dieser Zellpopulation aber angezweifelt wird bzw. noch weitgehend unbekannt ist [Jonuleit et al. 2003]. Die neueste Art der Charakterisierung von regulatorischen T-Zellen besteht auf molekularer Ebene, nämlich durch Nachweis der Expression des intrazellulären Transkriptionsfaktors Fox p 3 (forkhead box p 3). Er gehört zur so genannten forkhead family. Die Expression von Fox p 3 spielt bei der Entwicklung der re- 16 gulatorischen T-Zellen eine wichtige Rolle, indem Fox p 3 ein genetisches Programm kontrolliert, das zur spezifischen Entwicklung dieser Zellart führt. Die große Mehrheit der Fox p 3-exprimierenden regulatorischen T-Zellen findet sich in der Gruppe der CD4+ T-Zellen, die MHC II-Moleküle auf ihrer Oberfläche tragen und die zusätzlich auch CD25 exprimieren [Campbell et al. 2007, Bacchetta et al. 2007, Allan et al. 2007]. Vor der Identifizierung von Fox p 3 wurde – wie bereits ausgeführt - die Expression der beiden Zelloberflächenmoleküle CD4 und CD25 verwendet, um diese Zellpopulation zu definieren, welche folglich als CD4+CD25+ T-Zellen bezeichnet wurden. Allerdings ist der Gebrauch von CD25 zur Definition von regulatorischen T-Zellen problematisch, da CD25 auch von nicht-regulatorischen T-Zellen exprimiert wird, nämlich beispielsweise bei deren Aktivierung im Rahmen einer Immunantwort gegen Pathogene. Inzwischen ist allerdings auch für Fox p 3 bekannt, dass auch dieser Transkriptionsfaktor von via T-Zell-Rezeptor aktivierten T-Zellen exprimiert wird, obwohl es sich bei diesen um keine regulatorischen T-Zellen handelt. Deshalb ist auch dieser Marker nicht in der Lage, die von ihm markierten Zellen eindeutig als regulatorische T-Zellen zu charakterisieren. Allerdings erreichen die nachgewiesenen Konzentrationen von Fox p 3 in aktivierten T-Zellen nicht das Niveau der Konzentrationen in regulatorischen T-Zellen; auch ist in den aktivierten T-Zellen das Vorhandensein von Fox p 3 nicht von Dauer [Allan et al. 2007, Bacchetta et al. 2007, Campbell et al. 2007]. Nach wie vor ist es ein großes Ziel, Oberflächenmarker zu identifizieren, die spezifisch für regulatorische T-Zellen sind. CD4+CD25+ regulatorische T-Zellen wurden auch als natürliche regulatorische T-Zellen bezeichnet (Entstehung im Thymus), um sie von weiteren regulatorischen T-Zellen unterscheiden zu können, die in der Peripherie im Lauf des Lebens erzeugt werden (sog. adaptive regulatorische T-Zellen). Tatsächlich ist die natürlich vorkommende CD4+CD25+ regulatorische T-Zell-Generation eine Untergruppe aller Fox p 3-exprimierenden regulatorischen T-Zellen [Bluestone et al. 2003]. Genetische Mutationen im Fox p 3-Gen, die zu erblichen Krankheiten führten, konnten sowohl beim Menschen als auch bei der Maus identifiziert werden. Dies ist ein klarer Beweis dafür, dass die Fox p 3-exprimierenden regulatorischen T-Zellen eine entscheidende Rolle bei der Aufrechterhaltung der normalen Funktion des Immunsystems spielen. Menschen mit Veränderungen im 17 Fox p 3-Gen leiden an einer ernsten und bald letal endenden Autoimmunstörung, die als Immune dysregulation, Polyendocrinopathy, Enteropathy X-linked (IPEX) syndrome bezeichnet wird. Dieses Syndrom ist charakterisiert durch die Entwicklung von systemischen Autoimmunreaktionen innerhalb des ersten Lebensjahres, was zur Trias wässrige Diarrhoe, ekzematöse Dermatitis und Endokrinopathien (meistens Diabetes mellitus Typ I) führt. Häufig treten zusätzlich weitere Autoimmunphänomene wie z.B. Coombs-positive Anämie, Thrombozytopenie, Neutropenie und tubuläre Nephropathie auf. Die Mehrzahl der betroffenen männlichen Individuen stirbt innerhalb des ersten Lebensjahres entweder an metabolischen Störungen oder an Sepsis. Ähnliche Krankheitserscheinungen wurden bei sogenannten „scurfy“ Mäusen beobachtet, die eine spontane Fox p 3-Mutation aufweisen [Shevach 2002, Sakaguchi et al. 2004, Campbell et al. 2007, Bacchetta et al. 2007, Allan et al. 2007]. Über einen oder mehrere der oben genannten Mechanismen haben CD4+CD25+ regulatorische T-Zellen die Fähigkeit, in höchst effizienter Weise autoreaktive T-Zellen zu kontrollieren, wodurch die Selbsttoleranz aufrechterhalten werden kann. Verglichen mit autoreaktiven T-Zellen, die im gesunden Immunsystem vorkommen und normalerweise einen T-Zell-Rezeptor mit niedriger Affinität für körpereigene Antigene tragen, können regulatorische T-Zellen aufgrund ihrer höheren Affinität und der damit verbundenen rascheren Aktivierung und Migration schneller zum Ort des Geschehens geführt werden und dort leichter aktiviert werden, wodurch sie autoreaktive T-Zellen kontrollieren, die ebenfalls vor Ort gelangt sind. Sogar bei der Konfrontation mit Molekülen, die körpereigenen stark ähneln (Antigenmimikry), reagieren die regulatorischen T-Zellen sensitiver auf dieses Antigen und schneller als die autoreaktiven T-Zellen, die auch auf dieses Antigen ansprechen. Das ist vielleicht der Grund, warum Peptide, die körpereigene Strukturen/Moleküle imitieren, in der Lage sind, autoreaktive T-Zellen in vitro zu aktivieren, nicht aber in vivo Autoimmunerkrankungen auszulösen vermögen [Sakaguchi 2001, Sakaguchi et al. 2008, Sakaguchi et al. 2009]. In den bisherigen in vivo Studien wurde vor allem die Rolle der CD4+CD25+ regulatorischen T-Zellen bei der Toleranzinduktion und Suppression von organ-spezifischer Autoimmunität untersucht [Taylor PA et al. 2001], wobei es augenscheinlich ist, dass in vivo die CD4+CD25+ regulatorischen T-Zellen und die TGF-β- und IL-10-produzierenden Th3- und Tr1-Zellen nicht nur eng zusammenarbeiten, um autoimmunen Reaktionen im Körper vor- 18 zubeugen, sondern sogar direkt die gegenseitige Entwicklung induzieren [Jonuleit et al. 2003, Bluestone et al. 2003], indem sie beispielsweise im Mausmodell ihre suppressiven Eigenschaften auf konventionelle CD4+ T-Zellen übertragen konnten, mit denen sie sich in Kultur befanden [Jonuleit et al. 2003, Zelenika et al. 2001]. In diesem Zusammenhang sind auch die Begriffe der „bystander suppression“ und der „infectious tolerance“ zu nennen, wobei letztere die Fähigkeit beschreibt, die Suppressor-Eigenschaften von regulatorischen T-Zellen auf konventionelle CD4+ T-Zellen zu übertragen. Diese sekundäre SuppressorAktivität, die von CD4+CD25+ T-Zellen via Zell-Zell-Kontakt auf konventionelle CD4+ T-Zellen übertragen wird, ist ihrerseits dann zellkontaktunabhängig und wird über die immunmodulatorischen Faktoren TGF-β und IL-10 vermittelt. Somit lassen sich eventuell die widersprüchlichen Ergebnisse zur Rolle der Zytokine bei dem Mechanismus der CD4+CD25+ regulatorischen T-Zellen erklären, über den die Suppression vermittelt wird. Hierbei kommt es nämlich zu einem Transfer der Toleranz-begünstigenden Aktivität von den natürlich vorkommenden CD4+CD25+ regulatorischen T-Zellen, die ihrerseits keine Zytokine in größerem Umfang sezernieren, auf die induzierten sekundären regulatorischen T-Zellen mit einer anderen Antigenspezifität, die im Gegensatz zu den CD4+CD25+ regulatorischen T-Zellen ihre Suppressorfunktion über Zytokine (TGF-β und IL-10) vermitteln. Dieses Ausweiten des suppressiven Effektes mag einer der fundamentalen Mechanismen sein, durch den es zur Induktion und Aufrechterhaltung der peripheren Toleranz kommt [Jonuleit et al. 2003, Bohle et al. 2007, Blaser et al. 2004]. Vor wenigen Jahren wurde das „duale“ Th1/Th2-Modell um eine 3. Untergruppe von T-Helfer-Zellen erweitert, die sog. Th17-Zellen. Ihre Hauptfunktion besteht in der Induktion von Entzündung im Gewebe sowie dem Schutz des Organismus vor Krankheitserregern, insbesondere Bakterien und Pilze (extrazelluläre Pathogene). Induziert wird ihre Entstehung durch die Zytokine IL-6 und TGF-ß, die in den Vorläuferzellen die Entstehung des Transkriptionsfaktors ROR-γt bewirken. Sie produzieren hauptsächlich IL-17, welches wiederum die Freisetzung der proinflammatorischen Zytokine IL-6, TNF-α und IL-1ß sowie von Chemokinen, Metalloproteinasen und Prostaglandin E2 bewirkt, was zur Folge hat, dass Entzündungszellen einwandern („Neutrophilen-Rekrutierung“) [Bettelli et al. 2008, Awasthi et al. 2009]. 19 Den Th17-Zellen wird eine relevante Beteiligung bei der Entwicklung einiger Autoimmun-Erkrankungen zugewiesen, so z.B. bei der Rheumatoiden Arthritis, bei der Multiplen Sklerose, bei den chronisch-entzündlichen Darmerkrankungen sowie bei der Psoriasis, wobei entsprechende Hinweise hierfür sowohl beim Menschen als im Tiermodell gesehen wurden. Beim Vergleich zwischen den CD4+CD25+ regulatorische T-Zellen und den Th17-Zellen wird ein reziprokes Verhältnis beschrieben: TGF-ß alleine induziert den Transkriptionsfaktor Fox p 3 und somit CD4+CD25+ regulatorische T-Zellen; in Gegenwart von IL-6 und TGF-ß wird die Entwicklung von CD4+CD25+ regulatorische T-Zellen inhibiert und Th17-Zellen werden induziert. Es wurde sogar nachgewiesen, dass sich die beiden Transkriptionsfaktoren ROR-γt (für Th17-Zellen) und Fox p 3 (für CD4+CD25+ regulatorische T-Zellen) gegenseitig binden und dadurch gegenseitig antagonisieren können [Awasthi et al. 2009]. Neben dem großen Feld der Autoimmunität werden CD4+CD25+ regulatorische T-Zellen auch im Zusammenhang mit Toleranz gegenüber Organtransplantationen beforscht. Von den zahlreichen Arbeiten zu diesem Thema seien an dieser Stelle drei exemplarisch erwähnt [Hara et al. 2001, Taylor PA et al. 2001, Zhai et al. 1999]. Über die Rolle der humanen CD4+CD25+ regulatorischen T-Zellen bei der Toleranzinduktion gegen Inhalationsallergene lagen zum Zeitpunkt des Beginns der vorliegenden Arbeit keine Untersuchungen vor. Die Beteiligung der CD4+CD25+ regulatorischen T-Zellen an der Wirkung der spezifischen Immuntherapie wurde im vorliegenden Projekt bei definierter Typ I-Allergie auf Bet v 1, das Hauptallergen der Birke, untersucht. Für die Untersuchung von Patienten mit definiertem Sensibilisierungsprofil ist dieses Modell-Allergen besonders geeignet, da bei 60% der Patienten mit Sensibilisierung auf früh- und mittelblühende Bäume eine ausschließliche Sensibilisierung auf dieses 17-kDa-Allergen vorliegt. 20 4. Materialien und Methoden 4.1. Inklusionskriterien zur Studienteilnahme Geeignete Patienten mit positiver Anamnese, Pricktest- und CAP-FEIABefunden auf früh- und mittelblühende Bäume wurden in der Allergieambulanz der Hautklinik Universitätsklinikum Erlangen rekrutiert. Die Indikation zur spezifischen Immuntherapie wurde nach den Empfehlungen der WHO und nach positiver nasaler Provokation gestellt. Die Studienteilnehmer wurden mündlich und schriftlich aufgeklärt. Ein positives Votum der Ethikkommision der medizinischen Fakultät der Universität Erlangen-Nürnberg (Bearbeitungsnummer 2375) liegt vor. Das komponentenspezifische Sensibilisierungprofil wurde im IgE-Immunoblot auf aufgetrennten natürlichen Pollenextrakten nach etablierten Methoden [Furin et al. 1991] bestimmt. Als Einschlusskriterium für die Studie galten neben Indikation zur Hyposensibilisierung und Fehlen entsprechender Ausschlusskriterien nach WHO eine Sensibilisierung auf das Hauptallergen der Birke, Bet v 1. Zusätzliche, aber nicht ausschließliche Sensibilisierungen auf Minorallergene der Birke (z.B. bei 9, 14, 21, 33 und 65 kDa) waren erlaubt. Dreizehn den Einschlusskriterien entsprechende Patienten, die nach schriftlicher und mündlicher Aufklärung freiwillig an der Studie teilnahmen, wurden im Verlauf der präsaisonalen Hyposensibilisierungstherapie bezüglich der Rolle der CD4+CD25+ T-Zellen untersucht. Als Impfstoff wurde Pollinex Quattro™ (Bencard Allergy GmbH, München, Deutschland) verwendet; hierbei handelt es sich um tyrosinadsorbierte, chemisch modifizierte Allergenextrakte (Allergoide) zur s.c.Impfung, wobei bei der 1. Impfung 300, bei der 2. Impfung 800 und bei der 3. und der 4. Impfung 2000 SU/ml (SU = Standardised Units) allergene Substanzen verabreicht werden. Als Adjuvans kommt in diesem Impfstoff MPL® (= Monophosphoryl-Lipid A), die gereinigte, detoxifizierte Lipid-A-Komponente aus dem Lipopolysaccharid von Salmonella minnesota, in einer Konzentration von 50 µg/ml zum Einsatz [Drachenberg et al. 2001, Drachenberg et al. 2002, Drachenberg et al. 2003]. 21 Zu definierten Zeitpunkten während der SIT wurden den Patienten Blutproben (160 ml Heparin-Vollblut und 7,5 ml zur Serumgewinnung) durch Punktion einer Vene der Ellenbogeninnenseite zur weiteren Analyse entnommen (Abbildung 1). Abbildung 1: Schema der Spezifischen Immuntherapie (SIT) und Blutentnahmen 4.2. Puffer und Medien 10%-SDS-Lösung (10 g Lauryl Sulfat = Sodiumdodecylsulfat = SDS = C12H25O4SNa (Lot No. 81K0177, EC No. 205-788-1, Sigma®-Aldrich Chemie GmbH, Steinheim, Deutschland), 100 ml Aqua dest.) Lower-Tris-Lösung (363,3 g (= 3-molar) Tris (= Tris(hydroxymethyl)-aminomethan = H2NC(CH2OH)3, EC-No.: 201-064-4, Merck KGaA, Darmstadt, Deutschland), 40 ml (= 0,4% w/v) 10%-SDS-Lösung. Aqua dest. ad 1000 ml, pH = 8,85) 22 Upper-Tris-Lösung (30,3 g (= 0,5-molar) Tris, 20 ml (= 0,4% w/v) 10%SDS-Lösung, Aqua dest. ad 500 ml, pH = 6,8) 10%-APS-Lösung (10 g Ammoniumperoxodisulfat = (NH4)2S2O8, Merck KGaA, Darmstadt, Deutschland, 100 ml Aqua dest.) Trenngel 12,5% (50 ml Lower-Tris-Lösung, 62,4 ml 40%-Acrylamidstammlösung (=Rotiphorese® Gel 40, Art.No.: 3030.1, Carl Roth GmbH & Co., Karlsruhe, Deutschland), 87,6 ml Aqua dest., 40 µl TEMED (=N,N,N’,N’-Tetramethylethylendi-amin, Electrophoresis Reagent, Lot No.: 112K0586, EC No.: 203-744-6, Sigma®-Aldrich Chemie GmbH, Steinheim, Deutschland), 800 µl 10%-APS-Lösung) Sammelgel (20 ml Upper-Tris-Lösung, 10 ml 40%-Acrylamidstammlösung, 50 ml Aqua dest., 40 µl TEMED, 480 µl 10%-APS-Lösung) 10fach-Proteinlauf(gel)puffer = 10fach-Elektrophoresepuffer (60,6 g TrisPulver, 292 g Glycin (= C2H5NO2, Art.Nr. 3908.3, Carl Roth GmbH & Co., Karlsruhe, Deutschland), 20 g SDS, Aqua dest. ad 2000 ml, pH = 8,3) 2%-Bromphenolblau-Lösung (2 g Bromphenol Blue (= 3’,3’’,5’,5’’-Tetrabromophenolsulfonphthalein, Sodium Salt, Lot No. 66H3672, EEC No.: 263-653-2, Sigma®-Aldrich Chemie GmbH, Steinheim, Deutschland ), 100 ml Aqua dest.) Auftragspuffer = Fünffachpuffer (1 g SDS, 6,25 g Glycin, 4 ml Upper-TrisLösung, 1,0 ml 2-Mercaptoethanol (= 2-Hydroxyethylmercaptan = C2H6OS, Lot No.: 95H09235, Sigma Chemical Co. St. Louis, USA), 0,5 ml 2%-Bromphenolblau-Lösung) Transferpuffer = Blotpuffer (15,13 g Tris, 72,06 g Glycin, 1000 ml Methanol (= CH4O, Art.-Nr.: 4627.5, Carl Roth GmbH & Co., Karlsruhe, Deutschland), Aqua dest. ad 5000 ml) Coomassie-Lösung (1 g Coomassie® Brillant Blue R-250 (Catalog 1610400, Bio-Rad Laboratories, 2000 Alfred Nobel Dr., Hercules, Kalifornien, USA), 500 ml Methanol, 100 ml Essigsäure (= C2H4O2, Art.-Nr.: 3738.5, Carl Roth GmbH & Co., Karlsruhe, Deutschland), Aqua dest. ad 1000 ml) Entfärber (40 ml Methanol, 10 ml Essigsäure, 50 ml Aqua dest.) 0,6%-Topagarosegel (3 g Agarose ultraPURE (Electrophoresis Grade, Life Technologies, Paisley, Schottland), 500 ml Aqua dest.) 23 Goldpuffer (37,5 g Na2HPO4 (= di-Natriumhydrogenphosphat, Art.-Nr.: 4984.1, Carl Roth GmbH & Co., Karlsruhe, Deutschland), 5 g NaH2PO4 (= Natriumdihydrogenphosphat, Art.-Nr.: T879.2, Carl Roth GmbH & Co., Karlsruhe, Deutschland), 25 g (= 0,5%) BSA (Bovine Serum Albumin Fraktion V, 90732521, 735094, Roche Diagnostics GmbH, Mannheim, Deutschland), 2,5 g (= 0,05%) NaN3 (= Natriumazid, Batch No.: 023K0024, Sigma-Aldrich® Chemie GmbH, Steinheim, Deutschland), 25 ml (= 0,5%) Tween 20 (Cat.-Nr.: 27,434-8, Lot.-Nr.: S05561-022, Sigma-Aldrich® Chemie GmbH, Steinheim, Deutschland), Aqua dest. ad 5000 ml) DPBS/EDTA-Lösung (500 ml DPBS (BioWhittaker Europe, Verviers, Belgien), 1 ml 0,5-molare EDTA-Lösung (AccuGENE™, BioWhittaker, Walkersville, Maryland)) 10%-Natriumazid-Lösung (10 g NaN3, 100 ml Aqua dest.) FACS-Puffer (500 ml DPBS, 5 ml FCS (=Foetales Calf Serum Gold, Cat.No.: A15-649, Lot.No.: A01120-437, PAA Laboratories GmbH, Pasching, Österreich), 1 ml 10%-Natriumazid-Lösung, pH = 7,3) MACS®-Puffer (500 ml DPBS, 12,5 ml HSA (= Human-Albumin, Kabi 20%, salzarm, octapharm, Langenfeld, Deutschland)) 2%-Formaldehydlösung (2,7 ml 37%-Formaldehydlösung (Art.-Nr.: 4979.1, Carl Roth GmbH & Co., Karlsruhe, Deutschland), 47,3 ml DPBS) X-Medium (250 ml x-vivo-20 (BioWhittaker), 5 ml Glutamin (= LGlutamine, Cat.No.: BE17-605E, Lot.No.: 3MB0031, BioWhittaker, Verviers, Belgien), 200 µl Gentamicin (Merck), 12,5 ml Pool-Serum (BioWhittaker)) AB-Medium (500 ml RPMI 1640 without Glutamine (BioWhittaker Europe, Verviers, Belgien), 5 ml hitzeinaktiviertes unverdünntes AB-Plasma (aus Eigenproduktion der Hautklinik Erlangen), 5 ml Glutamin (BioWhittaker), 200 µl Gentamicin (Merck)) Einfriermedium (25 ml 40%-Glucose-Lösung (= Glucosteril 40%, Inhaltsstoff: Glucose-Monohydrat, Fresenius Kabi, Bad Homburg, Deutschland), 20 ml DMSO (= Dimethyl Sulfoxide, Lot.-Nr.: 101K00291, EC No.: 200664-3, Sigma-Aldrich® Chemie GmbH, Steinheim, Deutschland), 55 ml HSA) 24 3 H-Thymidin-Lösung (1 ml methyl-3H-Thymidin (185 MBq = 5 mCi) ae- queous solution containing 10% Ethanol sterilized 25 Ci/mmol (amersham pharmacia biotech), 49 ml RPMI 1640 without Glutamine (BioWhittaker)) DC-Medium (1% Poolserum (= Human Serum, Cat.No.: 14-402E, Lot.No.: 017642, BioWhittaker, Walkersville, Maryland, USA), 1% Penstrep (= Penicillin/Streptomycin, 10.000 U Penicillin/ml, 10 mg Streptomycin/ml, Cat.No.: P06-07100, Lot.No.: 530403, PAN™, Biotech GmbH, Aidenbach, Deutschland) in x-vivo 15 without Phenol Red or Gentamicin (BioWhittaker)) 1-M-Salzsäure (13 ml Salzsäure 25% (Art.Nr. 6331.2, Carl Roth GmbH & Co., Karlsruhe, Deutschland), 100 ml Aqua dest.) 1-M-Natronlauge (40 g Natriumhydroxid (Art.No. 71690, EEC No. 2151855, Fluka Chemie-AG, Buchs, Schweiz), Aqua dest. ad 1000 ml) Coating Buffer (8,40 g NaHCO3 (= Natriumhydrogencarbonat, Merck KGaA, Darmstadt, Deutschland), 3,56 g Na2CO3 (= Natriumcarbonat, Art. A135.2, Carl Roth GmbH & Co., Karlsruhe, Deutschland), Aqua dest. ad 1000 ml) Wash Buffer (500 ml DPBS, 0,25 ml (= 0,05%) Tween 20) Stop Solution (= 1 M H3PO4 (5 ml ortho-Phosphorsäure 85%, 1 Liter = 1,71 kg, 1.00573.1000, Merck KGaA, Darmstadt, Deutschland), 45 ml Aqua dest.) 4.3. Protein-Extraktion aus Birkenpollen Vor ihrer weiteren Verwendung in der Elektrophorese müssen die Proteine zunächst aus den kommerziellen Birkenpollen extrahiert werden. 2 g Birkenpollen (Betula verrucosa, Allergon, Välinge, Schweden) wurden zu diesem Zweck in 100 ml Aqua dest. aufgeschwemmt. Diese Suspension wurde mithilfe eines Ultraturrax (ULTRA-TURRAX T25, Janke & Kunkel, IKA®Labortechnik, Stauffen, Deutschland) für 1-2 min auf maximaler Stufe (24.000 rpm) homogenisiert. Anschließend wurde die Suspension für 3 h bei 4°C gerührt (RCT basic, IKA Labortechnik), anschließend zentrifugiert (13.000 rpm / 20 min / 4°C) in der Biofuge pico (Heraeus Sepatech, Heraeus Instruments, Fabr.-Nr. 234255, Osterode, Deutschland) mit Festwinkelrotor 25 (Best.-Nr. 75003324). Der Überstand wurde in 1 ml Portionen auf EppendorfCups verteilt, in deren Deckel anschließend mit einer Nadel mehrere kleine Löcher gestochen wurden. Mit flüssigem Stickstoff wurden die Eppendorf-Cups schockgefroren, anschließend 3 Tage lyophilisiert (Freezedryer, Virtis, Gardiner, NY, US). Bis zu ihrer Verwendung wurden sie bei -20°C aufbewahrt [vgl. Heiss et al. 1999, Niederberger et al. 1998]. 4.4. Gel-Herstellung Um die Birkenpollenproteine mittels Elektrophorese auftrennen zu können, muss zunächst das dafür benötigte Gel gegossen werden. Die Platten der Gelkammer (Hoefer SE600-15-1,5 Electrophoresis Unit, Amersham Pharmacia Biotech Inc., San Francisco CA, USA; Breite des Gels: 12,5 cm, Breite des präparativen Slots: 12,0 cm) wurden mit 70%-Alkohol gereinigt und zwischen die Glasplatten Spacer gelegt und in den Gelgießständer eingespannt. 0,6%-Topagarose wurde in der Mikrowelle erhitzt, bis sie flüssig wurde. Die Spalten zwischen den eingespannten Platten und der Unterlage des Gelgießständers wurden mit Topagarose abgedichtet, welche aushärten musste, bevor mit dem Gießen des Gels begonnen werden konnte. Zuerst wurde das Trenngel in den Gelgießständer gegossen. Darauf wird noch eine Schicht Isopropanol (= 2-Propanol = C3H8O, Art.-Nr.: 6752.2, Carl Roth GmbH & Co., Karlsruhe, Deutschland) von etwa 5 mm aufgetragen, so dass das Trenngel einen geraden oberen Rand ausbildet. Nach Aushärtung des Trenngels wurde das Isopropanol abgegossen und mit Aqua dest. gewaschen. Anschließend wurde das Sammelgel darüber gegossen und die Kämme zur Herstellung präparativer Gele eingesetzt. Nach Aushärtung des Sammelgels und Entfernung der Kämme, wurden die Taschen mit Aqua dest. gespült. Nach Erstarren des Sammelgels wurden die Gele in das Ständersystem der oben genannten Gelkammer eingebaut. 4.5. SDS (Sodiumdodecylsulfat)-PAGE (Polyacrylamid- Gelelektrophorese) Durch dieses Verfahren werden die Birkenpollenproteine elektrophoretisch aufgetrennt, um anschließend mittels Blot auf die Nitrocellulosemembran übertragen werden zu können. 26 Pro präparatives Gel (Slotbreite 12 cm) wurden 100 µg Extrakt eingesetzt. Hierfür wurde der Inhalt eines jeden oben genannter Extrakte, aliquotiert zu je 20 µg, mit 150 µl Aqua dest. gelöst. Zu dieser Lösung wurden 37,5 µl Auftragspuffer gegeben. Diese Mischung wurde gevortext und für 5 min bei 95°C denaturiert. Nach Befüllen und Zusammensetzen der Blotkammer (insgesamt wurden etwa 5 Liter Einfach-Proteinlaufpuffer benötigt) wurde der Inhalt der Eppendorf-Cups mit einer 1 ml-Spritze (BD Plastipak™ Syringe, Becton Dickinson S.A., Madrid, Spanien) in die Gelschlitze gefüllt. Mit einer Hamilton-Spritze wurden als Leistenmarker 10 µl BenchMark™ Prestained Protein Ladder (Invitrogen, USA, Katalog-Nr.10748-010) in die Marker-Taschen gefüllt. Bei einer Stromstärke von 60 mA pro Gel wurde so lange elektrophoretisch aufgetrennt, bis die Front des BenchMark™ ca. 13 cm zurückgelegt hatte (nach ca. 1 h) [vgl. Niederberger et al. 1998]. 4.6. Blotten der Gele auf Nitrocellulose Hierbei werden die elektrophoretisch aufgetrennten Proteine vom Gel auf die Nitrocellulosemembran übertragen. Die Proteine wurden vom Gel auf eine Nitrocellulose-Membran (Schleicher & Schüll, Dassel, Deutschland) mittels Elektrotransfer übertragen, wobei die Proteine zur Anode wandern. Dazu wurden pro Gel zwei Whatman-Papiere (Whatman, Maidstone, England) und eine Nitrocellulose-Membran zurechtgeschnitten (jeweils 15 cm x 13 cm). Das Gel wurde aus den Glasplatten entfernt, in denen es sich bis dahin noch befunden hatte (vgl. 4.4. und 4.5.), und auf ein befeuchtetes Whatman-Papier gelegt. Zur Qualitätskontrolle des Extraktaufschlusses wurde jeweils ein 1,5 cm breiter Gelabschnitt des Trenngels abgetrennt und 30 bis 60 min auf der Schaukel mit Coomassie-Lösung gefärbt. Anschließend wurde das Coomassie-gefärbte Gelstück mehrfach mit dem Entfärber auf der Schaukel behandelt. Die Trenngele auf dem Whatman-Papier wurden mit der Nitrocellulose-Membran und einem weiteren Whatman-Papier bedeckt. Unter Zuhilfenahme der Schwämme der Transferkammer (Hoefer Transphor Unit + 2 Cassettes, Amersham Pharmacia Biotech Inc., San Francisco CA, USA) wurde dieser Stapel in die Haltegestelle der Transferkammer eingespannt. Das Stapeln und Einspannen geschah in einer Wanne mit Aqua dest., um das Einschließen von Luftblasen zu vermeiden. Die Transferkammer wurde mit Transferpuffer befüllt. Anschließend wurden die Haltegestelle in die 27 Transferkammer eingebaut. Bei 250 mA wurde 3 h lang in der NassBlotkammer geblottet. Anschließend wurde die Nitrocellulose herausgenommen und auf Whatman-Papier getrocknet. Bis zur weiteren Verwendung wurde die Nitrocellulose bei -20°C aufbewahrt [vgl. Towbin et al. 1979, Niederberger et al. 1998]. 4.7. IgE-Immunoblot mit Patientenserum Mit Hilfe der hergestellten Nitrocellulosemembran können die im Patientenserum potentiell vorhandenen Antikörper gegen Proteine der Birkenpollen nachgewiesen werden. Die Nitrocellulose-Membran wurde parallel zur Laufrichtung in etwa 5 mm breite Streifchen geschnitten, die in einem Inkubationsgefäß (1-well Reservoir, Ani Labsystems Ltd. Oy, FI-01720 Vantaa, Finnland) auf der Schaukel (Heidolph Polymax 1040) zweimal für 10 min und einmal für 30 min mit Goldpuffer (GP) gewaschen wurden, um freie Bindungsstellen abzusättigen. Das Patientenserum wurde mit Goldpuffer 1:10 verdünnt. Hiervon wurde 1 ml auf ein Streifchen gegeben. Parallel dazu wurde als Negativkontrolle ein Kontrollstreifchen mit 1 ml Goldpuffer versehen. Die Streifchen wurden weiterhin über Nacht bei 4°C in der Serumverdünnung beziehungsweise im Goldpuffer auf der Schaukel geschwenkt. Daraufhin wurde wieder zweimal für 10 min und einmal für 30 min mit Goldpuffer gewaschen. Die Arbeit wurde zu diesem Zeitpunkt im Radioaktivlabor fortgesetzt. 125 Iod-markierte Antihuman-IgE-Antikörper (Pharmacia CAP System™ Specific IgE RIA, Diagnostics AB, Pharmacia & Upjohn, Uppsala, Sweden & Freiburg, Germany) wurden mit Goldpuffer 1:10 verdünnt. Jedes Streifchen wurde mit 1 ml dieser Verdünnung über Nacht bei Raumtemperatur auf der Schaukel (Rocking Platform, Biometra) inkubiert. Die Streifchen wurden wieder zweimal für 10 min und einmal für 30 min mit Goldpuffer gewaschen und anschließend auf Whatman-Papier getrocknet. In einer Kodak-RöntgenKassette wurden die auf einer Pappe fixierten Streifchen mit einen Film (Hyperfilm™MP, Amersham Pharmacia Biotech UK Limited, Amersham Place, Little Chalfont, Buckinghamshire, England, HP7 9NA) für 2-3 beziehungsweise 710 Tage bei -80°C exponiert (Autoradiographie) [vgl. Valenta et al. 1992a, Valenta et al. 1992b, Niederberger et al. 1998]. 28 4.8. Lymphoprep™-Gradient aus Heparin-Vollblut Durch dieses Verfahren werden PBMC aus Heparin-Vollblut für die weiteren Untersuchungen gewonnen. Das entnommene Vollblut (160 ml), das mit 800 µl Liquemin® N 5000 (Wirkstoff: Heparin-Natrium, Hersteller: Roche) als Antikoagulans gemischt wurde, wurde zu gleichen Teilen à 20 ml auf acht 50-ml-Röhrchen (Falcon®, Becton Dickinson Labware, New Jersey) verteilt, in die jeweils 10 ml DPBS ungekühlt vorgelegt worden waren. Dieses Gemisch wurde mit 13 ml Lymphoprep™ (Nycomed Pharma AS, Oslo, Norwegen) unterschichtet und anschließend mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (1.500 rpm / 25 min / 22°C). Die PBMC, die sich nach der Zentrifugation zwischen der Serum- und der Lymphoprep™-Schicht befinden, wurden abpipettiert, wobei auch Serum und Lymphoprep™ teilweise überführt wurde. Die gewonnenen PBMC wurden auf vier neue 50-ml-Röhrchen verteilt, in die jeweils 10 ml DPBS/EDTA-Lösung vorgelegt worden war. Nach dem Befüllen der vier Röhrchen mit den isolierten PBMC wurden sie mit DPBS/EDTA-Lösung jeweils auf 50 ml Gesamtinhalt aufgefüllt. Die geschwenkten Röhrchen wurden mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (1.100 rpm / 10 min / 4°C). Anschließend wurden die Überstände abgesaugt und verworfen. Die vier vorhandenen Pellets wurden in insgesamt 50 ml DPBS/EDTA-Lösung resuspendiert und in einem Röhrchen vereint. Die Zahl der PBMC wurde anschließend bestimmt, indem 40 µl Zellsuspension mit 40 µl Türkscher Lösung (Fluka Chemie GmbH, Buchs, Schweiz, No. 93770) gemischt wurde. Dieses Gemisch wurde in eine mit einem Deckglas (Deckgläser geschliffen 20 x 26 mm, Carl Roth GmbH & Co., Karlsruhe, Deutschland) bestückte Neubauer-Zählkammer (Zählkammer Neubauer-improved, Tiefe 0,100 mm, Fläche 0,0025 mm2, Art.-Nr. 340-8100104, Hirschmann Laborgeräte, Deutschland) gegeben, die unter dem Mikroskop (Axiostar, Zeiss, Jena, Deutschland) ausgezählt wurde. Von der Zellsuspension wurden daraufhin 500.000 Zellen für die FACS-Färbung entnommen und in ein 15-ml-Röhrchen (Falcon®, Becton Dickinson Labware, New Jersey) gegeben. Sowohl das Röhrchen für die FACS-Färbung als auch 29 das mit den restlichen PBMC wurden nun mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (1.000 rpm / 10 min / 4°C) [vgl. Dieckmann et al. 2001]. 4.9. PBMC-FACS Hierdurch kann der Anteil der CD4+CD25- T-Zellen an den gesamten PBMC bestimmt werden. Der Überstand des 15-ml-Röhrchens wurde abgesaugt und verworfen. Die Zellen wurden in 300 µl FACS-Puffer resuspendiert und zu gleichen Teilen auf drei durchnummerierte FACS-Röhrchen (Greiner Labortechnik GmbH, Frickenhausen, Deutschland) verteilt. Zu den Röhrchen wurden nach folgendem Pipettierschema Farbstoff-Antikörper (PharMingen, Becton Dickinson Company) gegeben: Röhrchen 1 2 3 FITC PE Cy-Chrome™ 2 µl 2 µl 2 µl FITC Mouse IgG1, PE Mouse IgG1, Cy-Chrome™ Mouse IgG1, Cat.No.: 555748 Cat.No.: 555749 Cat.No.: 555750 2 µl 2 µl 2 µl FITC anti-human CD4, PE anti-human CD25, Cy-Chrome™anti-human CD3, Cat.No.: 555346 Cat.No.: 555432 Cat.No.: 555334 2 µl - 2 µl FITC anti-human CD4, Cy-Chrome™anti-human CD3, Cat.No.: 555346 Cat.No.: 555334 Anschließend wurden die Röhrchen gevortext (Heidolph) und für 30 min bei 4°C inkubiert. Anschließend wurde in jedes Röhrchen 250 µl FACS-Puffer gegeben. Daraufhin wurde in der Tischzentrifuge Universal 2S (Hettich, Tuttlingen, Deutschland) mit „Ausschwingrotor, 2fach“ (Best.-Nr. 1460) zentrifugiert (1.500 rpm / 3 min / Raumtemperatur). Der Überstand wurde jeweils abgesaugt. Es wurden jeweils 100 µl FACS-Puffer zugegeben. Nach erneutem Vortexen wurden noch 100 µl 2%-Formaldehyd-Lösung in die Röhrchen gegeben und diese mit Parafilm verschlossen. Bis zur Einmessung am flow cytomter BD FACScan™ mit CellQuest™ Software wurden die Zellen bei 4°C aufbewahrt (für maximal 5 Tage) [vgl. Dieckmann et al. 2001]. 30 4.10. CD4-Negativ-Selektions-MACS® Durch dieses Verfahren werden die gewonnen PBMC in CD4+ und CD4T-Zellen aufgetrennt. Der Überstand des zentrifugierten 50-ml-Röhrchens, in dem sich die PBMC befinden, die nicht für die FACS-Färbung verwendet worden waren, wurde verworfen. Die Zellen wurden entsprechend ihrer Zahl in MACS®-Puffer aufgenommen, wobei 8 µl MACS®-Puffer pro 106 Zellen verwendet wurde. Anschließend wurde pro 106 Zellen 1 µl Hapten-Antibody Cocktail (CD4+ T Cell Isolation Kit, Miltenyi Biotec, Bergisch Gladbach, Germany), der anti-CD8-, anti-CD11b-, anti-CD16-, anti-CD19-, anti-CD36- und anti-CD56-Antikörper enthält, zugefügt und 15 min lang bei 4°C inkubiert. Daraufhin wurde mindestens die 10fache Menge an MACS®-Puffer zugegeben und die Zellsuspension mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (1.000 rpm / 5 min / 4°C). Der Überstand wurde verworfen und 8 µl MACS®-Puffer pro 106 Zellen zugegeben. Anschließend wurden pro 106 Zellen 1 µl Anti-Hapten MicroBeads (CD4+ T Cell Isolation Kit, Miltenyi Biotec, Bergisch Gladbach, Germany) zugefügt und für 20 min bei 4°C inkubiert. Nun wurde mindestens die 10fache Menge an MACS®-Puffer zugegeben und die Zellsuspension mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (1.000 rpm / 5 min / 4°C). Der Überstand wurde verworfen. Den Zellen wurde 5 µl MACS®-Puffer pro 106 Zellen zugefügt. Mit Hilfe der MACS® LS Separation Columns (Miltenyi Biotec, Bergisch Gladbach, Germany) wurden die mit den oben genannten anti-CD8-, anti-CD11b-, anti-CD16-, anti-CD19-, antiCD36- und anti-CD56-Antikörpern markierten CD4- Zellen von den unmarkierten CD4+ Zellen getrennt. Hierfür wurde die Säule in den Magneten des Systems gesteckt. Sie wurde des Weiteren zunächst mit 3 ml MACS®-Puffer gespült. Nun wurde ein 15-ml-Röhrchen (beschriftet mit: CD4+ [= Ansatz 1]; Erklärung: zunächst passiert tatsächlich die CD4+ Fraktion die Säule, da es sich ja in diesem Falle um eine negative Selektion handelt) unter die Säule gegeben. Die in MACS®-Puffer gelösten Zellen wurden nun auf die Säule gegeben. Daraufhin wurde zweimal mit jeweils 3 ml MACS®-Puffer nachgespült. Dann wurde die Säule aus dem Magneten genommen, auf ein weiteres 15-ml-Röhrchen (be- 31 schriftet mit: CD4- [= Ansatz 2]) gesetzt, mit 5 ml MACS®-Puffer versehen und mit dem Stempel der Säule in das Röhrchen entleert. Die Zahl der CD4+ bzw. der CD4- Zellen wurde anschließend unter Verwendung von Türkscher Lösung bestimmt (s.o.). Von den CD4+ Zellen wurden 2,3·106 Zellen entnommen und in ein weiteres 15-ml-Röhrchen (beschriftet mit: 2,3 Mio. CD4+ Zellen [= Ansatz 3]) gegeben. Daraufhin wurden alle drei Röhrchen (Ansatz 1, 2, 3) mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (1.000 rpm / 5 min / 4°C). Nachdem der Überstand verworfen worden war, wurden die 2,3·106 CD4+ Zellen (= Ansatz 3) in 2,3 ml X-Medium aufgenommen und bei 4°C bis zu ihrer weiteren Verwendung aufbewahrt [vgl. Dieckmann et al. 2001]. 4.11. CD25-Positiv-Selektions-MACS® Durch dieses Verfahren werden die CD4+ T-Zellen in CD4+CD25- und CD4+CD25+ T-Zellen aufgetrennt. Nachdem ihr Überstand abgesaugt und verworfen worden war, wurden die restlichen CD4+ Zellen (= Ansatz 1) wieder in 8 µl MACS®-Puffer pro 106 Zellen aufgenommen. Pro 106 Zellen wurden 2 µl MACS® Reagents CD25 MicroBeads (Miltenyi Biotec, Bergisch Gladbach, Germany) zugegeben. Es wurde für 15 min bei 4°C inkubiert. Daraufhin wurde mindestens die 10fache Menge an MACS®-Puffer zugegeben. Die Zellen wurden mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (1.000 rpm / 5 min / 4°C). Der Überstand wurde verworfen. Den Zellen wurde 5 µl MACS®-Puffer pro 106 Zellen zugefügt. Mit Hilfe der MACS® LS Separation Columns (Miltenyi Biotec, Bergisch Gladbach, Germany) wurden die markierten CD4+CD25+ Zellen von den unmarkierten CD4+CD25- Zellen getrennt. Hierfür wurde die Säule in den Magneten des Systems gesteckt. Sie wurde des Weiteren zunächst mit 3 ml MACS®-Puffer gespült. Nun wurde ein 15-ml-Röhrchen (beschriftet mit: CD25- [= Ansatz 4]) unter die Säule gegeben. Die in MACS®-Puffer gelösten Zellen wurden nun auf die Säule gegeben. Daraufhin wurde zweimal mit jeweils 3 ml MACS®-Puffer nachgespült. Dann wurde die Säule aus dem Magneten genommen, auf ein weiteres 15-ml-Röhrchen (beschriftet mit: CD25+ [= Ansatz 5]) gesetzt, mit 5 ml MACS®-Puffer versehen und mit dem Stempel der Säule in das Röhrchen entleert. Die Zahl der CD4+CD25+ bzw. der 32 CD4+CD25- Zellen wurde anschließend unter Verwendung von Türkscher Lösung bestimmt (s.o.). Daraufhin wurden beide Röhrchen (Ansatz 4, 5) mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (1.000 rpm / 5 min / 4°C). Nachdem ihr Überstand abgesaugt und verworfen worden war, wurden die Zellen in X-Medium aufgenommen und bei 4°C aufbewahrt [vgl. Dieckmann et al. 2001]. 4.12. CD4+CD25+/- FACS Dieses Verfahren dient der Qualitätskontrolle und Reinheit der gewonnenen CD4+CD25- und CD4+CD25+ T-Zellen. Je 100.000 der CD25- Zellen wurden in 2 FACS-Röhrchen (Nr. 4 und 5) gegeben, ebenso wurden je 100.000 der CD25+ Zellen in 2 weitere FACS-Röhrchen (Nr. 6 und 7) gegeben. Da sie sich im Medium befanden, wurden die Zellen in der Tischzentrifuge Universal 2S (Hettich, Tuttlingen, Deutschland) mit „Ausschwingrotor, 2fach“ (Best.-Nr. 1460) zentrifugiert (1.500 rpm / 3 min / Raumtemperatur). Nachdem der Überstand verworfen worden war, wurde je 100 µl FACS-Puffer in jedes der Röhrchen gegeben. Zu den Röhrchen wurden nach folgendem Pipettierschema Farbstoff-Antikörper gegeben: Röhrchen 4 5 6 7 FITC PE Cy-Chrome™ 2 µl 2 µl 2 µl FITC Mouse IgG1, PE Mouse IgG1, Cy-Chrome™ Mouse IgG1, Cat.No.: 555748 Cat.No.: 555749 Cat.No.: 555750 2 µl 2 µl 2 µl FITC anti-human CD4, PE anti-human CD25, Cy-Chrome™anti-human CD3, Cat.No.: 555346 Cat.No.: 555432 Cat.No.: 555334 2 µl 2 µl 2 µl FITC Mouse IgG1, PE Mouse IgG1, Cy-Chrome™ Mouse IgG1, Cat.No.: 555748 Cat.No.: 555749 Cat.No.: 555750 2 µl 2 µl 2 µl FITC anti-human CD4, PE anti-human CD25, Cy-Chrome™anti-human CD3, Cat.No.: 555346 Cat.No.: 555432 Cat.No.: 555334 Anschließend wurden die Röhrchen gevortext, und für 30 min bei 4°C inkubiert. Daraufhin wurde in jedes Röhrchen 250 µl FACS-Puffer gegeben. Die Röhrchen wurden in der Tischzentrifuge Universal 2S (Hettich, Tuttlingen, Deutsch- 33 land) mit „Ausschwingrotor, 2fach“ (Best.-Nr. 1460) zentrifugiert (1.500 rpm / 3 min / Raumtemperatur). Nachdem der Überstand verworfen worden war, wurde in jedes Röhrchen 100 µl FACS-Puffer gegeben. Nach erneutem Vortexen wurden noch 100 µl 2%-Formaldehyd-Lösung in die Röhrchen gegeben und diese mit Parafilm verschlossen. Bis zur Einmessung am flow cytometer BD FACScan™ mit CellQuest™ Software wurden die Zellen bei 4°C aufbewahrt (maximal für 5 Tage) [vgl. Dieckmann et al. 2001]. 4.13. Züchtung dendritischer Zellen Um den verschiedenen T-Zell-Subpopulationen Antigene der Birkenpollen später in der Zellkultur präsentieren zu können, müssen aus der Fraktion der CD4T-Zellen zunächst autologe dendritische Zellen gezüchtet, gereift und teilweise mit den Proteinen beladen werden. Der Überstand der zentrifugierten CD4- Zellen (= Ansatz 2) wurde verworfen. Die Zellen (Monozyten, Granulozyten, B-Zellen, CD4- T-Zellen) wurden in 10 ml AB-Medium resuspendiert. Die Suspension wurde auf eine Primaria®Kulturplatte (Falcon® 3803, Becton Dickinson Labware, New Jersey) gegeben und für 1 h bei 37°C im Brutschrank (5% CO2-Anteil) inkubiert. In dieser Zeit kam es zur Plastik-Adhäsion der B-Zellen und Monozyten an die Platte, wobei sich aus den Monozyten im weiteren Verlauf die reifen dendritischen Zellen entwickeln. Anschließend wurde die nichtadhärente Fraktion (Granulozyten, CD4- T-Zellen) abgesaugt und verworfen und die Platte mehrfach mit „RPMI 1640 without Glutamine“ gewaschen. Das RPMI wurde abgesaugt und nun wieder 10 ml AB-Medium auf die Platte gegeben. Nun wurde die Platte bei 37°C und 5% CO2-Anteil inkubiert (Tag 0). An den Tagen 0, 2 und 4 wurde den Zellen pro ml Medium 26 µg GM-CSF (= Leukine®, Berlex Laboratories Inc., Richmond, CA 94804, USA) und 625 U IL-4 (Art.-Nr. 1003, Cell Genix, Technologie Transfer GmbH, Freiburg, Deutschland) zugegeben. Bei der 2. Gabe wurde zuvor 5 ml Medium zugegeben. An Tag 6 wurden die dendritischen Zellen gereift, die sich im Verlauf der 6 Tage wieder von der Kulturplatte gelöst hatten und zu diesem Zeitpunkt frei im Medium schwammen. Hierfür wurde das Medium der Platte in ein 15-ml-Röhrchen überführt (die zu Beginn noch enthaltenen B-Zellen sind zwischenzeitlich in Apoptose gegangen). Nun wurde mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwing- 34 rotor (Best.-Nr. 75006445) zentrifugiert (1.000 rpm / 9 min / 4°C). Der Überstand wurde bis auf 6 ml abgesaugt und der überschüssige Überstand verworfen. Es wurde resuspendiert und je 3 ml auf 2 wells einer 6-wellFlachbodenplatte (35-3046 Multiwell™ 6 well, Becton Dickinson Labware, New Jersey) gegeben. In jedes well wurde ein Reifungscocktail gegeben, so dass folgende Konzentrationen erreicht wurden: 400 U/ml IL-1β (Art.-Nr. 1011, Cell Genix, Technologie Transfer GmbH, Freiburg, Deutschland), 1.000 U/ml IL-6 (Art.-Nr. 1004, Cell Genix, Technologie Transfer GmbH, Freiburg, Deutschland), 10 ng/ml TNF α-1a (= Beromun®, Wirkstoff: Tasonermin, Boehringer-Ingelheim International GmbH, Ingelheim am Rhein, Deutschland) und 1 µg/ml PGE2 (= Minoprostin® E2 5000 µg, Wirkstoff: Dinoproston, Pharmacia N.V./S.A., Puurs, Belgien). Außerdem wurde den Zellen wieder pro ml Medium 26 µg GM-CSF und 625 U IL-4 zugegeben. In eines der beiden wells wurde dann noch 150 µg rBet v 1 der Isoform a (BIOMAY Produktions- und Handelsges. m. b. H., Wien, Österreich) gegeben. Die Platte wurde wieder bei 37°C inkubiert. An Tag 7 wurde der Inhalt der beiden wells jeweils in ein 15-ml-Röhrchen gegeben. Je 40 µl der beiden Suspensionen wurden entnommen, um mit 10 µl 0,4%-Trypanblau-Lösung (Sigma Chemical Co., St. Louis, USA) gefärbt zu werden. Mit der Neubauer-Zählkammer wurde unter dem Mikroskop die Zellzahl bestimmt. Die Röhrchen wurden mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (900 rpm / 8 min / 4°C). Entsprechend der errechneten Zahl wurden die Zellen in so vielen Portionen eingefroren, dass eine Portion zumindest 500.000 Zellen enthielt. Die weitere Beschreibung schildert den Vorgang, bei dem die Zellen in jeweils nur einer Portion eingefroren wurden: In zwei entsprechend beschriftete Einfrier-Röhrchen (Cellstar®Cryo.s, Greiner Labortechnik GmbH, Frickenhausen, Deutschland) wurde jeweils 500 µl Einfriermedium vorgelegt. Der Überstand der beiden 15-ml-Röhrchen wurde verworfen und in die Röhrchen wurden je 500 µl HSA gegeben, worin die dendritischen Zellen resuspendiert wurden. Die Suspension wurde nun jeweils in ein Einfrier-Röhrchen überführt, das geschwenkt und in einem Cryo-Container (Nalgene®Cryo 1°C Freezing Container, Cat. No. 5100-0001, Nalge Nunc International, Hereford, U.K.) auf -80°C tiefgefroren wurde. So wurden die Zellen 35 bis zu ihrer Verwendung bei einer späteren Untersuchung desselben Patienten aufbewahrt. Um die Zellen später aufzutauen, wurde pro Einfrier-Röhrchen je 5 ml 4°C kaltes DPBS in je einem 15-ml-Röhrchen vorgelegt. Die Einfrier-Röhrchen wurden angewärmt. Sobald sich die gefrorene Suspension von der Wand des EinfrierRöhrchens gelöst hatte, wurde der teilweise noch gefrorene Inhalt in das 15-mlRöhrchen gegeben. Das Einfrier-Röhrchen wurde mit DPBS nachgespült. Sobald der Inhalt nun gänzlich getaut war, wurden 40 µl der geschwenkten Suspension abgenommen, um mit 10 µl 0,4%-Trypanblau-Lösung gefärbt zu werden. Mit der Neubauer-Zählkammer wurde unter dem Mikroskop die Zellzahl bestimmt. Es wurde mit der Multifuge® 3 S-R (Heraeus, Kendro Laboratory Products GmbH, Hanau, Deutschland) mit installiertem Ausschwingrotor (Best.-Nr. 75006445) zentrifugiert (900 rpm / 8 min / 4°C), der Überstand verworfen und die Zellen in X-Medium aufgenommen [vgl. Dieckmann et al. 2001]. 4.14. Proliferations-Assay (Ansetzen und Überstandabnahme) Die Zellkulturen werden angesetzt und auf unterschiedliche Arten ihre Proliferation stimuliert; Überstände werden zur Untersuchung des Zytokin-Profils abgenommen. Zur Allergen-unspezifischen Stimulation wurden in 24 wells einer 96-wellFlachbodenplatte (Microtest™96, 35-3072, Falcon®, Becton Dickinson Labware, New Jersey) jeweils 49,5 µl DPBS und 0,5 µl Anti-CD3-Antikörperlösung (CD3, purified mouse anti-human monoclonal antibody, Katalog-Nummer 555329, BD PharMingen, San Diego) gegeben. Die Flachbodenplatte wurde mit Parafilm abgedichtet und inkubierte mindestens 4 h bei 4°C. Daraufhin wurde der Inhalt der wells abgesaugt und die wells dreimal mit DPBS gewaschen. Anschließend wurden 6 wells mit je 105 CD4+CD25- Zellen beladen, weitere 6 wells mit je 105 CD4+CD25+ Zellen. In die nächsten 6 wells wurden je 105 CD4+CD25- Zellen und zusätzlich je 105 CD4+CD25+ Zellen gegeben. In die letzten 6 wells wurden je 105 Zellen des CD4+ bulk gegeben (mit dem CD4+ bulk sind die Zellen gemeint, die nicht noch weiter in CD4+CD25+ und CD4+CD25- Zellen aufgetrennt wurden; hier liegt also noch die natürliche Mischung zwischen den CD4+CD25+ und den CD4+CD25- T-Zellen vor). Alle wells wurden mit X-Medium auf 200 µl aufgefüllt. Anschließend wurden pro well 2 µl Anti-CD28-Antikörper-Lösung (CD28, purified mouse anti-human monoclonal 36 antibody, Katalog-Nummer 555725, BD PharMingen, San Diego) zugegeben. Die Platte wurde nun bei 37°C im Brutschrank (5% CO2-Anteil) inkubiert. Bei den Patienten 1-4 (vgl. Kapitel 4.1): Nach 24 h und nochmals nach 72 h wurde jeder der vier 6-well-Einheiten jeweils 400 µl Überstand entnommen und bei -20°C bis zur ELISA-Auswertung eingefroren. Mit Ausnahme der CD4+ bulk-Einheit wurden nach der 72h-Überstand-Abnahme jeweils 3 wells einer 6-well-Einheit für die Proliferations- und Regulationsbestimmung mit 3H-Thymidin wieder mit X-Medium auf 200 µl aufgefüllt und weiterhin bei 37°C inkubiert. Basierend auf den gewonnenen Erkenntnissen wurden die Untersuchungen folgendermaßen erweitert/modifiziert: Bei den Patienten 5-13 (vgl. Kapitel 4.1): Nach 48 h wurden aus jeweils 3 wells jeder der vier 6-well-Einheiten mindestens 300 µl Überstand entnommen und bei -20°C bis zu den ELISAAuswertungen eingefroren (in 4 Portionen zu zweimal mindestens 50 µl und zweimal mindestens 100 µl). Die Platte wurde weiterhin bei 37°C inkubiert. Die anderen 3 wells jeder 6-well-Einheit blieben bislang unangetastet. Der folgende Teil dieses Abschnitts 4.14 entfiel jeweils bei der 1. Blutentnahme eines jeden Patienten, da zu diesem Termin noch keine gezüchteten dendritischen Zellen von einer vorangehenden Blutentnahme zur Verfügung standen: Zur Allergen-spezifischen Stimulation mittels rBet v 1-beladener reifer autologer dendritischer Zellen ab der 2. Blutentnahme wurden in 3 wells einer 96-wellRundbodenplatte (Microtest™ U-Bottom, 35-3077, Falcon®, Becton Dickinson Labware, New Jersey) je 105 Zellen des CD4+ bulk gegeben. In 3 weitere wells wurden je 105 CD4+CD25- Zellen gegeben und in 3 weitere wells je 105 CD4+CD25+ Zellen. In 3 weitere wells wurden je 5.000 reife dendritische Zellen (mDC) gegeben, die im Rahmen einer der vorhergehenden Blutentnahmen desselben Patienten ohne Zusatz von rBet v 1 gezüchtet und eingefroren worden waren und für das jetzige Experiment, wie in Kapitel 4.13 beschrieben, aufgetaut worden waren. In die nächsten 3 wells wurden ebenfalls je 5.000 mDC gegeben, die entsprechend, allerdings unter Zugabe von rBet v 1, gezüchtet worden waren (mDC+rBet v 1). In 6 weitere wells wurden jeweils 105 Zellen des CD4+ bulk und zusätzlich jeweils 5.000 mDC gegeben. In wiederum 6 weitere wells wurden 37 jeweils 105 Zellen des CD4+ bulk und zusätzlich jeweils 5.000 mDC+rBet v 1 gegeben. In 6 weitere wells wurden jeweils 105 CD4+CD25- Zellen und zusätzlich jeweils 5.000 mDC gegeben. In wiederum 6 weitere wells wurden jeweils 105 CD4+CD25- Zellen und zusätzlich jeweils 5.000 mDC+rBet v 1 gegeben. In 6 weitere wells wurden jeweils 105 CD4+CD25+ Zellen und zusätzlich jeweils 5.000 mDC gegeben. In wiederum 6 weitere wells wurden jeweils 105 CD4+CD25+ und zusätzlich jeweils 5.000 mDC+rBet v 1 gegeben. Alle 51 wells wurden nun mit X-Medium auf jeweils 200 µl aufgefüllt. Die Platte wurde nun bei 37°C im Brutschrank (5% CO2-Anteil) inkubiert. Bei den Patienten 1-4: Nach 24 h und nochmals nach 72 h wurde aus jeder der sechs 6-well-Einheiten jeweils 400 µl Überstand entnommen und bis zu den ELISA-Auswertungen bei -20°C eingefroren. Jeweils 3 wells einer 6-well-Einheit wurden nach der 72hÜberstand-Abnahme für die Proliferationsbestimmung mit 3H-Thymidin wieder mit X-Medium auf 200 µl aufgefüllt und weiter bei 37°C inkubiert. Die drei 3well-Einheiten blieben bislang unangetastet. Bei den Patienten 5-13: Nach 72 h wurden aus jeweils 3 wells jeder der sechs 6-well-Einheit mindestens 300 µl Überstand entnommen und bei -20°C bis zu den ELISA-Auswertungen eingefroren (in 4 Portionen zu zweimal mindestens 50 µl und zweimal mindestens 100 µl). Die Platte wurde weiter bei 37°C inkubiert. Die anderen 3 wells jeder 6-well-Einheit und die drei 3-well-Einheiten blieben bislang unangetastet [vgl. Dieckmann et al. 2001]. 4.15. Auswertung der Proliferations-Assays mit 3H-Thymidin Die Proliferationsaktivität der verschiedenen Zellkulturansätze wird mit 3 H- Thymidin bestimmt. Etwa 5 Tage nach Ansetzen der 96-well-Rund- (Allergen-spezifische Stimulation) und auch der 96-well-Flachbodenplatte (Allergen-unspezifische Stimulation) wurde jedes well mit 50 µl der 3H-Thymidin-Lösung versehen; in dieser Pilotstudie zur Etablierung der Methodik wurden die Kulturplatten eingemessen, sobald sich mikroskopisch gräuliche „Proliferationsinseln“ in den Zellhaufen in den wells zeigten (vgl. hierzu auch die Kapitel „Ergebnisse“ (5.3) und „Diskussion“). Die Platten wurden nun für weitere 16 h im Brutschrank (5% CO2-Anteil) bei 38 37°C inkubiert. Der Inhalt jeder Platte wurde mit Hilfe des Cell Harvesters (Inotech) durch einen Glasfaserfilter (Printed Filtermat A, 90*120 mm, Nr. 1450-421, Wallac Oy) gesaugt, so dass nur die Zellen auf dem Filter hängenblieben. Die wells wurden dreimal mit Aqua dest. gespült, um die in den wells verbliebenen Zellen auch auf den Filter zu überführen und das radioaktive Medium aus dem Filter auszuwaschen. Der Filter wurde nun auf der Heizplatte Präzitherm (StorkTronic) bei 85°C getrocknet. Anschließend wurde ein Melt-on Scintillator Sheet (MeltiLex™ A, 73*109 mm, average weight 4 g, Nr. 1450-441, Wallac Oy) auf den Filter auf der Heizplatte gelegt. Sobald das Wachs auf dem Filter geschmolzen war, wurde der Filter wieder von der Heizplatte genommen, so dass das Wachs auf und in dem Filter wieder erkaltete und somit erstarrte. Der so präparierte Filter wurde am 1450 MicroBeta PLUS Liquid Scintillation Counter (Wallac Oy) mit Hilfe der MicroBeta Workstation Software Version 3.20 (Perkin Elmer Life Sciences, Wallac Oy) eingemessen [vgl. Dieckmann et al. 2001]. Die so gemessene Szintillation korreliert mit der Zellteilung (Proliferation). 4.16. Zytokin-ELISA der Überstände und der Serumproben Die aus den Zellkulturen gewonnenen Überstände werden auf ihr Zytokinmuster hin untersucht. Die Zytokin-Konzentration der eingefrorenen Überstände (siehe Kapitel 4.14) und Seren (siehe Kapitel 4.1) wurde mit Hilfe des BD Human Th1/Th2 Cytokine Cytometric Bead Array (CBA) Kit (Cat.No.: 550749, BD PharMingen, Becton Dickinson Company, San Diego, USA) bestimmt. Zur Bestimmung der Probenwerte war ein Standard nötig. Hierfür wurde ein Fläschchen „Human Th1/Th2 Cytokine Standards“ mit 0,2 ml des Assay Diluent aufgefüllt, so dass ein 10fach Standard entstand. Dieser musste 15 min lang inkubieren. Neun 15-mlRöhrchen wurden folgendermaßen beschriftet: 5000 pg/ml, 2500 pg/ml, 1250 pg/ml, 625 pg/ml, 312,5 pg/ml, 156 pg/ml, 80 pg/ml, 40 pg/ml, 20 pg/ml. In das 5000 pg/ml-Röhrchen wurden 900 µl Assay Diluent vorgelegt, in alle anderen Röhrchen 300 µl. 100 µl des 10fach Standards wurden in das 5000 pg/ml-Röhrchen gegeben, in das– wie schon bereits oben erwähnt - 900 µl Assay Diluent vorgelegt worden waren. Der Inhalt wurde nun gut vermischt. Aus dem 5000 pg/ml -Röhrchen wurden nun 300 µl in das 2500 pg/ml -Röhrchen überführt und gut mit dem Inhalt vermischt. Aus dem 2500 pg/ml -Röhrchen wurden nun 300 µl in das 39 1250 pg/ml -Röhrchen überführt usw. bis zum 20 pg/ml -Röhrchen. Pures Assay Diluent diente als Negativkontrolle. Die Zahl der für den Versuch notwendigen Probenröhrchen wurde bestimmt (1 Negativkontrolle + 9 Standardverdünnungen + Anzahl der Proben). Für jedes dieser Probenröhrchen wurden jeweils 10 µl aus jeweils jeder der 6 HumanCapture-Beads-Fläschchen (IL-2, IL-4, IL-5, IL-10, TNF-α, IFN-γ) entnommen, wobei die Fläschchen unmittelbar vor der Entnahme gut geschwenkt worden waren. Die entnommenen Mengen wurden in dem mit „Antikörper-Mix“ beschrifteten Röhrchen zusammengeführt und gut durchmischt. Es wurde entsprechend der errechneten Zahl an Probenröhrchen FACS-Röhrchen beschriftet und mit jeweils 50 µl des Antikörper-Mix versehen. Zu diesen Röhrchen wurden nun entsprechend 50 µl des Standards, der Negativkontrolle oder der eigentlichen Testproben (= Überstände oder Serum) gegeben. Anschließend wurden je 50 µl Human Th1/Th2 PE Detection Reagent in jedes Röhrchen gegeben. Die Röhrchen wurden gut durchmischt und 3 h bei Raumtemperatur inkubiert. Anschließend wurde 1 ml Wash Buffer zu jedem Röhrchen gegeben und zentrifugiert (200·g / 5 min / Raumtemperatur). Der Überstand wurde verworfen, und 300 µl Wash Buffer wurden jedem Röhrchen zugegeben, um das Pellet zu resuspendieren. Nun wurden die Proben am flow cytometer BD FACScan™ mit CellQuest™ Software eingemessen und ausgewertet. 4.17. TGF-β-ELISA Die aus den Zellkulturen gewonnenen Überstände werden auf ihre TGF-βKonzentration hin untersucht. Die TGF--Konzentration in den Überständen wurde mit Hilfe des Human TGF-1 ELISA Set (BD OptEIA™, Cat.No. 559119, Lot.No. 0000075872, BD Biosciences Pharmingen, San Diego, CA, USA) bestimmt. Hierzu wurde der im Kit enthaltene Capture Antibody (= Anti-human TGF-β1, Cat.No.: 51-26341E, Lot.No.: 0000059676, BD Biosciences Pharmingen, San Diego, CA, USA) 1:250 mit Coating Buffer verdünnt. Die Mikro-wells von 96-well-BD-Falcon™ELISA-Platten (Cat.No. 353279, BD Biosciences Pharmingen) wurden mit 100 µl pro well des verdünnten Capture Antibody gecoatet. Die Platten wurden mit Parafilm versiegelt und über Nacht bei 4°C inkubiert. Am nächsten Tag wurden die gecoateten wells entleert und dreimal mit mindestens 300 µl Wash Buffer pro well gewaschen. Nach dem letzten Waschvorgang 40 wurden die Platten umgedreht und auf absorbierendem Papier ausgeklopft, um auch die letzten Reste an Wash Buffer zu entfernen. Nun wurden die Platten mit mindestens 200 µl Assay Diluent (BD Pharmingen™, Cat.No. 555213, Lot.No. 0000056940, BD Biosciences Pharmingen, San Diego, CA, USA) pro well geblockt. Bei Raumtemperatur inkubierten die Platten nun für 1 h. Die Proben (= Überstände) mussten vor der Verwendung aktiviert werden. Hierzu wurde 1-molare Salzsäure im Verhältnis 1:25 den Proben zugefügt (8 µl Säure auf 200 µl Probe), die anschließend für 60 min bei 4°C inkubierten. Das im Kit enthaltene Röhrchen mit lyophilisiertem Standard (= rekombinantes humanes TGF-β1, Cat.No. 51-26346E, Lot No. 0000075874, BD Biosciences Pharmingen, San Diego, CA, USA) wurde auf Raumtemperatur erwärmt, mit 1,0 ml entionisiertem Wasser versehen und vorsichtig in Lösung gebracht, um den so genannten Stockstandard (100 ng/ml) zu erhalten. Der Stockstandard musste für mindestens 15 min inkubieren, bevor die Verdünnungen angesetzt werden konnten beziehungsweise die überschüssige Menge eingefroren werden konnte. Die nicht benötigte Menge Stockstandard wurde sofort zu Portionen à 50 µl aliquotiert und in Polypropylen-Gefäßen eingefroren (-80°C). Bis zu seiner Verwendung innerhalb der nächsten 8 h wurden 50 µl Stockstandard bei 4°C aufbewahrt. Diesen 50 µl wurden nun 1200 µl Assay Diluent zugegeben, um eine Konzentration von 4000 pg/ml zu erreichen. Es wurden nun 6 weitere Röhrchen vorbereitet (beschriftet mit: 2000 pg/ml, 1000 pg/ml, 500 pg/ml, 250 pg/ml, 125 pg/ml, 62,5 pg/ml), in die jeweils 300 µl Assay Diluent vorgelegt wurde. Nun wurde eine Serienverdünnung durchgeführt, indem jeweils 300 µl Standard ins nachfolgende Röhrchen überführt wurden, wobei nach jeder Überführung der Röhrcheninhalt sorgfältig vermischt wurde. Pures Assay Diluent diente als Negativkontrolle (0 pg/ml). Nach der einstündigen Inkubation der Platten wurden die wells entleert und dreimal mit mindestens 300 µl Wash Buffer pro well gewaschen. Nach dem letzten Waschvorgang wurden die Platten umgedreht und auf absorbierendem Papier ausgeklopft, um auch die letzten Reste an Wash Buffer zu entfernen. Nach der einstündigen Inkubationszeit wurden die Proben mit 1-molarer Natronlauge im Verhältnis 1:25 (8 µl Lauge auf 200 µl Probe zu Anfang) wieder neutralisiert. Nun wurden jeweils 100 µl der Proben, des Standards oder der Negativkontrolle in die vorgesehenen wells pipettiert, wobei jeweils Doppelbestimmungen durch- 41 geführt wurden. Die Platten wurden mit Parafilm versiegelt und inkubierten bei Raumtemperatur für 2 h. In der Zwischenzeit wurde der im Kit enthaltene Detection Antibody (= Biotinylated anti-human TGF-β1, Cat.No. 51-26342E, Lot No. 0000059676, BD Biosciences Pharmingen, San Diego, CA, USA) im Verhältnis 1:250 mit Assay Diluent verdünnt (z.B. 48 µl Detection Antibody auf 12 ml Assay Diluent). Maximal 15 min vor der Verwendung wurde nun zusätzlich Enzyme Reagent (= Avidin-horseradish peroxidase conjugate, Cat.No. 51-26437E-21, Lot No. 0000075874, BD Biosciences Pharmingen, San Diego, CA, USA) auch im Verhältnis 1:250 zugegeben (z.B. 48 µl Enzyme Reagent auf 12 ml verdünnten Detection Antibody). Diese Working-Detector-Lösung wurde sorgfältig gemischt. Nach der zweistündigen Inkubationszeit wurden die wells entleert und fünfmal mit mindestens 300 µl Wash Buffer pro well gewaschen. Nach dem letzten Waschvorgang wurden die Platten umgedreht und auf absorbierendem Papier ausgeklopft, um auch die letzten Reste an Wash Buffer zu entfernen. Es wurden nun 100 µl Working-Detector-Lösung in jedes well gegeben. Die Platten wurden mit Parafilm versiegelt und inkubierten eine Stunde lang bei Raumtemperatur. Substrate Solution wurde maximal 15 min vor ihrer Verwendung hergestellt, indem Substrate Reagent A und Substrate Reagent B des TMB Substrate Reagent Set (Cat.No. 555214, BD Biosciences Pharmingen, San Diego, CA, USA) im Verhältnis 1:1 gemischt wurden. Nach der einstündigen Inkubationszeit wurden die wells entleert und siebenmal mit mindestens 300 µl Wash Buffer pro well gewaschen, wobei die wells bei jedem Waschvorgang 30-60 s lang mit Wash Buffer gefüllt blieben, ehe sie geleert wurden. Nun wurden 100 µl Substrate Solution in jedes well gegeben. Die Platten inkubierten nun ohne Versiegelung für 30 min im Dunkeln bei Raumtemperatur. Anschließend wurden 50 µl Stop Solution in jedes well gegeben. Innerhalb der nächsten 30 min wurden die Platten photometrisch (Wellenlänge: 450 nm) eingemessen (Photometer: Labsystems Multiskan® Plus, Labsystems, Frankfurt am Main, Deutschland) und mit Hilfe einer Software von elias Medizintechnik (Freiburg) ausgewertet, wobei eine so genannte Spline Approximation zur Anwendung kam. 42 4.18. Bestimmung von Allergen-spezifischen IgE-, IgG- und IgG4-Werten gegen Birkenpollenallergene (Gesamtextrakt) und rekombinante Birkenpollenallergene (rBet v 1, rBet v 2, rBet v 4) im Serum im Verlauf der SIT Durch diese Bestimmungen werden die Änderungen im Antikörperprofil im Patientenserum im Verlauf der SIT bestimmt. Die Bestimmung der Allergen-spezifischen IgE- und IgG-Werte (gegen Birkenpollengesamtextrakt, aber auch spezifisch gegen die rekombinanten Birkenpollenallergene rBet v 1, rBet v 2, rBet v 4) im Serum erfolgten im Routine-Labor der Hautklinik Universitätsklinikum Erlangen mittels UniCAP® Specific IgE Fluoroenzymeimmunoassay (52-5200-99/04, Pharmacia Diagnostics AB, Uppsala, Schweden) bzw. UniCAP® Specific IgG Fluoroenzymeimmunoassay (52-520299/02, Pharmacia Diagnostics AB, Uppsala, Schweden). Anhand der ermittelten IgE-Werte wurden die entsprechenden CAP-Klassen bestimmt, wobei folgende Referenzbereiche gelten: Klasse 0: < 0,35 kU/L Klasse 1: 0,35-0,70 kU/L Klasse 2: 0,71-3,50 kU/L Klasse 3: 3,51-17,50 kU/L Klasse 4: 17,51-50,00 kU/L Klasse 5: 50,01-100,00 kU/L Klasse 6: > 100,00 kU/L Zur Bestimmung der Allergen-spezifischen IgG4-Werte (gegen Birkenpollengesamtextrakt und rekombinante Birkenpollenallergene rBet v 1, rBet v 2, rBet v 4) im Serum wurden Serum-Proben an Pharmacia (Diagnostic Labor, Freiburg) übersandt. 43 5. Ergebnisse 5.1. Charakterisierung der Patienten Nr. Beruf Alter CAP-FEIA CAP- (Birke) Klasse Nachweis einer Sensibilisierung (IgEImmunoblot) auf ... 1 Studentin 24 0,72 kU/l 2 Bet v 1 2 Ingenieur 35 6,78 kU/l 3 Bet v 1 59 23,0 kU/l 4 Bet v 1 25 >100 kU/l 6 3 4 Industriemeister Werkzeugmechaniker Symptome Bet v 1, Bet v 3, Bet v 5, Bet v 8 R, C, A, OAS R, C, N R, C, A, OAS R, C, N 5 Angestellte 46 52,2 kU/l 5 Bet v 1 A, OAS 6 Lehrerin 60 3,63 kU/l 3 Bet v 1 R, C 7 Student 27 0,72 kU/l 2 Bet v 1 8 Schüler 19 >100 kU/l 6 9 Studentin 26 30,7 kU/l 4 Bet v 1, Bet v 2, Bet v 4 10 Studentin 20 23,1 kU/l 4 Bet v 1 38 34,4 kU/l 4 Bet v 1, Bet v 3, Bet v 5 45 >100 kU/l 6 Bet v 1, Bet v 2, Bet v 4 27 25,8 kU/l 4 Bet v 1, Bet v 2 11 12 13 Elektroingenieur DiplomIngenieur Ärztin R, C, A, OAS Bet v 1, Bet v 2, Bet v 4, R, C, OAS, Bet v 5, Bet v 8 A R, C, A, OAS R, C, N, A, OAS R, C, OAS R, C, A, OAS R, C, OAS Tabelle 2: Charakterisierung der Patienten (R = Rhinitis, C = Conjunctivitis, A = Asthma, OAS = Orales Allergie Syndrom, N = Neurodermitis). Bet v 1: 17 kDa, Bet v2: 14-15 kDa, Bet v 3: 21-24 kDa, Bet v 4: 8-9 kDa, Bet v 5: 33-34 KDa, Bet v 6: 35 kDa, Bet v 7: 18 kDa, Bet v 8: 65 kDa [Mahler et al. 2001]. 44 Die Patienten waren zum Zeitpunkt der Studieninkludierung zwischen 19 und 60 Jahre alt und wurden in verschiedenen Saisons rekrutiert. Aufgrund ihrer spezifischen IgE-Werte gegen Birkengesamtextrakt lagen die CAP-Klassen 2-6 vor. Die klinischen Symptome (Rhinitis, Konjunktivitis, Asthma, orales Allergiesyndrome, Neurodermitis) korrelierten nicht mit den IgE-Werten (Tabelle 2). Die Charakterisierung des Sensibilisierungsprofils erfolgte mit IgE-ImmunoblotUntersuchungen der Patientenseren (Abbildung 2). Abbildung 2: Sensibilisierungsprofil der 13 in die Studie inkludierten Patienten sowie einer ausgeschlossenen Patientin im IgE-Immunoblot (Birke) Die Auswertung der IgE-Immunoblots (Abbildung 2) zeigt, dass n = 7 Patienten (1, 2, 3, 5, 6, 7, 10) ausschließlich gegen das Hauptallergen der Birke (Bet v 1) reagieren, das ein Molekulargewicht von 17 kDa hat. Die weiteren (n = 6) Patienten (4, 8, 9, 11, 12, 13) reagieren zusätzlich auf Minorallergene (z.B. auf Bet v 2 bei 14 kDa und Allergenen im hochmolekularen Bereich). Patienten, die ausschließlich auf Minorallergene reagieren, nicht aber auf das Hauptallergen, wurden nicht in die Studie aufgenommen (siehe z.B. „Ausgeschlossene Patientin“; Abbildung 2). 45 Nach Abschluss der Hyposensibilisierungsbehandlung wurden nochmals Serumproben im Vergleich zu Proben vor der Therapie im IgE-Immunoblot untersucht, um herauszufinden, ob es im Verlauf der Behandlung zu Neusensibilisierungen auf bislang nicht erkannte Minorallergene der Birke gekommen ist. Dies konnte bei keinem der Patienten beobachtet werden. Die beiden Proben („vor SIT“ und „nach SIT“) eines jeden der 13 Patienten sind paarweise nebeneinander in Abbildung 3 dargestellt (Patientin Nr. 1 zeigt bei einem spezifischen IgEWert von 0,72 kU/l im CAP-FEIA-Verfahren nur eine sehr schwache Reaktion im IgE-Immunoblot, so dass die in der Autoradiographie eindeutig zu erkennende IgE-Immunoblot-Reaktion für die Darstellung in Abbildung 3 mit Hilfe eines Bildbearbeitungsprogrammes deutlicher sichtbar gemacht werden konnte). Abbildung 3: Sensibilisierungsprofil der 13 in die Studie inkludierten Patienten im IgEImmunoblot (Birke) im Vergleich vor und nach der SIT. Es trat bei keinem der Patienten eine de novo Sensibilisierung auf Allergene auf (v = vor SIT, n = nach SIT) 46 5.2. Ergebnisse der PBMC-FACS-Auswertung Der prozentuale Anteil der CD4+CD25+ Zellen an den gesamten PBMC vor der Hyposensibilisierungsbehandlung variierte bei den einzelnen Patienten zwischen den Werten 2,91 % und 9,34 %. Dies steht mit den vorbeschriebenen natürlichen Schwankungen um den Durchschnittswert von etwa 6 % in Einklang. Dieser prozentuale Anteil wurde bei jedem Patienten bei jeder Blutentnahme bestimmt. Aus diesen Werten wurden nun Durchschnittswerte des Kollektivs zu den verschiedenen Blutentnahmezeitpunkten errechnet. Es zeigt sich im Verlauf der Behandlung ein ansteigender Verlauf, was den durchschnittlichen Anteil der CD4+CD25+ T-Zellen betrifft (Abbildungen 4 und 5). % Abbildung 4: Prozentualer Anteil der CD4+CD25+ T-Zellen an den PBMC (Mittelwerte aller Patienten (n=13)) im Verlauf der spezifischen Immuntherapie (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf. (= Erreichen der Allergenhöchstdosis); 5. BE: 4 Wo. nach 3. Impf.) 47 % Abbildung 5: Prozentualer Anteil der CD4+CD25+ T-Zellen an den PBMC (Mittelwerte aller Patienten (n=13)) zum Zeitpunkt vor der 1. Impfung (BE1) und 4 Wochen nach der 3. Impfung (BE5; die 3. Impfung entspricht dem Erreichen der Allergenhöchstdosis) 48 Teilt man die Patienten in zwei Gruppen auf, nämlich in Patienten, die ausschließlich auf das Hauptallergen der Birke Bet v 1 allergisch sind (n = 7), und in solche, die neben diesem Hauptallergen noch auf Minorallergene der Birke reagieren (n = 6), so zeigt sich folgendes: Der Anteil der CD4+CD25+ Zellen an den gesamten PBMC steigt bei den ausschließlich Bet v 1-allergischen Patienten an (Abbildungen 6 und 7). % Abbildung 6: Prozentualer Anteil der CD4+CD25+ T-Zellen an den PBMC (Mittelwerte der Patienten, die ausschließlich auf Bet v 1 allergisch sind (n=7)) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf. (= Erreichen der Allergenhöchstdosis); 5. BE: 4 Wo. nach 3. Impf.) 49 % Abbildung 7: Prozentualer Anteil der CD4+CD25+ T-Zellen an den PBMC (Mittelwerte der Patienten, die ausschließlich auf Bet v 1 allergisch sind (n=7)) zum Zeitpunkt vor der 1. Impfung (BE1) und 4 Wochen nach der 3. Impfung (BE5; die 3. Impfung entspricht dem Erreichen der Allergenhöchstdosis)) 50 Im Gegensatz dazu ist bei den Patienten, die zusätzlich auf Minorallergene reagieren, kein vergleichbarer Anstieg zu verzeichnen (Abbildungen 8 und 9), was auf eine gewisse Allergenspezifität schließen lässt. % Abbildung 8: Prozentualer Anteil der CD4+CD25+ T-Zellen an den PBMC (Mittelwerte der Patienten, die neben Bet v 1 zusätzlich auf Minorallergene der Birke allergisch sind (n=6)) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf. (= Erreichen der Allergenhöchstdosis); 5. BE: 4 Wo. nach 3. Impf.) 51 % Abbildung 9: Prozentualer Anteil der CD4+CD25+ T-Zellen an den PBMC (Mittelwerte der Patienten, die neben Bet v 1 zusätzlich auf Minorallergene der Birke allergisch sind (n=6)) zum Zeitpunkt vor der 1. Impfung (BE1) und 4 Wochen nach der 3. Impfung (BE5; die 3. Impfung entspricht dem Erreichen der Allergenhöchstdosis)) 52 5.3. Ergebnisse der Proliferations-Assays mit unspezifischer Stimulation (anti-CD3/CD28-Antikörper) Bei jeder Blutentnahme eines jeden Patienten wurde ein Proliferations-Assay mit unspezifischer Stimulation (anti-CD3/CD28-Antikörper) durchgeführt (demgegenüber steht die in Kapitel 5.4 beschriebene Allergen-spezifische Stimulation, bei der rBet v 1-beladene reife Dendritische Zellen (mDC) als Allergen-spezifische Stimulans zum Einsatz kommen, da hierbei die Präsentation von rBet v 1 durch die mDC auf die T-Zellen als Stimulus wirkt). Die Werte wurden wie oben beschrieben allesamt in Tripletts bestimmt, aus denen dann Durchschnittswerte gebildet wurden. Diese absoluten Durchschnittswerte wurden nach folgendem Prinzip weiter verrechnet: Vom Proliferationswert des gemischten Kulturansatzes m (100.000 CD4+CD25und 100.000 CD4+CD25+ Zellen in jedem well) wurde der Proliferationswert der CD4+CD25+ Zellen p (100.000 CD4+CD25+ Zellen in jedem well) abgezogen: m-p . Dies geschah aus dem Grunde, dass der (ohnehin geringe) Proliferationsanteil der CD4+CD25+ Zellen alleine aus dem gemischten Ansatz eliminiert werden sollte. Diese Differenz wurde nun ins Verhältnis zum Proliferationswert der CD4+CD25Zellen n (100.000 CD4+CD25- Zellen) gesetzt: (m-p):n (Abbildung 10). Dieser Wert – theoretisch zwischen 0 und 1 gelegen – gibt nun an, auf welchen relativen Anteil die Proliferation der CD4+CD25- Zellen durch die Zugabe von CD4+CD25+ Zellen in den Kulturansatz reduziert werden kann (Abbildung 10). Ein Wert von 1 bedeutet somit, dass die Proliferation der CD4+CD25- Zellen durch Zugabe der CD4+CD25+ Zellen nicht reduziert werden kann; ein Wert von nahezu 0 entspricht einer sehr starken Proliferationsinhibition der CD4+CD25Zellen durch die CD4+CD25+ Zellen. 53 Absolute Proliferation Bei der Darstellung der absoluten Proliferationsraten der CD4+CD25+ T-Zellen, der CD4+CD25- T-Zellen und des Ansatzes, in dem CD4+CD25+ T-Zellen und CD4+CD25- T-Zellen 1:1 gemischt wurden, zeigten sich in dieser Pilotphase unterschiedliche absolute Proliferationswerte im Verlauf der SIT. Die variierenden Werte sind darauf zurückzuführen, dass die Kulturplatten zu variierenden Zeitpunkten mit der Thymidin-Lösung inkubiert wurden, sobald sich mikroskopisch gräuliche „Proliferationsinseln“ in den Zellhaufen in den wells zeigten (vgl. Kapitel „Materialien und Methoden“ (4.15)). Dieses Vorgehen hatte sich somit in der hier vorliegenden Pilotstudie (u.a. zur Etablierung des Testsystems bzw. -regimes) nicht bewährt. In der Folgearbeit, in der regulatorische CD4+CD25+ T-Zellen unter SIT mit verschiedenen Allergen-Präparaten (Vakzine-Lösungen) untersucht werden, werden die Kulturplatten zu definierten Zeitpunkten eingemessen, worunter sich deutlich konstantere Proliferationsraten messen lassen. Die Proliferationswerte der verschiedenen Subsets zeigen zueinander jeweils robuste reproduzierbare Größenordnungen, weshalb eine Darstellung der Ergebnisse nach entsprechender Verrechnung der Werte (wie oben beschrieben) zur relativen Proliferation („ (m-p):n “) erfolgt (Abbildung 10). 54 Relative Proliferation Es zeigt sich im Untersuchungszeitraum eine relativ konstante Fähigkeit der CD4+CD25+ Zellen, die Proliferation der CD4+CD25- Zellen zu inhibieren; der Quotient ändert sich nicht wesentlich. Bei 1:1-Kokultur von 100.000 CD4+CD25Zellen und 100.000 CD4+CD25+ Zellen waren die CD4+CD25+ Zellen im Untersuchungszeitraum durchweg in der Lage, die Proliferationsrate der CD4+CD25Zellen auf etwa 50 % zu reduzieren (Abbildung 10). Dies heißt, dass in der vorliegenden Pilotuntersuchung im Untersuchungszeitraum keine Steigerung der Inhibitionsfähigkeit der einzelnen regulatorischen CD4+CD25+ Zelle eintritt (vgl. auch Diskussion), was sich in Abbildung 10 in einem Abfall der Werte im zeitlichen Verlauf zeigen würde. 55 y-Achse: Relative Proliferation (m-p):n Abbildung 10: Relative Proliferation (Inhibition der Proliferation von CD4+CD25- T-Zellen durch CD4+CD25+ T-Zellen nach unspezifischer Stimulation mit anti-CD3/CD28- 5 Antikörpern); Mittelwerte aller Patienten (n=9) Ein Abfall der Werte auf der y-Achse würde eine Zunahme der Inhibitionsfähigkeit der CD4+CD25+ T-Zellen anzeigen. (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 5 Diese Untersuchung wurde bei den Patienten 5-13 durchgeführt. 56 5.4. Ergebnisse der Proliferations-Assays mit spezifischer Stimulation (reife dendritische Zellen – unbeladen und mit rBet v 1 beladen) Bei den Werten, die in die folgenden Grafiken und weiteren Berechnungen eingehen, wurde vom errechneten Triplettdurchschnittswert (s.o.) eines gemischten Zellkulturansatzes aus T-Zellen und DCs die Triplettdurchschnittswerte der T-Zell- und der DC-Reinkulturen jeweils abgezogen, also „backgroundbereinigt“. Diese bereinigten Werte gehen in die graphische Auswertung ein. Vergleicht man die Proliferationsraten der verschiedenen Zellkulturansätze, so fällt auf, dass durchweg die CD4+CD25+ Zellen die geringste Proliferation zeigen, unabhängig davon, ob sie durch unbeladene oder durch mit rBet v 1 beladene dendritische Zellen stimuliert werden, was dafür spricht, dass es sich um regulatorische CD4+CD25+ T-Zellen handelt. Vergleicht man die einzelnen Zellpopulationen – also die CD4+ (Abbildungen 11-13), die CD4+CD25- (Abbildungen 14-16) und die CD4+CD25+ Zellen (Abbildung 17) – darin, wie stark sie in Abhängigkeit davon proliferieren, ob sie von unbeladenen oder von rBet v 1 präsentierenden reifen dendritischen Zellen stimuliert werden, so zeigt sich erwartungsgemäß, dass die mit rBet v 1 beladenen reifen dendritischen Zellen eine stärkere Proliferation hervorrufen als die unbeladenen Zellen (Abbildungen 11-17). Bei getrennter Betrachtung von Bet v 1-Mono-Sensibilisierten und Bet v 1-/Minorallergen-Sensibilisierten zeigen sich Unterschiede zwischen diesen beiden Kollektiven. Bei konstant eingesetzten Zellzahlen zeigen sich lediglich bei dem Kollektiv der Bet v 1-Mono-Sensibilisierten sowohl bei den CD4+ bulk Zellen (Abbildung 12) als auch bei den CD4+CD25- Zellen (Abbildung 15) Hinweise auf eine Rückläufigkeit der Proliferation während und wenige Wochen nach Durchführung der SIT. Bei dem Kollektiv der Bet v 1-/Minorallergen-Sensibilisierten zeigen sich keine Hinweise auf eine Rückläufigkeit der Proliferation während und wenige Wochen nach Durchführung der SIT – weder bei den CD4+ bulk Zellen (Abbildung 13) noch bei den CD4+CD25- Zellen (Abbildung 16). 57 Bei der graphischen Auswertung der Proliferationsexperimente nach Allergenspezifischer Stimulation der CD4+ bulk Zellen aller untersuchten Patienten lässt sich erkennen, dass die Stimulation mittels rBet v 1-beladener mDC eine stärkere Proliferation der CD4+ bulk Zellen hervorruft als unbeladene mDC (Abbildung 11). cpm Abbildung 11: Allergen-spezifische Stimulation der CD4+ bulk Zellen; Mittelwerte aller untersuchten Patienten (n=9)6 Links: 100.000 CD4+ bulk T-Zellen & 5.000 mDC Rechts: 100.000 CD4+ bulk T-Zellen & 5.000 mDC + rBet v 1 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 6 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 58 Polysensibilisierte Patienten, die neben Bet v 1 zusätzlich auf Minorallergene der Birke allergisch sind (Abbildung 13), wiesen im vorliegenden Versuchsansatz bei der Stimulation mit rBet v 1-beladenen mDC eine höhere Proliferation der CD4+ bulk Zellen auf als Patienten mit ausschließlicher Bet v 1-Sensibilisierung (Abbildung 12). Bei konstant eingesetzten Zellzahlen zeigen sich bei dem Kollektiv der Bet v 1Mono-Sensibilisierten bei den CD4+ bulk Zellen Hinweise auf eine Rückläufigkeit der Proliferation während und wenige Wochen nach Durchführung der SIT (Abbildung 12). cpm Abbildung 12: Allergen-spezifische Stimulation der CD4+ bulk Zellen; Mittelwerte nur der Patienten, die ausschließlich auf Bet v 1 allergisch sind (n=4)7 Links: 100.000 CD4+ bulk T-Zellen & 5.000 mDC Rechts: 100.000 CD4+ bulk T-Zellen & 5.000 mDC + rBet v 1 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 7 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 59 Bei dem Kollektiv der Bet v 1-/Minorallergen-Sensibilisierten zeigen sich keine Hinweise auf eine Rückläufigkeit der Proliferation der CD4+ bulk Zellen während und wenige Wochen nach Durchführung der SIT (Abbildung 13). cpm Abbildung 13: Allergen-spezifische Stimulation der CD4+ bulk Zellen; Mittelwerte nur der polysensibilisierten Patienten, die zusätzlich auf Minorallergene der Birke allergisch sind (n=5)8 Links: 100.000 CD4+ bulk T-Zellen & 5.000 mDC Rechts: 100.000 CD4+ bulk T-Zellen & 5.000 mDC + rBet v 1 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 8 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 60 In der graphischen Darstellung der Experimente der Allergen-spezifischen Stimulation der CD4+CD25- Zellen aller untersuchten Patienten lässt sich wiederum erkennen, dass die Stimulation mittels rBet v 1-beladener mDC eine stärkere Proliferation der CD4+CD25- Zellen hervorruft als unbeladene mDC. Im Verlauf des ersten Zyklus der Hyposensibilisierungsbehandlung sind bei konstant eingesetzten Zellzahlen dezente Hinweise auf eine Rückläufigkeit der Proliferationswerte zu erkennen (Abbildung 14). cpm Abbildung 14: Allergen-spezifische Stimulation der CD4+CD25- T-Zellen; Mittelwerte aller untersuchten Patienten (n=9)9 Links: 100.000 CD4+CD25- T-Zellen & 5.000 mDC Rechts: 100.000 CD4+CD25- T-Zellen & 5.000 mDC + rBet v 1 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 9 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 61 Polysensibilisierte Patienten, die neben Bet v 1 zusätzlich auf Minorallergene der Birke allergisch sind, erreichten im vorliegenden Untersuchungsansatz im Vergleich zu den Patienten mit ausschließlicher Bet v 1-Sensibilisierung höhere Proliferationsraten der CD4+ CD25- Zellen bei der Stimulation mit rBet v 1beladenen mDC (Abbildungen 15 und 16). Bei konstant eingesetzten Zellzahlen zeigen sich bei dem Kollektiv der Bet v 1Mono-Sensibilisierten bei den CD4+CD25- Zellen Hinweise auf eine Rückläufigkeit der Proliferation während und wenige Wochen nach Durchführung der SIT (Abbildung 15). cpm Abbildung 15: Allergen-spezifische Stimulation der CD4+CD25- T-Zellen; Mittelwerte nur der Patienten, die ausschließlich auf Bet v 1 allergisch sind (n=4)10 Links: 100.000 CD4+CD25- T-Zellen & 5.000 mDC Rechts: 100.000 CD4+CD25- T-Zellen & 5.000 mDC + rBet v 1 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 10 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 62 Bei dem Kollektiv der Bet v 1-/Minorallergen-Sensibilisierten zeigen sich keine Hinweise auf eine Rückläufigkeit der Proliferation der CD4+CD25- Zellen während und wenige Wochen nach Durchführung der SIT (Abbildung 16). cpm Abbildung 16: Allergen-spezifische Stimulation der CD4+CD25- T-Zellen; Mittelwerte nur der polysensibilisierten Patienten, die zusätzlich auf Minorallergene der Birke allergisch sind (n=5)11 Links: 100.000 CD4+CD25- T-Zellen & 5.000 mDC Rechts: 100.000 CD4+CD25- T-Zellen & 5.000 mDC + rBet v 1 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 11 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 63 Im Vergleich zu den entsprechenden Ansätzen der CD4+ bulk Zellen (Abbildung 11) und den CD4+CD25- Zellen (Abbildung 14) zeigt das Subset der CD4+CD25+ Zellen erwartungsgemäß eine deutlich niedrigere Proliferation (Abbildung 17). cpm Abbildung 17: Allergen-spezifische Stimulation der CD4+CD25+ T-Zellen; Mittelwerte aller untersuchten Patienten (n=9)12 Links: 100.000 CD4+CD25+ T-Zellen & 5.000 mDC Rechts: 100.000 CD4+CD25+ T-Zellen & 5.000 mDC + rBet v 1 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 12 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 64 Die Kulturen der CD4+CD25- Zellen, aber auch die der nicht weiter aufgetrennten CD4+ Zellen (der CD4+ bulk) zeigen durchgehend deutlich höhere Proliferationsraten als die Kulturen der CD4+CD25+ Zellen. Vergleicht man die beiden Gruppen der CD4+CD25- Zellen und der unaufgetrennten CD4+ Zellen, so zeigt sich, dass die CD4+CD25- Zellen wiederum deutlich höhere Proliferationsraten aufweisen als die CD4+ (bulk) Zellen, die ja nach wie vor den natürlichen Anteil an CD4+CD25+ Zellen besitzen, im Gegensatz zu den CD4+CD25- Zellen, bei denen dieser entfernt worden ist. In diesen Darstellungen, in denen die eingesetzten Zahlen an CD4+ bulk, CD4+CD25+ und CD4+CD25- Zellen jeweils konstant sind (jeweils 100.000 Zellen), zeigen sich lediglich bei dem Kollektiv der Bet v 1-Mono-Sensibilisierten sowohl bei den CD4+ bulk Zellen als auch bei den CD4+CD25- Zellen (Abbildungen 20 und 21) Hinweise auf eine Rückläufigkeit der Proliferation während und wenige Wochen nach Durchführung der SIT (vgl. auch den vorangegangenen Abschnitt mit den Abbildungen 11-17). Im spezifischen Ansatz (ebenso wie im (in Kapitel 5.3 ausgeführten) unspezifischen Ansatz) bestand eine deutliche Variabilität in den absoluten Proliferationswerten im Verlauf der SIT. Diese sind darauf zurückzuführen, dass in der Pilotstudie die Kulturplatten zu einem variablen Zeitpunkt mit der ThymidinLösung inkubiert wurden, sobald sich mikroskopisch gräuliche „Proliferationsinseln“ in den Zellhaufen in den wells zeigten (vgl. Kapitel „Materialien und Methoden“ (4.15)). In den Folgearbeiten, in denen regulatorische CD4+CD25+ T-Zellen unter SIT mit verschiedenen Allergen-Präparaten (Vakzine-Lösungen) untersucht wurden, wurden die Kulturplatten zu fixen Zeitpunkten eingemessen, worunter konstantere und somit vergleichbare Proliferationsraten gemessen wurden. 65 Bei der Betrachtung aller untersuchten Patienten zeigen sich bei der Stimulation der CD4+CD25- T-Zellen und der CD4+ bulk Zellen mit unbeladenen reifen dendritischen Zellen (mDC) leichte Hinweise auf einen Abfall der Proliferationsraten während und wenige Wochen nach Durchführung der SIT (Abbildung 18). cpm CD4+ bulk CD4+CD25+ CD4+CD25- Abbildung 18: Stimulation mit unbeladenen reifen dendritischen Zellen (mDC); Mittelwerte aller untersuchten Patienten (n=9)13 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 13 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 66 Bei der Betrachtung aller untersuchten Patienten zeigt sich bei der allergenspezifischen Stimulation der CD4+CD25- T-Zellen und der CD4+ bulk Zellen mit den mit Bet v 1 beladenen reifen dendritischen Zellen (mDC + Bet v 1) leichte Hinweise auf einen Abfall der Proliferationsraten während und wenige Wochen nach Durchführung der SIT (Abbildung 19). cpm CD4+ bulk CD4+CD25+ CD4+CD25- Abbildung 19: Allergen-spezifische Stimulation mit rBet v 1 präsentierenden reifen dendritischen Zellen (mDC+rBet v 1); Mittelwerte aller untersuchten Patienten (n=9)14 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 14 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 67 Betrachtet man diese Zusammenhänge bei der Stimulation der CD4+CD25T-Zellen und der CD4+ bulk Zellen mit unbeladenen reifen dendritischen Zellen (mDC) speziell nur bei den Patienten, die ausschließlich auf Bet v 1 allergisch sind, so zeigen sich Hinweise auf einen Abfall der Proliferationsraten während und wenige Wochen nach Durchführung der SIT (Abbildung 20). cpm CD4+ bulk CD4+CD25+ CD4+CD25- Abbildung 20: Stimulation mit unbeladenen reifen dendritischen Zellen (mDC); Mittelwerte nur der Patienten, die ausschließlich auf Bet v 1 allergisch sind (n=4)15 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 15 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 68 Betrachtet man diese Zusammenhänge bei der allergen-spezifischen Stimulation der CD4+CD25- T-Zellen und der CD4+ bulk Zellen mit den mit Bet v 1 beladenen reifen dendritischen Zellen (mDC + Bet v 1) speziell nur bei den Patienten, die ausschließlich auf Bet v 1 allergisch sind, so zeigen sich Hinweise auf einen Abfall der Proliferationsraten während und wenige Wochen nach Durchführung der SIT (Abbildung 21). cpm CD4+ bulk CD4+CD25+ CD4+CD25- Abbildung 21: Allergen-spezifische Stimulation mit rBet v 1 präsentierenden reifen dendritischen Zellen (mDC+rBet v 1); Mittelwerte nur der Patienten, die ausschließlich auf Bet v 1 allergisch sind (n=4)16 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 16 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 69 Betrachtet man diese Zusammenhänge bei der Stimulation der CD4+CD25T-Zellen und der CD4+ bulk Zellen mit unbeladenen reifen dendritischen Zellen (mDC) speziell nur bei den polysensibilisierten Patienten, die neben dem Majorallergen Bet v 1 zusätzlich auf Minorallergene allergisch sind, so lässt sich im vorliegenden Versuchsansatz feststellen, dass diese Patienten höhere absolute Proliferationsraten aufweisen (Abbildung 22) als dies bei den Patienten der Fall ist, die ausschließlich auf das Majorallergen allergisch sind (Abbildung 20). cpm CD4+ bulk CD4+CD25+ CD4+CD25- Abbildung 22: Stimulation mit unbeladenen reifen dendritischen Zellen (mDC); Mittelwerte nur der polysensibilisierten Patienten, die zusätzlich auf Minorallergene der Birke allergisch sind (n=5)17 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 17 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 70 Patienten, die zusätzlich auf Minorallergene sensibilisiert sind, zeigen eine höhere absolute Proliferation nach allergenspezifischer Stimulation (Abbildung 23) als dies bei den Patienten der Fall ist, die ausschließlich auf das Majorallergen allergisch sind (Abbildung 21). Bei der allergen-spezifischen Stimulation der CD4+CD25- T-Zellen und der CD4+ bulk Zellen mit den mit Bet v 1 beladenen reifen dendritischen Zellen (mDC + Bet v 1) zeigen sich bei den polysensibilisierten Patienten keine Hinweise auf einen Abfall der Proliferationsraten während und wenige Wochen nach Durchführung der SIT (Abbildung 23). cpm CD4+ bulk CD4+CD25+ CD4+CD25- Abbildung 23: Allergen-spezifische Stimulation mit rBet v 1 präsentierenden reifen dendritischen Zellen (mDC+rBet v 1); Mittelwerte nur der polysensibilisierten Patienten, die zusätzlich auf Minorallergene der Birke allergisch sind (n=5)18 (2. Blutentnahme (BE): 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 18 Diese Untersuchung wurde nur bei den Patienten 5-13 durchgeführt. 71 5.5. Ergebnisse der Zytokin-Bestimmungen aus dem Serum und aus den Überständen der Zellkulturansätze Bei der Untersuchung des Serums auf u.g. Zytokine lagen sämtliche untersuchten Werte unterhalb ihrer jeweiligen Nachweisgrenze von 20 pg/ml. Die im folgenden dargestellten Zytokinbestimmungen erfolgten aus den Zellkulturüberständen sowohl der unspezifisch mit anti-CD3/CD28-Antikörper- stimulierten Zellkulturen als auch der mittels rBet v 1-präsentierenden reifen dendritischen Zellen antigenspezifisch stimulierten Zellkulturen. Die Zytokinkonzentrationen in den Überständen der Antigen-spezifisch mittels reifen dendritischen Zellen stimulierten Ansätze lagen im vorliegenden System z.T. unterhalb oder im Bereich der Nachweisgrenze des ELISAs von 20 pg/ml. Bei den gemessenen Zytokinen handelte es sich um Interleukin-2 (IL-2), IL-4, IL-5, IL-10, Interferon-γ (IFN-γ) und Tumor-Nekrose-Faktor-α (TNF-α), für die kein relevanter Anstieg in unserem System nachgewiesen werden konnte. Gleiches gilt für die gemessenen Zytokine IL-2, IL-4, IL-5 und TNF-α bei den unspezifisch mit anti-CD3/CD28-Antikörper-stimulierten Zellkulturen. Auch diese bewegten sich in ihren Konzentrationen an oder unterhalb der Nachweisgrenze. 72 IFN-γ Bezüglich der IFN-γ-Konzentration bei den unspezifisch mit anti-CD3/CD28Antikörper-stimulierten Zellkulturen konnten in sämtlichen Ansätzen, also bei den CD4+ bulk Zellen (Abbildung 24), bei den CD4+CD25- (Abbildung 25) und den CD4+CD25+ Zellen (Abbildung 26), als auch bei dem 1:1-Regulationsansatz aus CD4+CD25- und CD4+CD25+ Zellen (Abbildung 27), keine relevanten Veränderungen der IFN-γ-Konzentration im Verlauf der SIT festgestellt werden. pg/ml Abbildung 24: IFN-γ-Verlauf aus den 48h-Überständen der CD4+ bulk Zellen (antiCD3/CD28-Antikörper-stimuliert) aller untersuchten Patienten (n=9) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 73 pg/ml Abbildung 25: IFN-γ-Verlauf aus den 48h-Überständen der CD4+CD25- Zellen (antiCD3/CD28-Antikörper-stimuliert) aller untersuchten Patienten (n=9) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 74 pg/ml Abbildung 26: IFN-γ-Verlauf aus den 48h-Überständen der CD4+CD25+ Zellen (antiCD3/CD28-Antikörper-stimuliert) aller untersuchten Patienten (n=9) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 75 pg/ml Abbildung 27: IFN-γ-Verlauf aus den 48h-Überständen der 1:1-Regulation zwischen CD4+CD25- und CD4+CD25+ Zellen (anti-CD3/CD28-Antikörper-stimuliert) aller untersuchten Patienten (n=9) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) Bei Unterteilung der Patienten in die verschiedenen Untergruppen bezüglich ihrer zusätzlichen Sensibilisierung auf Minorallergene zeigt sich bei den gewählten Untergruppen kein abweichendes Verhalten – auch hier kam es durchgehend zu einem diskreten Abfall der gemessenen IFN-γ-Konzentration. Auf eine graphische Darstellung wurde deshalb an dieser Stelle verzichtet. 76 IL-10 Die Durchschnittswerte der gemessenen Konzentrationen der IL-10-Werte der 1:1-Regulation aus CD4+CD25- und CD4+CD25+ Zellen rangieren in einer Größenordnung von etwa 100 pg/ml, was eine Deutung zulässt. Bei der Betrachtung aller Patienten kommt es im Verlauf der SIT zu keiner erkennbaren Änderung der im Überstand gemessenen IL-10-Werte (Abbildung 28). pg/ml Abbildung 28: + IL-10-Verlauf - + aus 48h-Überständen der 1:1-Regulation zwischen + CD4 CD25 und CD4 CD25 Zellen (anti-CD3/CD28-Antikörper-stimuliert) aller untersuchten Patienten (n=9) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) Die gemessenen Konzentrationen der IL-10-Werte in den Zellkulturüberständen rangieren bei den separaten Ansätzen von CD4+ bulk Zellen, von CD4+CD25und von CD4+CD25+ Zellen unterhalb und knapp oberhalb der Nachweisgrenze. Relevante Unterschiede zeigen sich nicht. Die Graphiken werden hier nicht gezeigt. 77 Unterteilt man nun die Patienten wieder in Untergruppen bezüglich der zusätzlichen Sensibilisierung auf Minorallergene der Birke, so zeigt sich folgendes: Die Patienten, die ausschließlich auf das Hauptallergen Bet v 1 allergisch sind, zeigen in den Regulationsexperimenten einen Anstieg der IL-10-Werte im Verlauf des ersten Zyklus der Hyposensibilisierungsbehandlung (Abbildung 29). pg/ml Abbildung 29: + - IL-10-Verlauf + aus 48h-Überständen der 1:1-Regulation zwischen + CD4 CD25 und CD4 CD25 Zellen (anti-CD3/CD28-Antikörper-stimuliert) nur der Patienten, die ausschließlich auf Bet v 1 allergisch sind (n=4) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 78 Die Patienten hingegen, die außer auf Bet v 1 zusätzlich auf Minorallergene der Birke allergisch sind, zeigen in diesem Ansatz bei der Konzentration der IL-10Werte in den Zellkulturüberständen keinen vergleichbaren Anstieg im Verlauf der Behandlung (Abbildung 30). pg/ml Abbildung 30: + - IL-10-Verlauf + aus 48h-Überständen der 1:1-Regulation zwischen + CD4 CD25 und CD4 CD25 Zellen (anti-CD3/CD28-Antikörper-stimuliert) nur der Patienten, die zusätzlich auf Minorallergene der Birke allergisch sind (n=5) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 79 Vergleicht man die IL-10-Sekretion der CD4+CD25- Zellen mit der der CD4+CD25+ Zellen im unspezifisch stimulierten Ansatz, so fällt auf, dass die CD4+CD25+ Zellen etwa doppelt so viel IL-10 produzieren wie die CD4+CD25Zellen (ca. 50 pg/ml im Vergleich zu ca. 25 pg/ml; Abbildung 31). Abbildung 31: IL-10-Verlauf aus 48h-Überständen sowohl der CD4+CD25- als auch der CD4+CD25+ Zellen (anti-CD3/CD25-stimuliert) aller untersuchten Patienten (n=9) Rot und Blau: Trendlinien (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) Die Bestimmungen von TGF-β in den Überständen der Zellkulturansätze ergaben Ergebnisse unterhalb der Nachweisgrenze. Dies gilt sowohl für die Überstände aus der Antigen-spezifischen Stimulation vermittelt über rBet v 1beladene dendritische Zellen als auch für die Überstände aus der unspezifischen Stimulation mittels anti-CD3/CD28-Antikörper. 80 5.6. Ergebnisse der Allergen-spezifischen IgE-, IgG- und IgG4Bestimmungen gegen Birkenpollenallergene (Gesamtextrakt) und rekombinante Birkenpollenallergene (rBet v 1, rBet v 2, rBet v 4) im Serum im Verlauf der SIT Übersicht der Abbildungen und Tabellen der Ergebnisse der unterschiedlichen Immunglobulinsubsets: Allergen → ↓ Ak-Subset BirkenpollenGesamtextrakt Mono Poly Bet v 1 Bet v 2 Bet v 4 Mono Poly Mono Poly Mono Poly IgE 32 33 34 35 36* 38* 39* IgG 40 41 42 43 44 37a 37b* 45 47 IgG4 48 49 50* 51a 51b* 52* 46a 46b* 54* 53a 53b* 55* Mono(sensibilisierte): Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind Poly(sensibilisierte): Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind * Tabelle 81 IgE Bei der Auswertung des Allergen-spezifischen IgE gegen Birkenpollengesamtextrakt in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, konnte kein relevanter Anstieg im Verlauf des 1. Zyklus der SIT beobachtet werden (Abbildung 32). Die Nachweisgrenze des Testverfahrens beträgt 0,35 kU/L. kU/L Abbildung 32: Allergen-spezifisches IgE im Serum gegen Birkenpollengesamtextrakt im Verlauf der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 82 Bei der Auswertung des Allergen-spezifischen IgE gegen den Birkenpollengesamtextrakt konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, im Verlauf der SIT ein sehr diskreter Anstieg beobachtet werden (Abbildung 33). Die durchschnittlichen spezifischen IgEWerte liegen mit ca. 100 kU/l höher als dies mit ca. 12 kU/l in der Gruppe der Patienten der Fall ist, die ausschließlich auf Bet v 1 allergisch sind (Abbildung 32). kU/L Abbildung 33: Allergen-spezifisches IgE im Serum gegen Birkenpollengesamtextrakt im Verlauf der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 83 Die Allergen-spezifischen IgE-, IgG- und IgG4-Werte gegen die rekombinanten Allergene rBet v 1, rBet v 2 und rBet v 4 wurden jeweils aus den Serumproben der ersten und fünften Blutentnahme bestimmt, was einem prätherapeutischen und einem posttherapeutischen Wert (4 Wochen nach Erreichen der Höchstdosis des 1. SIT-Zyklus) bezüglich der Hyposensibilisierungsbehandlung entspricht. Bei der Auswertung des Allergen-spezifischen IgE gegen rBet v 1 konnte in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, im Verlauf der SIT kein Anstieg beobachtet werden (Abbildung 34). kU/L 1. BE 5. BE Abbildung 34: Allergen-spezifisches IgE im Serum gegen rBet v 1 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 84 Bei der Auswertung des Allergen-spezifischen IgE gegen rBet v 1 konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, im Verlauf der SIT ebenfalls keine nennenswerte Veränderung beobachtet werden (Abbildung 35). Die durchschnittlichen Werte liegen mit ca. 80 kU/l höher als dies mit ca. 13 kU/l in der Gruppe der Patienten der Fall ist, die ausschließlich auf Bet v 1 allergisch sind (Abbildung 34). kU/L 1. BE 5. BE Abbildung 35: Allergen-spezifisches IgE im Serum gegen rBet v 1 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 85 Bei der Auswertung des Allergen-spezifischen IgE gegen rBet v 2 wurde definitionsgemäß in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, vor Beginn der SIT keine Sensibilisierung gegen rBet v 2 nachgewiesen. Dies bestätigte sich auch nach Durchführung des 1. Therapiezyklus. Eine Neusensibilisierung auf Bet v 2 trat unter der SIT nicht ein. Aufgrund der ausschließlich negativen Ergebnisse wurde eine tabellarische und keine grafische Darstellung gewählt (Abbildung 36). Diese Ergebnisse bestätigen die prä- und posttherapeutischen Ergebnisse der IgE- Immunoblotuntersuchung (Abbildung 2) (ausschließliche Sensibilisierung gegen Bet v 1 in diesem Patientenkollektiv). Patient 1 Patient 2 Patient 3 Patient 5 Patient 6 Patient 7 Patient 10 Blutentnahme IgE gegen rBet v 2 prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L Abbildung 36: Allergen-spezifisches IgE im Serum gegen rBet v 2 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) 86 Bei der Auswertung des Allergen-spezifischen IgE gegen rBet v 2 konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, im Verlauf der SIT keine Veränderung beobachtet werden (Abbildungen 37a und b). Auch hier bestätigen sich die Ergebnisse des IgE-Immunoblot (Abbildungen 2 und 3). kU/L 1. BE 5. BE Abbildung 37a: Allergen-spezifisches IgE im Serum gegen rBet v 2 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 87 Patient 4 Patient 8 Patient 9 Patient 11 Patient 12 Patient 13 Blutentnahme IgE gegen rBet v 2 prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT 6,41 kU/L post SIT 4,70 kU/L prae SIT 7,60 kU/L post SIT 9,40 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT 4,25 kU/L post SIT 6,50 kU/L prae SIT 1,73 kU/L post SIT 1,85 kU/L Abbildung 37b: Allergen-spezifisches IgE im Serum gegen rBet v 2 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) 88 Bei der Auswertung des Allergen-spezifischen IgE gegen rBet v 4 konnte in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, vor und nach der SIT keine Sensibilisierung auf rBet v 4 nachgewiesen werden (Abbildung 38). Diese Ergebnisse bestätigen die Ergebnisse des IgE-Immunoblot (Abbildungen 2 und 3). Patient 1 Patient 2 Patient 3 Patient 5 Patient 6 Patient 7 Patient 10 Blutentnahme IgE gegen rBet v 4 prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L Abbildung 38: Allergen-spezifisches IgE im Serum gegen rBet v 4 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) 89 Bei der Auswertung des Allergen-spezifischen IgE gegen rBet v 4 konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, vor und nach der SIT keine Sensibilisierung auf rBet v 4 nachgewiesen werden (Abbildung 39). Patient 4 Patient 8 Patient 9 Patient 11 Patient 12 Patient 13 Blutentnahme IgE gegen rBet v 4 prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L prae SIT < 0,35 kU/L post SIT < 0,35 kU/L Abbildung 39: Allergen-spezifisches IgE im Serum gegen rBet v 4 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) 90 IgG Bei der Auswertung des Allergen-spezifischen IgG gegen Birkenpollengesamtextrakt konnte in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, im Verlauf der SIT keine relevante Veränderung beobachtet werden (Abbildung 40). Die Nachweisgrenze des Testverfahrens beträgt 2 mg/L. mg/L Abbildung 40: Allergen-spezifisches IgG im Serum gegen Birkenpollengesamtextrakt im Verlauf der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 91 Bei der Auswertung des Allergen-spezifischen IgG gegen Birkenpollengesamtextrakt konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, im Verlauf der SIT ein unwesentlicher Anstieg beobachtet werden (Abbildung 41). mg/L Abbildung 41: Allergen-spezifisches IgG im Serum gegen Birkenpollengesamtextrakt im Verlauf der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 92 Die Allergen-spezifischen IgE-, IgG- und IgG4-Werte gegen die rekombinanten Allergene rBet v 1, rBet v 2 und rBet v 4 wurden jeweils aus den Serumproben der ersten und fünften Blutentnahme bestimmt, was einem prae- und einem posttherapeutischen Wert (4 Wochen nach Erreichen der Höchstdosis des1. SIT-Zyklus) bezüglich der Hyposensibilisierungsbehandlung entspricht. Bei der Auswertung des Allergen-spezifischen IgG gegen rBet v 1 konnte in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, im Verlauf der SIT ein geringer Anstieg beobachtet werden (Abbildung 42). mg/L 1. BE 5. BE Abbildung 42: Allergen-spezifisches IgG im Serum gegen rBet v 1 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 93 Bei der Auswertung des Allergen-spezifischen IgG gegen rBet v 1 konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, im Verlauf der SIT ein Abfallen der Werte beobachtet werden (Abbildung 43). Die durchschnittlichen Werte liegen geringfügig höher als dies in der Gruppe der Patienten der Fall ist, die ausschließlich auf Bet v 1 allergisch sind (Abbildung 42). mg/L 1. BE 5. BE Abbildung 43: Allergen-spezifisches IgG im Serum gegen rBet v 1 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 94 Bei der Auswertung des Allergen-spezifischen IgG gegen rBet v 2 zeigte sich in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, ein nahezu unveränderter Befund (Abbildung 44). mg/L 1. BE 5. BE Abbildung 44: Allergen-spezifisches IgG im Serum gegen rBet v 2 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 95 Bei der Auswertung des Allergen-spezifischen IgG gegen rBet v 2 konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, im Verlauf der SIT keine Veränderung beobachtet werden (Abbildung 45). Die durchschnittlichen Werte sind unwesentlich höher als dies in der Gruppe der Patienten der Fall ist, die ausschließlich auf Bet v 1 allergisch sind (Abbildung 44). mg/L 1. BE 5. BE Abbildung 45: Allergen-spezifisches IgG im Serum gegen rBet v 2 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 96 In der Auswertung des Allergen-spezifischen IgG gegen rBet v 4 in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, lag lediglich bei einem Patienten der Wert oberhalb der Nachweisgrenze (Abbildungen 46a und b). mg/L 1. BE 5. BE Abbildung 46a: Allergen-spezifisches IgG im Serum gegen rBet v 4 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 97 Patient 1 Patient 2 Patient 3 Patient 5 Patient 6 Patient 7 Patient 10 Blutentnahme IgG gegen rBet v 4 prae SIT 2,64 mg/L post SIT 2,91 mg/L prae SIT < 2,00 mg/L post SIT < 2,00 mg/L prae SIT < 2,00 mg/L post SIT < 2,00 mg/L prae SIT < 2,00 mg/L post SIT < 2,00 mg/L prae SIT < 2,00 mg/L post SIT < 2,00 mg/L prae SIT < 2,00 mg/L post SIT < 2,00 mg/L prae SIT < 2,00 mg/L post SIT < 2,00 mg/L Abbildung 46b: Allergen-spezifisches IgG im Serum gegen rBet v 4 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) 98 Bei der Auswertung des Allergen-spezifischen IgG gegen rBet v 4 konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, kein Anstieg nachgewiesen werden (Abbildung 47). mg/L 1. BE 5. BE Abbildung 47: Allergen-spezifisches IgG im Serum gegen rBet v 4 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 99 IgG4 Bei der Auswertung des Allergen-spezifischen IgG4 gegen Birkenpollengesamtextrakt konnte in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, im Verlauf der SIT kein Anstieg beobachtet werden (Abbildung 48). Die Nachweisgrenze des Testverfahrens beträgt 0,15 mg/L. mg/L Abbildung 48: Allergen-spezifisches IgG4 im Serum gegen Birkenpollengesamtextrakt im Verlauf der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 100 Bei der Auswertung des Allergen-spezifischen IgG4 gegen Birkenpollengesamtextrakt konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, im Verlauf der SIT kein wesentlicher Anstieg im Untersuchungszeitraum beobachtet werden (Abbildung 49). mg/L Abbildung 49: Allergen-spezifisches IgG4 im Serum gegen Birkenpollengesamtextrakt im Verlauf der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 2. BE: 1-2 Wo. nach 1. Impf.; 3. BE: 1-2 Wo. nach 2. Impf.; 4. BE: 1-2 Wo. nach 3. Impf.; 5. BE: 4 Wo. nach 3. Impf.) 101 Die Allergen-spezifischen IgG4-Werte gegen die rekombinanten Allergene rBet v 1, rBet v 2 und rBet v 4 wurden jeweils aus den Serumproben der ersten und fünften Blutentnahme bestimmt, was einem prae- und einem posttherapeutischen Wert (4 Wochen nach Erreichen der Höchstdosis des 1. SIT-Zyklus) bezüglich der Hyposensibilisierungsbehandlung entspricht. Bei der Auswertung des Allergen-spezifischen IgG4 gegen rBet v 1 konnten in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, weder vor noch nach der Hyposensibilisierung IgG4Antikörper nachgewiesen werden (Abbildung 50). Patient 1 Patient 2 Patient 3 Patient 5 Patient 6 Patient 7 Patient 10 Blutentnahme IgG4 gegen rBet v 1 prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L Abbildung 50: Allergen-spezifisches IgG4 im Serum gegen rBet v 1 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) 102 Bei der Auswertung des Allergen-spezifischen IgG4 gegen rBet v 1 konnte in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, im Untersuchungszeitraum keine nennenswerte Veränderung der Werte beobachtet werden, zumal sich diese zumeist im Bereich der Nachweisgrenze befinden (Abbildungen 51a und b). mg/L 1. BE 5. BE Abbildung 51a: Allergen-spezifisches IgG4 im Serum gegen rBet v 1 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 103 Patient 4 Patient 8 Patient 9 Patient 11 Patient 12 Patient 13 Blutentnahme IgG4 gegen rBet v 1 prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT 1,84 mg/L post SIT 0,72 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT 0,18 mg/L prae SIT 1,26 mg/L post SIT 1,21 mg/L prae SIT 3,64 mg/L post SIT 5,03 mg/L Abbildung 51b: Allergen-spezifisches IgG4 im Serum gegen rBet v 1 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) 104 Bei der Auswertung des Allergen-spezifischen IgG4 gegen rBet v 2 konnten in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, weder vor noch nach der Hyposensibilisierung IgG4Antikörper nachgewiesen werden (Abbildung 52). Patient 1 Patient 2 Patient 3 Patient 5 Patient 6 Patient 7 Patient 10 Blutentnahme IgG4 gegen rBet v 2 prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L Abbildung 52: Allergen-spezifisches IgG4 im Serum gegen rBet v 2 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) 105 Allergen-spezifisches IgG4 gegen rBet v 2 konnte bei einzelnen Individuen in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind nachgewiesen werden (Abbildungen 53a und b). mg/L 1. BE 5. BE Abbildung 53a: Allergen-spezifisches IgG4 im Serum gegen rBet v 2 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) (1. Blutentnahme (BE): vor der 1. Impfung; 5. BE: 4 Wochen nach 3. Impf.) 106 Patient 4 Patient 8 Patient 9 Patient 11 Patient 12 Patient 13 Blutentnahme IgG4 gegen rBet v 2 prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT 0,20 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT 0,60 mg/L prae SIT 1,88 mg/L post SIT 1,72 mg/L Abbildung 53b: Allergen-spezifisches IgG4 im Serum gegen rBet v 2 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) 107 Bei der Auswertung des Allergen-spezifischen IgG4 gegen rBet v 4 konnten in der Gruppe der Patienten, die ausschließlich eine Sensibilisierung gegen Bet v 1 aufweisen, weder vor noch nach der Hyposensibilisierung IgG4Antikörper nachgewiesen werden (Abbildung 54). Patient 1 Patient 2 Patient 3 Patient 5 Patient 6 Patient 7 Patient 10 Blutentnahme IgG4 gegen rBet v 4 prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L Abbildung 54: Allergen-spezifisches IgG4 im Serum gegen rBet v 4 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die ausschließlich auf Bet v 1 sensibilisiert sind (n=7) 108 Auch in der Gruppe der Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind, waren weder vor noch nach der Hyposensibilisierung spezifische IgG4-Antikörper gegen rBet v 4 nachweisbar (Abbildungen 54 und 55). Patient 4 Patient 8 Patient 9 Patient 11 Patient 12 Patient 13 Blutentnahme IgG4 gegen rBet v 4 prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L prae SIT < 0,15 mg/L post SIT < 0,15 mg/L Abbildung 55: Allergen-spezifisches IgG4 im Serum gegen rBet v 4 vor und nach dem 1. Behandlungszyklus der SIT bei Patienten, die zusätzlich auf Minorallergene der Birke sensibilisiert sind (n=6) Vier Wochen nach Erreichen der Höchstdosis wurden somit keine relevanten Veränderungen bei den spezifischen Antikörpern IgE, IgG und IgG4 sowohl gegen Birkenpollen als auch gegen rekombinante Birkenpollen-Allergene (rBet v 1, rBet v 2, rBet v 4) beobachtet. Dies steht in Einklang mit der Literatur; vgl. hierzu die Ausführungen im folgenden Kapitel 6 „Diskussion“. 109 6. Diskussion Ziel der vorliegenden Arbeit war, Methoden zur Untersuchung regulatorischer T-Zellen bei der Induktion Allergen-spezifischer Toleranz durch spezifische Immuntherapie (SIT) zu etablieren. Als Allergie-Vakzine wurde hierbei eine präsaisonale Kurzzeitimmuntherapie mit Tyrosin-adsorbierten Allergoiden und Adjuvans MPL® eingesetzt. Diese Kurzzeit-Therapie umfasst vier s.c. Injektionen, wobei bei der dritten Injektion bereits die Allergen-Höchstdosis erreicht wird (Abbildung 1). Das Adjuvans MPL® (Monophosphoryl Lipid A®), ein detoxifiziertes Lipopolysaccharid aus dem Endotoxin von Salmonella minnesota, das an sich einen Th1-induzierenden Effekt hat [Moore A et al. 1999], ist in jeder Injektion in einer Konzentration von 50 µg/ml enthalten [Drachenberg et al. 2001, Drachenberg et al. 2002, Drachenberg et al. 2003]. Das Adjuvans MPL® wird nicht nur in dieser Allergie-Vakzine als „Wirkverstärker“ verwendet, sondern auch in Impflösungen gegen Infektionskrankheiten, z.B. gegen die humanen Papillomviren 16 und 18 (Cervarix®) sowie gegen das Hepatitis-B-Virus (Fendrix®). Die Konzentration der Allergoide in der Impflösung ist wie allgemein bei Allergie-Vakzinen üblich nach dem Hauptallergengehalt standardisiert. Die Minorallergene (Bet v 2 usw.) sind in den Lösungen zwar ebenfalls enthalten, allerdings nicht in standardisierten Konzentrationen. Ein unterschiedliches therapeutisches Ansprechen auf eine Impftherapie mit bisherigen Allergie-Vakzinen von Patienten mit ausschließlicher Sensibilisierung auf das Hauptallergen Bet v 1 im Vergleich zu Patienten, die zusätzlich auf Minorallergene der Birke allergisch reagieren, kann dadurch bedingt sein [Cromwell et al. 2006]. Es ist zu erwarten, dass Patienten von Allergie-Vakzinen, die auf ihr individuelles Sensibilisierungsprofil durch gezielten Einsatz entsprechender rekombinanter Allergene zugeschnitten sind, profitieren [Valenta et al. 1999, Valenta et al. 2007]. In klinischen Studien zeigte sich, dass SIT mit rekombinanten Allergenen sowohl klinisch (Reduktion der Symptome, gemessen in Symptomenscores) als auch laborchemisch (Anstieg des Allergen-spezifischen IgG4 und Abfall des Allergen-spezifischen IgE) ein deutliches therapeutisches Ansprechen zeigen [Jutel et al. 2005]. 110 Zum Zeitpunkt des Beginns der vorliegenden Arbeit war der Transkriptionsfaktor Fox p 3, der zum gegenwärtigen Zeitpunkt der Selektionsfaktor der Wahl ist, um die CD4+CD25+ regulatorischen T-Zellen nachzuweisen, noch nicht etabliert. Der intrazelluläre Transkriptionsfaktor Fox p 3 stellt einen spezifischeren Marker für die regulatorischen T-Zellen dar, da er im Gegensatz zum CD25Oberflächenmolekül kaum in aktivierten T-Zellen zu finden ist. Der Grund hierfür ist, dass Fox p 3 ein genetisches Programm kontrolliert, das zur spezifischen Entwicklung der Zellart der CD4+CD25+ regulatorischen T-Zellen führt. Durch Nachweis der Expression des intrazellulären Transkriptionsfaktors Fox p 3 (forkhead box p 3) auf molekularer Ebene, der zur sogenannten forkhead family gehört, können regulatorische T-Zellen beschrieben werden. Die große Mehrheit der Fox p 3-exprimierenden regulatorischen T-Zellen findet sich in der Gruppe der CD4+ T-Zellen, die MHC II-Moleküle auf ihrer Oberfläche tragen und die zusätzlich auch CD25 exprimieren [Campbell et al. 2007, Bacchetta et al. 2007, Allan et al. 2007]. Bis zur Identifizierung von Fox p 3 wurde die Expression der beiden Zelloberflächenmoleküle CD4 und CD25 verwendet, um diese Zellpopulation zu definieren, welche folglich als CD4+CD25+ T-Zellen bezeichnet wurden. CD25 wird auch von nicht-regulatorischen T-Zellen exprimiert, beispielsweise bei deren Aktivierung im Rahmen einer Immunantwort gegen Pathogene. Inzwischen ist auch für Fox p 3 bekannt, dass auch dieser Transkriptionsfaktor von T-Zell-Rezeptor aktivierten T-Zellen exprimiert wird, obwohl es sich bei diesen nicht um regulatorische T-Zellen handelt [Baccheta et al. 2007]. Auch dieser Marker charakterisiert nicht eindeutig regulatorische T-Zellen. Allerdings erreichen die nachgewiesenen Konzentrationen von Fox p 3 in aktivierten T-Zellen (low) nicht das Niveau der Konzentrationen in regulatorischen T-Zellen (high); auch ist in den aktivierten T-Zellen das Vorhandensein von Fox p 3 nicht von Dauer [Allan et al. 2007, Bacchetta et al. 2007, Campbell et al. 2007]. Die Suche nach weiteren spezifischen Oberflächenmarkern für regulatorische TZellen hält an. CD4+CD25+ regulatorische T-Zellen werden in natürliche CD4+CD25+ regulatorische T-Zellen (Entstehung im Thymus) und die in der Peripherie im Lauf des Lebens entstehenden adaptiven (= induzierbaren) CD4+CD25+ regulatorische T-Zellen unterschieden. Sowohl die natürlich vorkommende als auch die adaptive CD4+CD25+ regulatorische T-Zell-Generation ist eine Untergruppe aller 111 Fox p 3-exprimierenden regulatorischen T-Zellen [Bluestone et al. 2003, Bacchetta et al. 2007]. Genetische Mutationen im Fox p 3-Gen, die zu erblichen Krankheiten führten, konnten sowohl beim Menschen als auch bei der Maus identifiziert werden. Dies ist ein klarer Beweis dafür, dass die Fox p 3-exprimierenden regulatorischen T-Zellen eine entscheidende Rolle bei der Aufrechterhaltung der normalen Funktion des Immunsystems spielen [Shevach 2002, Sakaguchi et al. 2004, Campbell et al. 2007, Allan et al. 2007, Bacchetta et al. 2007]. Dass es sich bei dem untersuchten Subset der isolierten CD4+CD25+ Zellen tatsächlich um regulatorische T-Zellen handelt, zeigen folgende zwei Charakteristika, die wir in unseren Ergebnissen nachweisen konnten: Zum einen proliferieren sie im Vergleich zum Subset der CD4+CD25- Zellen bzw. auch zum Subset der CD4+ Zellen nur unwesentlich, was sich bei der Allergen-spezifischen Stimulation mittels rBet v 1 beladenen dendritischen Zellen sowohl bei der Gesamtpopulation beobachten lässt (Abbildung 19) als auch bei der Patientengruppe, die ausschließlich auf das Hauptallergen Bet v 1 sensibilisiert ist (Abbildung 21). Zum anderen zeigt das Subset der isolierten CD4+CD25+ T-Zellen eindeutig inhibitorisches Potential: Sowohl in den Allergen-unspezifischen (Abbildung 10) als auch in den Allergen-spezifischen Ansätzen (Abbildungen 1823) wurde durch die Zugabe der CD4+CD25+ Zellen eine deutliche Hemmung der Proliferation der entsprechenden T-Zell-Population erreicht, die in Kokultur zu den regulatorischen T-Zellen gegeben wurden. Diese Hemmung der Proliferation auch in vitro stellt das zentrale Charakteristikum der regulatorischen T-Zellen dar [Sakaguchi et al. 2008, Sakaguchi et al. 2009, Wing et al. 2006, Akdis CA et al. 2009, Akdis M et al. 2007]. Zahlreiche Subsets regulatorischer T-Zellen tragen zur peripheren Toleranz bei, nicht zuletzt die Tr1-Zellen (Tabelle 1). Ziel unserer Untersuchung war Etablierung einer Read-out-Methodik zum Verlauf der CD4+CD25+ regulatorischen T-Zellen unter SIT. Diese Zellen sind in der Lage, aktiv und dominant die Aktivierung und Effektorfunktion anderer T-Zellen über einen zellkontaktabhängigen Mechanismus zu unterdrücken, wodurch sie in höchst effizienter Weise autoreaktive T-Zellen kontrollieren und die Selbsttoleranz aufrechterhalten [Suri-Payer et al. 1999, Shevach 2002, Shevach 2001, Dieckmann et al. 2001, Jonuleit et al. 2001a]. Sie zeigen einen anergen Phänotyp, d.h. durch Stimulation über ihren 112 T-Zellrezeptor können sie in vitro nur in sehr geringem Ausmaß zur Proliferation gebracht werden [Dieckmann et al. 2001]. Die neueste Art der Charakterisierung von regulatorischen T-Zellen besteht auf molekularer Ebene, nämlich durch Nachweis der Expression des intrazellulären Transkriptionsfaktors Fox p 3 (forkhead box p 3). Tr1-Zellen, die ebenfalls während der SIT induziert werden, üben ebenfalls Suppressorfunktionen auf die Allergen-spezifischen Effektor-T-Zellen aus, wobei die Frage aktuell noch unbeantwortet bleiben muss, ob es sich bei den induzierten CD4+CD25+ regulatorischen T-Zellen um induzierte Tr1-Zellen handelt, die CD25 im Rahmen ihrer Aktivierung hochreguliert haben, oder es sich tatsächlich um die sogenannten natürlich vorkommenden (aus dem Thymus stammenden) CD4+CD25+ regulatorischen T-Zellen handelt [Akdis M et al. 2005, Akdis CA et al. 2009, Akdis M et al. 2007]. Um diese Frage endgültig beantworten zu können, sind weitere zukünftige Studien erforderlich. Es gibt des Weiteren Erkenntnisse, dass es sich bei den natürlich vorkommenden (aus dem Thymus stammenden) CD4+CD25+ regulatorischen T-Zellen und den adaptiven Tr1-Zellen um Populationen handelt, die gemeinsame Vertreter aufweisen können, was bedeutet, dass es Zellen gibt, die aufgrund ihrer Herkunft bzw. ihrer Oberflächenmarker- und Zytokin-Ausstattung gleichzeitig beiden Populationen angehören [Jutel et al. 2003]. Bezüglich der Fragestellung, ob Patienten mit ausschließlicher Sensibilisierung auf Bet v 1 in höherem Maße von der Impftherapie mit bisherigen Vakzinen profitieren als Patienten, die zusätzlich auf Minorallergene der Birke allergisch reagieren, konnten wir in unseren Experimenten aufzeigen, dass der Anteil der CD4+CD25+ Zellen an den Gesamt-PBMC, ermittelt durch FACS-Analysen, im Verlauf der SIT bei den ausschließlich auf Bet v 1 sensibilisierten Patienten einen deutlichen Anstieg zeigt (Abbildungen 6 und 7), was bei den Patienten mit zusätzlicher Minorallergensensibilisierung im untersuchten Kollektiv nicht beobachtet werden kann (Abbildungen 8 und 9). Dieser Anstieg des Subsets der CD4+CD25+ T-Zellen bei den monosensibilisierten Patienten weist auf einen immunologischen Effekt der Kurzzeit-Hyposensibilisierung hin (4 Gaben der Allergievakzine mit oben genanntem Adjuvans Monophosphoryl Lipid A). Unsere Ergebnisse stehen im Einklang mit Untersuchungsergebnissen anderer Arbeitsgruppen unter SIT mit Graspollenallergenen [Francis et al. 2003] und 113 Hausstaubmilbenallergenen [Gardner et al. 2004]. Die Arbeitsgruppe um Francis isolierte PBMC von Graspollen-allergischen Patienten, nachdem sich diese einer subkutanen Immuntherapie mit rekombinanten Grasspollenallergenen unterzogen hatten, sowie von atopischen und nicht-atopischen Probanden, die als Kontrollgruppe zuvor jeweils keine SIT erhalten hatten. Nach 6tägiger in vitro Stimulation der PBMC mit Phleum pratense (Wiesen-Lieschgras) wurden die Produktion von IL-10, IL-5, IL-4 und IFN-gamma sowie die Proliferation und die Anzahl der CD4+CD25+ T-Zellen in der PBMC-Kultur bestimmt. Die Patienten, die zuvor die SIT erhalten hatten, zeigten hierbei eine höhere Produktion von IL-10 in den Überständen der PBMC-Kultur als beide Kontrollgruppen. Auch war die Zahl der mittels FACS-Analyse bestimmten CD4+CD25+ T-Zellen in der Allergen-stimulierten PBMC-Kultur in der SIT-Gruppe höher. Nur T-Zellen der SIT-Gruppe waren positiv für interzelluläres IL-10 (bestimmt per FACSAnalyse), wobei dies wiederum v.a. CD4+CD25+ T-Zellen waren. Inhibitionsuntersuchungen mit den CD4+CD25+ T-Zellen wurden in dieser Untersuchung nicht durchgeführt. Die Arbeitsgruppe um Gardner untersuchte Hausstaubmilben-allergische Patienten, wobei 9 Patienten eine konventionelle subkutane spezifische Immuntherapie mit einem standardisierten Hausstaubmilben-Extrakt erhielten; 3 Patienten stellten die Kontrollgruppe dar, die nur symptomatisch therapiert wurde. Symptome, Medikamentenverbrauch und die Allergen-induzierte verzögerte kutane Reaktion wurde vor der Therapie und 9 Monate nach Therapiebeginn bestimmt. Vor sowie 3 und 9 Monate nach Therapiebeginn wurden PBMC isoliert und mit Hausstaubmilbenextrakt für 14 Tage kultiviert. Per FACS-Analyse wurden im Anschluss die Produktion von interzellulär bestimmtem IL-10, IFN-gamma und IL-4 der CD4+ und CD8+ T-Zellen untersucht. Nach 9 Monaten zeigten alle mit SIT behandelten Patienten reduzierte Symptome und reduzierte verzögerte kutane Reaktionen verglichen mit den Ausgangsbefunden. Die Zahl der IL-4+ produzierenden T-Zellen (CD4+ und CD8+) nahm ab verglichen mit dem Ausgangswert; die Zahl der CD4+CD25+ T-Zellen, die IL-10+ produzieren, nahm zu, was einer Induktion regulatorischer T-Zellen durch die SIT entspricht. Die positiven Effekte der SIT werden somit auch in diesen Arbeiten auf die Induktion von CD4+CD25+ regulatorischen T-Zellen als Hauptursache zurückgeführt. 114 In der Arbeitsgruppe um Pfützner wurde bei einer kleinen inkludierten Patientenzahl (n=5) hingegen kein Anstieg der CD4+CD25+ regulatorischen T-Zellen unter SIT gesehen. Als Vakzine wurde in dieser Arbeit ALK-depot SQ der Firma ALK-Abello während der Erhaltungsphase monatlich s.c. injiziert. Hierbei handelt es sich somit im Gegensatz zur vorliegenden Arbeit um ein „konventionelles“ Schema; entsprechend sind die gewählten Untersuchungsintervalle (1, 3, 6 und 12 Monate nach Erreichen der Erhaltungsdosis von 100.000 Standard Quality-Units pro Injektion) größer als in der vorliegenden Arbeit, in der mit dem Präparat Pollinex Quattro™ der Firma Bencard Allergy GmbH eine präsaisonale Kurzzeitimmuntherapie mit Tyrosin-adsorbierten Allergoiden und Adjuvans MPL® durchgeführt wurde (Abbildung 1). In dem Studienprotokoll der Arbeitsgruppe um Pfützner [Möbs et al. 2010] wurde ebenso wie in der vorliegenden Arbeit die FACS-Analyse zur Bestimmung der CD4+CD25+ T-Zellen aus PBMC durchgeführt; in der grafischen Auswertung wurde (im Gegensatz zur vorliegenden Arbeit) der prozentuale Anteil der CD4+CD25+ T-Zellen an den CD4+ T-Zellen (und nicht an den gesamten PBMC) dargestellt. Der durch die FACSAnalyse bestimmte Anteil der CD4+CD25+ T-Zellen an den gesamten CD4+ T-Zellen lag bei der Arbeitsgruppe um Pfützner lediglich bei 1-2 %. Nach Literaturangaben [Dieckmann et al. 2001] sind Werte für den Anteil der CD4+CD25+ T-Zellen an den gesamten CD4+ T-Zellen von etwa 6 % zu erwarten. In der vorliegenden Arbeit zeigt sich ein konstanter Anstieg der Zahl der CD4+CD25+ T-Zellen im Beobachtungszeitraum bei den Patienten, die ausschließlich gegen Bet v 1 allergisch sind. Weitere immunologische Effekte wurden in den o.g. Arbeiten unter SIT beobachtet (z.B. erhöhte Produktion von IL-10). Diese Effekte werden in Zusammenschau mit unseren Ergebnissen diskutiert (s.u.). In unserer Untersuchung ca. 4 Wochen nach Erreichen der Höchstdosis bei der SIT zeigten sich bei Patienten, die ausschließlich auf Bet v 1 allergisch sind, erhöhte Werte der CD4+CD25+ T-Zellen im Vergleich zu den Ausgangswerten (Abbildungen 4-7). Dieser Effekt zeigt sich nicht bei den Patienten, die zusätzlich auf Minorallergene allergisch sind (Abbildungen 8 und 9). Dies steht in Einklang mit den Ergebnissen der Arbeitsgruppe um Bohle: unter täglicher sublingualer Immuntherapie mit Birkenpollenextrakt kam es nach 4 Wochen zu einem deutlichen Anstieg der CD4+CD25+ T-Zellen [Bohle et al. 2007]. Die positiven Effekte der SIT werden zu späteren Zeitpunkten durch an- 115 dere immunologische Effekte bedingt. Später kam es zu einem Abfall der regulatorischen CD4+CD25+ T-Zellen bei Kontrolle 12 Monate nach der SIT etwa auf das Ausgangsniveau vor SIT. Hierfür kommen eine zumindest teilweise klonale Deletion der Allergenspezifischen Lymphozyten oder die Überführung der Allergen-spezifischen T-Lymphozyten in einen anergen Status in Frage; in diesem Zusammenhang wird des Weiteren der Nachweis einer erhöhte Produktion von IFN-γ durch Allergen-spezifische T-Zellen 12 Monate nach Beendigung der SIT als mögliche (Teil-)Ursache beschrieben [Bohle 2008]. Um abschließend die immunologischen Ursachen einer mittel- und langfristigen Allergen-Toleranz nach SIT aufzuklären, sind weitere Untersuchungen erforderlich. Unter unseren Versuchsbedingungen zeigte sich bei der Auswertung der Proliferationsansätze mit unspezifischer Stimulation + durch Anti-CD3/CD28- + Antikörper unter Zugabe des Subsets der CD4 CD25 T-Zellen ein hemmender Effekt auf die Proliferationsfähigkeit der CD4+CD25- Zellen. Die Proliferationsraten konnten im Mittel etwa auf die Hälfte herunter reguliert werden (Abbildung 10). Dies steht im Einklang mit früheren Arbeiten unserer und anderer Arbeitsgruppen [Dieckmann et al. 2001, Sakaguchi 2000, Jutel et al. 2003, SuriPayer et al. 1998, Jonuleit et al. 2003, Shevach 2001, Taylor PA et al. 2001, Jonuleit et al. 2001a, Stephens et al. 2001]. Eine nennenswerte Änderung der Fähigkeit der CD4+CD25+ T-Zellen, im Verlauf in stärkerem Ausmaß die Proliferation zu inhibieren, zeigt sich bei gleichen eingesetzten Zellzahlen nicht (Abbildung 10). Die steigende Zahl der CD4+CD25+ T-Zellen trägt zum positiven Effekt der SIT bei (Abbildungen 4-7). In einer anderen Arbeit [Klimek et al. 1999] war es nicht möglich, einen Effekt der SIT vorrangig auf die Proliferation der kokultivierten T-Zellen nachzuweisen, wobei in diesen Experimenten allerdings die Kulturen direkt aus PBMC angelegt worden waren und nicht wie bei unserer Versuchsanordnung die PBMC zunächst in ihre verschiedenen Subsets durch MACS® aufgetrennt (CD4+, CD4+CD25+, CD4+CD25-) und anschließend separat oder auch in 1:1Regulationsansätzen (CD4+CD25+ und CD4+CD25-) kultiviert wurden. Neben dem Anstieg der Gesamtzahl an CD4+CD25+ T-Zellen im Verlauf der Impftherapie konnten wir in unserer Arbeit einen Anstieg der IL-10-Werte in den Regulationsexperimenten (Zellkulturen mit CD4+CD25- Zellen und CD4+CD25+ Zellen im Verhältnis 1:1 im unspezifisch stimulierten Ansatz) bei Blutentnah- 116 me 5 (2-4 Wochen nach der 4. und letzten verabreichten Allergie-Vakzine) nachweisen. Diese Ergebnisse zeigten sich im Verlauf der SIT bei Patienten, die ausschließlich auf das Hauptallergen Bet v 1 allergisch reagierten (Abbildung 29). Die Patienten hingegen, die außer auf Bet v 1 zusätzlich noch auf Minorallergene allergisch sind, zeigten im entsprechenden Ansatz keinen Anstieg von IL-10 im Verlauf der Behandlung (Abbildung 30). Diese Ergebnisse sind hinweisgebend darauf, dass Patienten die ausschließlich auf das Hauptallergen, im vorliegenden Fall Bet v 1, sensibilisiert sind, von einer SIT in höherem Maße profitieren, da ihre Sensibilisierungsprofile offensichtlich besser von der Allergievakzine abgedeckt sind, die leichter einen immunologischen Switch induzieren kann, als in einem Milieu konkurrierender Allergene. Dass es tatsächlich die regulatorischen CD4+CD25+ T-Zellen sind, die an der IL-10-Produktion mittelbar oder unmittelbar beteiligt sind, konnten wir in dieser Arbeit auch dadurch belegen, dass die CD4+CD25+ Zellen in den separaten Kulturen im unspezifisch stimulierten Ansatz etwa die doppelte Menge an IL-10 produzierten als dies die CD4+CD25- Zellen vermochten (Abbildung 31), was im Einklang mit den vorbeschriebenen Erkenntnissen aus anderen Arbeitsgruppen steht [Nouri-Aria et al. 2004, Bohle et al. 2007, Blaser et al. 2004]. In einer früheren Arbeit, in der PBMC-Zellkulturen aus dem peripheren Blut SITbehandelter Bienengift-Allergiker vor und während der SIT gegen Bienengift angelegt wurden, wurde beschrieben, dass die Produktion der Zytokine IL-5, IL-13 und IFN-γ in den PBMC-Zellkulturüberständen nach 5tägiger Inkubation abnahm; die Konzentration von IL-10 in den PBMC-Zellkulturüberständen hingegen nahm nach 5tägiger Inkubation unter der SIT zu [Akdis CA et al. 1998]. In einer weiteren Arbeit (mit ähnlichem Setting), in der PBMC-Zellkulturen aus dem peripheren Blut SIT-behandelter Bienen- und Wespengift-Allergiker vor und während der SIT gegen Bienen- bzw. Wespengift angelegt wurden, wurde beschrieben, dass in den PBMC-Zellkulturüberständen die Konzentration von IL-10 im Verlauf der SIT zunahm [Bellinghausen et al. 1997]. In den durch autologe dendritische Zellen stimulierten Ansätzen wurden unter den Versuchsbedingungen der vorliegenden Arbeit keine nennenswerte Zytokin-Produktion in den Zellkulturüberständen nachgewiesen (alle Ansätze sowohl vor als auch während als auch nach der SIT waren unterhalb oder allenfalls im Bereich der Nachweisgrenze des ELISAs, vgl. auch Kapitel 5.5). In anderen 117 Versuchsansätzen wurde die IL-10- und IL-12-Produktion in den Zellkulturüberständen Antigen-präsentierender Zellen erhöht nachgewiesen [Bohle et al. 2007, Blaser et al. 2004, Durham et al. 1998, Ebner 1999]. In zahlreichen Arbeiten wurde beschrieben, dass die Produktion und die Zunahme von IL-10 im Serum mit dem klinischen Ansprechen der SIT korreliert [Blaser et al. 2004, Akdis CA et al. 1998, Bellinghausen et al. 1997, Durham et al. 1998, Ebner 1999, Jonuleit et al. 2003]. In diesen Arbeiten werden als Ansätze für den Wirkungsmechanismus, u.a. die Inhibition von antigenpräsentierenden Zellen oder auch die direkten antiproliferativen Effekte auf T-Zellen, aufgezeigt [Ding et al. 1992, Fiorentino et al. 1991, Takeuchi et al. 1998, Kitani et al. 2000, Sakaguchi et al. 2008, Sakaguchi et al. 2009, Letterio et al. 1998, Moore KW et al. 2001, Gorelik et al. 2000]. Bohle beschreibt einen Abfall des IL-10-Wertes etwa auf den ursprünglichen Wert vor der SIT 12 Monate nach Erreichen der Höchstdosis bei der SIT [Bohle et al. 2007, Bohle 2008], wobei hier nach 12 Monaten keine erhöhten IL-10-Werte und keine erhöhte Zahl von CD4+CD25+ Zellen mehr festgestellt wurden; dies wurde dahingehend bewertet, dass zu späteren Zeitpunkten im Verlauf der SIT die immunologischen Veränderungen, die durch die SIT hervorgerufen werden, nicht mehr durch regulatorische T-Zellen vermittelt werden, sondern möglicherweise durch klonale Reduktion der Allergen-spezifischen T-Zellen oder der Übergang der Allergen-spezifischen T-Zellen in einen anergen Zustand. Für die positiven Langzeiteffekte der SIT kann die zu diesem Zeitpunkt im Vergleich zu den Ausgangswerten erhöhte Produktion von IFN-γ durch Allergen-spezifische T-Zellen ursächlich sein [Sakaguchi 2000, Durham et al. 1998, Secrist et al. 1993, Varney et al. 1993, Durham et al. 1996, Iliopoulos et al. 1991, van Neerven 1999b, Till et al. 1997, Jutel et al. 1995, McHugh SM et al. 1995, Akdis CA et al. 1998]. Effekte der SIT auf Zytokinebene wurden mit dem Ausdruck des „Th2/Th1Shifts“ zusammenfassend beschrieben [Secrist et al. 1993, Ebner et al. 1997, Eusebius et al. 2002, Varney et al. 1993, Durham et al. 1996, Hamid et al. 1997]: Hierbei kommt es im Verlauf der Allergenexposition zu einer Verschiebung des Zytokinsekretionsmusters der Allergen-spezifischen Zellen weg vom Th2-Profil, das große Mengen an IL-4 (IgE-heavy-chain-switching in B-Zellen mit nachfolgender Produktion von Antikörpern) und IL-5 (selektive Differenzierung, Lebensverlängerung und Aktivierung von Eosinophilen [Lopez et al. 118 1988]) aufweist, hin zu einer Immunantwort vom Th1-Profil, wobei vor allem große Mengen an IFN-γ produziert werden. Zellen vom Th1-Typ führen auch zu zellvermittelter Immunität, indem sie Makrophagen oder CD8+ zytotoxische Lymphozyten aktivieren [Sakaguchi 2000]. Diese Beobachtungen wurden sowohl unter konventioneller Pollen-Immuntherapie über mehrere Monate hinweg [Durham et al. 1998, Secrist et al. 1993, Varney et al. 1993, Durham et al. 1996, Iliopoulos et al. 1991, van Neerven 1999b, Till et al. 1997] als auch unter schnellen und ultra-schnellen Regimen [Jutel et al. 1995, McHugh SM et al. 1995, Akdis CA et al. 1998] gemacht. In weiteren Arbeiten wird zusätzlich darüber berichtet, dass IL-10 die Produktion von IgE hin zu IgG4 verschieben kann [Akdis CA et al. 2009, Punnonen et al. 1993, Bohle et al. 2007, Blaser et al. 2004, Bodtger et al. 2005]. Bei der Allergen-spezifischen Stimulation der verschiedenen T-Zell-Fraktionen lässt sich deutlich erkennen, dass die Stimulation mittels dendritischer Zellen, die mit dem Hauptallergen der Birke rBet v 1 beladen sind, eine deutlich stärkere Proliferation der CD4+ bulk Zellen (Abbildung 11) und der CD4+CD25- Zellen (Abbildung 14) bewirkt. Es lässt sich somit klar eine Allergen-spezifische Stimulierbarkeit (durch das Hauptallergen der Birke rBet v 1) seitens der proliferierenden Zellen (CD4+ bulk Zellen, CD4+CD25- Zellen) nachweisen. Eine Dosisabhängigkeit konnte bereits Blaser nachweisen [Jutel et al. 2003, Blaser et al. 2004], wobei er aufzeigte, dass es im Rahmen der SIT gegen Hausstaubmilbenallergen erst dann zu einem Anstieg der Zahl der regulatorischen T-Zellen kam, wenn eine bestimmte Allergendosis bei der Hyposensibilisierungsbehandlung erreicht bzw. überschritten wurde. Titrationen im Allergengehalt wurden in der vorliegenden Arbeit nicht durchgeführt. In der vorliegenden Pilotstudie zur Etablierung der Read-out-Systems unter SIT kam es bis zur 5. Blutentnahme, die 4 Wochen nach Erreichen der Höchstdosis durchgeführt wurde, zu keinem relevanten Abfall der Proliferationswerte bei der Allergen-unspezifischen Stimulation mit Anti-CD3/CD28-Antikörpern (vgl. Kapitel 5.3 inkl. Abbildung 10). Bei der Stimulation mit Bet v 1-beladenen (Allergen-spezifische Stimulation) als auch mit unbeladenen dendritischen Zellen (Allergen-unspezifische Stimulation) (Abbildungen 11-23) zeigen sich bei Betrachtung des Kollektivs der Bet v 1Mono-Sensibilisierten bei konstant eingesetzten Zellzahlen sowohl bei den CD4+ bulk Zellen (Abbildung 12) als auch bei den CD4+CD25- Zellen (Abbil- 119 dung 15) Hinweise auf eine Rückläufigkeit der Proliferation während und wenige Wochen nach Durchführung der SIT. Bei dem Kollektiv der Bet v 1-/Minorallergen-Sensibilisierten zeigen sich keine Hinweise auf eine Rückläufigkeit der Proliferation während und wenige Wochen nach Durchführung der SIT – weder bei den CD4+ bulk Zellen (Abbildung 13) noch bei den CD4+CD25- Zellen (Abbildung 16). In den Untersuchungsergebnissen anderer Arbeiten [Jutel et al. 2003] wurde eine Abnahme der Proliferationbereitschaft der Effektorzellen unter SIT ebenfalls beschrieben, wobei die Kontrollen nach mehreren Monaten durchgeführt wurden und keine Unterscheidung zwischen mono- und polysensibilisierten Patienten gemacht wurde; in der vorliegenden Arbeit lagen 4 Wochen nach Erreichen der Allergenhöchstdosis Hinweise auf eine Abnahme der Proliferationbereitschaft der Allergen-spezifischen Effektorzellen unter SIT vor. In Folgearbeiten zu der vorliegenden Pilotuntersuchung wird eine Nachverfolgung über mehrere Monate erfolgen. In der vorliegenden Arbeit wurde ebenfalls der Verlauf der IgE-, IgG- und IgG4Antikörper im Serum vor der SIT und 4 Wochen nach Erreichen der Höchstdosis der SIT untersucht, wobei die Induktion von IgG4-Antikörpern im Rahmen der SIT die Aktivierung von CD4+ T-Zellen durch Inhibition der Serum-IgEvermittelten Allergen-Präsentation durch CD23- oder Fcε-RI-tragende Antigenpräsentierenden Zellen (APC) reduziert („blocking-antibody“-Theorie) [van Neerven et al. 1999a, Bodtger et al. 2005, Witteman et al. 1996, Golden et al. 1982]. Spezifische IgE-Antikörper gegen Birkenpollengesamtextrakt steigen im Untersuchungsintervall bis 4 Wochen nach SIT bei den Patienten, die ausschließlich auf das Hauptallergen Bet v 1 allergisch reagieren, nicht an. Bei den Patienten, die außer auf Bet v 1 zusätzlich auf Minorallergene allergisch sind, war im Verlauf der SIT ein geringer Anstieg festzustellen (Abbildungen 32 und 33). Ein Anstieg von Allergen-spezifischen IgE-Antikörpern vor einem Anstieg der „kompensatorischen“ und die o.g. Wirkung vermittelnden Allergen-spezifischen IgGund IgG4-Antikörpern wurde häufig beschrieben [Akdis M et al. 2007, Bodtger et al. 2005, van Neerven et al. 1999a, Witteman et al. 1996, Golden et al. 1982] (vgl. auch unten). Die Serumkonzentration des rBet v 1-spezifischen IgE weist bei beiden Patientengruppen im Verlauf der SIT einen konstanten Verlauf auf (Abbildungen 34 und 35). 120 Es zeigte sich kein Anstieg der IgG-Werte gegen Birkenpollengesamtextrakt im Serum beider Patientengruppen im Verlauf der SIT (Abbildungen 40 und 41). Des Weiteren zeigte sich im Verlauf der SIT ein leichter Anstieg der IgG-Werte gegen Bet v 1 im Serum der ausschließlich Bet v 1-sensibilisierten Patienten (Abbildung 42); bei den polysensibilisierten Patienten zeigt sich ein leichter Abfall (Abbildung 43). Bei beiden mit o.g. Kurzzeitvakzine behandelten Patientengruppen zeigt sich im Untersuchungszeitraum kein Anstieg der IgG4-Antikörper (Birkenpollengesamtextrakt) im Serum im Verlauf der SIT (Abbildungen 48 und 49). In der vorliegenden Arbeit waren keine messbaren IgG4-Antikörper gegen rBet v 1 im Serum beider Patientengruppen nachzuweisen (Abbildungen 50, 51a und b). In der Literatur wird ein Anstieg der Allergen-spezifischen IgG- und IgG4Antikörper zumeist erst nach Monaten nach Einleitung einer SIT beschrieben [Akdis M et al. 2007]. In den initiierten Folgearbeiten sind auch mittel- und langfristige Verlaufsuntersuchungen vorgesehen. Die durch die SIT hervorgerufene Besserung des klinischen Befundes korreliert zeitlich nicht eng mit den beobachteten immunologischen Veränderungen (Abfall des spezifischen IgE nach anfänglichem Anstieg und vermehrte Synthese von spezifischen IgG und IgG4) [Akdis M et al. 2007, Birkner et al. 1990, Bodtger et al. 2005, Durham et al. 1998, Reid et al. 1986, Lichtenstein et al. 1973, Djurup et al. 1984, Bousquet et al. 1988], die sich nicht durchgehend bei allen hyposensibilisierten Patienten gleichermaßen einstellen [Heiss et al. 1999]. Zusammenfassend konnte in der vorliegenden Arbeit gezeigt werden, dass CD4+CD25+ regulatorische T-Zellen bei der Behandlung von allergischen Erkrankungen eine wichtige Rolle spielen; Patienten, die ausschließlich gegen Bet v 1 sensibilisiert sind, vorrangig immunologische Veränderungen zeigten, die für einen therapeutischen Effekt sprechen. Unter Therapie wurden regulatorische CD4+CD25+ T-Zellen induziert, für deren regulatorische Natur spricht, dass sie selbst in Kultur kaum proliferieren und dass sie die Fähigkeit zur Proliferationsinhibition bei CD4+CD25T-Zellen im Allergen-spezifischen und -unspezifischen Ansatz aufweisen. Bei den Patienten, die ausschließlich auf das Hauptallergen der Birke Bet v 1 allergisch sind, nahm der Anteil der CD4+CD25+ regulatorischen T-Zellen an den Gesamt-PBMC im Verlauf der SIT zu; dies gibt Hinweis da- 121 rauf, dass der Effekt der SIT unter anderem auf einer Zunahme der Zahl der CD4+CD25+ regulatorischen T-Zellen beruht. Es kam zu einem Anstieg der Konzentration von IL-10 im Verlauf der SIT und unmittelbar nach Beendigung der SIT (1:1-Regulationsexperimente zwischen CD4+CD25- T-Zellen und CD4+CD25+ T-Zellen im Allergenunspezifisch stimulierten Ansatz bei Bet v 1-allergischen Patienten). Bei der Stimulation mit Bet v 1-beladenen (Allergen-spezifische Stimulation) als auch mit unbeladenen dendritischen Zellen (Allergen-unspezifische Stimulation) zeigen sich bei den Bet v 1-monosensibilisierten Patienten bei den CD4+ bulk Zellen und den CD4+CD25- Zellen Hinweise auf eine Rückläufigkeit der Proliferation während und wenige Wochen nach Durchführung der SIT. Bei der Allergen-unspezifischen Stimulation mit Anti-CD3/CD28-Antikörpern kam es zu keinem relevanten Abfall der Proliferation der Effektorzellen. Ein wesentlicher Anstieg der Allergen-spezifischen IgG- und IgG4-Antikörper gegen Birkenpollengesamtextrakt und rBet v 1 im Serum konnte im Verlauf des 1. SIT-Zyklus und 4 Wochen nach Erreichen der Allergen-Höchstdosis nicht beobachtet werden. Die derzeit kommerziell erhältlichen Allergievakzinen sind zumeist nach ihrem Gehalt am Hauptallergen standardisiert, im Fall der Birkenpollenvakzinen also Bet v 1. In Anbetracht oben dargelegter Ergebnisse ist ein Verbesserungspotential bezüglich der peripheren Toleranzinduktion und des therapeutischen Effekts – insbesondere bei polysensibilisierten Patienten – durch Einsatz von Allergievakzinen zu erwarten, die auf rekombinanten Allergenen basieren und auf das individuelle Sensibilisierungsprofil des jeweiligen Patienten abgestimmt sind. Dies soll in Folgeuntersuchungen überprüft werden. 122 7. Literaturverzeichnis 1. Akdis CA, Akdis M (2009). Mechanisms and treatment of allergic disease in the big picture of regulatory T cells. J Allergy Clin Immunol; 123: 735-746 2. Akdis CA, Blesken T, Akdis M, Wuthrich B, Blaser K (1998). Role of interleukin 10 in specific immunotherapy. J Clin Invest; 102: 98-106 3. Akdis M, Akdis CA (2007). Mechanisms of allergen-specific immunotherapy. J Allergy Clin Immunol; 119: 780-791 4. Akdis M, Blaser K, Akdis CA (2005). T regulatory cells in allergy: novel concepts in the pathogenesis, prevention, and treatment of allergic diseases. J Allergy Clin Immunol; 116: 961-9 5. Allan E, Crome SQ, Crellin NK, Passerini L, Steiner TS, Bacchetta R, Roncarolo MG, Levings MK (2007). Activation-induced FOXP3 in human T effector cells does not suppress proliferation or cytokine production. Int Immunol; 19: 345-54 6. Asseman C, Mauze S, Leach MW, Coffman RL, Powrie F (1999). An essential role for interleukin 10 in the function of regulatory T cells that inhibit intestinal inflammation. J Exp Med; 190: 995-1004 7. Awasthi A, Kuchroo VK (2009). Th17 cells: from precursors to players in inflammation and infection. Int Immunol; 21:489-98 8. Bacchetta R, Gambineri E, Roncarolo MG (2007). Role of regulatory T cells and FOXP3 in human diseases. J Allergy Clin Immunol; 120: 227-37a 9. Bellinghausen I, Metz G, Enk AH, Christmann S, Knop J, Saloga J (1997). Insect venom immunotherapy induces interleukin-10 production and a Th2- 123 to-Th1 shift, and changes surface marker expression in venom-allergic subjects. Eur J Immunol; 27: 1131-1139 10. Bettelli E, Korn T, Oukka M, Kuchroo VK (2008). Induction and effector functions of T(H)17 cells. Nature; 453:1051-7 11. Birkner T, Rumpold H, Jarolim E, Ebner H, Breitenbach M, Skvaril F, Scheiner O, Kraft D (1990). Evaluation of immunotherapy-induced changes in specific IgE, IgG and IgG subclasses in birch pollen allergic patients by means of immunobloting. Correlation with clinical response. Allergy; 45: 418-426 12. Blaser K, Akdis CA (2004). Interleukin-10, T regulatory cells and specific allergy treatment. Clin Exp Allergy; 34: 328-331 13. Bluestone JA, Abbas AK (2003). Natural versus adaptive regulatory T cells. Nature Reviews; 3: 253-257 14. Bodtger U, Ejrnaes AM, Hummelshoj L, Jacobi HH, Poulsen LK, Svenson M (2005). Is immunotherapy-induced birch-pollen-specific IgG4 a marker for decreased allergen-specific sensitivity?. Int Arch Allergy Immunol; 136: 340346 15. Bohle B, Kinaciyan T, Gerstmayr M, Radakovics A, Jahn-Schmid B, Ebner C (2007). Sublingual immunotherapy induces IL-10-producing T regulatory cells, allergen-specific T-cell tolerance, and immune deviation. J Allergy Clin Immunol; 120: 707-713 16. Bohle B (2008). T cell responses during allergen-specific immunotherapy of Type I allergy. Front Biosci; 13: 6079-6085 17. Bousquet J, Lockey RF, Malling HJ (1998). Allergen immunotherapy – therapeutic vaccines for allergic diseases. Allergy; 53 (Suppl. 44): 4-42 124 18. Bousquet J, Maasch H, Martinot B, Hejjaoui A, Wahl R, Michel FB (1988). Double-blind, placebo-controlled immunotherapy with mixed grass-pollen allergoids. II. Comparison between parameters assessing the efficacy of immunotherapy. J Allergy Clin Immunol; 82: 439-446 19. Campbell DJ, Ziegler SF (2007). FOXP3 modifies the phenotypic and functional properties of regulatory T cells. Nat Rev Immunol; 7: 305-10 20. Casolaro S, Georas SN, Song Z, Ono SJ (1996). Biology and genetics of atopic disease. Curr Opin Immunol; 8: 796-803 21. Chai JG, Tsang JY, Lechler R, Simpson E, Dyson J, Scott D (2002). CD4+CD25+ T cells as immunoregulatory T cells in vitro. Eur J Immunol; 32: 2365-2375 22. Chen W, Jin W, Wahl SM. Engagement of cytotoxic T lymphocyteassociated antigen 4 (CTLA-4) induces transforming growth factor beta (TGF-beta) production by murine CD4(+) T cells (1998). J Exp Med; 188: 1849-1857 23. Creticos PS, Adkinson NF Jr, Kagey-Sobotka A, Proud D, Meier HL, Naclerio RM, Lichtenstein LM, Norman PS (1985). Nasal challenge with ragweed pollen in hay fever patients. Effect of immunotherapy. J Clin Invest; 76: 2247-2253 24. Cromwell O, Fiebig H, Suck R, Kahlert H, Nandy A, Kettner J, Narkus A (2006). Strategies for Recombinant Allergen Vaccines and Fruitful Results from First Clinical Studies. Immunol Allergy Clin N Am; 26: 261-281 25. Des Roches A, Paradis L, Menardo JL, Bouges S, Daures JP, Bousquet J (1997). Immunotherapy with a standardized Dermatophagoides pteronyssinus extract. VI. Specific immunotherapy prevents the onset of new sensitizations in children. J Allergy Clin Immunol; 99: 450-453 125 26. Dieckmann D, Ploettner H, Berchtold S, Berger T, Schuler G (2001). Ex vivo isolation and characterization of CD4+CD25+ T cells with regulatory properties from human blood. J Exp Med; 193: 1303-1310 27. Ding L, Shevach EM (1992). IL-10 inhibits mitogen-induced T cell proliferation by selectively inhibiting macrophage costimulatory function. J Immunol; 148: 3133-3139 28. Djurup R, Osterballe O (1984). IgG subclass antibody response in grass pollen-allergic patients undergoing specific immunotherapy. Prognostic value of serum IgG subclass antibody levels early in immunotherapy. Allergy; 39: 433-441 29. Drachenberg KJ, Heinzkill M, Urban E (2002). Kurzzeit-Immuntherapie mit Baumpollen-Allergoiden und dem Adjuvans Monophosphoryl Lipid-A. Allergologie; 25: 466-474 30. Drachenberg KJ, Heinzkill M, Urban E, Woroniecki SR (2003). Efficacy and tolerability of short-term specific immunotherapy with pollen allergoids adjuvanted by monophosphoryl lipid A (MPL®) for children and adolescents. Allergol et Immunopathol; 31: 270-277 31. Drachenberg KJ, Wheeler AW, Stuebner P, Horak F (2001). A well-tolerated grass pollen-specific allergy vaccine containing a novel adjuvant, monophosphoryl lipid A, reduces allergic symptoms after only four preseasonal injections. Allergy; 56: 498-505 32. Durham SR, Till SJ (1998). Immunological changes associated with allergen immunotherapy. J Allergy Clin Immunol; 102: 157-164 33. Durham SR, Ying S, Varney VA, Jacobson MR, Sudderick RM, Mackay IS, Kay AB, Hamid QA (1996). Grass pollen immunotherapy inhibits allergeninduced infiltration of CD4+ T lymphocytes and eosinophils in the nasal mucosa and increases the number of cells expressing messenger RNA for interferon-gamma. J Allergy Clin Immunol; 97: 1356-1365 126 34. Ebner C (1999). Immunological mechanisms in allergen-specific immunotherapy: impact on future trends in type-1 allergy management, Wien Med Wochenschr; 149: 438-441 35. Ebner C, Siemann U, Bohle B, Willheim M, Wiedermann U, Schenk S, Klotz F, Ebner H, Kraft D, Scheiner O (1997). Immunological changes during specific immunotherapy of grass pollen allergy: reduced lymphoproliferative responses to allergen and shift from TH2 to TH1 in T cell clones specific for Phl p 1, a major grass pollen allergen. Clin Exp Allergy; 27: 1007-1015 36. Eusebius NP, Papalia L, Suphoiglu C, McLellan SC, Varney M, Rolland JM, O’Hehir RE (2002). Oligoclonal analysis of the atopic T cell response to the group 1 allergen of Cynodon dactylon (Bermuda grass) pollen: pre- and post-allergen-specific immunotherapy. Int Arch Allergy Immunol; 127: 234244 37. Fiorentino DF, Zlotnik A, Vieira P, Mosmann TR, Howard M, Moore KW, O'Garra A (1991). IL-10 acts on the antigen-presenting cell to inhibit cytokine production by Th1 cells. J Immunol; 146: 3444-3451 38. Francis JN, Till SJ, Durham SR (2003). Induction of IL-10+CD4+CD25+ T cells by grass pollen immunotherapy. J Allergy Clin Immunol; 111: 12551261 39. Frankland AW, Augustin R (1954). Prophylaxis of summer hay-fever and asthma: a controlled trial comparing crude grass-pollen extracts with the isolated main protein component. Lancet; 1:1055-1057 40. Freeman J, Noon L (1911). Further observations on the treatment of hayfever by hypodermic inoculations of pollen vaccine. Lancet; 1: 814-817 41. Furin MJ, Norman PS, Creticos PS, Proud D, Kagey-Sobotka A, Lichtenstein LM, Naclerio RM (1991). Immunotherapy decreases antigen-induced eosinophil cell migration into the nasal cavity. J Allergy Clin Immunol; 88: 27-32 127 42. Gardner LM, Thien FC, Douglass JA, Rolland JM, O’Hehir RE (2004). Induction of T ‚regulatory‘ cells by standardized house dust mite immunotherapy: an increase in CD4+ CD25+ interleukin-10+ T cells expressing peripheral tissue trafficking markers. Clin Exp Allergy; 34: 1209-1219 43. Gershon RK (1975). A disquisition on suppressor T cells. Transplant Rev; 26: 170-185 44. Golden DB, Meyers DA, Kagey-Sobotka A, Valentine MD, Lichtenstein LM (1982). Clinical relevance of the venom-specific immunoglobulin G antibody level during immunotherapy. J Allergy Clin Immunol; 69: 489-493 45. Gorelik L, Flavell RA (2000). Abrogation of TGFbeta signaling in T cells leads to spontaneous T cell differentiation and autoimmune disease. Immunity; 12: 171-181 46. Hamid QA, Schotman E, Jacobson MR, Walker SM, Durham SR (1997). Increase in IL-12 messenger RNA+ cells accompany inhibition of allergeninduced late skin responses after successful grass pollen immunotherapy. J Allergy Clin Immunol; 99: 254-260 47. Hara M, Kingsley CI, Niimi M, Read S, Turvey SE, Bushell AR, Morris PJ, Powrie F, Wood KJ (2001). IL-10 is required for regulatory T-cells to mediate tolerance to alloantigens in vivo. J Immunol; 166: 3789-3796 48. Heiss S, Mahler V, Steiner R, Spitzauer S, Schweiger C, Kraft D, Valenta R (1999). Component-Resolved Diagnosis (CRD) of Type I Allergy with Recombinant Grass and Tree Pollen Allergens by Skin Testing. The Journal Of Investigative Dermatology; 113: 830-837 49. Iliopoulos O, Proud D, Adkinson NF Jr, Creticos PS, Norman PS, KageySobotka A, Lichtenstein LM, Naclerio RM (1991). Effects of immunotherapy on the early, late, and rechallenge nasal reaction to provokation with allergen: changes in inflammatory mediators and cells. J Allergy Clin Immunol; 87: 855-866 128 50. Jeannin P, Lecoanet S, Delneste Y, Gauchat JF, Bonnefoy JY (1998). IgE versus IgG4 production can be differentially regulated by IL-10. J Immunol; 160: 3555-3561 51. Jonuleit H, Schmitt E (2003). The regulatory T cell family: distinct subsets and their interrelations. J Immunol; 171: 6323-6327 52. Jonuleit H, Schmitt E, Schuler G, Knop J, Enk AH (2000). Induction of interleukin 10-producing, nonproliferating CD4+ T cells with regulatory properties by repetitive stimulation with allogeneic immature human dendritic cells. J Exp Med; 192: 1213-1222 53. Jonuleit H, Schmitt E, Stassen M, Tuettenberg A, Knop J, Enk AH (2001). Identification and functional characterization of human CD4+CD25+ T cells with regulatory properties isolated from peripheral blood. J Exp Med; 193: 1285-1294 (zitiert als „Jonuleit et al. 2001a“) 54. Jonuleit H, Schmitt E, Steinbrink K, Enk AH (2001). Dendritic cells as a tool to induce anergic and regulatory T cells. Trends Immunol; 22: 394-400 (zitiert als „Jonuleit et al. 2001b“) 55. Jutel M, Jaeger L, Suck R, Meyer H, Fiebig H, Cromwell O (2005). Allergenspecific immunotherapy with recombinant grass pollen allergens. J Allergy Clin Immunol; 116: 608-613 56. Jutel M, Akdis M, Budak F, Aebischer-Casaulta C, Wrzyszcz M, Blaser K, Akdis CA (2003). IL-10 and TGF-beta cooperate in the regulatory T cell response to mucosal allergens in normal immunity and specific immunotherapy. Eur J Immunol; 33: 1205-1214 57. Jutel M, Pichler WJ, Skrbic D, Urwyler A, Dahinden C, Muller UR (1995). Bee venom immunotherapy results in decrease of IL-4 and IL-5 and increase of IFN-gamma secretion in specific allergen-stimulated T cell cultures. J Immunol; 154: 4187-4194 129 58. Kay AB (1997). Allergy and Allergic Diseases. Oxford: Blackwell Science. 59. Kitani A, Fuss IJ, Nakamura K, Schwartz OM, Usui T, Strober W (2000). Treatment of experimental (Trinitrobenzene sulfonic acid) colitis by intranasal administration of transforming growth factor (TGF)-β1 plasmid: TGF-β1mediated suppression of T helper cell type 1 response occurs by interleukin (IL)-10 induction and IL-12 receptor β2 chain downregulation. J Exp Med; 192: 41-52 60. Kleine-Tebbe J, Bergmann KC, Friedrichs F, Fuchs T, Jung K, Klimek L, Kühr J, Lässig W, Lepp U, Niggemann B, Rakoski J, Rebien W, Renz H, Saloga J, Simon J, Sitter H, Virchow C, Worm M (2006). Die spezifische Immuntherapie (Hyposensibilisierung) bei IgE-vermittelten allergischen Erkrankungen. Allergo J; 15: 56-74a 61. Klimek L, Dormann D, Jarman ER, Cromwell O, Riechelmann H, ReskeKunz AB (1999). Short-term preseasonal birch pollen allergoid immunotherapy influences symptoms, specific nasal provocation and cytokine levels in nasal secretions, but not peripheral T-cell responses, in patients with allergic rhinitis. Clin Exp Allergy; 29: 1326-1335 62. Kuniyasu Y, Takahashi T, Itoh M, Shimizu J, Toda G, Sakaguchi S (2000). Naturally anergic and suppressive CD4(+)CD25(+) T cells as a functionally and phenotypically distinct immunoregulatory T cell subpopulation. Int Immunol; 12: 1145-1155 63. Letterio JJ, Roberts AB (1998). Regulation of immune responses by TGF-β. Annu Rev Immunol; 16: 137-161 64. Lichtenstein LM, Ishizaka K, Norman PS, Sobotka AK, Hill BM (1973). IgE antibody measurements in ragweed hayfever. Relationship to clinical severity and the results of immunotherapy. J Clin Invest; 52: 472-482 130 65. Lopez AF, Sanderson CJ, Gamble JR, Campbell HD, Young IG, Vadas MA (1988). Recombinant human interleukin-5 is a selective activator of human eosinophil function. J Exp Med; 157: 219-225 66. Mahler V, Fischer S, Heiss S, Duchene M, Kraft D, Valenta R (2001). cDNA Cloning and Characterization of a Cross-Reactive Birch Pollen Allergen: Identification as a Pectin Esterase. Int Arch Allergy Immunol; 124: 64-66 67. McAllen MK (1969). Hyposensitisation in grass pollen hay fever: a double blind trial of alumn precipitated pollen extracts and depot emulsion pollen extract compared with placebo injections. Acta Allergol; 24: 421-431 68. McHugh RS, Shevach EM, Thornton AM (2001). Control of organ-specific autoimmunity by immunoregulatory CD4(+)CD25(+) T cells. Microbes Infect; 3: 919-927 69. McHugh SM, Deighton J, Stewart AG, Lachmann PJ, Ewan PW (1995). Bee venom immunotherapy induces a shift in cytokine responses from a TH-2 to a TH-1 dominant pattern: comparison of rush and conventional immunotherapy. Clin Exp Allergy; 25: 828-838 70. Möbs C, Slotosch C, Löffler H, Jakob T, Hertl M, Pfützner W (2010). Birch Pollen Immunotherapy Leads to Differential Induction of Regulatory T Cells and Delayed Helper T Cell Immune Deviation. J Immunol; 184: 2194-2203 71. Moore A, McCarthy L, Mills KH (1999). The adjuvant combination monophosphoryl lipid A and QS21 switches T cell responses induced with a soluble recombinant HIV protein from Th2 to Th1. Vaccine; 17: 2517-2527 72. Moore KW, de Waal Malefyt R, Coffman RL, O’Garra A (2001). Interleukin10 and the interleukin-10 receptor. Annu Rev Immunol; 19: 683-765 73. Nakamura K, Kitani A, Strober W (2001). Cell contact-dependent immunosuppression by CD4(+)CD25(+) regulatory T cells is mediated by cell surface-bound transforming growth factor beta. J Exp Med; 194: 629-644 131 74. Niederberger V, Pauli G, Grönlund H, Fröschl R, Rumpold H, Kraft D, Valenta R, Spitzauer S (1998). Recombinant birch pollen allergens (rBet v 1 and rBet v 2) contain most of the IgE epitopes present in birch, alder, hornbeam, hazel, and oak pollen: A quantitative IgE inhibition study with sera from different populations. J Allergy Clin Immunol; 102: 579-591 75. Nouri-Aria KT, Wachholz PA, Francis JN, Jacobson MR, Walker SM, Wilcock LK, Staple SQ, Aalberse RC, Till SJ, Durham SR (2004). Grass pollen immunotherapy induces mucosal and peripheral IL-10 responses and blocking IgG activity. J Immunol; 172: 3252-3259 76. Ortolani C, Pastorello E, Moss RB, Hsu YP, Restuccia M, Joppolo G, Miadonna A, Cornelli U, Halpem G, Zanussi C (1984). Grass pollen immunotherapy: a single year double-blind, placebo-controlled study in patients with grass pollen induced asthma and rhinitis. J Allergy Clin Immunol; 73: 283-290 77. Otsuka H, Mezawa A, Ohnishi M, Okubo K, Seki H, Okuda M (1991). Changes in nasal metachromatic cells during allergen immunotherapy. Clin Exp Allergy; 21: 115-119 78. Punnonen J, De Waal Malefyt R, Van Vlasselaer P, Gauchat J-F, De Vries JE (1993). IL-10 and viral IL-10 prevent IL-4-indiced IgE synthesis by inhibiting the accessory cell function of monocytes. J Immunol; 151: 1280-9 79. Rak S, Bjönson A, Håkanson L, Sorenson S, Venge P (1991). The effect of immunotherapy on eosinophil accumulation and production of eosinophil chemotactic activity in the lung of subjects with asthma during natural pollen exposure. J Allergy Clin Immunol; 88: 878-888 80. Read S, Malmstrom V, Powrie F (2000). Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD4+CD25+ regulatory cells that control intestinal inflammation. J Exp Med; 192: 295-302 132 81. Reid MJ, Moss RB, Hsu YP, Kwasnicki JM, Commerford TM, Nelson BL (1986). Seasonal asthma in northern California : allergic causes and efficacy of immunotherapy. J Allergy Clin Immunol; 78: 590-600 82. Rocklin RE, Sheffer AL, Greineder DK, Melmon KL (1980). Generation of antigen-specific suppressor cells during allergy desensitization. N Engl J Med; 302: 1213-1219 83. Sakaguchi S (2001). Policing the regulators. Nature Immunology; 2: 283284 84. Sakaguchi S (2000). Regulatory T Cells: Key Controllers of Immunologic Self-Tolerance. Cell; 101: 455-458 85. Sakaguchi S, Shimon T. Naturally arising CD4+ regulatory T cells for immunologic self-tolerance and negative control of immune responses (2004). Annual Review of Immunology; 22: 531-562 86. Sakaguchi S, Yamaguchi T, Nomura T, Ono M (2008). Regulatory T cells and immune tolerance. Cell; 133: 775-87 87. Sakaguchi S, Wing K, Yamaguchi T (2009). Dynamics of peripheral tolerance and immune regulation mediated by Treg. Eur J Immunol; 39: 2331-6 88. Salomon B, Lenschow DJ, Rhee L, Ashourian N, Singh B, Sharpe A, Bluestone JA (2000). B7/CD28 costimulation is essential for the homeostasis of the CD4+CD25+ immunoregulatory T cells that control autoimmune diabetes. Immunity; 12: 431-440 89. Secrist H, Chelen CJ, Wen Y, Marshall JD, Umetsu DT (1993). Allergen immunotherapy decreases interleukin 4 production in CD4+ T cells from allergic individuals. J Exp Med; 178: 2123-2130 133 90. Seddon B, Mason D (1999). Peripheral autoantigen induces regulatory T cells that prevent autoimmunity. J Exp Med; 189: 877-882 (zitiert als „Seddon et al. 1999a”) 91. Seddon B, Mason D (1999). Regulatory T cells in the control of autoimmunity: the essential role of transforming growth factor beta and interleukin 4 in the prevention of autoimmune thyroiditis in rats by peripheral CD4(+)CD45RC- cells and CD4(+)CD8(-) thymocytes. J Exp Med; 189: 279288 (zitiert als „Seddon et al. 1999b”) 92. Segal DM, Taurog JD, Metzger H (1977). Dimeric immunoglobulin E serves as a unit signal for mast cell degranulation. Proc Natl Acad Sci USA; 74: 2993-2997 93. Shevach EM (2001). Certified Professionals: CD4+CD25+ Suppressor T Cells. J Exp Med; 193: F41-F46 94. Shevach EM (2000). Regulatory T cells in autoimmunity. Annu Rev Immunol; 18: 423-449 95. Shevach EM (2002). CD4+ CD25+ suppressor T cells: more questions than answers. Nat Rev Immunol; 2: 389-400 96. Stephens LA, Mottet C, Mason D, Powrie F (2001). Human CD4+CD25+ thymocytes and peripheral T cells have immune suppressive activity in vitro. Eur J Immunol; 31: 1247-1254 97. Suri-Payer E, Amar AZ, McHugh R, Natarajan K, Margulies DH, Shevach EM (1999). Post-thymectomy autoimmune gastritis: fine specifity and pathogenicity of anti-H/K ATPase-reactive T cells. Eur J Immunol; 29: 669677 98. Suri-Payer E, Amar AZ, Thornton AM, Shevach EM (1998). CD4+CD25+ T cells inhibit both the induction and effector function of autoreactive T cells 134 and represent a unique lineage of immunoregulatory cells. J Immunol; 160: 1212-1218 99. Takahashi T, Tagami T, Yamazaki S, Uede T, Shimizu J, Sakaguchi N, Mak TW, Sakaguchi S (2000). Immunologic self-tolerance is maintained by CD4+CD25+ regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4. J Exp Med; 192: 303-310 100. Takeuchi M, Alard P, Streilein JW (1998). TGF-β promotes immune de- viation by altering accessory signals of antigen-presenting cells. J Immunol; 160: 1589-1597 101. Tamir R, Castracane JM, Rocklin RE (1987). Generation of suppressor cells in atopic patients during immunotherapy that modulate IgE synthesis. J Allergy Clin Immunol; 79: 591-598 102. Taylor A, Verhagen J, Akdis CA, Akdis M (2004). T regulatory cells in allergy and health: a question of allergen specifity and balance. Int Arch Allergy Immunol; 135: 73-82 103. Taylor PA, Noelle RJ, Blazar BR (2001). CD4(+)CD25(+) immune regula- tory cells are required for induction of tolerance to alloantigen via costimulatory blockade. J Exp Med; 193: 1311-1318 104. Thornton AM, Shevach EM (1998). CD4+CD25+ immunoregulatory T cells suppress polyclonal T cell activation in vitro by inhibiting interleukin 2 production. J Exp Med; 188: 287-296 105. Till S, Walker S, Dickason R, Huston D, O’Brien F, Lamb J, Kay AB, Cor- rigan C, Durham S (1997). IL-5 production by allergen-stimulated T cells following grass pollen immunotherapy for seasonal allergic rhinitis. Clin Exp Immunol; 110: 114-121 135 106. Towbin H, Staehelin T, Gordon T (1979). Electrophoretic transfer of pro- teins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci USA; 76: 4350-4354 107. Valenta R, Vrtala S, Ebner C, Kraft D, Scheiner O (1992). Diagnosis of grass pollen allergy with recombinant timothy grass (Phleum pratense) pollen allergens. Int Arch Allergy Immunol; 97: 287-294 (zitiert als „Valenta et al. 1992a”) 108. Valenta R, Duchene M, Ebner C, Valent P, Sillaber C, Deviller P, Ferreira F, Tejkl M, Edelmann H, Kraft D (1992). Profilins constitute a novel family of functional plant pan-allergens. J Exp Med; 175: 377-385 (zitiert als „Valenta et al. 1992b”) 109. Valenta R, Lidholm J, Niederberger V, Hayek B, Kraft D, Grönlund H (1999). The recombinant allergen-based concept of component resolved diagnostics and immunotherapy (CRD & CRIT). Clin Exp Allergy; 29: 896-904 110. Valenta R, Niederberger V (2007). Recombinant allergens for immuno- therapy. J Allergy Clin Immunol; 119: 826-830 111. van Neerven RJ, Wikborg T, Lund G, Jacobsen B, Brinch-Nielsen A, Arnved J, Ipsen H (1999). Blocking antibodies induced by specific allergy vaccination prevent the activation of CD4+ T cells by inhibiting serum-IgEfacilitated allergen presentation. J Immunol; 163: 2944-2952 (zitiert als „van Neerven et al. 1999a”) 112. van Neerven RJ (1999). The role of allergen-specific T cells in the aller- gic immune response: relevance to allergy vaccination. Allergy; 54: 552-561 (zitiert als „van Neerven 1999b”) 113. Varney VA, Hamid QA, Gaga M, Ying S, Jacobson M, Frew AJ, Kay AB, Durham SR (1993). Influence of grass pollen immunotherapy on cellular in- 136 filtration and cytokine mRNA expression during allergen-induced late-phase cutaneous responses. J Clin Invest; 92: 644-651 114. von Mutius E, Fritzsch C, Weiland SK, Roll G, Magnussen H (1992). Prevalence of asthma and allergic disorders among children in united Germany: a descriptive comparison. BMJ; 305: 1395-1399 115. Wachholz PA, Soni NK, Till SJ, Durham SR (2003). Inhibition of allergen- IgE binding to B cells by IgG antibodies after grass pollen immunotherapy. J Allergy Clin Immunol; 112: 915-922 116. Williams A, Henzgen M, Rajakulasingam K (2007). Additional benefit of a third year of specific grass pollen allergoid immunotherapy in patients with seasonal allergic rhinitis. Eur Ann Allergy Clin Immunol; 39: 123-6 117. Wing K, Sakaguchi S (2006). Regulatory T cells as potential immuno- therapy in allergy. Curr Opin Allergy Clin Immunol; 6: 482-488 118. Witteman AM, Stapel SO, Sjamsoedin DH, Jansen HM, Aalberse RC, van der Zee JS (1996). Fel d 1-specific IgG antibodies induced by natural exposures have blocking activity in skin tests. Int Arch Allergy Immunol; 109: 369-375 119. Zelenika D, Adams E, Humm S, Lin CY, Waldmann H, Cobbold SP (2001). The role of CD4+ T-cell subsets in determining transplantation rejection or tolerance. Immunol Rev; 182: 164 120. Zhai Y, Kupiec-Weglinski JW (1999). What is the role of regulatory T cells in transplantation tolerance? Curr Opin Immunol; 11: 497-503 121. [Keine Autoren aufgeführt] (1998). Allergen immunotherapy: therapeutic vaccines for allergic diseases. Geneva: January 27-29 1997. Allergy; 53: 142 137 8. Abkürzungsverzeichnis °C Grad Celsius µg Mikrogramm µl Mikroliter A Ampere ACE Angiotensine converting enzyme APC Antigen-präsentierende Zelle(n) APS Ammoniumperoxodisulfat = (NH4)2S2O8 Aqua dest. destilliertes Wasser Art. Artikel AWMF Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften BD Becton & Dickinson Bet v Betula verrucosa BSA Bovine Serum Albumin bzw. beziehungsweise CA California Cat. Catalog(ue) CD cluster of determination Ci Curie cm Zentimeter cpm counts per minute CTLA-4 cytotoxic T lymphocyte-associated antigen-4 Cy-Chrome™ neuer Name: PECy5™ (siehe unter PE) D Tag(e) Da Dalton DC Dendritische Zelle(n) dest. destilliert DMSO Dimethyl Sulfoxid DPBS Dublecco’s phosphate buffered saline EDTA Ethylendiamintetraessigsäure ELISA enzyme linked immuno sorbent assay 138 FACS fluorescence-activated cell sorting FCS fötales Kälberserum FEIA Fluoroenzymeimmunoassay FEV1 forciertes expiratorisches 1-Sekunden-Volumen FITC Fluorescein isothiocyanate Fox p 3 forkhead box p 3 g Erdbeschleunigung g Gramm geb. geborene ggf. gegebenenfalls GITR = TNFRSF18 (TNF receptor superfamily member 18) GM-CSF Granulozyten und Makrophagen-Kolonie stimulierender Faktor h Stunde HSA Humanes Serumalbumin IFN Interferon IgE Immunglobulin E IgG Immunglobulin G IL Interleukin Impf. Impfung Kat. Katalog kDa Kilo-Dalton kU Kilo-Unit l, L Liter M molar mA Milli-Ampere MACS® Magnetic Cell Separation® MBq Mega-Becquerel mCi Milli-Curie mDC mature dendritic cells mDC+rBet v 1 mature dendritic cells, mit rBet v 1 beladen mg Milligramm MHC major histocompatibility complex min Minute mm Millimeter 139 mm2 Quadratmillimeter mmol Millimol MPL® Monophosphoryl Lipid A® nas. Prov. nasale Provokation nm Nanometer No. Nummer Nr. Nummer NY New York OAS orales Allergie Syndrom OX40 = CD134 PBMC peripheral blood mononuclear cell(s) PD-1 programmed death-1, cell surface molecule PE Phycoerythrin Penstrep Penicillin/Streptomycin pg Pikogramm PGE2 Prostaglandin E2 PIF Proliferationsinhibitionfähigkeit RAST Radio-Allergo-Sorbens-Test rBet v rekombinantes Betula verrucosa-Protein RCA Rhinokonjunktivitis allergica rDC reife dendritische Zelle rDC+rBet v 1 reife dendritische Zelle, mit rBet v 1 beladen RIA Radioimmunassay rpm rounds per minute, Umdrehungen pro Minute RPMI 1640 Roswell Park Memorial Institute 1640, cell medium S Sekunde s.c. subcutan SDS Sodiumdodecylsulfat = Lauryl Sulfat Sec Sekunde Sek Sekunde SU Standardised Units TCR T-Zell-Antigen-Rezeptoren TEMED N,N,N’,N’-Tetramethylethylendi-amin TGF-β (soluble) transforming growth factor-β TNF Tumor Nekrose Faktor 140 Tr1 eine Untergruppe regulatorischer T-Zellen TReg regulatorische T-Zelle(n) Tris Tris(hydroxymethyl)-aminomethan = H2NC(CH2OH)3 U Unit UK United Kingdom ÜS Überstand/Überstände US United States USA United States of America vgl. vergleiche w/v weight per volume WHO World Health Organisation z.B. zum Beispiel 141 9. Ethikkommission Ein positives Votum der Ethikkommision der medizinischen Fakultät der Universität Erlangen-Nürnberg (Bearbeitungsnummer 2375) liegt vor. 142 10. Danksagung Herrn Prof. Dr. med. G. Schuler danke ich an dieser Stelle vielmals für die Übernahme des Korreferates und für die Bereitstellung der Forschungseinrichtungen, die eine derartige Arbeit erst ermöglicht haben. Frau Prof. med. V. Mahler und Herrn Dr. med. D. Dieckmann danke ich für die Überlassung des Themas und für die hervorragende Betreuung und Anleitung bei der Durchführung und Gestaltung der Arbeit. Die fachliche Unterstützung sowie die Tatsache, dass sie jederzeit bei Fragen und Problemen zur Verfügung standen, haben die Umsetzung der Arbeit ganz erheblich erleichtert. Den medizinisch-technischen Assistentinnen Heidi Ploettner, Andrea Wüst, Stefanie Dotterweich und Julia Günter möchte ich für die hervorragende Anleitung im Rahmen der Laborarbeit ebenfalls ganz herzlich danken. Sie haben es immer geschafft, eine angenehme Arbeitsatmosphäre zu schaffen, und sind bei unterschiedlichsten Problemen sofort zu Hilfe gekommen. Ganz herzlicher Dank gilt auch den Assistenzärzten und Schwestern der Allergie-Abteilung der Hautklinik Universitätsklinikum Erlangen, die mich bei der Rekrutierung und der Aufklärung der Patienten sowie bei den Blutentnahmen tatkräftig unterstützt haben. 143 11. Lebenslauf Am 22. März 1977 wurde ich, Andreas Stefan Maronna, als Sohn des Zahnarztes Dr. Michael Maronna und seiner Ehefrau Ursula Maronna, geb. Dittmann, in Bayreuth geboren. Im Jahre 1978 kam mein jüngerer Bruder Oliver zur Welt. Nach Besuch der Lerchenbühl-Volksschule in Bayreuth seit dem Jahre 1983 trat ich 1988 in das Graf-Münster-Gymnasium in Bayreuth ein. Im Jahre 1997 erreichte ich die allgemeine Hochschulreife mit einer Abiturnote von 1,0. Anschließend leistete ich ein Jahr lang meinen Zivildienst am Bayreuther Klinikum ab. Parallel zu Schulausbildung und Zivildienst erhielt ich eine klassische Klavierausbildung über 12 Jahre. Im Wintersemester 1998/99 begann ich an der Friedrich-Alexander-Universität Erlangen-Nürnberg mit dem Studium der Humanmedizin. Im September 2000 bestand ich das Physikum und im August 2001 das 1. Staatsexamen. Das 2. Staatsexamen legte ich im September 2003 ab. Von April 2004 bis März 2005 absolvierte ich das Praktische Jahr des Medizinstudiums. Im Juni 2005 bestand ich das 3. Staatsexamen. Seit Juli 2005 bin ich als Assistenzarzt an der Hautklinik Universitätsklinikum Erlangen tätig.