IR-Spektroskopie organischer Moleküle
Werbung

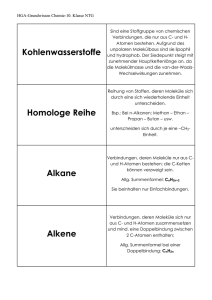
Spektrenkurs IR-Spektroskopie organischer Moleküle IR-Spektroskopie organischer Moleküle Die Infrarot-Spektroskopie dient in der Organischen Chemie der Ermittlung von Strukturelementen, funktionellen Gruppen und ggf. von Isomeren und Konformeren. Ein Schwingungsspektrum eines organischen Moleküls lässt sich in substanzspezifische Schwingungen (a) und charakteristische Schwingungen (b) aufteilen. a) Im Bereich 1500 cm-1 liegen Absorptionsbanden, die durch starke Schwingungskopplung hervorgerufen werden. Gekoppelte Schwingungen sind stark vom Molekülrest abhängig, weswegen der Wellenlängenbereich <1500 cm-1 Fingerprint-Bereich genannt wird, da er für die Substanz spezifisch ist. b) Charakteristische Schwingungen sind nahezu unabhängig von der Molekülstruktur, die Schwingungen treten also quasi „lagenkonstant“ auf. D.h. die Absorptionsbanden können einer bestimmten Atomgruppe zugeordnet werden. 1. Schwingungsarten Unter einer Schwingung versteht man die Bewegung der Massenträger relativ zum Schwerpunkt. Der Schwerpunkt selbst ändert die Lage nicht. Man unterscheidet hauptsächlich die Valenzschwingung und die Deformationsschwingung. Valenzschwingung Deformationsschwingung Abbildung 1: Schwingungsarten 1 Spektrenkurs IR-Spektroskopie organischer Moleküle 2. Lage und Intensität charakteristischer Schwingungen Die Intensität der Bande ist proportional zu der Größe der Änderung des Dipolmomentes. Die Lage der Schwingungen im IR-Spektrum hängt von der Kraftkonstanten, f, und der reduzierten Masse, µ, der beteiligten Atome ab. vosz = f 1 ⋅ µ 2π µ= m1 ⋅ m2 m1 + m2 Die Kraftkonstante steigt mit a) der Bindungsordnung ( fC-C < fC=C) b) zunehmenden s-Charakter im Hybrid-Orbital (f=C-H (sp2) > f-C-H (sp3) c) der effektiven Kernladungszahl Bei großen Massendifferenzen ist die reduzierte Masse klein, somit hat die Schwingung zwischen Atomgruppen mit großer Massendifferenz eine hohe Frequenz. Abbildung 2: Übersicht über die Lage der Absorptionsbanden der funktionellen Gruppen. 2 Spektrenkurs IR-Spektroskopie organischer Moleküle In den folgenden Tabellen sind die charakteristischen Wellenzahlen für verschiedene funktionelle Gruppen zusammengestellt. Die Auflistung hat keinen Anspruch auf Vollständigkeit (siehe auch ausführliche Tabellenwerke z.B. Hesse, Meier, Zeeh Spektroskopische Methoden in der Organischen Chemie). Übersicht über charakteristische Schwingungen Tabelle 1: Charakteristische Gruppenschwingungen Schwingung ν [cm ] OH-, NH- und CH 3650 – 2800 OH – Valenzschwingung (Tabelle 2) 3650 - 3000 Meist breite Bande NH – Valenzschwingung (Tabelle 3) 3500 - 3300 Meist breite Bande -1 2 3100 - 3010 3 CH - Valenzschwingung (sp ) (Tabelle 4) 2960 – 2850 Dreifachbindung u. kummulierte Doppelbindung 2300 - 1900 C≡C Valenzschwingung 2300 – 2100 C≡N Valenzschwingung 2250 -N=C=O Cyanate, Valenzschwingung 2270 -N=C=S Thiocyanate, Valenzschwingung 2150 C=C=C Allene, Valenzschwingung 1950 Doppelbindungen Valenzschwingung 1850 – 1500 C=O – Valenzschwingung (Tabelle 7) 1850 – 1650 C=C – Valenzschwingung (Tabelle 6) 1600 – 1500 C=N – Valenzschwingung 1690 – 1630 Fingerprintbereich < 1500 CH - Valenzschwingung (sp ) (Tabelle 5) Schwingungskopplungen tionsmuster, das für charakteristisch ist. Bemerkung Scharfe Bande Intensive Bande führen zu einem Absorpeine bestimmte Substanz CH- Deformationsschwingungen in Alkanen (Tabelle 4) 1465 – 1355 CH – Out of plane Schwingungen bei Alkenen (Tabelle 5) 990 – 660 CH - Deformationsschwingung am Aromaten (Tabelle 6) 900 - 690 3 Intensive Banden Spektrenkurs IR-Spektroskopie organischer Moleküle Schwingungen der OH-Gruppe Tabelle 2: OH - Valenz- und Deformationsschwingungen Schwingung ν [cm ] OH – Valenzschwingungen 3650 – 3000 Freie OH-Valenz (Gasphase, hoch verd. Lösungen) 3650 - 3520 Spezifische Einzelbrücken 3550 - 3450 Scharfe Bande Höhere Assoziate 3400 – 3200 Breite Bande Carbonsäure-Dimere um 3000 Extrem breite Bande OH - Deformationsschwingungen 1420 – 650 In plane bending 1420 - 1330 Out of plane bending (Alkohole und Phenole) 770 - 650 Out of plane bending (Carbonsäure-Dimere) 920 -1 Bemerkung Schwingungen der NH-Gruppe Tabelle 3: NH - Valenz- und Deformationsschwingungen Schwingung ν [cm ] NH - Valenzschwingungen 3500 – 3300 Primäre Amine 3500 Asymmetrische Schw. 3400 Symmetrische Schw. -1 Bemerkung Sekundäre Amine 3350 - 3310 Höhere Arylamine und heterocycl. N-H 3490 - 3450 Primäre Amide 3520 Asymmetrische Schw. 3400 Symmetrische Schw Sekundäre Amide 3460 - 3400 NH - Deformationsschwingungen 1650 - 1500 Primäre Amine 1650 - 1580 Primäre Amide 1620 - 1590 Sekundäre Amide 1570 - 1510 4 Verd. Lösungen Spektrenkurs IR-Spektroskopie organischer Moleküle CH-Schwingungen Tabelle 4: CH - Valenz- und Deformationsschwingungen - Alkane Schwingung ν [cm ] CH-Valenzschwingungen 2960 – 2850 CH3 (Alkane) 2962 u. 2872 je ± 10; νa > νs CH2 (Alkane) 2926 u. 2852 je ± 10; νa > νs CH (Alkane) 2890 meist nur schwach CH – Deformationsschwingungen 1465 – 1355 CH3 (Alkane) 1450 u. 1375 CH2 (Alkane) 1465 -1 Bemerkung νa > νs Tabelle 5: CH - Valenz- und Deformationsschwingungen – Alkene, Alkine Schwingung ν [cm ] CH-Valenzschwingungen 3300 – 3010 -CH=CH2 3040–3010 u. -1 3095 - 3075 R2C=CH2 3095 - 3075 R2C=CHR 3040 – 3010 -CΞCH 3300 CH - Deformationsschwingungen 990 – 660 RCH=CH2 990 u. 915 R2C=CH2 890 R-CH=CH-R´ Alkene (trans) 980 – 960 R-CH=CH-R´ Alkene (cis) 730 – 665 R2C=CHR 840 - 790 Bemerkung Alle Banden sind zumeist in Multipletts aufgespalten Scharf, wenig intensiv Tabelle 4: CH - Valenz- und Deformationsschwingungen – Aromaten Schwingung ν [cm ] Bemerkung CH-Valenzschwingungen ~ 3030 Scharf, wenig intensiv CH - Deformationsschwingungen 900 – 690 5 benachbarte H (Aromat) 770 – 690 4 benachbarte H (Aromat) 770 – 735 3 benachbarte H (Aromat) 810 – 750 2 benachbarte H (Aromat) 860 – 800 1 isoliertes H (Aromat) 900 - 860 -1 5 zwei Banden (mono) zwei Banden (meta) Spektrenkurs IR-Spektroskopie organischer Moleküle C-C Schwingungen Valenzschwingungen von C-C-Einfachbindungen liegen im Bereich von 1200 – 800 cm-1, sie sind aber wenig intensiv und dienen daher nur als “fingerprint“ zur Identifizierung einer spezifischen Substanz. C-C Deformationsschwingungen liegen < 500 cm-1 und liegen daher außerhalb des Messbereiches. Tabelle 6: C=C - Valenzschwingungen Schwingung ν [cm ] Bemerkung C=C – Valenzschwingung bei Alkenen 1640 – 1680 wenig intensiv RCH=CH2 ~ 1643 R2C=CH2 ~ 1653 R-CH=CH-R´ Alkene (trans) ~ 1673 R-CH=CH-R´ Alkene (cis) ~ 1657 R2C=CHR´ ~ 1670 C=C – Valenzschwingung bei Aromaten 1605 - 1440 Schwingungssystem mit vier Banden (zwei Hauptbanden und zwei Satteliten) 1605 – 1595 Hauptbande (1590 – 1575) Oft nur Schulter ~ 1500 Hauptbande (1470 – 1440) Mittlere Intensität -1 ggf. Multiplettstruktur Carbonylschwingungen Je höher der Doppelbindungscharakter der Carbonyl-Bindung desto höher ist die Wellenzahl. Daher verschieben elektronenziehende Substituenten Richtung höherer Wellenzahlen und elektronenliefernde Substituenten Richtung niedriger Wellenzahlen. Basisterm ist aliphatisches Keton mit ~ 1715 cm-1. Tabelle 7: C=O - Valenzschwingungen Schwingung ν [cm ] Bemerkung C=O – Valenzschwingung RCX=O 1640 – 1680 Generell sehr intensiv X = R´ (Keton) 1725 – 1705 -1 - X = O (Carboxylat) 1650 – 1550 X = NH2, NHR, NR2 (Amid) 1695 – 1650 X = H (Aldehyd) 1740 – 1720 X = OR´ (Ester) 1750 – 1735 X = OH (Carbonsäure) 1760 X = Cl (Carbonsäurechlorid) 1815 – 1785 X = O-COR´ (Anhydrid) 1850 – 1800 1790 - 1740 6 Monomer Doppelbande Spektrenkurs IR-Spektroskopie organischer Moleküle Beispielspektren A) B) C) 7 Spektrenkurs IR-Spektroskopie organischer Moleküle D) E) F) Summenformel: C6H12 8 Spektrenkurs IR-Spektroskopie organischer Moleküle G) H) I) 9 Spektrenkurs IR-Spektroskopie organischer Moleküle J) K) L) 10 Spektrenkurs IR-Spektroskopie organischer Moleküle 3. Knobelaufgaben a) Aus der Elementaranalyse ergibt sich eine Summenformel von C8H10. Um welche Verbindung handelt es sich? b) Ordnen Sie die beiden Spektren cis-2-Penten bzw. trans-2-Penten zu 11 Spektrenkurs IR-Spektroskopie organischer Moleküle c) Um welche Verbindung mit der Summenformel C7H8O handelt es sich? d) Sie haben Essigsäurechlorid mit Ethanol umgesetzt, hat sich das gewünschte Produkt gebildet? 12