Chemische Thermodynamik
Werbung

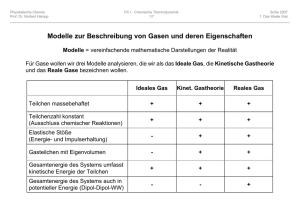
Physikalische Chemie Prof. Dr. Norbert Hampp Physikalische Chemie I 1/8 SoSe 2009 15. Chemische Thermodynamik Zustands€nderungen Mit Hilfe des chemischen Potentials, k€nnen wir offene und kommunizierende Systeme mit Materieaustausch behandeln. Die Trennung zwischen den gekoppelten Systemen (Laborsystem) und der Umwelt wird durch eine fiktive Wand repr•sentiert. Wir bestimmen die Energie- und Materiefl‚sse durch diese ƒWand„. System Zustands€nderung abgeschlossen adiabatische ZA (q=konst) geschlossen offen Konstanten Variable exten- intensiv siv Austausch mit •Umwelt‚ Energie Materie n - p, V, T - - isotherme ZA n T p, V + - isobare ZA n p T, V + - isochore ZA n, V - p, T + - - - - + + ZA Die extensiven Zustandsgr€…en skalieren das System, z.B. die Stoffmenge n oder das Volumen V, die intensiven Zustandsgr€…en haben keinen Skaleneffekt, sind also unabh•ngig davon welchen Bruchteil des Gesamtsystems wir betrachten; z.B. der Druck p, die Temperatur T und das Molvolumen Vm. Physikalische Chemie Prof. Dr. Norbert Hampp Physikalische Chemie I 2/8 SoSe 2009 15. Chemische Thermodynamik Zustandsfunktionen Eine Zustandsfunktion ist eine von den intensiven und extensiven Zustandsgr€…en abh•ngige Funktion, die - nur von den Zustandsgr€…en abh•ngig ist, unver•ndert bleibt, wenn das System eine beliebige zyklische Ver•nderung durchf‚hrt, nicht von der Vorgeschichte des Systems abh•ngig ist. Es zeigt sich, dass die Innere Energie U, die Enthalphie H und die Entropie S Zustandsfunktionen eines geschlossenen Systems (kein Materieaustausch) sind. U €q•w H € U • pV q S€ T Physikalische Chemie Prof. Dr. Norbert Hampp Physikalische Chemie I 3/8 SoSe 2009 15. Chemische Thermodynamik Haupts€tze der Thermodynamik (Annahmen - nicht ableitbar) 0. Hauptsatz T(A) = T(B) und T(B) = T(C) € T(A) = T(C), thermische Kommutativit•t (Isotropie des Raumes) 1. Hauptsatz €U = 0 • abgeschlossenes System (Erhaltung der Energie) 2. Hauptsatz €S ‚ 0 3. Hauptsatz S(T=0) := 0 Definition !!!! T=0 nicht erreichbar (In dieser Form nicht richtig, wird spÄter in der Stat. Thermodynamik prÄzisiert) Physikalische Chemie Prof. Dr. Norbert Hampp Physikalische Chemie I 4/8 SoSe 2009 15. Chemische Thermodynamik Hierarchie der Grƒ„en in der chemischen Thermodynamik S € Richtung der ƒGesamtreaktion„ €S‚0 (= System + Umwelt) Unterscheidung zwischen - reversibel (€S=0) und - irreversible (€S>0) Kopplung zwischen System und Umwelt Vektor, korreliert mit der Zeit (dS ~ dt) Richtung einer Reaktion im Mehrkomponentensystem Gleichgewichtslage (€• = 0) im Mehrkomponentensystem S G q p w V G,A Trennung von System und Umwelt ƒFreiwilligkeit„ (G < 0, A < 0) einer Reaktion des Laborsystems (Energieerhaltung und Entropieproduktion) U,H Energieerhaltung q,w Aufteilung der Energie zwischen thermischer und nicht-thermischer Energie Boltzmannverteilung (eindeutige Energieverteilung h•ngt von M/T ab) p,V,T Externe Systemparameter n, M Massenerhaltung € A U T H m Physikalische Chemie Prof. Dr. Norbert Hampp Physikalische Chemie I 5/8 SoSe 2009 15. Chemische Thermodynamik Chemische Thermodynamik / Klassische Thermodynamik Energie ist an Teilchen bzw. Masse gekoppelt € Reichweite der Wechselwirkung/Systembegrenzung inneratomar interatomar innermolekular intermolekular systemisch Kernaufbau chemische Bindung Rotation Lenard-JonesPotential Kinetische Energie Elektronenh‚llen chemische Reaktionen Schwingung Van-der-Waals Kr•fte Systembegrenzungen Elektr. Anregung BoltzmannVerteilung externe Felder und Potentiale Isotropie/Anisotro pie des Raumes Dimensionalit•t des Raumes (z.B. Oberfl•chen) Quantenmechanik Quantenmechanik Quantenmechanik Quantenmechanik auch klassisch Welle-Teilchen-Dualismus Wechselwirkung = Diskretisierung Austausch von Energie durch (Elektromagnetische) Wellen (Spektroskopie) Physikalische Chemie Prof. Dr. Norbert Hampp Physikalische Chemie I 6/8 SoSe 2009 15. Chemische Thermodynamik Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die systematisch durch die Mischung unterschiedlicher Teilchen hervorgerufen werden. Die Art der gemischten Teilchensorten spielt dabei eine wesentlich weniger wichtige Rolle als das zahlenm•…ige Verh•ltnis zwischen den Teilchensorten. Wichtige kolligative Eigenschaften sind: Gefrierpunktserniedrigung Schmelzpunktserniedrigung Siedepunktserh€hung Osmotischer Druck Eutektika Azeotrope Wasserdampfdestillation Physikalische Chemie Prof. Dr. Norbert Hampp Physikalische Chemie I 7/8 SoSe 2009 15. Chemische Thermodynamik Die thermodynamischen Potentiale U, H, A und G Thermodyn. Potential Vollst€ndiges Differential Partielles Differential Maxwell-Formeln U ( S ,V ) dU € TdS ‚ pdV ƒ €U † ƒ €U † … ˆ € T, … ˆ € ‚p „ €S ‡ V „ €V ‡ S ƒ €T † ƒ €p † … ˆ € ‚… ˆ „ €V ‡ S „ €S ‡ V H ( S , p) dH € TdS • Vdp ƒ €H † ƒ €H † € T , … ˆ … ˆ €V „ €S ‡ p „ €p ‡ S ƒ €T † ƒ €V † € … ˆ … ˆ „ €p ‡ S „ €S ‡ p A ( T ,V ) dA € ‚ SdT ‚ pdV ƒ €A † ƒ €A † € ‚ S , … ˆ … ˆ € ‚p „ €T ‡ V „ €V ‡ T ƒ €S † ƒ €p † € … ˆ … ˆ „ €V ‡ T „ €T ‡ V G (T , p) dG € ‚ SdT • Vdp ƒ €G † ƒ €G † … ˆ € ‚S, … ˆ € V „ €T ‡ p „ €p ‡ T ƒ €S † ƒ €V † € ‚ … ˆ … ˆ „ €T ‡ p „ €p ‡ T Physikalische Chemie Prof. Dr. Norbert Hampp Physikalische Chemie I 8/8 SoSe 2009 15. Chemische Thermodynamik Die Prinzipien Bilanzgleichungen 1. Hauptsatz Energie, Impuls, Masse Zustandsgleichungen 2. Hauptsatz Kreisprozesse, Gleichgewichte Reale Gase Joule-Thompson Koeffizient Intermolekulare Wechselwirkung Bedeutung der Entropie Phasen‚berg•nge Kolligative Eigenschaften Chemisches Potential Offene Systeme Chemische Reaktionen Mehrphasensysteme Chemisches Gleichgewicht ƒNegative Temperaturen„ Elektrochemie Thermoelektrische Prozesse irreversible Thermodynamik Relaxationserscheinungen Turbulenz Attraktoren Confinementeffekte (Kinetik) Die …chemischen† Ergebnisse Weitere Themen Magnetismus Oberfl•chenspannung Supraleitung Elastizit•t von Festk€rpern