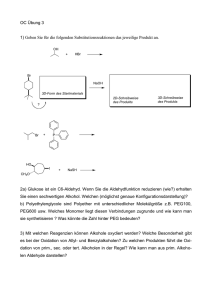
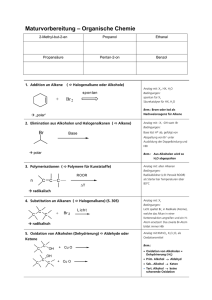
Fragenkomplexe zur LU Synthesepraktikum (163.145
Werbung

Fragenkomplexe – Synthesepraktikum LU – Technische Universität Wien Allgemeine Fragestellungen (bei jeder Besprechung) 1) Durchführung der Reaktion: Apparatur, Vorgehensweise und Erklärung der einzelnen Arbeitsschritte und Reaktionsbedingungen inkl. Aufarbeitung, mögliche Probleme und Nebenreaktionen, Sicherheitsaspekte 2) Mechanismus der eigenen Reaktion 3) Synthesemöglichkeiten für die Edukte 4) Alternativsynthesen für die herzustellende Substanz / Substanzklasse 5) Eigenschaften und typische Reaktionen des nach dieser Reaktion erhaltenen Verbindungstyps 6) Entsorgung Themengebiete A) Radikalreaktionen 1) Reaktionstypen bei Radikalreaktionen i. Additions-, Substitutions- und Polymerisationsreaktionen ii. Darstellung von Radikalen (thermisch, photochemisch, Redoxreaktion, usw.) iii. Radikalstarter, Mechanismus einer Kettenreaktion, Abbruchreaktion iv. Stabilität von Radikalen, langlebige und kurzlebige Radikale 2) Beispiele i. Halogenierung (auch mit NBS) ii. Radikalische Additionen von X2 und HX iii. Nitrierung, Sulfochlorierung, Autoxidation, Vinylpolymerisation iv. Kolbe-Elektrolyse, Acyloinkondensation, Pinakolbildung B) Additionsreaktionen an C-C-Mehrfachbindungen (Alkene, Alkine) 1) Allgemeine Mechanismen bei elektrophilen und nucleophilen Additionen an C-CMehrfachbindungen, Stereochemie der Addition, Additionsrichtung (Regioselektivität), Addition an konjugierte Diene (1,2- und 1,4-Addition) 2) Beispiele i. Elektrophile Addition (X2, HX, H2O, HOX, „BH3“, H2, OsO4, KMnO4, Persäuren, O3, kationische Polymerisation ii. Nucleophile Addition (Addition an ,-ungesättigte Carbonylverbindungen (Michael-Reaktion, Cyanethylierung, usw.) iii. Cycloadditionen (Diels-Alder, 1,3-dipolare Cycloadditionen) C) Eliminierungsreaktionen - und -Eliminierungen Mechanismen (E1, E2, E1cB) Einfluss von Struktur, Solvent, Temperatur, usw. Gegenüberstellung mit SN Stereochemie bei Eliminierungen (syn-, anti-Eliminierungen, Saytzeff- und HofmannRegel) 6) Beispiele: Eliminierung von HX, X2, H2O, Hofmann-, Cope-, Tschugaeff-Eliminierung, Ester-Pyrolyse 1) 2) 3) 4) 5) D) Nucleophile Substitution am gesättigten C-Atom 1) 2) 3) 4) 5) 6) Mechanismen (SN1, SN2, SNi) Einfluss von Nucleophil, Abgangsgruppe, Struktur, Solvent, Temperatur, usw. Gegenüberstellung mit E Nachbargruppeneffekte und Stereochemie Ambidente Nucleophile Beispiele: i. Nucleophile Reaktionen ausgehend von z.B. R-X oder R-OTs zu Alkoholen, Ethern, Thiolen, Thioethern, Nitrilen, Nitroverbindungen ii. Probleme bei der Reaktion mit Aminen (Gabriel-Synthese) iii. Alkylierung von C-H-aciden Verbindungen (Malonester, Acetessigester usw.) iv. Enamin-Alkylierungen (Stork-Reaktion, Vorteile) v. Herstellung von RX aus ROH, Etherspaltungen, Finkelstein-Reaktion E) Reaktionen mit Metallorganylen 1) Struktur, allgemeine Mechanismen und Handhabung bei Grignard-Reaktionen, Herstellung von Grignard-Reagenzien und mögliche Nebenreaktionen 2) Beispiele: i. Reaktion von RMgX mit protischen Verbindungen (H2O, ROH, RCOOH, RNH2, usw.), Aldehyden, Ketonen, Estern, orhto-Estern, Nitrilen, Epoxiden, CO2, Alkylhalogeniden ii. Reformatzky (Unterschied, Vorteile), Wurtz-Fittig, Zerewitinoff iii. Reaktion von Li-Organylen F) Kondensationsreaktionen zur Bildung von C-C-Bindungen 1) Allgemeine Mechanismen bei Kondensationsreaktionen, Definition 2) Beispiele: Aldol, Perkin, Knoevenagel, Claisen, Dieckmann, Thorpe-Ziegler, Acyloin, Stobbe, Wittig, Wittig-Horner, Benzoin, Darzens G) Reduktionen 1) Katalytische Hydrierung (C-C-Mehrfachbindungen, NO2, usw.), Katalysatoren, Stereoselektivität, Rosenmund 2) Hydridreagenzien (LiAlH4, NaBH4, „BH3“, DiBAl-H) i. Unterschiede, Reaktivität, Stabilität, Handhabung ii. Reaktion mit Aldehyden, Ketonen, Iminen, Säurederivaten, Sulfonen, Oximen, Epoxiden 3) Reduktion mit Metallen (Zn, Na, Mg, Sn): Clemmensen, Birch, Pinakolbildung, Acyloin-Kondensation, Reduktion des Nitrobenzols 4) Wolff-Kishner (Huang-Minlon) 5) Reduktive Aminierung (Eschweiler-Clarke, Leuckart-Wallach), Meerwein-PonndorfVerley H) Oxidationen 1) Oxidation von Alkanen zu Alkoholen: Autoxidation, radikalische Halogenierung mit anschließender Hydrolyse 2) Oxidation von Alkoholen zu Carbonylverbindungen: MnO2, CrO3, PCC, Sommelet (Kröhnke), Swern, Dess-Martin, Oppenauer 3) Oxidation von Alkanen zu Carbonylverbindungen: SeO2, Etard-Reaktion, Diazoniumsalze mit C-H-aciden Verbindungen 4) Oxidation von Alkanen zu Carbonsäuren: KMnO4, Haloform-Reaktion, CrO3 5) Oxidation von Aldehyden zu Carbonsäuren: z.B. Pinnick-Oxidation 6) Oxidation von C=C-Bindungen: KMnO4, OsO4, Malaprade, Criegée, O3 7) Oxidation am N-Atom: Aminoxide, Nitroverbindungen 8) Oxidation am S-Atom: Thiole zu Disulfiden und weiter zu Sulfonsäuren, Thioether zu Sulfoxiden und weiter zu Sulfonen I) Nucleophile Reaktionen an C-X-Mehrfachbindungen (Carbonyle, Imine, Nitrile) 1) Reaktivitätsverhalten verschiedener C-X-Mehrfachbindungen, allgemeine Mechanismen (Additions-Reaktionen, Additions-Eliminierungsreaktionen, SN2t) 2) Beispiele: i. Additionsreaktionen (H2O, ROH, RSH, HCN, Bisulfit-Addukte) ii. Additions-Eliminierungsreaktionen (Carbonyle zu Iminen, Hydrazonen, Oximen, Enaminen, Mannich-Reaktion, Verseifungen, Veresterung, Umesterung, Synthese von Säurechloriden und Reaktionen mit Alkoholen, Aminen oder Carboxylaten) J) Aromatische Substitutionen 1) Allgemeine Mechanismen bei SE und SNAr, - und -Komplexe, Aromatizität nach Hückel, Aktivierung und Desaktivierung, Substituenten erster und zweiter Ordnung, Additions-Eliminierungs- bzw. Arin-Mechanismus bei SNAr, Voraussetzungen für SNAr, Meisenheimer Komplex 2) Beispiele: Nitrierung, Halogenierung, Sulfonierung, Friedel-Crafts-Reaktionen, Chlormethylierung, Hydroxymethylierung, Vilsmeier-Haack, Gattermann, Gattermann-Koch, Reimer-Tiemann K) Diazoverbindungen, Diazoniumsalze und Diazotierung 1) Darstellung und Reaktionen von CH2N2 (Veresterung, Insertionen, Carbenherstellung, 1,3-dipolare Cycloaddition) 2) Herstellung von Diazoniumsalzen 3) Reaktionen von Diazoniumsalzen unter Abspaltung von N2: Verkochung, Einführung von Halogenen in Aromaten (Sandmeyer, Balz-Schiemann), Reduktion zur C-HBindung (H3PO2, HCOOH), Gomberg-Reaktion, Bart-Reaktion, Meerwein-SchusterReaktion 4) Reaktionen von Diazoniumsalzen unter Erhalt von N2: Reduktion zu Arylhydrazinen, Kupplungsreaktionen (Azofarbstoffe, Reaktion mit C-H-aciden Verbindungen: z.B. Japp-Klingemann-Reaktion) L) Umlagerungen 1) Allgemeine Mechanismen (kationotrope und anionotrope Umlagerungen) 2) Beispiele: i. Kationotrop: Stevens, Favorski, Wittig, Neber, Benzilsäureumlagerung ii. Anionotrop: Wanderung C (Wagner-Meerwein, Pinakol zu Pinakolon, CH2N2Insertionen, Tiffeneau-Demyanov) Wanderung N (Hofmann-, Curtius-. Lossen-, Schmidt-Abbau, Beckmann) Wanderung O (Baeyer-Villiger, Dakin) iii. Umlagerung an Aromaten (Fries, Claisen, Benzidin) M) Heterocyclen 1) Nomenklatur, Einteilung (elektronenreich, elektronenarm, aromatischer Charakter) 2) Synthesen und Reaktionsverhalten (mit Elektrophilen, Nucleophilen, Säuren, Alkylhalogeniden) der wichtigsten Heterocyclen: i. Furan (Paal-Knorr, Feist-Benary) ii. Pyrrol (Paal-Knorr, Hantzsch, Knorr) iii. Thiophen (Paal-Knorr, Gewald, Fiesselmann, Hinsberg) iv. Indol (Fischer) v. Pyrazol, Imidazol, Thiazol (Hantzsch) vi. Pyridin (Hantzsch, Tschitschibabin-Reaktion), Chinolin (Skraup, Friedländer), Isochinolin (Pictet-Spengler), Pyrimidin (Pinner, Biginelli) N) Carbonylverbindungen 1) Darstellung und Reaktivität von Aldehyden und Ketonen 2) Allgemeine Mechanismen (Addition-Eliminierung, SN2t) 3) Addition von Alkohol, Amin, Hydrazin, Hydroxylamin, Semicarbazid, Cyanwasserstoff, Metallhydriden an die Carbonylgruppe 4) Reaktionen von Carbonylverbindungen (Cannizzaro, Seebach-Umpolung, MeerweinPonndorf-Verley, Wittig, Wolff-Kishner, Mannich, Baeyer-Villiger, Knoevenagel, Haloform) O) Carbonsäure-Derivate 1) Darstellung und Reaktivität: Azid, Amid, Ester, Orthoester, Anhydrid, Säurechlorid und Nitril 2) Allgemeine Mechanismen (Addition-Eliminierung, SN2t) 3) Umwandlung der einzelnen Derivate ineinander (Veresterung, Verseifung, Reaktion von Säurechloriden mit Alkoholen, Aminen, usw.) 4) Reaktionen (Arndt-Eistert-Homologisierung, Curtius-, Hofmann-Abbau, RosenmundReaktion, Hell-Vollhardt-Zelinsky, Claisen-Esterkondensation)