Komplexchemie
Werbung

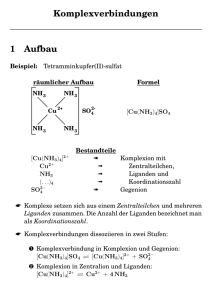
WWU Münster Institut für Anorganische Chemie Seminar zum Praktikum IIIa ( AC-F für Lehramt ) WS 2001/2002 Referent : Arne Hüls 20.November 2001 Komplexchemie : Struktur, Geometrie und Liganden 0. „Eine geniale Frechheit !“ – zur Geschichte der Komplexverbindungen Bereits im 19. Jhd. wurden viele Komplexverbindungen hergestellt, ohne dass bekannt gewesen wäre wie dieser Verbindungstyp genau zustande kommt oder welche Struktur er hat. 1893 postulierte Alfred Werner seine „Koordinationslehre“ und gab damit eine Erklärung zur Struktur von Komplexverbindungen. Das erstaunliche daran war, dass Werner nicht ein einziges Experiment im Vorfeld angestellt hatte, sondern ihm die Idee quasi über Nacht im Schlaf gekommen war. Im Nachhinein bestätigte er seine Theorie mit tausenden von Experimenten. Eine „geniale Frechheit“ wie ein Kollege Werners anmerkte. 1. Eine Definition der Komplexverbindung Ein Komplex ist eine chemische Verbindung, in der ein Zentralatom oder Zentralion als Koordinationszentrum von einer Ligandenhülle, bestehend aus Ionen oder Molekülen, umgeben ist. Die Bindung der Liganden an das Koordinationszentrum ist so fest, dass sie praktisch nicht mehr einzeln auftreten können. Das Zentralteilchen bindet mehr Liganden an sich als dies nach seiner Ladung oder Stellung im PSE zu erwarten wäre. Die Anzahl der gebundenen Liganden wird Koordinationszahl genannt, ihre geometrische Anordnung um das Zentralteilchen heißt Koordinationspolyeder. 2. Nomenklatur von Komplexen (i) Die Formeln von Komplexteilchen beginnen mit dem Zentralteilchen. Es folgen anionische und darauf neutrale Liganden, jeweils in alphabetischer Reihenfolge. Die Formeln werden in eckige Klammern gesetzt. Kationische Gegenionen werden vor die Klammer geschrieben, anionische dahinter. [ZA N ] n Zentralteilchen l m Ladung des Komplexes neutrale Liganden anionische Liganden ( ii ) Im Namen der Komplexteilchen werden zuerst die Liganden in alphabetischer Reihenfolge genannt. Anionische Liganden erhalten hierbei die Endung –o ; die Endung –id entfällt ( z.B. chloro für Cl Aus sprachlicher Bequemlichkeit verwendet man folgende Trivialnamen : O 2− 2− O2 2− S HS − oxo CN peroxo − SCN − ). cyano − thio CH 3 O mercapto CH 3 S thiocyanato − − methoxo methylthio Neutrale Liganden werden in Klammern geschrieben und behalten ihren Namen. Nicht in Klammern geschrieben werden die Trivialnamen für : ( iii ) H 2O aqua NH 3 amin CO carbonyl NO nitrosyl Die Anzahl der jeweiligen Liganden wird als griechische Zahlensilbe vor die Ligandenbezeichnung geschrieben : 1 mono 4 tetra 7 hepta 10 deca 2 di 5 penta 8 octa 11 undeca 3 tri 6 hexa 9 nona 12 dodeca 1 Bei mehrzähnigen Liganden und bei solchen Liganden die selbst schon Zahlensilben enthalten verwendet man die Vorsilben bis, tris, tetrakis, pentakis, usw. um Verwechslungen mit anderen Stoffen zu vermeiden. ( iv ) Nach den Liganden wird das Zentralteilchen genannt. Bei neutralen und kationischen Komplexteilchen wird einfach der Elementname verwendet, bei anionischen Komplexteilchen der lateinische Elementname mit der Endung –at ( z.B. ferrat für Eisen ). Hinter das Zentraleilchen kann in römischen Zahlen in runden Klammern die Oxidationsstufe des Zentralteilchens geschrieben werden. Alternativ kann auch die Ladung des gesamten Komplexteilchens in arabischen Zahlen in runden Klammern angegeben werden. Bei optischen Isomeren kann zusätzlich noch die Drehrichtung ( + oder - ) hinzugefügt werden. (v) Je nachdem ob das Komplexteilchen kationisch, neutral oder anionisch ist wird ggf. noch das entsprechende Gegenion angegeben. Bei anionischen Komplexteilchen wird das Kation vor die Komplexbezeichnung geschrieben und durch einen Bindestrich abgetrennt. Bei kationischen Komplexteilchen kommt das Anion ans Ende des Namens, wiederum abgetrennt durch einen Bindestrich. 3. Struktur von Komplexen – Koordinationszahlen und Koordinationspolyeder Koordinationszahl 2 + + Die KZ 2 ist recht selten und auf die Elemente der 1. Nebengruppe Cu , Ag , Au beschränkt. Komplexe dieser Zusammensetzung sind fast ausschließlich linear gebaut. + sowie auf Hg 2+ Koordinationszahl 3 Die KZ 3 ist sehr selten. Die Liganden sind hierbei trigonal planar um das Zentralteilchen angelagert. Koordinationszahl 4 KZ 4 ist sehr häufig. Hauptsächlich bildet sich hierbei eine tetraedrische Struktur, aber auch quadratisch planare oder verzerrte Tetraederformen sind möglich. Koordinationszahl 5 Die KZ 5 ist relativ selten und tritt in Form von trigonalen Bipyramiden und tetragonalen Pyramiden auf. Diese beiden Formen lassen sich durch Deformation leicht ineinander überführen. Koordinationszahl 6 Sechs Liganden ist die mit Abstand häufigste Koordinationszahl. Komplexe dieser Form sind mit ganz wenigen Ausnahmen fast ausschließlich oktaedrisch gebaut. Dies können neben regelmäßigen Oktaedern auch verzerrte, also gestreckte und gestauchte Oktaeder sein. 2 Koordinationszahlen > 6 Insbesondere ist die KZ 8 noch recht häufig vertreten, da hierbei große Zentralteilchen eine gute Verteilung in der Ligandensphäre ermöglichen. Alle KZ größer als 9 sind extrem selten, da hier die sterische Hinderung der Liganden untereinander einfach zu groß wird. 4. Isomerie in Komplexverbindungen Isomere sind Verbindungen gleicher Zusammensetzung, aber unterschiedlicher Struktur. Man unterscheidet folgende Arte der Isomerie : Ionisationsisomerie Hierbei kann ein Ion entweder als Ligand oder als Gegenion außerhalb des Komplexes gebunden sein. Dies führt dazu dass es zu völlig unterschiedlichem Verhalten in dissoziierter Form kommt, da ja verschiedene Ionen vorliegen. Ein Beispiel ist : [CoCl (NH ) ]SO → [CoCl (NH ) ] + SO [CoSO (NH ) ]Cl → [CoSO (NH ) ] + Cl 2+ 3 5 4 3 5 + 4 3 5 4 2− 4 − 3 5 Wenn es sich bei den ausgetauschten Teilchen um Wassermoleküle handelt so spricht man von Hydratisomerie. Koordinationsisomerie Bei Komplexen in denen sowohl Kation als auch Anion Komplexteilchen sind tritt Koordinationsisomerie auf, wenn die Zentralteilchen vertauscht werden. Salzisomerie Wenn ein Ligand über verschiedene Atome an das Zentralteilchen gebunden sein kann, so nennt man die jeweiligen Möglichkeiten Salzisomere. Stereoisomerie Bei Stereoisomeren ist die räumliche Anordnung der Liganden verschieden. Man unterscheidet hierbei noch zwischen cis/trans Isomerie und Spiegelbildisomerie. ( i ) cis/trans Isomerie ( a ) cis ( b ) trans Liegen bei zwei Arten von Liganden zwei gleiche Liganden an einer Kante so spricht man von einer ciskonfiguration. Liegen sie diametral an gegenüberliegenden Ecken, so spricht man von einer trans-konfiguration. 3 ( ii ) fac/mer Isomerie Bei oktaedrischen Komplexen kommt es auch zur sog. fac (facial) / mer (meridional) Isomerie. ( iii ) Spiegelbildisomerie Spiegelbildisomere oder Enantiomere verhalten sich zueinander wie Bild und Spiegelbild. Dies bedeutet, dass sie ein sogenanntes Chiralitätszentrum besitzen, also ein Teilchen welches keine Symmetrieeigenschaften besitzt. Enantiomere sind „optische“ Isomere, da sie die Schwingungsebene von polarisiertem Licht drehen. Enantiomere drehen das Licht um den selben Betrag, aber in entgegengesetzte Richtungen. 4. Liganden und ihre Zähnigkeit – der Chelateffekt Die Fähigkeit von Liganden sich an Zentralteilchen zu binden beruht darauf, dass sie über ein freies Elektronenpaar verfügen. Besitzt nun ein Ligand mehrere freie Elektronenpaare, so kann er theoretisch auch mehrere Koordinationsstellen am Zentralteilchen besetzen. Die Anzahl der Bindungen, die ein Ligand eingeht nennt man die Zähnigkeit des Liganden. Komplexe in denen mehrzähnige Liganden gebunden sind bezeichnet man als Chelat-Komplexe. Diese sind um ein vielfaches stabiler als Komplexe mit einzähnigen Liganden. Die Stabilität von Chelat-Komplexen ist hauptsächlich ein thermodynamischer Entropieeffekt. Bei der Bildung solcher Komplexe aus anderen Komplexen entstehen mehr freie Teilchen, da ja z.B. zwei einzähnige Liganden durch einen zweizähnigen Liganden ersetzt werden. Zusätzlich gibt es auch noch kinetische Gründe für die größere Stabilität von Chelat-Komplexen. Selbst wenn eine Bindung des Liganden zum Zentralteilchen gelöst wird ist er immer noch mit einer oder mehreren Bindungen an das Zentralteilchen gebunden, kann also leicht wieder in die ursprüngliche Position zurückkehren und die gelöste Bindung wieder schließen. Literatur • Demuth / Kober : Grundlagen der Komplexchemie Salle+Sauerländer ( Frankfurt a/M , Aarau, Salzburg ); 1992 ( 2. Auflage ) • Jäckel / Risch : Chemie heute – Sekundarbereich II Schroedel ( Hannover ) ; 1988 • Mortimer : Chemie – Das Basiswissen der Chemie Georg Thieme Verlag ( Stuttgart , New York ) ; 1996 ( 6. Auflage ) • Atkins / Beran : Chemie – Einfach alles VCH ( Weinheim ) ; 1996 ( 2. Auflage ) • Riedel : Anorganische Chemie de Gruyer ( Berlin , New York ) ; 1994 ( 3. Auflage ) 4