Nuclear Magnetic Resonance (NMR) Spektrokopie
Werbung
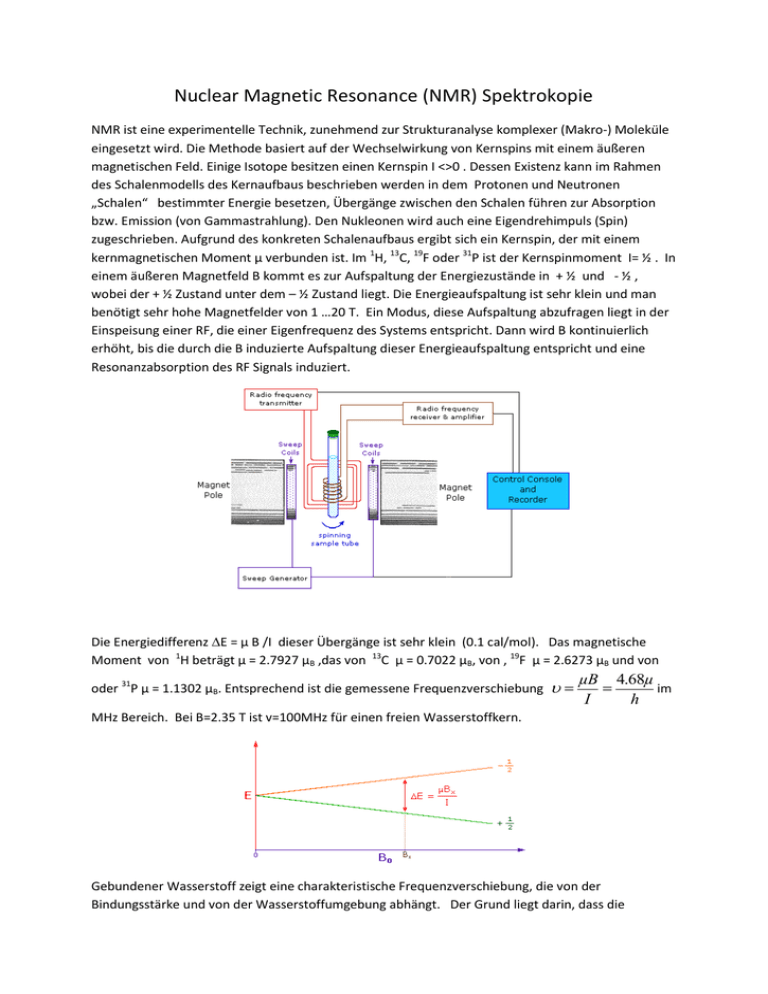
Nuclear Magnetic Resonance (NMR) Spektrokopie NMR ist eine experimentelle Technik, zunehmend zur Strukturanalyse komplexer (Makro-) Moleküle eingesetzt wird. Die Methode basiert auf der Wechselwirkung von Kernspins mit einem äußeren magnetischen Feld. Einige Isotope besitzen einen Kernspin I <>0 . Dessen Existenz kann im Rahmen des Schalenmodells des Kernaufbaus beschrieben werden in dem Protonen und Neutronen „Schalen“ bestimmter Energie besetzen, Übergänge zwischen den Schalen führen zur Absorption bzw. Emission (von Gammastrahlung). Den Nukleonen wird auch eine Eigendrehimpuls (Spin) zugeschrieben. Aufgrund des konkreten Schalenaufbaus ergibt sich ein Kernspin, der mit einem kernmagnetischen Moment µ verbunden ist. Im 1H, 13C, 19F oder 31P ist der Kernspinmoment I= ½ . In einem äußeren Magnetfeld B kommt es zur Aufspaltung der Energiezustände in + ½ und - ½ , wobei der + ½ Zustand unter dem – ½ Zustand liegt. Die Energieaufspaltung ist sehr klein und man benötigt sehr hohe Magnetfelder von 1 …20 T. Ein Modus, diese Aufspaltung abzufragen liegt in der Einspeisung einer RF, die einer Eigenfrequenz des Systems entspricht. Dann wird B kontinuierlich erhöht, bis die durch die B induzierte Aufspaltung dieser Energieaufspaltung entspricht und eine Resonanzabsorption des RF Signals induziert. Die Energiedifferenz E = µ B /I dieser Übergänge ist sehr klein (0.1 cal/mol). Das magnetische Moment von 1H beträgt µ = 2.7927 µB ,das von 13C µ = 0.7022 µB, von , 19F µ = 2.6273 µB und von oder 31P µ = 1.1302 µB. Entsprechend ist die gemessene Frequenzverschiebung µB 4.68µ im I h MHz Bereich. Bei B=2.35 T ist v=100MHz für einen freien Wasserstoffkern. Gebundener Wasserstoff zeigt eine charakteristische Frequenzverschiebung, die von der Bindungsstärke und von der Wasserstoffumgebung abhängt. Der Grund liegt darin, dass die Elektronen einer kovalenten Bindung und benachbarter Ionen das magnetische Feld des Kerns vom äußeren magnetischen Feld abschirmen. Man muss also B erhöhen, um die entsprechende Resonanz zu beobachten. Diese Verschiebung nennt man Chemical shift . Ist die Elektronendichte am Protonkern relativ hoch, muss das externe Feld größer werden als im Fall einer geringeren Elektronendichte. Die Resonanzsignale für verschiedene chemische Konfigurationen des Protons führen zu klar definierten Werten von , die jeweils durch entweder einem verändertem B bei festem RF oder veränderter RF bei festem B angesprochen werden können. Beispiele zeigt Tabelle Generell ist der Protonen chemical shift mit entsprechenden funktionalen Gruppen im Molekül zu geordnet. Das erlaubt die Analyse der Molekularen Struktur. Proton Chemical Shifts of Methyl Derivatives Compound (CH3)4C (CH3)3N (CH3)2O CH3F δ 0.9 2.1 3.2 4.1 Compound (CH3)4Si (CH3)3P (CH3)2S CH3Cl δ 0.0 0.9 2.1 3.0 Proton Chemical Shifts (ppm) Cpd. / Sub. CH3X CH2X2 CHX3 X= Cl 3.0 5.3 7.3 X=B r 2.7 5.0 6.8 X= I 2.1 3.9 4.9 X=O X=S R R 3.1 2.1 4.4 3.7 5.0 Protonen chemical shifts in ppm Die Änderung der infolge Abschirmung induzierten Änderung ist sehr klein, und wird daher in Einheiten von ppm (parts per million) angegeben. Ein bei 2.34 T detektiertes Protonensignal wird in Wasser um 42ppm verschoben, das entspricht auf der MHz Skala einer Verschiebung um 4.2kHz. UM alle Verschiebungen zu klassifizieren, werden sie relativ zu einem Standardsignal angegeben. Das wird mit der eigentlichen Probe gemischt, sollte chemisch nicht reaktiv und leicht von der Probe wieder entfernbar sein. Ebenso soll es ein scharfes NMR Signal liefern. Dazu eignet sich Tetramethylsilane (CH3)4Si – abgekützt TMS. Meistens sind die Skalen für den chemischen shift auf TMS bezogen. Die Signalstärke der Resonanzabsorption skaliert mit der Zahl von Wasserstoffatomen gleichen Bindungstyps. In der folgenden Grafik links ist die Zahl der H Atome in den Methylgruppen größer als am Benzolring. Im Molekül daneben kommt CH3 Gruppe zweimal , die CH2 Gruppe nur einmal vor . Der genaue Wert des Chemischen Shifts ist auch vom Lösungsmittel abhängig, in der das Molekül gelöst ist. Ein weiterer Einflußfaktor ist mit der Spin-Spin Wechselwirkung benachbarter Kerne verbunden. der zu einer Aufspaltung von Resonanzlinien im Bereich weniger Hz mit der Kopplungskonstante J führt. Abhängig von der Zahl koppelnder H-Atome spricht man von Dubletts, Tripletts , Quartetts usw. De Intensitätsverhältnisse sind immer 1:1, 1:2:1 oder 1:3.3:1. Kerne mkt gleichem chemical shift (Isocronous) zeigen rotz Spinkopplung keine Peakaufspaltung, Kerne, die über 2 oder mehrere Bindungen separiert sind Spin gekoppelt und zeigen eine Aufspaltung, Die Stärke der Ausspaltung ist vielfältig , ist durch J gegeben und unabhängig von B. Die n+1 Regel sagt, dass die Kopplung von n Spins zur Ausspaltung in n+1 Linien führt. Nicht alle Moleküle enthalten H- Atome, oder aus der Anordnung der H-Atome kann nicht auf die Struktur des Moleküls geschlossen werden. Die Moleküle A und B im linken Bild sind mit Hilfe der Protonen NMR zu unterscheiden, nicht aber im mittleren und rechten Bild. Hier hilft die 13C NMR. 13C kommt in der Natur mit einer Häufigkeit von 1.1% vor und kann somit bei größeren Probenmengen detektiert werden. Allerdings ist die Detektiertbarkeit des 13C Kerns 50mal geringer als die des Protons. Wasserstoffe, die an ein 13C gebunden sind zeigen eine zusätzliche Aufspaltung. Die relative Stärke des 13C NMR Signals ist nicht proportional zur zahl der Kerne, alerdings sit der generierte chemische shift i.allg. vel größer als der Protonen chemische shift. 13 C Chemical Shift Ranges* Low Field Regio n High Field Regio n * For samples in CDCl3 solution. The δ scale is relative to TMS at δ=0.

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)








