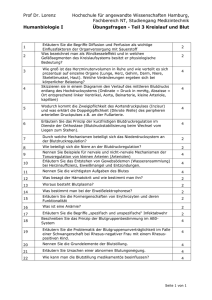
Übungsaufgaben - Fachrichtung Chemie und Lebensmittelchemie
Werbung

-1- Victor Rogachev, Dr. sc. chem. habil. (VAK Moskau), Lehrbeauftragter OC Technische Universität Dresden Fachrichtung Chemie – Professur Organische Chemie I Übungsaufgaben Übung zur Organische Chemie für die Studiengänge Verfahrens- und Naturstofftechnik und Werkstoffwissenschaften Sommersemester 2014 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. Womit befasst sich die organische Chemie? Welche Kohlenstoffverbindungen zählen nicht zu den organischen Verbindungen? Nennen Sie mindestens 5 Namen und formulieren Sie die dazugehörigen Formeln! Durch welches Kohlenstoffgerüst sind folgende Stoffklassen gekennzeichnet: a) Aliphaten, b) Aromaten, c) Alicyclische Verbindungen, d) Heterocyclen ? Erklären Sie an Beispielen die Begriffe Summenformel, Konstitutionsformel und Strukturformel! Erläutern Sie deren unterschiedlichen Informationsgehalt! Erklären Sie die Segment-Valenzstrich-Schreibweise von Konstitutionsformeln an je 2 Beispielen aus folgenden Substanzklassen: a) Gesättigte Aliphaten, b) Ungesättigte Aliphaten, c) Alicyclische Verbindungen, d) Aromaten, e) Heterocyclen! Erklären Sie die Keilvalenzstrich-Schreibweise zur Festlegung der Struktur organischer Verbindungen! Zeichnen Sie alle Konstitutionsformeln für: a) C3H4, b) CH5N, c) CH4O, d) C2H6O, e) C5H12, f) C4H10O. Wonach klassifiziert man organisch-chemische Reaktionen? Nennen Sie die jeweiligen Reaktionstypsymbole! Definieren Sie die reaktionstheoretischen Begriffe Substrat und Agens! Wann kann ein Molekül als Nukleophil reagieren? Nennen Sie je zwei Beispiele für starke und für schwache Nukleophile! Was unterscheidet starke und schwache Nukleophile? Erläutern Sie den Begriff Nukleophilie! Welcher Unterschied und welcher Zusammenhang besteht zur Basizität? Erklären Sie die Bedeutung des Reaktionssymbols SN2! Wodurch unterscheidet sich dieser Reaktionstyp von der SN1-Reaktion? Formulieren Sie für jeden dieser Reaktionstypen die Reaktionsgleichung eines typischen konkreten Beispiels! Nennen Sie je ein Beispiel (Reaktionsgleichungen!) für die Reaktionstypen AdE und AdN und kennzeichnen Sie Substrat und Agens! Formulieren Sie die Elektronenkonfiguration des C-Atoms im Grundzustand (Ordnungszahl 6) und erklären Sie die Bindungsverhältnisse im Methan! Warum sind alle 4 CH-Bindungen gleichwertig? Worin unterscheiden sich die σ-Bindungen eines sp3-, sp2- und sp-hybridisierten Kohlenstoffatoms? Erklären Sie die Bildung von π-Bindungen und ihre Geometrie mit Hilfe des Modells der Hybridisierung! Wann haben Kohlenstoffverbindungen planare und lineare Strukturen? Nennen Sie einige Beispiele! Wie kennzeichnet man die Polarität einer Bindung in der Konstitutionsformel? Nennen und erläutern Sie das Maß für die Polarität eines Stoffes? Welche Eigenschaften lassen sich für die organischen Verbindungen der elektronegativen Elemente Sauerstoff und Stickstoff mit gewinkelten Baus der Moleküle (sp3-hybridisierter O bzw. N) ableiten? Erläutern Sie den Sachverhalt an je 2 organischen Verbindungen dieser Elemente! Warum sind CO2 und CCl4 trotz polarer Bindungen unpolare Moleküle? Was ist der induktive Effekt (oder Induktionseffekt)? Geben Sie Beispiele für +I- und -ISubstituenten an. -2- 22. Was ist der mesomere Effekt (oder M-Effekt)? Geben Sie Beispiele für +M- und -M-Substituenten an. 23. Nennen Sie je 2 Beispiele (Name, Konstitutionsformel) für stabile und instabile (reaktive) organische Kationen und Anionen! 24. Erläutern Sie den prinzipiellen Aufbau von Seifen! Wodurch unterscheiden sich Neutralseifen von klassischen Seifen? 25. Was sind Wasserstoffbrückenbindungen? Erklären Sie die Auswirkung intermolekularer Wasserstoffbrückenbindungen auf die Eigenschaften niedermolekularer organischer Verbindungen an 2 Beispielen! 26. Was sind intramolekulare Wasserstoffbrückenbindungen? Nennen Sie ein Beispiel (Name, Formel) bei dem diese eine Rolle spielen. 27. Nennen Sie je einen natürlichen und einen synthetischen makromolekularen Werkstoff, für dessen Eigenschaften Wasserstoffbrückenbindungen sehr wichtig sind! Zeichnen Sie die Konstitutionsformeln der Wiederholungseinheiten und kennzeichnen Sie die Wasserstoffbrücken-bindungs-Akzeptoratome durch Pfeile. 28. Was ist Konfiguration und wie gibt man die Konfiguration eines chiralen Zentrums an? 29. Erläutern Sie die Begriffe Enantiomere und Diastereomere an Beispielen mit sp3hybridisierten Kohlenstoffen als chiralen Zentren! Worin unterscheiden sie sich? Welche Eigenschaften haben sie? 30. Zeichnen Sie die FISCHER-Projektionsformeln und die Stereoformeln (unter Verwendung von Keilvalenzstrichen) für L-Alanin (L-α-Aminopropansäure) und R-Glycerinaldehyd (R-2,3-Dihydroxypropanal)! 31. Zeichnen Sie die Strukturformeln der unter Aufgabe 7. f) möglichen Enantiomeren unter Verwendung der Keilvalenzstrichschreibweise! 32. Wie und woraus bilden sich Enantiomere? 33. Zeichnen Sie die Strukturformeln der stereoisomeren Weinsäuren (2,3-Dihydroxybutandisäuren) und benennen Sie diese exakt unter Angabe der absoluten Konfiguration der chiralen Zentren! Was für Isomere sind die einzelnen Formen zueinander? 34. Zeichnen Sie die Strukturformeln der stereoisomeren C4-Monosaccharide (2,3,4Trihydroxy-butanale) in der offenkettigen Aldehydform und benennen Sie diese so, dass durch die Bezeichnung die Konfiguration der chiralen Zentren festgelegt wird! Was für Isomere sind die einzelnen Formen zueinander? 35. Formulieren Sie die Strukturformeln von 4 in der Biosphäre vorkommenden Isomeren C3H6O3! Kennzeichnen Sie alle vorhandenen chiralen Zentren mit * und benennen Sie jede Substanz exakt. Erläutern Sie, welche Isomerie zwischen den Substanzen vorliegt! 36. Erläutern Sie den Begriff „Optische Aktivität“! (Definition! Wie wird sie angegeben, wie gemessen, wovon hängt sie ab?) 37. Wie verändert sich die Zahl der Konfigurationsisomeren Aldohexosen C6H12O6 durch Ringschluß der offenkettigen Formen zu Pyranosen? 38. Erläutern Sie das „Prinzip der Struktur-Wirkungs-Beziehung“ organischer Substanzen an einem Werkstoff- oder einem Wirkstoffbeispiel! 39. Zeichnen Sie die Struktur der stereoisomeren Polypropylene und erläutern Sie deren unterschiedliche Materialeigenschaften! 40. Erläutern Sie die Begriffe Konstitutions-, Konformations- und Konfigurationsisomerie! 41. Erläutern Sie die verschiedenen Cyclohexankonformationen! 42. Zeichnen Sie die stabilsten Strukturen für cis- und trans-1,2-Dimethylcyclohexan sowie 1,3-Dimethylcyclohexan, indem Sie H- oder CH3-Gruppen an die freien Valenzstriche der Cyclohexansesselformen schreiben! Welche Isomerie liegt zwischen den vier Molekülstrukturen vor? H H H H H H H H H H H H H H H H cis- trans1,2-Dimethylcyclohexan H H H H H H H H H H H H H H cis- trans1,3-Dimethylcyclohexan H H -3- Was bedeutet cis-/trans-Isomerie a) bei Cyclohexanderivaten, b) bei Alkenen? Was sind E-/Z-Isomere? Erläutern Sie die Isomerie organischer Verbindungen (mit Beispielen)! Welche Stereoisomeren (Strukturformeln!) erwarten Sie für 2-Brompent-3-en? 43. 44. 45. 46. Br 47. Was sind primäre, sekundäre, tertiäre und quartäre C-Atome in organischen Verbindungen und wie unterscheiden sie sich in ihrer Reaktivität? Erläutern Sie die verschiedenen CAtome am Isooctan oder den konstitutionsisomeren Pentanen! 48. a) Benennen Sie die folgenden aliphatischen Kohlenwasserstoffe exakt! a b c d b) Erläutern Sie, von welchen Verbindungen Konfigurationsisomere möglich sind und welche Art von Konfigurationsisomeren Sie erwarten können! 49. Erläutern Sie an einem Beispiel den Mechanismus der radikalischen Substitution an Alkanen! Erklären Sie, warum es bei der Chlorierung von Methan zu einem Produktgemisch kommt! 50. Erläutern Sie die Gewinnung von Kohlenwasserstofffraktionen aus Erdöl! 51. Nennen und charakterisieren Sie die technischen Prozesse mit denen die Kraftstoffausbeute in der Erdölverarbeitung erhöht wird! 52. Nennen und charakterisieren Sie die technischen Prozesse mit denen die Qualität der Kraftstoffe in der Erdölverarbeitung erhöht wird. 53. Was charakterisiert die Octanzahl OZ ? 54. Was charakterisiert die Cetanzahl CZ ? 55. Geben Sie die allgemeinen Summenformeln der homologen Reihen der Alkane, Alkene und Alkine an. Diskutieren Sie, für welche anderen homologen Kohlenwasserstoffe diese Formeln ebenfalls gelten! 56. Erläutern Sie an einem Beispiel den Mechanismus der elektrophilen Addition an Alkene! Welche durch diese Reaktionen gebildeten Produkte sind Ihnen bekannt? 57. Was besagt die MARKOVNIKOV-Regel? Erläutern Sie den Sachverhalt an der elektrophilen Addition von Wasser an Isobuten! 58. Welches Produkt erwarten Sie bei der Hydratisierung von Propen in Gegenwart von Schwefelsäure und welche Ursache hat die Regioselektivität der Reaktion? 59. Welche organischen Produkte werden aus Ethen hergestellt? Nennen Sie dabei mindestens 3 Kunststoffe, die auf der Basis von Ethen produziert werden und geben Sie die Konstitutionsformeln der Wiederholungseinheiten an! 60. Welche organischen Produkte werden (bzw. wurden) aus Acetylen hergestellt? 61. Formulieren Sie die Reaktionsgleichung für die Umsetzung von a) Cyclopropan und b) Cyclohexan mit je einem Molekül Brom! 62. Was sind Aromaten bzw. wodurch ist Aromatizität gekennzeichnet? 63. Benennen Sie die folgenden aromatischen Verbindungen exakt! a) b) c) d) e) f) OH NO2 g) NH2 NH2 NO2 OH -4- 64. Erklären Sie den Mechanismus der elektrophilen Substitution am Benzol. Erläutern Sie dabei die Nitrierung, Sulfonierung und Halogenierung! 65. Welches Hauptprodukt (Name, Konstitutionsformel) erwarten Sie, wenn man in Gegenwart von AlCl3 überschüssiges Propen mit Benzol reagieren läßt? Begründen Sie Ihre Entscheidung! 66. Vervollständigen Sie folgende Gleichung unter Verwendung von Konstitutionsformeln! Die Reaktion soll in der Kälte ablaufen. Reaktionstyp? + Br2 Fe-Pulver Cumol 67. Zeichen Sie die Konstitutionsformel des Hauptproduktes, das erhalten wird, wenn Cumol ohne Eisen in der Siedehitze und unter intensiver Lichteinstrahlung bromiert wird! Reaktionstyp? 68. Welche Produkte werden aus Benzol durch elektrophile Substitution hergestellt, und wofür sind sie Ausgangsstoffe? 69. Welche u. a. für die Polyesterproduktion wichtigen Dicarbonsäuren bzw. ihre Derivate werden durch Oxidation aus Aromaten hergestellt? 70. Erläutern Sie an jeweils typischen Heteroaromaten die Begriffe π-Überschuß- und πMangel-aromat. Diskutieren Sie die Konsequenzen für die Reaktivität dieser Aromaten gegenüber Elektrophilen! 71. Wonach werden Heterocyclen klassifiziert? Nennen Sie 5 wichtige Heterocyclenklassen mit je einem Beispiel (Name, Konstitutionsformel)! 72. Nennen Sie die Namen der 3 wichtigsten 5-Ring-Heteroaromaten mit einem Heteroatom und formulieren Sie die dazugehörigen Konstitutionsformeln! 73. Nennen Sie 3 bedeutende Naturstoffklassen, die Heterocyclen enthalten und ordnen Sie diesen Naturstoffklassen jeweils einen dafür typischen heterocyclischen Grundkörper zu! 74. Wie wurde und wie wird Vinylchlorid hergestellt, wozu wird es verwendet? 75. Nennen Sie ein wichtiges fluorhaltiges Monomer, formulieren Sie dessen Konstitutionsformel und nennen Sie den makromolekularen Werkstoff, der daraus gewonnen wird! Erläutern Sie daran die besonderen Eigenschaften stark fluorhaltiger makromolekularer Werkstoffe! 76. Was sind FCKW? Formulieren Sie zwei Formelbeispiele und erläutern Sie wichtige Eigenschaften der FCKW, die zu deren breiter Anwendung und schließlich aber auch zu deren Anwendungsverbot führten. 77. Nennen Sie a) 3 aliphatische und b) 3 aromatische Verbindungen des Chlors, die die Umwelt belasten und formulieren Sie für je eine Verbindung die Konstitutionsformel! 78. Wodurch gelangten toxische Chlordibenzodioxine in unsere Umwelt? 79. Wie werden Alkohole klassifiziert? a) Schreiben Sie Konstitutionsformeln (falls notwendig die Strukturformeln) für alle isomeren Butanole C4H9OH auf und benennen Sie die Isomeren! b) Erläutern Sie [eventuell an Antwort a)] was primäre, sekundäre und tertiäre Alkohole sind! c) Wie verhalten sich primäre, sekundäre und tertiäre Alkohole bei der Oxydation? d) Wie verhalten sich primäre, sekundäre und tertiäre Alkohole bei der nukleophilen Substitution? 80. Wie kann man sekundäre Alkohole herstellen? Nennen und erläutern Sie 2 verschiedene Synthesewege! 81. Erläutern Sie die Herstellung von Phenol nach 2 verschiedenen Verfahren anhand der Reaktionsgleichungen! 82. Für welche makromolekularen Werkstoffe ist Phenol das Ausgangsmaterial? (Nennen Sie mindestens 3!) -5- 83. a) Benennen Sie die folgenden organischen Hydroxyverbindungen exakt! OH OH OH a b HO OH c HO HO d e f b) Erläutern Sie, von welchen Verbindungen Konfigurationsisomere möglich sind und welche Art Konfigurationsisomere Sie erwarten können! 84. Erläutern Sie die Herstellung von Phenoplasten anhand der Reaktionsgleichungen! Nach welchem Mechanismus erfolgen die Kondensationsschritte? 85. Erläutern Sie die Bildung von Polyetheralkoholen aus Ethylen- oder Propylenoxid (mit einer Reaktionsgleichung)! Wofür werden Polyetheralkohole benötigt? 86. Erläutern Sie die Klassifizierung der Amine und an je 3 Beispielen unter Einbeziehung heterocyclischer Amine (falls möglich) die Begriffe primäres, sekundäres und tertiäres Amin! 87. Ordnen Sie die Konstitutionsformeln von Anilin, Cyclohexylamin und Ammoniak nach steigender Basizität (> bzw. < verwenden!) und begründen Sie kurz die Reihenfolge! 88. Erklären Sie die Bildung von Ethanolamin in der Technik und in der Biosphäre an Hand der Reaktionsgleichungen! 89. Wie und woraus wird Anilin gewonnen? 90. Was sind proteinogene Aminosäuren? Erläutern Sie deren Strukturmerkmale! 91. Wie klassifiziert man proteinogene Aminosäuren nach der Polarität ihrer Seitenketten? Nennen Sie für jede Seitenkettenpolarität ein Beispiel (Name, Strukturformel)! 92. Was sind biogene Amine, woraus und wie bilden sie sich? 93. Welche Reaktion der Amine verläuft eindeutig nach einem SN2-Mechanismus? Formulieren Sie eine entsprechende Reaktionsgleichung mit Konstitutionsformeln und benennen Sie die Edukte und Produkte! 94. Erläutern Sie Gemeinsamkeiten und Unterschiede zwischen C=C- und C=O-Bindungen! Welche polaren Substituenteneffekte übt die Carbonyl-Gruppe aus? 95. Nennen sie die Namen und Trivialnamen der 3 ersten Glieder der homologen Reihe der Aldehyde und formulieren Sie die dazugehörigen Konstitutionsformeln! 96. Nennen sie die Namen und Trivialnamen der 2 ersten Glieder der homologen Reihe der Ketone und formulieren Sie die dazugehörigen Konstitutionsformeln! 97. Nennen Sie 3 Carbonylreaktionen! Welche Teilschritte sind für den Mechanismus einer Carbonylreaktion typisch? 98. Erklären Sie die Halbacetal-Bildung als Beispiel einer nukleophilen Addition an die Carbonylgruppe! Wozu und in welcher Reaktion stabilisieren sich Halbacetale? 99. Welche Naturstoffklasse enthält Halbacetale bzw. Halbketale als funktionelle Gruppen? 100. Erläutern Sie die Bildung von Halbaminalen und Aminalen an einem Beispiel! 101. Welche Reaktion liegt der Eiweißhärtung zugrunde? Welcher halbsynthetische makromolekulare Werkstoff wurde damit erstmals erzeugt? 102. Nennen Sie 2 durch Carbonylreaktion herstellbare Produktgruppen mit dem Strukturelement RR’C=NR’’ und die dafür umzusetzenden Nukleophil-Gruppen! 103. Formulieren Sie mit Konstitutionsformeln die Bildungsgleichung für Cyclohexanonoxim! Welche technische Bedeutung hat diese Substanz? 104. Wie wird eine unbekannte organische Substanz als Aldehyd identifiziert? 105. Erläutern Sie die Aldolkondensation! 106. Erläutern Sie die Keto-Enol-Tautomerie! 107. Für welche makromolekularen Werkstoffe wird Formaldehyd als Ausgangsstoff benötigt? Nennen Sie mindestens 3 und erläutern Sie mit Reaktionsgleichungen die Herstellung eines dieser Kunststoffe ausgehend vom Formaldehyd! 108. Erläutern Sie mit Reaktionsgleichungen (Konstitutionsformeln verwenden!) die Bildung von -6- 109. 110. 111. 112. 113. 114. 115. 116. 117. 118. 119. Pentaerythrit C(CH2OH)4 aus Acetaldehyd und Formaldehyd durch Carbonylreaktionen, benennen Sie die einzelnen Reaktionsschritte! Nennen Sie mindestens 3 technisch wichtige Carbonsäuren bzw. Carbonsäurederivate (Namen und Konstituionsformel), die Ausgangsstoffe für makromolekulare Werkstoffe sind! a) Charakterisieren Sie die strukturellen Merkmale der natürlichen Fettsäuren und nennen Sie je ein Beispiel einer gesättigten und einer ungesättigten natürlichen Fettsäure. b) Welches Strukturmerkmal kennzeichnet die essentiellen Fettsäuren? Zu welcher Substanzklasse gehören die Fette? Erläutern Sie mit Konstitutionsformeln deren Aufbau! Gegen welche Reagenzien sind Carbonsäurederivate reaktiv und nach welchem Mechanismus verlaufen diese Reaktionen? Unterscheiden Sie die Carbonsäureamide in drei Gruppen nach dem Substitutionstyp des Stickstoffs der Amid-Funktion! Aus welchen Nukleophilen erhält man diese verschieden substituierten Carbonsäureamide? Zu welchem Carbonsäureamid-Substitutionstyp gehören Peptidbindungen? Wie ist die Peptidbindung konfiguriert? Erläutern Sie mittels mesomerer Grenzformeln die Bindungsverhältnisse in Carbonsäureamiden und leiten Sie daraus wesentliche Eigenschaften ab, die auch für die Peptidchemie wichtig sind! Welche Konstitutionsisomeren (Name und Formel!) können bei der Polymerisation von Olefinen des Typs R'CH=CH2 entstehen? Erläutern Sie die Bildung der möglichen Konstitutionsisomeren in Abhängigkeit vom Mechanismus der Polymerisation! Welche Konstitution müssen Ausgangsstoffe für die Bildung von Polyestern haben? Erläutern Sie den Sachverhalt allgemein und an je einer Konstitutionsformel konkret! Welche Konstitution müssen Ausgangsstoffe für die Bildung von Polyamiden haben? Erläutern Sie den Sachverhalt allgemein und an je einer Konstitutionsformel konkret! Erläutern Sie den Begriff der Polykondensation und nennen Sie mindestens 3 makromolekulare Werkstoffe, die durch Polykondensation hergestellt werden! Fakultative Fragen für VNT-Studenten mit Interesse an der Vertiefungsrichtung ChemieIngenieurtechnik 120. Benennen Sie alle Substanzen, für die Sie in Aufgabe 7 die Konstitutionsformel geschrieben haben, exakt und mit Trilvialnamen (falls vorhanden)! 121. Wie beeinflussen Substituenten in p-Position die Basizität entsprechender Aniline bzw. die Acidität entsprechender Phenole? 122. Wenn Sie 2S-Chlorbutan (Struktur formulieren!) mit Hydroxidanionen umsetzen und dabei die Reaktionsbedingungen (Lösungsmittel und Temperatur) so wählen, das a) eine monomolekulare und b) eine bimolekulare Reaktion abläuft, welche Produkte erhalten Sie dann? Begründen Sie Ihre Entscheidung! 123. Nennen Sie 3 Beispiele (Name, Strukturformel) bei denen die Konfigurationsangabe mit der FISCHER-Nomenklatur nicht möglich ist! 124. Was bedeutet die Angabe ee bei modernen organischen Synthesen? 125. Geben Sie die Strukturen (unter Verwendung von Keilvalenzstrichen) für cis- und transDecalin an! Worin unterscheiden sich diese Konfiguratiosisomeren? 126. Zeichnen Sie die Strukturformeln von zwei Fettmolekülen A und B in denen nur Stearinsäure C17H35COOH und Palmitinsäure C15H31COOH verestert sind, wobei das Molekül A chiral und das Molekül B achiral (d. h. nicht chiral) sein soll. Kennzeichnen Sie das chirale Zentrum und ermitteln sie dessen absolute Konfiguration! Erwarten Sie diese Fette bei Raumtemperatur fest oder flüssig (kurz begründen)? 127. Benennen Sie die in Aufgabe 48 möglichen Konfigurationsisomeren exakt und formulieren Sie deren Strukturformeln! 128. Welche Produkte erwarten Sie, wenn Chlor unter UV-Einstrahlung mit 3-Ethylpentan in äquimolarer Menge reagiert? Was ist das Hauptprodukt? Begründen Sie Ihre Entscheidung! Was wird zum Hauptprodukt bei der Bromierung von 3-Ethylpentan unter intensiver Lichteinstrahlung? -7- 129. Zeichnen Sie die - und -Komplexe der Bromierung von Benzol. 130. Wie erhält man ausgehend von der Aromatennitrierung wichtige aromatische Di- und Polyisocyanate und wozu werden diese verwendet? 131. Was sind GRIGNARD-Verbindungen, welche strukturellen Vorstellung kennen Sie zu dieser Verbindungsklasse und wie bilden sie sich? 132. Welche Bedeutung haben GRIGNARD-Verbindungen in der organischen Synthesechemie? Nennen Sie 4 Reaktionsbeispiele die zu verschiedenen Substanzklassen (nennen) führen und formulieren Sie für ein Beispiel die Reaktionsgleichung! 133. Diskutieren Sie die Ursachen für die folgende Basizitäten: pKB = 3.4 (Cyclohexylamin), pKB = 9.4 (Anilin) – zum Vergleich: pKB = 4.8 (Ammoniak)! 134. Erklären Sie anhand der Halbacetal-Bildung aus einem geeigneten konkreten Aldehyd und Ethanol den Begriff “Prochiralität”! Welcher Aldehyd (Name, Konstitutionsformel) ist bei der Halbacetal-Bildung nicht prochiral? 135. Erläutern Sie mit Reaktionsgleichungen (Konstitutionsformeln verwenden!) die Gemeinsamkeiten und Unterschiede der Bildung von Azomethinen und Enaminen! 136. Zeichnen Sie die FISCHER-Projektionsformeln von D-Glucose in der offenkettigen Aldehydform! Zeichnen Sie dazu in gleicher Weise zwei beliebige Isomere der D-Glucose und benennen Sie die Monosaccharide so exakt wie möglich und geben Sie an, was für Isomere zur D-Glucose vorliegen! 137. Erläutern Sie den Prozess der Mutarotation! 138. Formulieren Sie die Strukturformeln aller Dipeptide, die sich aus L-Alanin und Glycin bilden können! 139. Erläutern Sie Gemeinsamkeiten und Unterschiede der Polyamide, Peptide (Proteine) und Polyurethane anhand ihrer Wiederholungseinheiten! 140. Wie nennt man die cyclischen intramolekularen Amide von Aminosäuren? Formulieren Sie die Konstitutionsformel des intramolekularen Amids aus 6-Aminohexansäure und benennen Sie es mit dem üblichen Trivialnamen! 141. Erläutern Sie am Beispiel der Polyurethanbildung den Ablauf einer Polyaddition!