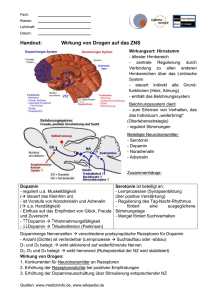
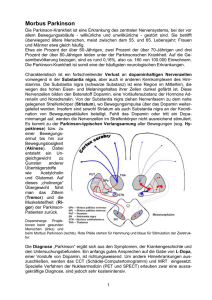
Facharbeit - Einleitung - was bewegt mich diese Arbeit zu schreiben?
Werbung

Gymnasium Weilheim Kollegstufenjahrgang 2007/2009 FACHARBEIT aus dem Fach Biologie Thema: Dopamin als zentraler Neurotransmitter am Beispiel des Segawa-Syndroms und der Schizophrenie Verfasser: Barbara Pfäffl Leistungskurs: Biologie 1 Kursleiter: Susanne Brunner Abgabetermin: 30.01.2009 Erzielte Note: in Worten: Erzielte Punkte: (einfache Wertung) in Worten: Abgabe am: (Stempel des Sekretariats) (Unterschrift des Kursleiters) 1 Vorwort ............................................................................................................... 3 1 Einleitung - was bewegt mich diese Arbeit zu schreiben? ........................... 3 2 Dopamin, als zentraler Neurotransmitter ..................................................... 4 2.1 Das zentrale Nervensystem und die Rolle von Dopamin ..................... 4 2.2 Neurotransmitter .................................................................................. 6 Einteilung der Neurotransmitter ................................................................... 6 2.3 Dopamin ............................................................................................... 7 2.3.1 Synthese von Dopamin ................................................................. 7 2.3.2 Wirkung von Dopamin ................................................................... 9 2.3.3 Dopamin-Rezeptoren .................................................................... 9 3 Krankheiten, die mit Dopamin in Verbindung gebracht werden ................. 11 3.1 Segawa-Syndrom als Dopaminmangelerkrankung ............................ 11 3.1.1 Entdeckungsgeschichte des Segawa-Syndroms ........................ 11 3.1.2 Klinik und Symptome der Erkrankung ......................................... 12 3.1.3 Diagnose ..................................................................................... 12 3.1.4 Fehldiagnosen ............................................................................ 13 3.1.5 Therapiemöglichkeiten unter dem Aspekt der Dosierung............ 15 3.1.6 Genetik........................................................................................ 18 3.1.7 Epidemiologie, Verbreitung ......................................................... 19 3.2 Schizophrenie, diskutiert als Dopaminüberschusserkrankung ........... 19 3.2.1 Symptome ................................................................................... 19 3.2.2 Verbreitung ................................................................................. 20 3.2.3 Vererbung ................................................................................... 21 3.2.4 Auslösende Ereignisse................................................................ 21 3.2.5 Mögliche Ursachen und Diagnoseansätze .................................. 22 3.2.5.1 Dopaminhypothese.................................................................. 22 3.2.5.2 Glutamathypothese ................................................................. 24 3.2.5.3 Theorie der neuronalen Entwicklungsstörung ......................... 24 3.2.5.4 Vulnerabilitäts-Stress-Coping-Modell ...................................... 25 3.2.6 Therapie ...................................................................................... 25 3.2.7 Volkswirtschaftliche Bedeutung .................................................. 27 4 Ausblick ..................................................................................................... 27 Literatur ............................................................................................................ 28 Bücher: .................................................................................................. 28 Zeitschriften: .......................................................................................... 28 Doktorarbeiten: ...................................................................................... 29 Internet:.................................................................................................. 29 2 Vorwort 1971 schob eine 51 Jahre alte Frau nach 43 Jahren Krankheit und 36 Jahren im Rollstuhl - dieses für sie so notwendig gewordene Fortbewegungsmittel - in jene Ecke des Heimes, in der sie morgens das Pflegepersonal wieder abzuholen gewohnt war, nahm den Koffer mit ihren persönlichen Habseligkeiten vom Tisch und ging langsam den Gang hinunter, an dessen Ende Ihre Enkeltochter stand, freudig winkte und sich für ihre Oma freute, die das erste Mal seit ihrer Kindheit wieder laufen konnte. Die Behandelbarkeit ihrer körperlichen Behinderung war als genetisches Syndrom bei eben dieser Enkeltochter festgestellt worden... 1 Einleitung - was bewegt mich diese Arbeit zu schreiben? Es gibt zwei Gründe die mich dazu veranlassen, diese Arbeit zu schreiben. Einer davon ist die Tatsache, dass ich selbst von dem Segawa-Syndrom betroffen bin. Mithilfe der Informationen und den Erkenntnissen, die ich im Zuge der Recherche für diese Arbeit sammle, möchte ich mehr über Abläufe im menschlichen Körper im Allgemeinen und über die Fehlfunktionen speziell in meinem Körper verstehen. Auch möchte ich den Grund begreifen, warum ich Tag ein Tag aus meine zwei Tabletten L-DOPA schlucken muss. Dabei habe ich eigentlich doch sehr Glück, dass ich diese Krankheit habe und nicht irgendeine andere Bewegungsstörung, welche nicht behandelbar wäre, die den Rollstuhl und ein sehr eingeschränktes Leben zur Folge hätte. Ein weiterer Grund ist, dass ich dem Segawa-Syndrom mehr Bekanntheit in der Bevölkerung und vor allem auch in der Ärzteschaft verschaffen will. Aufgrund der geringen Inzidenz (Häufigkeit) dieser Erkrankung wird sie meistens nicht erkannt, obwohl die Bewegungsstörung nach der richtigen Diagnose leicht zu behandeln ist. Oft wird die Diagnose jahrelang verschleppt und der Patient macht eine Odysee durch sämtliche Fachbereiche der Medizin, um am Ende resigniert festzustellen, dass ihm angeblich mit seiner Krankheit nicht zu helfen ist. Um möglichst vielen verzweifelt Ratsuchenden die Möglichkeit zu geben, sich zu informieren und sich selbst zu helfen, werde ich mit Beendigung dieser Arbeit diese unter www.dystonie-segawa.de ins Internet stellen. Vielleicht ereignet sich die oben im Vorwort geschilderte Geschichte ja wieder ein Mal oder manch ein Kind muss einige Ärzte weniger als ich selbst konsultieren. 3 2 Dopamin als zentraler Neurotransmitter 2.1 Das zentrale Nervensystem und die Rolle von Dopamin Unter dem Begriff des Zentralen Nervensystems (ZNS) wird das Gehirn und das Rückenmark zusammengefasst. Man grenzt es so vom peripheren Nervensystem ab. Das ZNS wird in die fünf folgenden Hauptabschnitte eingeteilt: Großhirn, Zwischenhirn, Kleinhirn, Stammhirn und Rückenmark. Das ZNS ist in die graue und in die weiße Substanz unterteilt. Die graue Substanz besteht aus den Somata der Neuronen, die weiße Substanz aus den Axonen der Neuronen. Abbildung 1: Gehirnstrukturen (aus www.sinnesphysiologie.de 11.03.2008) Im Stammhirn und hier insbesondere im Mittelhirn liegt die Substantia nigra, welche bezüglich des Segawa-Syndroms eine besondere Rolle spielt. Der Name Substantia nigra (lat. niger „schwarz“) stammt vom hohen Gehalt an Eisen und Melanin, die dieser Gewebestruktur des Mittelhirns seine Farbe verleihen. Abbildung 2: Strukturen im Stammhirn (aus www.sinnesphysiologie.de 11.03.2008) 4 Abbildung 3: Dopaminerge Bahnen im Gehirn (www.sinnesphysiologie.de 11.03.2009) Die Substantia nigra steht über verschiedene Schaltkreise mit anderen Gehirnstrukturen in Verbindung. Zur Substantia nigra verlaufen zuführende Nervenfasen (Afferenzen) vom motorischen Cortex (ein histologisch abgrenzbarer Bereich, der die willkürlichen Bewegungen steuert), aus dem Nucleus caudatus (Anteil der Basalganglien, der auch für die Kontrolle willkürlicher Bewegungen verantwortlich ist) und dem Putamen (Teil der grauen Substanz des Gehirns, ebenfalls Kontrolle der Bewegungen). Die ableitenden Nervenfasern (Efferenzen) ziehen zum Striatum (Streifenkörper, Teil der Basalganglien) und zum Thalamus (größter Teil des Zwischenhirns). Histochemisch lassen sich verschiedene Neurotransmitter in den Neuronen der Substantia nigra nachweisen, jedoch sticht ein hoher Dopamingehalt besonders hervor. Über die genannten dopaminergen Neurone werden Signale vermittelt, die besonders auf die Planung und den Beginn einer Bewegung wirken („Starterfunktion“) und ebenso wird von diesem Neuronensystem die Motorik überwacht. Entstehen hier Gewebeabbau durch Alterung oder neurologische Krankheiten, verletzungsbedingte Gewebezerstörungen oder Tumoren, führt dies zu Bewegungs- und Gangstörungen. 5 2.2 Neurotransmitter Die Evolution hat sich bei der Signalweiterleitung für chemische Schnittstellen entschieden, damit das Signal, wie bei einer Einbahnstraße nur in eine Richtung weitergeleitet werden kann. Es gibt afferente Bahnen, z.B. vom Sensor zum Gehirn und efferente Bahnen, z.B. vom Gehirn zum Muskel. Die Signalstoffe, die an den Schnittstellen (Synapsen) ihre Wirkung entfalten, nennt man Neurotransmitter. Dies sind biochemische Stoffe, die durch elektrische Reize von einer Nervenzelle abgegeben werden und damit die Reizleitung eines Nervenimpulses modulieren, den Reiz verstärken oder abschwächen. Nervenzellen verknüpfen sich untereinander mit Synapsen. Die gemeinsame Verbindungsstelle der Nervenzellen ist der sogenannte synaptische Spalt, der die Weiterleitung eines Signals reguliert. Wird eine Nervenzelle durch einen ankommenden elektrischen Impuls (Aktionspotential) erregt, so schütten die Speicherorte (Vesikel) der Neurotransmitter ihre Botenstoffe in den synaptischen Spalt aus und ermöglichen damit die Besetzung der Rezeptoren des nachgeschaltenen Neurons. Die Wirkung des Aktionspotentials wird auf diese Art und Weise in ein chemisches Signal umgewandelt, welches die Weiterleitung des Aktionspotentials steuert. Der Neurotransmitter selbst wird nach seiner Ausschüttung schnell enzymatisch abgebaut und der Wiederverwendung zugeführt. Abbildung 4: Synaptische Übertragung (aus www.medizininfo.de/kopfundseeele/alzheimer /synaptische_uebertragungung.shtml 11.03.2008) Einteilung der Neurotransmitter Chemisch gesehen handelt es sich bei den Neurotransmittern um eine sehr heterogene Gruppe. Sie lassen sich nach unterschiedlichen Kriterien einteilen. Eine der möglichen Einteilungen ist die Klassifizierung nach ihren chemischen Merkmalen in Neuropeptide, biogene Amine, Aminosäuren und lösliche Gase. 6 Ebenso ist eine Unterteilung in kleinmolekulare Substanzen und neuroaktive Peptide möglich. Zu den Neuropeptiden zählen unter anderem Endorphine, Enkephaline, Substanz P, Somatostatin und Insulin. Dopamin, Adrenalin, Noradrenalin, Acetylcholin, Histamin und Serotonin gehören zu den biogenen Aminen. Zur Gruppe der Aminosäuren gehören Glutamat, Aspartat, Glyzin und γAminobuttersäure (GABA). Beispiele für atemgängige lösliche Gase sind Stickoxid und Kohlenstoffmonoxid (siehe Tabelle). Nicht alle Neurotransmitter sind in jeder Nervenzelle enthalten, sondern je nach dem Aufgabengebiet der Nervenzelle verteilt. Stoffgruppe Neurotransmitter Neuropeptide Endorphine, Enkephaline, Substanz P, Somatostatin und Insulin Biogene Amine Dopamin, Adrenalin, Noradrenalin, Acetylcholin, Histamin und Serotonin Aminosäuren Glutamat, Aspartat, Glyzin und γ-Aminobuttersäure (GABA) Lösliche Gase Stickoxid und Kohlenstoffmonoxid Tabelle 1: Einteilung der Neurotransmitter in deren Stoffgruppen 2.3 Dopamin Dopamin ist ein biogenes Amin. Es hat die Summenformel C8H11NO2 und folgende Strukturformel: Abbildung 5: Strukturformel von Dopamin Dopamin kann im menschlichen Organismus aus den Aminosäuren Phenylalanin beziehungsweise Tyrosin synthetisiert werden. Die für die Synthese benötigten Reaktionsschritte laufen in den chromaffinen Zellen von Nebennierenmark, Hypothalamus, Substantia nigra und in anderen Teilen des Nervensystems ab. Dopamin ist ein Zwischenprodukt der Synthese von Adrenalin und Noradrenalin, fungiert aber auch selbst als Neurotransmitter. 2.3.1 Synthese von Dopamin Als Ausgangssubstanz dient die Aminosäure Tyrosin, welche zuerst die Bluthirnschranke passieren muss, da die Synthese in den dopaminergen Neuronen der Substantia nigra abläuft. 7 Die Blut-Hirn-Schranke ist eine physiologische Barriere zwischen ZNS und Blutkreislauf. Sie schränkt den Austausch von verschiedenen chemischen Substanzen und Krankheitserregern zwischen dem Blutkreislauf und dem neuronalen Gewebe ein, während sie den Durchfluss von essentiellen Substanzen (z.B. Sauerstoff) erlaubt. Die Blut-Hirn-Schranke ist wichtig, damit Milieubedingungen im Gehirn unbeeinflusst vom restlichen Blutkreislauf aufrecht erhalten bleiben und schützt das Gehirn vor gefährlichen Toxinen. Substanzen wie Alkohol, Nikotin und Drogen können diese Schranke überwinden, weil sie fettlöslich sind. Wasserlösliche Stoffe müssen über die Transportsysteme der Endothelzellen (Zellen, die die Blutgefäße auskleiden) ins Gehirn eingeschleust werden. Somit haben Endothelzellen die Kontrolle darüber, welche Substanzen ins Gehirn eindringen können und welche ausgesperrt bleiben. Im ersten Schritt wird Tyrosin am C3-Atom durch das Enzym Tyrosin-Hydroxylase mit einer zweiten Hydroxylgruppe ausgestattet und liegt damit als L-DOPA (3,4-Dihydroxyphenyl alanin) vor. Danach decarboxyliert das Enzym LDOPA-Decarboxylase das entstandene Molekül zum Stoffwechsel-wirksamen Amin Dopamin. Abbildung 6: Synthese von Dopamin Die Geschwindigkeit der Umwandlung von Tyrosin in L- (aus www.wikipedia.org/wiki/Dopamin 11.03.2008) DOPA wird durch einen essentiellen Cofaktor, dem Tetrahydrobiopterin (BH4) gesteuert. Tetrahydrobiopterin selbst Abbildung 7: Strukturformel von BH4 8 entsteht durch die Umwandlung von Guanosintriphosphat (GTP), welche durch die GTP-Cyclohydrolase I katalysiert wird. Als weitere Cofaktoren werden Magnesium und Zink benötigt. 2.3.2 Wirkung von Dopamin Im Volksmund gilt Dopamin als Glückshormon. Genauer betrachtet wird es aber für eine Vielzahl von lebensnotwendigen Steuerungs- und Regelungsvorgängen benötigt: • Dopamin ist an der Steuerung der Motorik beteiligt. Dopaminerge Bahnen von der Substantia nigra im Mittelhirn zu den Basalganglien spielen eine wichtige Rolle bei der Bewegungssteuerung, d.h. Dopamin gibt die Befehle des Nervensystems an die Muskulatur weiter (siehe Abbildung 2). • Dopamin beeinflusst Wahrnehmung und Gefühle. • Dopamin hemmt in der Hypophyse die Ausschüttung des Hormons Prolaktin, welches die Produktion von Milch in der Brustdrüse steuert. • Als Neurotransmitter im vegetativen Nervensystem reguliert es die Durchblutung innerer Organe. Insbesondere ist Dopamin an der Steuerung der Urinproduktion in den Nieren beteiligt. 2.3.3 Dopamin-Rezeptoren Der Dopamin-Rezeptor ist die Empfangseinheit für Signale durch den Neurotransmitter Dopamin. Der Rezeptor sitzt auf der Zelloberfläche des postsynaptischen Neurons. Heutzutage sind uns fünf (in neueren Forschungen sogar 18!) verschiedene Dopamin-Rezeptoren bekannt. Aufgrund des intrazellulären Signalwegs und der Wirkungweise werden die Dopamin-Rezeptoren in zwei Gruppen eingeteilt: • D1-Familie (D1- und D5-Rezeptoren) Bei Stimulation der D1-Rezeptorgruppe durch Dopamin erfolgt die intrazelluläre Signalübermittlung zuerst über ein sogenanntes stimulierendes G-Protein. Dieses aktiviert das Enzym Adenylatcyclase. Die aktivierte Adenylatcyclase bewirkt die Umwandlung von intrazellulärem ATP in cAMP (cyclisches Adenosinmonophosphat). cAMP wiederum aktiviert andere intrazelluläre Proteine. Sinn dieser Signalkaskade ist vor allem die Verstärkung des Signals, 9 das von einem Rezeptor ausgeht, da auf jeder Aktivierungsstufe mehrere folgende Proteine aktiviert werden. Diese D1-Gruppe wirkt somit aktivierend auf die Zelle. • D2-Familie (D2,- D3,- D4-Rezeptoren) Bei Stimulation dieser Rezeptorgruppe durch Dopamin erfolgt die intrazelluläre Signalübermittlung zuerst über ein sogenanntes inhibitorisches, d.h. hemmendes G-Protein. Dieses Protein hemmt die Adenylatcyclase. Dadurch wird weniger cAMP hergestellt und somit der nachfolgende Signalweg gehemmt bzw. abgebremst. Außerdem aktiviert diese Gruppe die Kalium-Kanäle. Dadurch wird z.B. das Ruhepotential von Nervenzellen stabilisiert und eine Erregung einer Nervenzelle erschwert. Die D2-Gruppe wirkt somit hemmend auf die Nervenzelle. Abbildung 8: Diverse Dopaminrezeptoren (aus Doktorarbeit Stefan Pelz, Martin-Luther-Universität, Halle-Wittenberg, 2005) Es existieren aber auch präsynaptische Dopaminrezeptoren, welche die Ausschüttung von Dopamin im Sinne eines Rückkopplungs-Mechanismus („Feed back“) steuern. 10 Weiterhin gibt es an der präsynaptischen Nervenfaser den Autorezeptor (D2a), der die Impulsfrequenz dopaminerger Neurone steuert. Zusammenfassend wirken also die D1-verwandten Rezeptoren stimulierend, die D2-Rezeptoren jedoch hemmend. 3 Krankheiten, die mit Dopamin in Verbindung gebracht werden 3.1 Segawa-Syndrom als Dopaminmangelerkrankung Das Segawa-Syndrom gehört in das große Krankheitsbild der Dystonien. Als Dystonie bezeichnet man Bewegungsstörungen, die durch unwillkürliche, langsame, anhaltende Muskelkontraktionen charakterisiert sind. Diese führen zu drehenden, sich wiederholenden Bewegungen oder abnormen Haltungen. Die einzige, kausal behandelbare Dystonie ist das Segawa-Syndrom, welches leider oft sogar von Neurologen mit Parkinson verwechselt wird. 3.1.1 Entdeckungsgeschichte des Segawa-Syndroms Das Segawa-Syndrom und die Dystonien sind innerhalb der Neurologie noch relativ junge Krankheitsbilder. Der deutsche Neurologe Oppenheim führte 1911 den Begriff Dystonie ein, als er ein Syndrom mit Gangstörung als Dystonia musculorum deformans bezeichnete. Jedoch schon 1908 wurde dieses Krankheitsbild von seinem Fachkollegen Schwalbe als „eigentümliche tonische Krampfform mit hysterischen Symptomen“ beschrieben (Ceballos-Baumann, 1996; S. 89). Hinzugekommen sind viele neue Erkrankungsformen, die nicht nur Ähnlichkeiten in der Symptomatik, sondern auch Verwandtschaft in der pathophysiologischen Grundstruktur aufweisen. Eine dieser Erkrankungen ist das Segawa-Syndrom, eine seltene Dystonie, die der japanische Neurologe Masaya Segawa erstmals 1970 als eigenes Krankheitsbild beschrieb und somit Namensgeber dieses Krankheitsbildes wurde. Im Jahre 1976 erschien der erste englischsprachige Bericht (Segawa et al. 1976). In Fachkreisen ist das SegawaSyndrom auch als Dopamin-Responsive-Dystonie (DRD) bekannt. Heute wird sie häufig als DYT5-Dystonie bezeichnet. 11 3.1.2 Klinik und Symptome der Erkrankung Als früheste Symptome treten in der ersten Lebensdekade dystone Haltungen, zum Beispiel die Einwärtsdrehung der Füße, auf. Die Erkrankung verläuft unbehandelt in der Regel fortschreitend und erfasst die gesamte untere Extremität. In schweren Fällen generalisiert die Erkrankung und führt zu völliger Bewegungsunfähigkeit. Außer Dystonie finden sich beim Segawa-Syndrom eines oder mehrere Symptome der Parkinson-Erkrankung wie Rigor (erhöhte Steifigkeit der Muskeln), Bradykinese (Bewegungsverarmung und -verlangsamung), Tremor (Zittern), Dyskinesie (plötzlich auftretende Fehlbewegungen und Verkrampfungen der Muskulatur) und der Verlust von Haltungsreflexen. Die Ausprägung der Symptome unterliegt häufig einer tageszeitlichen Schwankung. In etwa 75 % der Fälle ist die Symptomatik in den Morgenstunden oder nach einer längeren Schlafphase gebessert und verschlechtert sich dann im Verlauf des Tages. 3.1.3 Diagnose Für einen mit dem Krankheitsbild vertrauten Neurologen ist die Diagnose extrem einfach, da der Verdacht des Segawa-Syndroms oft schon durch eine gezielte Befragung des Patienten bestätigt werden kann. Die Dystonie ist ein fehlregulierter Spannungszustand bestimmter Muskelgruppen, der durch die unwillkürlichen Verkrampfungen zu bizarren Körperhaltungen und Bewegungen führen kann. Im speziellen Fall des Segawa-Syndroms ist eine ausführliche Befragung von Eltern und betroffenem Kind wegweisend. Kein Labortest oder funktioneller Nerventest gibt einen spezifischen Hinweis auf die Erkrankung. Die Untersuchung des Patienten zeigt die für die Dystonie typischen Muskelverkrampfungen und das Muskelzittern. Der Arzt muss in dieser Situation nachfragen, ob nach dem Schlafen oder nach längeren Ruhephasen die Symptome weniger stark ausgeprägt sind und nach stärkeren körperlichen Belastungen (z.B. Spiel mit Freunden oder spazieren gehen) in ihrer Ausprägung deutlich zunehmen. Kinder können am Morgen oft selbst essen und müssen am Abend gefüttert werden. Bei dieser Konstellation von Symptomen und Krankengeschichte ist der Goldstandard der Diagnosestellung eine Testdosis von Dopamin zu verabreichen. Die Wirkung von Dopamin setzt 12 innerhalb von Stunden ein und beseitigt fast vollständig alle Symptome des Segawa-Syndroms. 3.1.4 Fehldiagnosen Beim Segawa-Syndrom handelt es sich um ein sehr seltenes und deshalb leider bei den Ärzten wenig bekanntes Krankheitsbild. Da die Symptome bei der Geburt kaum oder gar nicht ausgeprägt sind und keine perinatale Diagnostik möglich ist, wird die Diagnosestellung oft über Jahre verschleppt. Sollten Symptome schon bei einem Säugling auffallen, wird in der Regel ein verzögerter Geburtsverlauf mit einer Sauerstoffschädigung des Mittelhirns verantwortlich gemacht. Den betroffenen Eltern wird dann oft empfohlen, intensive Krankengymnastik zu betreiben, da möglicherweise ein geburtsbedingter Sauerstoffschaden des Gehirns zu irreversiblen Schäden geführt hat, die man durch physiotherapeutische Übungen in seiner Wirkung abschwächen kann. Leichte Symptome nach dem ersten Lebenshalbjahr fallen manchmal einem aufmerksamen Kinderarzt auf, der eine Bewegungsarmut der Beine, einen verzögerten Laufbeginn oder die Einwärtsdrehung meist des rechten Fußes feststellt. Es beginnt dann nicht selten für Eltern und Kind eine lange Odyssee durch verschiedene Fachgebiete der Medizin. Weil die Einwärtsdrehung des Vorfußes das häufigste Frühsymptom ist, wird der Kinderorthopäde als Erstes aufgesucht. Da die Dystonie normalerweise kein typisch orthopädisches Krankheitsbild verursacht und weitere hinweisgebende Symptome fehlen oder noch nicht auffallen, ist die häufigste Fehldiagnose eine Schwäche des sogenannten Peroneusnerven. Meist wird deshalb zunächst eine konservative Therapie beschritten, bei der durch Anlegen einer orthopädischen „Thomasschiene“, besonders in der Nacht, der Spitzfußstellung entgegengewirkt werden soll. Da aufgrund der Fehldiagnose naturgemäß keine Besserung eintreten kann, wird von orthopädischer Seite oft eine Verlängerungsoperation der Achillessehne oder eine andere Sehnenumstellungsoperation des Vorfußes vorgenommen, d.h. im ungünstigsten Fall wird die Diagnose über Monate und Jahre verschleppt und schließlich als Verzweiflungstat eine eingreifende, medizinisch nicht indizierte, verstümmelnde orthopädische Operation gewählt. 13 Die vermutete Schwäche des Peroneusnerven ruft oft den Neurologen auf den Plan. Da rein statistisch ein normaler Neurologe während seiner Lebensarbeitszeit nur einmal die Gelegenheit hat, die Erstdiagnose eines Segawa-Syndroms zu stellen, besteht leider auch hier eine große Wahrscheinlichkeit, dass die Diagnose nicht auf Anhieb korrekt gestellt wird. Der Patient durchwandert meistens zunächst einen Irrgarten von neurologischen Untersuchungsmethoden. Der Besuch beim Neurologen findet naturgemäß oft in den Vormittagsstunden statt, dann, wenn die Symptome am wenigsten ausgeprägt sind. Bei vielen Patienten mit Segawa-Syndrom wird die Nervenleitungsgeschwindigkeit des Peroneusnerven unter Stimulation als völlig normal gemessen. Eine Nerven- und Muskelbiopsie erbringt häufig auch eine völlig normale Gewebestruktur. Oft wird auch noch eine Nervenentzündung in Betracht gezogen, die zu einer Punktion des Gehirnwassers (Lumbalpunktion) führt. Größeres Glück mit einer früheren Diagnosestellung können Patienten haben, die glücklicherweise in den Abendstunden untersucht werden, nämlich dann, wenn zusätzliche Symptome wie Muskelkrämpfe oder Muskelzittern zur allgemeinen Muskelsteifheit hinzukommen. Überhaupt sorgt das oft tageszeitlich wechselnde Krankheitsbild zur Verwirrung von Eltern und Ärzten, da sich morgendliches normales Verhalten (aufgefüllte Dopaminspeicher) mit Muskelkrämpfen und Zittern nach starken körperlichen Belastungen (entleerte Dopaminspeicher) in bunter Folge abwechseln. Nicht wenige Patienten landen deswegen in der Psychiatrie, da ihnen Simulation, vegetative Dystonie oder versteckte Depression unterstellt werden. Die voreilige Verordnung von Tranquillizern (Beruhigungsmitteln) führt leider zu einer Abmilderung der typischen Leitsymptome der Erkrankung und oft zu einer fatalen Verschleierung der typischen Symptome mit psychiatrischen Fehldiagnosen, die alleine durch die medikamentöse Therapie zu erklären wären. Ein verschwindend kleiner Teil der Patienten wird aufgrund des in den Abendstunden vorherrschenden Zitterns als atypischer Parkinson eingestuft: nur sie erhalten glücklicherweise das typische Parkinsonmittel L-Dopa und gehen damit einer schnellen Behandlung entgegen. Sie werden mit dem einzig richtigen Medikament behandelt, allerdings ohne dass sie jemals ihre wahre Diagnose erfahren. Da das SegawaSyndrom auch Verspannungen im Bereich der Wirbelsäule erzeugen kann, die 14 unbehandelt zu Fehlstellungen der Wirbelkörper führen, verbleibt über 1/3 der Patienten in orthopädischer Behandlung, ohne der Diagnose einen Schritt näher zu kommen. Fehldiagnose in % Psychogene Ursache, „vegetative Dystonie“, larvierte Depression 28,9 Peroneusschwäche, Spitzfuß 25,2 Essentieller Tremor 8,4 Skoliose / Kyphose 5,8 „atypischer Parkinson“ 2,8 Andere orthopädische Diagnose 39,2 Spinale Muskelatrophie 2,8 „atypische Poliomyelitis“ 2,8 Inadäquate Therapiemaßnahmen in % Psychotherapie oder Unterbringung in psychiatrischer Einrichtung 22,4 Invasive orthopädische Therapie (Achillotomie, Sehnenumstellung) 16,8 Peroneusschiene, Thomasschiene, Stützkorsett 14,0 Andere konservative orthopädische Therapie 30,8 Betablocker, Tranquilizer 5,8 Tabelle 2: Fehldiagnosen und inadäquate Therapien (nach Deutsches Ärzteblatt 93, Heft 24, 14.Juni 1996 (57)) 3.1.5 Therapiemöglichkeiten unter dem Aspekt der Dosierung Sollte die Diagnose Segawa-Syndrom gestellt worden sein, so ist die Therapie einfach. In den meisten Fällen mindert eine Dosis von 20 mg pro kg Körpergewicht pro Tag von L-DOPA die Symptome vollständig. Da L-DOPA auch zur Parkinsonbehandlung und zum Eindämmen des „Restless-LegsSyndrom“ (Ruhelosigkeit der Beine) verwendet wird, ist es leicht und weltweit erhältlich. Es ist auch eine vergleichsweise billige Therapie. Die Strukturformel von L-DOPA ist: Abbildung 9: Strukturformel von L-DOPA 15 Als Arzneistoff wurde L-DOPA unter dem Namen Madopar® 1973 von Hoffmann-La Roche erstmals auf den Markt gebracht. Heute gibt es verschiedene Präparate, wobei L-DOPA in Kombination mit verschiedenen Decarboxylasehemmern verwendet wird: Madopar® (L-DOPA, Benserazid); Roche Nacom® (L-DOPA, Carbidopa); Bristol-Myers Squibb GmbH Warum wird L-DOPA und nicht Dopamin verabreicht? Der eigentliche Wirkstoff Dopamin kann die oben beschriebene Blut-HirnSchranke nicht überwinden. L-DOPA wird als „Prodrug“ bezeichnet. Es handelt sich dabei um die Vorstufe des eigentlichen Wirkstoffs. Die medikamentös wirksame Form Dopamin wird aus L-DOPA unter CO2-Abspaltung im Körper gewonnen. Abbildung 10: Wirkmechanismus eines Kombinationspräparates aus L-DOPA und Carbidopa (nach www.wikipedia.org/wiki/Parkinsonmittel 11.3.2008) L-DOPA aber muss mit Decarboxylase-Hemmern kombiniert werden, um eine Abspaltung von CO2 von L-DOPA vor dem Passieren der Blut-Hirn-Schranke zu vermeiden. Ohne Decarboxylierungshemmung würde 95 % des verabreichten L-DOPAs bereits außerhalb des Gehirns decarboxyliert und damit unwirksam gemacht werden. 16 Der Decarboxylase-Hemmer wiederum kann die Blut-Hirn-Schranke nicht passieren, was eine CO2-Abspaltung im Gehirn zur Folge hat. Somit liegt nun der gewünschte Wirkstoff Dopamin im Gehirn vor. Die tatsächliche Dosierung des Medikaments muss durch langsames Herantasten an die optimale Verabreichungsmenge für jeden Patienten individuell herausgefunden werden. Ist die Dosierung zu niedrig, so treten die Symptome des Segawa-Syndroms noch in verminderter Form auf. Die Muskelkrämpfe werden zwar schwächer und das Nachinnendrehen der Füße ist weniger stark ausgeprägt, jedoch noch deutlich erkennbar. Sollte zu viel des Medikamentes verabreicht werden, so kommt es zu Hyperaktivität, zittrigen und fahrigen Bewegungen, welche ruhiges Stillsitzen unmöglich machen. Ist die richtige Dosierung für den Patienten gefunden worden, so ist dieser völlig symptomfrei. Bei Kindern, die sich noch im Wachstum oder in der Pupertät befinden, muss das Medikament immer wieder neu dosiert werden und dem Köperwachstum angepasst werden. Es ist von Vorteil, die Tagesdosis auf mehrere Einnahmen zu verteilen. Zum Beispiel morgens zum Frühstück eine Einheit einnehmen und eine zweite Einheit zum Mittagessen, welche dann bis zum Abend wirkt. Sollte der Patient Abends nach einem anstrengenden Tag ein Zittern verspüren, ist es vorteilhaft eine Tablette einzunehmen, um besser einschlafen zu können. Nebenbemerkungen zu L-DOPA: • Im Buch „Awakenings“ (1973, Vintage Books) von Oliver Sacks schildert der Neurologe sehr anschaulich das Herantasten an die optimale Dosierung von L-DOPA und die leider nur kurzzeitigen Therapieerfolge bei Patienten, welche an Europäischer Schlafkrankheit (Encephalitis lethargica), einer Gehirnentzündung, erkrankt sind. • Der Nobelpreis für Medizin wurde 2000 an den schwedischen Wissenschaftler Arvid Carlsson vergeben, der als erster Forscher Mäusen mit Parkinsonsymptomen L-DOPA verabreichte und somit die Wirksamkeit des Medikaments L-DOPA im Tierexperiment nachwies. • Der Nobelpreis für Chemie ging 2001 an William S. Knowles für seine Arbeit an der Synthese von L-DOPA. 17 3.1.6 Genetik Das Segawa-Syndrom wird normalerweise autosomal-dominant vererbt, wobei Frauen weitaus häufiger betroffen sind als Männer (4:1). Bei den meisten Segawa-Betroffenen finden sich keine weiteren Familienangehörigen, die auch betroffen sind. Dies wurde damit erklärt, dass ein Großteil der Segawafälle auf Neumutationen zurückzuführen ist oder, dass aufgrund der unvollständigen Penetranz des Merkmals nur sehr wenige Träger des mutierten Gens auch erkranken. Verschiedene Gendefekte können zum gleichen Krankheitsbild führen. Das Segawa-Syndrom ist somit eine heterogene Erkrankung: • Es fand sich ein Gen auf Chromosom 14, welches für das Enzym GTPCyclohydrolase I (GCH I) codiert (siehe Synthese von Dopamin). Durch molekulargenetische Untersuchungen konnten Mutationen in dem Gen für GCH I bei Segawa-Patienten nachgewiesen werden. Diese Mutationen führen zu einer Verminderung der Enzymaktivität und damit zu einer verringerten Dopamin-Synthese. Die GTP Cyclohydrolase I wird durch das Gen GCH I auf Chromosom 14q22.1-q22.2 kodiert. Das Gen besteht aus 6 Exonen, die über 30 kb verteilt sind. Durch Mutationen in diesem Gen entsteht das Krankheitsbild des Segawa-Syndroms. Abbildung 11: Chromosom 14 mit GCH I-Genlocus (aus http://ghr.nlm.nih.gov/gene=gch1 11.03.2008) • Es ist auch eine vermutlich autosomal-rezessiv vererbte Form des Segawa-Syndroms im Gespräch. Bei dieser handelt es sich um eine 18 Mutation auf Chromosom 11 (Gen besteht aus 14 Exonen), wobei die Tyrosinhydroxylase nur unzureichend gebildet werden kann. Abbildung 12: Wirkstellen von GTP I und Tyrosinhydroxylase (nach Deutsches Ärzteblatt 93, Heft 24, 14.Juni 1996 (57)) Modus der Vererbung Chromosomale Lokalisation Mutation im Gen codierend für autosomal-dominant 14q22.1-q22.2 GTP-Cyclohydrolase I autosomal-rezessiv 11p15.5 Tyrosinhydroxylase Tabelle 3: Enzyme und korrespondierende Gene 3.1.7 Epidemiologie, Verbreitung Das Segawa-Syndrom ist eine seltene Krankheit mit geschätztem Vorkommen von 0,5 bis 1 pro 1 Mio. Einwohner, d.h. in Deutschland gibt es nur knapp 100 Patienten. Von den meisten Fällen wird in Japan und Südostasien berichtet. Aber mit steigendem Bewusstsein für diese Krankheit wird man auch in anderen Teilen der Welt mehr Erkrankungen entdecken. Epidemiologische Studien über das Auftreten des Segawa-Syndroms fehlen. 3.2 Schizophrenie, diskutiert als Dopaminüberschusserkrankung 3.2.1 Symptome Unter dem Sammelbegriff Schizophrenie wird eine Gruppe von Erkrankungen mit bestimmten Gemeinsamkeiten zusammengefasst, die sich durch 19 Realitätsverkennung auszeichnet. Sie wirken sich auf das Denken, die Überzeugung, die Wahrnehmung und die Gefühle des betroffenen Patienten aus, während die Intelligenz in der Regel nicht betroffen ist. Bei dieser Krankheitsgruppe unterscheidet man die vielfältigen Symptome nach zwei Kategorien: der sog. Positiv- und Negativ-Symptomatik. Die PositivSymptomatiken gehen einher mit einer „Mehr“-Wahrnehmung als dem real Erlebten. Typisch für Positivsymptome sind Wahnvorstellungen, Halluzinationen und Ich-Störungen, wie z.B. soziales Fehlverhalten. Die NegativSymptomatiken zeichnen sich aus durch ein vermindertes Realitätserleben. Hierbei typisch sind Symptome wie Motivationsarmut, Affektverflachung, emotionaler- und sozialer Rückzug (Anti-Sozial), Denkverarmung, sogenannte Ambivalenz (widersprüchliche Emotionen und Gedanken). Schizophrenie hat aber - entgegen einer häufigen Meinung - nichts mit einer gespaltenen Persönlichkeit zu tun. Erkrankte sind auch nicht gewalttätiger als Personen ohne dieser Erkrankung! 3.2.2 Verbreitung Schizophrenie ist weit häufigerer verbreitet als allgemein angenommen wird. Sie betrifft Menschen aller Kulturen und aller Biographien. Unter hundert Menschen aus einem beliebigen Land findet sich im Durchschnitt einer mit Schizophrenie, d.h. etwa 1% der Bevölkerung ist von dieser Krankheit betroffen. In Deutschland sind dies rund 700.000, weltweit 60 Millionen Menschen. Spricht man vom „Lifetime-Risiko“, so heißt dies, dass statistisch gesehen jeder Hundertste mindestens einmal im Leben eine schizophrene Phase durchlebt. Am häufigsten haben junge Erwachsene mit dieser Krankheit zu kämpfen, die Krankheit kann aber auch früher oder später beginnen. Männer und Frauen erkranken in etwa gleich häufig, Frauen (zwischen dem 25. und 30. Lebensjahr) erkranken aber im Durchschnitt 5 Jahre später als Männer (zwischen dem 20. und 25. Lebensjahr). Das Erkrankungsrisiko beträgt etwa 1:10, wenn bei einem Elternteil oder einem Geschwister Schizophrenie diagnostiziert wurde. Sind beide Eltern betroffen steigt das Risiko sogar auf 1:3, bei eineiigen Zwillingen ist das Risiko 1:2, bei Zweieiigen etwa 1:4. Wenn dagegen Onkel, Tante, ein Cousin oder eine 20 Cousine betroffen sind, liegt das Risiko zu erkranken, nicht sehr viel über dem der Normalbevölkerung (1:100). Dies alles spricht für eine starke genetische Komponente dieser Erkrankung. Genetische Faktoren Ohne Familienanamnese ca. 1% Onkel, Tante 2,4% Ein Elternteil 5,6% Geschwister 10% Zweieiige Zwillinge Eineiige Zwillinge 15,5% 40% Tabelle 4: Erkrankungsrisiko der Schizophrenie 3.2.3 Vererbung Es ist bisher noch niemandem gelungen, ein Gen zu finden, welches für die Entwicklung einer Schizophrenie verantwortlich gemacht werden könnte. Wäre Schizophrenie eine rein genetisch verursachte Erkrankung, müsste das Erkrankungsrisiko bei eineiigen Zwillingen 100% betragen. Vermutlich kann aber die „Anfälligkeit“ vererbt werden, d.h. die Wahrscheinlichkeit an Schizophrenie zu erkranken. Dies erklärt die gesteigerte Häufigkeit innerhalb von Familien. Man kann dies in Analogie zu Diabetes Typ I sehen, eine Erkrankung, bei der auch die Veranlagung vererbt wird, aber es zusätzlich Faktoren von Außen braucht, um die Krankheit zum Ausbruch zu bringen. 3.2.4 Auslösende Ereignisse Als Auslöser einer Schizophrenie können Lebensereignisse wirken, die mit viel Stress verbunden sind. Beispielhaft werden oft schulische Veränderungen, Beziehungsänderungen oder die Geburt eines Kindes angegeben. Auch andere Faktoren, wie Alkoholkonsum oder Drogen, können diese Erkrankung auslösen oder verschlimmern. Bei manchen Patienten treten die Symptome der Psychose auch erstmals bei hohem Fieber oder während einer anderen Erkrankung auf. 21 Risikofaktoren für schizophrene Erkrankungen: • • • • • • • Positive Familienanamnese Geburtskomplikationen Virusinfektion der Mutter in der zweiten Schwangerschaftshälfte Frühkindliche Infektionen Frühkindliche Hirnschädigung Drogen Konfliktreiche Beziehungen 3.2.5 Mögliche Ursachen und Diagnoseansätze Die genaue Ursache der Schizophrenie ist bislang nicht geklärt, aber es gibt verschiedene Forschungsansätze. 3.2.5.1 Dopaminhypothese Die Dopaminhypothese stellt einen Zusammenhang zwischen dem Neurotransmitter Dopamin und den psychotischen Krankheitsbildern der Schizophrenien her. Die Geschichte der Dopaminhypothese beginnt in den 60er Jahren des 20. Jahrhunderts und ist bis heute noch nicht abgeschlossen. Grundlage der Theorie war es, schizophrene Symptome auf der Basis einer gestörten dopaminergen Signalübertragung zu erklären. Dies beruht auf der Beobachtung, dass beim Verabreichen von Chlorpromazin, dem ersten klassischen Neuroleptikum der Medizingeschichte, die dopaminerge Signalübertragung geblockt wird und sich eine schizophrene Psychose verbessern kann. Die Basis der Dopaminhypothese bildet die Wirksamkeit von D2-blockierenden Neuroleptika, die zu einer klinischen Verbesserung der Symptome der Schizophrenie führt. Die Annahme, dass es sich um eine Erhöhung der zentralen Dopamin-D2-Rezeptoren handelt, konnte durch neuartige Verfahrensweisen an der Columbia Universität wiederlegt werden. Die Dopaminhypothese geht davon aus, dass eine überschießende Verfügbarkeit von Dopamin im Gehirn zu psychotischen Realitätsverkennungen führt. Dies wird mit verfälschten Reizübertragungen in den Synapsen aufgrund abnorm hoher Neurotransmitterkonzentrationen erklärt. 22 Abbildung 13: Dopaminmodell (aus www.psychiatrie.uni-luebeck.de/lehre/Schizophrenie 11.03.2008) Die Beobachtung, dass Neuroleptika zentrale Dopamin D2-Rezeptoren blockieren, unterstützt diese Hypothese und führte zu einem Therapieansatz der Schizophrenie (siehe Therapie). Die Dopaminhypothese wird auch getragen von der Beobachtung, dass dopaminerge Substanzen eine akute Psychose auslösen können. So kann die dopaminerge Therapie eines Parkinson-Patienten zu Symptomen der Schizophrenie führen. Die Schizophrenie-auslösende Eigenschaft von Drogen kann neurophysiologisch wie folgt erklärt werden: Kokain stimuliert die Ausschüttung von Dopamin in den synaptischen Spalt und Amphetamine hemmen die Dopaminaufnahme in präsynaptische Nervenendigungen und steigern damit ebenfalls die Neurotransmitterkonzentration von Dopamin im synaptischen Spalt. Die Dopaminhypothese: Ein Modell mit zu vielen Fehlern? Gegen die Dopaminhypothese spricht, dass Negativsymptome durch die Behandlung mit klassischen Neuroleptika entstehen können oder nicht behandelbar sind. Es werden also nur die Positivsymptome der Schizophrenie verdeckt. Die Dopaminhypothese ist aber bis heute eines der beständigsten Konzepte beim Erklären der Ursachen von Schizophrenien. Zusammenfassend muss man feststellen, dass die Schizophrenie im Gegensatz zum Segawa-Syndrom wahrscheinlich eine Dopaminüber schusserkrankung darstellt. 23 3.2.5.2 Glutamathypothese Im Gegensatz zur Dopaminhypothese steht die Glutamathypothese. Postuliert wird eine Unterfunktion von Glutamat am NMDA-Rezeptor (dem Glutamatrezeptor), als deren Folge es zur Ausbildung der Negativ-Symptomatik bei Schizophrenien kommt. Bei dieser Hypothese gelingt es mittels NMDA-Rezeptorantagonisten, wie Phenylcyclidin oder Ketamin eine Modellpsychose hervorzurufen, die wesentlich größere Ähnlichkeit mit schizophrenen Erkrankungen aufweist, wie andere Modellpsychosen. In der klinischen Praxis wurde Ketamin bereits als Provokationstest bei Schizophrenen eingesetzt. Die Patienten berichteten auch, dass der dabei induzierte Zustand ihrer Psychosen wesentlich ähnlicher sei, als Zustände, die bei anderen psychoaktiven Substanzen induziert werden. Die unmittelbaren therapeutischen Verwendungen dieser Hypothese sind aber deutlich eingeschränkt, da Glycin, ein Glutamatantagonist, neurotoxisch wirkt. 3.2.5.3 Theorie der neuronalen Entwicklungsstörung Neben der Dopamin- und Glutamathypothese, die einen biochemischen Erklärungsversuch darstellen, lassen sich manchmal im Gehirn von Schizophrenen auch organische Veränderungen finden. Manche schizophrene Patienten weisen leicht erweiterte Hirnventrikel auf. Oft tritt ein teilweiser Mangel an Nervenfasern und Nervenverbindungen auf, ein Phänomen, welches im Hirngewebe verstorbener Schizophrener nachgewiesen werden konnte. Bei Spezialuntersuchungen der Gehirne von SchizophreniePatienten, ist oft eine verminderte Aktivität des Frontalhirns zu erkennen. Diese messbaren Größen lassen sich durch die Theorie der neuronalen Entwicklungsstörung erklären. Hier wird ein Zusammenhang von Schizophrenie und frühkindlichen Hirnschädigungen angenommen, wie sie z.B. bei Geburtskomplikationen auftreten. Auch sollen frühkindliche Infektionen eine Rolle spielen können. Es stehen bestimmte Viren (Herpes simplex, Influenza und Borna-Viren) und andererseits Protozoen, wie Toxoplasma gondii (Übertragen durch Kontakt mit Katzen) und bestimmte Borellien (Zeckendiskussion) unter Verdacht Schizophrenie auszulösen. Diese Theorie der Entstehung der Schizophrenie ist jedoch nicht unumstritten, da hier mit dem Nachweis von Antikörpern im Blutserum argumentiert wird und 24 dieses Vorgehen wegen methodischer Unsicherheiten oft angezweifelt wird. Beide dieser biologischen Faktoren führen zu Entwicklungsstörungen im Gehirn, welche sich in einer veränderten Vernetzung von Nervenzellen im Feinaufbau des Gehirns äußern. Für diese Hypothese spricht der Zeitpunkts des Ausbruchs in der Pubertät, da es in diesem Lebensabschnitt zur vollständigen Hirnreifung kommt. 3.2.5.4 Vulnerabilitäts-Stress-Coping-Modell Ein weiteres Modell, welches die Entstehung der Schizophrenie erklären soll, ist das „Vulnerabilitäts-Stress-Coping-Modell“. In der Medizin bezeichnet Vulnerabilität (Verletzbarkeit) die Anfälligkeit, z.B. an Schizophrenie, zu erkranken. Bei vielen Erkrankungen wird die Anfälligkeit des Einzelnen durch verschiedene zusammenwirkende Faktoren bedingt. Eine angeborene, perinatale oder biographisch erworbene Vulnerabilität kann durch Stress zur Psychose führen. Ist diese Psychose durch Medikation unter Kontrolle, kann Stress zu einer erneuten Entgleisung führen. Abbildung 14: Stressabhängigkeit der Psychose (nach www.psychiatrie.uni-luebeck.de/lehre/Schizophrenie 11.03.2008) 3.2.6 Therapie Bis heute sind die schizophrenen Störungen nicht heilbar. Frühere Behandlungen, wie Insulinschock, Elektroschock oder Operationen am Frontallappen des Gehirns sind veraltet, da ihre Wirksamkeit nicht bewiesen werden konnte. 25 Heute unterscheidet man eine medikamentöse und eine nicht-medikamentöse Behandlung, wobei festgestellt werden muss, in welcher Phase der Erkrankung sich der Patient befindet. In der akuten Phase steht häufig die medikamentöse Behandlung im Vordergrund. Es werden, aufgrund der Dopaminhypothese, Neuroleptika eingesetzt, welche in den Neurotransmitterstoffwechsel eingreifen und damit schnell die Akut-Symptomatik mildern oder beseitigen können. Ältere Neuroleptika greifen in den Dopaminstoffwechsel ein. Hier treten aber oft gravierende Nebenwirkungen, wie Bewegungsstörungen, parkinsonähnliche Symptome und Ataxien (quälende Bewegungsunruhen) auf. Zusätzlich zu diesen Neuroleptika werden oft Antidepressiva oder angstlösende Medikamente vom Arzt verordnet. Abbildung 15: Wirkprinzip von Neuroleptika (aus www.psychiatrie.uni-luebeck.de/lehre/Schizophrenie 11.03.2008) In der nicht-akuten Phase, welche oft am Beginn der Erkrankung steht, ist eine nicht-medikamentöse Behandlung zu bevorzugen. Hierbei soll eine Bindung an den Therapeuten geschaffen werden. Im Vordergrund steht hier eine psychosoziale Erziehung. Dies kann durch Soziophrenietherapie, Arbeitstherapie und Ergotherapie erreicht werden, welche helfen sollen dem Patienten eine Tagesstruktur zu schaffen. Es wird darauf hingearbeitet, den Erhalt des Arbeitsplatzes oder eine Wiedereingliederung in die Gesellschaft zu ermöglichen. Begleitende Psychotherapie soll dem sozialen Abstieg entgegenwirken, indem von Betroffenen Eigenverantwortung wiedererlernt werden soll. Es kann hier aber nur eine konsequente Therapie, die möglichst früh beginnt die Krankheitsaussichten verbessern. Bei Patienten, welche die Kontrolle über ihren Krankheitsverlauf verloren haben, führt dies meist zu 26 schweren psychosozialen Einschränkungen, welche auch eine dauerhafte Betreuung und die regelmäßigen Gabe von Medikamenten notwendig macht. 3.2.7 Volkswirtschaftliche Bedeutung Die Schizophrenie ist die kostenintensivste psychiatrische Erkrankung überhaupt. Die jährlichen Gesamtkosten belaufen sich in Deutschland auf circa 5 Mrd. €. Mit circa 2,5 Mrd. € bringt die gesetzliche Krankenversicherung rund 1,7% ihrer gesamten Ausgaben für die Behandlung der Schizophrenien auf. Die Gesamtkosten sind damit mindestens vergleichbar mit denen der großen Volkskrankheiten wie Diabetes mellitus oder koronare Herzkrankheit. Die Weltgesundheitsorganisation (WHO) stuft die Schizophrenie weltweit als eine der teuersten Krankheiten ein. Die Gründe sind ihre Häufigkeit, der chronische Verlauf und die Beeinträchtigung der Fähigkeit zu selbständigem Leben. 4 Ausblick Wird es in der Zukunft eine Möglichkeit geben diese beiden Krankheiten zu heilen? Ethisch nicht unumstritten ist in unser heutigen Gesellschaft die moderne Gentherapie. „Unter Gentherapie versteht man alle Verfahren, die Ursache genetisch bedingter Erkrankungen durch Veränderung des Genoms behandeln. Es gibt die somatische Gentherapie und die Keimbahntherapie. Letztere ist in Deutschland verboten, da sie auf Ei- und Stammzellen zugreift. Bei der somatischen Gentherapie dagegen, werden nur Körperzellen in ihrer genetischen Zusammensetzung verändert. So ist die Therapie auf ein Individuum beschränkt.“ (aus www.stmugv.bayern.de/umwelt/gentechnik/anwendung/therap.htm) Bei Betrachtung der somatischen Genterapie in den oben diskutierten Krankheiten, unterscheiden sich diese sehr stark: Beim Segawa-Syndrom ist ein Genlokus bekannt und es wäre sicherlich in absehbarer Zeit möglich, diese Krankheit zu heilen. Leider wird es schwierig sein für die Forschung daran einen Geldgeber zu finden. Umgekehrt stellt sich dies bei der Schizophrenie dar: aufgrund der hohen Patientenzahlen ist es vorstellbar, dass viel Geld investiert würde; bei der 27 Schizophrenie gibt es aber keine Gendiagnose, weshalb bis heute keine Heilung in Aussicht ist. Ob für mich persöhlich die somatische Gentherapie die Heilung meiner Erkrankung darstellt, ist also noch nicht sicher, jedenfalls werde ich das Zeitalter der heilbaren Erbkrankheiten noch erleben. Literatur Bücher: • Segawa M., Hereditary Progressive Dystonia with Marked Diurnal Fluctuation, Verlag Parthenon Publishing, 1993 • Silbernagl S. und Lang F., Taschenatlas der Pathophysiologie, Verlag Thieme, 2005 • Prof. Dr. Linder H. und Prof. Dr. Knodel H., Linder Biologie, Verlag Schroedel, 2005 • Netter F. H., Atlas der Anatomie des Menschen, Band 1: Kopf und Hals, Verlag Novartis, 2003 • Hoffmann G. F. und Assmann B., Stoffwechselerkrankungen in der Neurologie, Verlag Thieme, 2004, Seite 92 – 101 • Klinke R. und Silbernagl S., Lehrbuch der Pysiologie, Verlag Thieme, 2001 • Masuhr K. F. und Neumann M., Neurologie, Verlag Thieme, 2005 Zeitschriften: • Steinberger D. und Müller U., Molekulargenetik und Klinik der Doparesponsiven Dystonie, in Deutsches Ärzteblatt 93, Heft 24, 14. Juni 1996, S.57 – 59 • Heinz A., Dopaminhypothese der Schizophrenien, in Der Nervenarzt, Januar 2000, S. 54-57 • Segawa M, Hosaka A, Miyagawa F, Nomura Y, Imai H (1976) Hereditary progressive dystonia with marked diurnal fluctuation. Adv Neurol 14: 215233 28 Doktorarbeiten: • Moers M. M., L-Dopa responsive Dystonie: Epidemiologische, klinische, psychosoziale und genetische Aspekte, Technische Universität, München, 1997 • Pelz S., Beurteilung der striatalen Dopamin-D2-Rezeptorblockade durch Neuroleptika mit Hilfe der 123Jod-IBZM-SPECT, Martin-LutherUniversität, Halle-Wittenberg, 2005 • Goertz M., Der Phenylalanin-Belasungstest in der Differentialdiagnose verschiedener Dystonieformen, Philipps-Universität, Marburg 2003 Internet: • www.neurologie.uni-duessldorf.de/priv-volkmann/Dystonia/drd.html (11.03.2008) • www.segawa.eu/texte/segawa-luebeck.htm (21.09.2008) • Röhl J.-E., Prof. Dr. med. Einhäupl K. M., Dr. med. Trottenberg Th., Dystonie, www.charite.de/ch/neuro/klinik/patienten/ag_bewegungsstoerungen/pdf/ Dystonie.pdf (11.03.2008) • www.dystonie.de/v2/index.htm (Deutsche Dystonie Gesellschaft) (11.03.2008) • www.dystonia-foundation.org/pages/more_info/64.php (11.03.2008) • Pfizer, Die Krankheit Schizophrenie, www.schizophrenieonline.de/patienten/krankheit_schizophreni/index.htm (11.03.2008) • www.flexikon.doccheck.com/Neurotransmitter (11.03.2008) • www.flexikon.doccheck.com/Dopamin (11.03.2008) • www.stmugv.bayern.de/umwelt/gentechnik/anwendung/therap.htm (19.01.2009) • http://deposit.ddb.de/cgibin/dokserv?idn=971888078&dok_var=d1&dok_ext=pdf&filename=9718 88078.pdf (19.01.2009) 29 Ich erkläre hiermit, dass ich die Facharbeit ohne fremde Hilfe angefertigt und nur die im Literaturverzeichnis angeführten Quellen und Hilfsmittel benützt habe. , den Ort Datum Unterschrift der Schülerin 30 Abbildung 1: Gehirnstrukturen ............................................................................ 4 Abbildung 2: Strukturen im Hirnstamm ............................................................... 4 Abbildung 3: Dopaminerge Bahnen im Gehirn ................................................... 5 Abbildung 4: Synaptische Übertragung .............................................................. 6 Abbildung 5: Strukturformel von Dopamin .......................................................... 7 Abbildung 6: Synthese von Dopamin.................................................................. 8 Abbildung 7: Strukturformel von BH4 ................................................................. 8 Abbildung 8: Diverse Dopaminrezeptoren ........................................................ 10 Abbildung 9: Strukturformel von L-DOPA ......................................................... 15 Abbildung 10: Wirkmechanismus eines Kombinationspräparates aus L-DOPA und Carbidopa ........................................................................................... 16 Abbildung 11: Chromosom 14 mit GCH I-Genlocus ......................................... 18 Abbildung 12: Wirkstellen von GTP I und Tyrosinhydroxylase ......................... 19 Abbildung 13: Dopaminmodell .......................................................................... 23 Abbildung 14: Stressabhängigkeit der Psychose.............................................. 25 Abbildung 15: Wirkprinzip von Neuroleptika ..................................................... 26 31