Zusammenfassung - B CUBE Dresden
Werbung

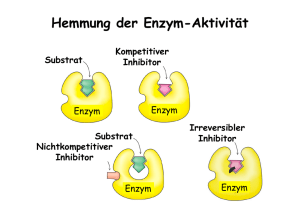
Basen Nukleobasen In der DNA vorkommend Adenin (A) C5H5N5 Purinbase Thymin (T) C5H6N2O2 Pyrimidinbase Guanin (G) C5H5N5O Purinbase Cytosin (C) C4H5N3O Pyrimidinbase In der RNA vorkommend Adenin, Guanin und Cytosin ebenfalls Thymin gegen Uracil ausgetauscht Uracil (U) C4H4N2O2 Pyrimidinbase Nukleosid (Base + Zucker) Mit Zucker Desoxyribose (Pentose) Desoxyadenosin (dA) Desoxythymidin (dT) Desoxyguanosin (dG) Desoxycytidin (dC) Mit Zucker Ribose (Pentose) Adenosin (A) Uridin (U) statt Thymidin Guanosin (G) Cytidin (C) Nukleotid (Base + Zucker + 1/2/3 Phosphatreste) DNA (Zucker Desoxyribose, Thymin) Desoxyadenosindiphosphat (dADP) Desoxythymidindiphosphat (dTDP) Desoxyguanosindiphosphat (dGDP) Desoxycytidindiphosphat (dCDP) RNA (Zucker Ribose, Uracil) Adenosindiphosphat (ADP) Uridindiphosphat (UDP) Guanosindiphosphat (GDP) Cytidindiphosphat (CDP) COFAKTOREN Def. Coenzym: Ein nicht-kovalent (dissoziierbar) an das Enzym gebundene organische Molekül, welches für die Katalyse essentiell ist. Def. prosthetische Gruppe: Ein kovalent (nicht dissoziierbar) an das Enzym gebundene organische Molekül, welches für die Katalyse essentiell ist. Def. Cosubstrat: Ein nicht kovalent an das Enzym gebundene organische Molekül, welches für die Katalyse essentiell ist, und aus der Reaktion verändert hervorgeht. Allgegenwärtige Co-Faktoren Cofaktorname Cofaktorart Enzym Funktion ATP Cosubstrat nicht enzymspezifisch Energiewährung der Zelle, Aktivierungsreaktionen Cosubstrat nicht enzymspezifisch Elektronenakzeptor/-donator bei der katabolen Oxidation von Energieträgern, Reduktionsäquivalent, welches Energie in Atmungskette abgibt Cosubstrat nicht enzymspezifisch Elektronenakzeptor/-donator bei der anabolen Oxidation von Energieträgern, Reduktionsäquivalent, welches Energie in Atmungskette abgibt (Adenosintriphosphat) NAD+/NADH (Nicotinamid-Adenin Dinucleotid) - NADP+/NADPH (Nicotinamid-Adenin Dinucleotid-Phosphat) FAD/FADH2 Cosubstrat, prosthetische Gruppe analog zu ATP (da ATP + nucleoside 5'-phosphate Elektronenakzeptor/-donator. Reduktion während β-Oxidation und Citratzyklus und Oxidation in Atmungskette zur ATP-Synthese AMP + 5'-phosphonucleoside 3'-diphosphate) CTP (Cytidintriphosphat) GTP (Guanosintriphosphat) UTP (Uridintriphosphat) Anaerober Glucoseabbau Cofaktorname Cofaktorart Enzym Funktion Thiaminpyrophosphat Coenzym Pyruvatdecarboxylase Decarboxyliert Pyruvat Struktur PDH-Komplex Cofaktorname Cofaktorart Enzym Funktion Struktur Thiaminpyrophosphat Coenzym Pyruvatdehydrogenase Umwandlung von Pyruvat (αKetocarbonsäure) in eine β-Ketocarbonsäure Lipoamid prosthetische Gruppe kovalent an Dihydrolipoyltran sacetylase (E2) gebunden nimmt das Hydroxyethyl-carbanion vom TTP auf Coenzym A Cosubstrat Dihydrolipoyltran sacetylase (E2) nimmt die AcetylGruppe vom Dihydrolipoamid auf FAD/FADH2 prosthetische Gruppe Dihydrolipoyldehydrogenase (E3) reduziert Dihydrolipoamid zu Lipoamid siehe oben NAD+ Cosubstrat Dihydrolipoyldehydrogenase (E3) reduziert FADH2 zu FAD siehe oben Atmungskette Cofaktorname Cofaktorart Enzym Funktion Ubichinon Coenzym nicht kovalent an Komplex I, II und III gebunden Protonen- und ElektronenÜberträger zwischen Komplex I bis III Cytochrom c Coenzym befindet sich im Intermembranraum Träger der Elektronen von Komplex III zu Komplex IV Häm-Gruppen/ prosthetische EisenGruppen Porphyrine z.B. Häm c kovalent an Cytochrom c gebunden Häm b bildet zusammen mit Globin und Eiweis Hämoglobin Häm c Elektronentransport zusammen mit Cytochrom c EisenSchwefelZentren prosthetische Gruppen z.B. 6 verschiedene Zentren in den Komplexen I bis IV der Atmungskette wirken in Verbindung mit ihren Enzymen oft als Elektronenüberträger (Atmungskette), aber auch als RadikalGeneratoren Flavinmononucleotid (FMN) prosthetische Gruppe kovalent an Komplex I gebunden trägt H+-Ionen in Matrixraum, überträgt e- auf Eisen-SchwefelKomplex FMN +2H -->FMNH2 Struktur Glykogen- Abbau Cofaktorname Cofaktorart Enzym Funktion Struktur Pyridoxalphosphat prosthetische Gruppe Glykogenphosphorylase -Säure-BaseKatalysator ↓ -u.a. auch essentielle Funktion im AminosäureStoffwechsel Pyridoxalphosphat auch beim Aminosäureabbau: prosthetische Gruppe der Transaminase(n), welche die Übertragung der α-NH2-Gruppe ALLER Aminosäuren auf αKG katalysieren Sonstige Cofaktoren Cofaktorname Cofaktorart Enzym Funktion Biotin prosthetische Gruppe Pyruvatcarboxylase vorübergehende Bindung der Carboxylgruppe und Übertragung auf Zielmolekül (Glukoneogenese) Acetyl-CoACarboxylase (Fettsäurebiosynthese) Struktur Biochemie(Formeln( Freie(Enthalpie((Gibbs&Helmholtz&Gleichung)4 ∆" = ∆$ − & ∙ ∆(4 ∆G44 ∆H44 ∆S4 >04endergon4 <04exergon4 >04endotherm4 <04exotherm4 Je4größer,4desto4höher4die4Unordnung4 Freie4Enthalpie4 Enthalpie4 Entropie4 44 ∆H4 &4 &4 ∆S4 +4 &4 4 Exergon4!4freiwillig,4keine4weitere4Energie4benötigt4 +4 +4 +4 &4 Nur4spontan4bei4Temperaturen4über4& = 4 ∆* Endergon4!4nicht4freiwillig,4eventuell4durch4Katalyse4möglich4 Nur4spontan4bei4Temperaturen4unter4& = ∆) ∆* ∆) 4 4 Chemisches(Gleichgewicht( ∆" = ∆"°, + . ∙ & ∙ ln 1 4 ∆"°, = −2 ∙ 3 ∙ ∆4°′4 ∆4°, = 4°, 6789:6;<=> − 4°′67?=@=> 4 1=A 7∆B°, C∙D 4 Arrhenius(Gleichung4(Reaktionskinetik)( 1 =E∙A 7∆B ‡ C∙D 4 G = 1 ∙ E ∙ [I]4 7∆B ‡ GKL< 1KL< = = A C∙D 4 G 1 ∆∆" ‡ = ∆" ‡ − ∆" ‡ KL< 4 pH9Wert( MN* = −OPQ Für4starke4Säuren4 4 4 E7 + [$ R ] 4 [$E] 4M$ = −logU[$V W R ]4 Henderson&Hasselbach&Gleichung4 4M$ = MN* + OPQ Dissoziationskonstante44 4 N* = 4 4 8X R[) Y ] [)8] 4 8X [)8] 4 Massenspektrometrie( G = Z ∙ [4 Z\@]6^L_6@ = ` Z −1 4 ` Z\@]6^. Z\@]6^. + ` ∙ Z) Y = U ` ` 4 Enzymkinetik( 7∆B ‡ fghij C∙D Gc@:de 1c@:de E ∙ [I] E ∙ A = = ‡ 7∆B G 1 E ∙ [I] E ∙ A C∙D 4 ∆" ‡ − ∆" ‡ c@:de = ∆∆" ‡ KL< 4 ∆∆B ‡ Gc@:de = A C∙D 4 G Michaelis9Menten(Modell( 4 + ( ↔ 4( ↔ 4 + l4 Enzymkonstanten:4k1,$k%1,$k2,$k%24 Michaelis4Konstante4 4 4 4 1m = Gp = 9Xn R9o 9n 4 GeLq ∙ ( r = 4 1m + ( ( " Hyperbolischer4Verlauf4der4Kurve4vom4Gp − [(]&Diagramm4 " Lineweaver&Burke&Diagramm4 ( = ( p ≙4Substratkonzentration4am4Beginn4der4Reaktion4 stabil41m ↓ UUU 1u ↑4 Wenn41w 4sehr4klein4 ( 1m 17u = 4 1u instabil41m ↑ UUU 17u ↑4 Lambert9Beer9Gesetz4(Spektroskopie)4 E x = Ԑ8 x ∙ z8 ∙ O4 E x 4 Ԑ8 x 4 z8 4 O4 Absorption4 Extinktionskoeffizient4von4A4für4λ4 Konzentration4von4A4in4Lösung4 ZPO O 4 Dicke4der4Küvette4[cm]4 4