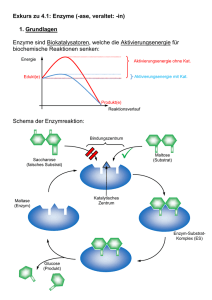
Pharmakologie
Werbung

Pharmakologie Klassische Penicilline penicillinasefest Aminopenicilline Beispielmedis Penicillin G = Benzyl, parenteral Penicillin V = Phenoxy, oral Oxacillin Amoxicillin oral Ampicillin parenteral Indikationen OAW, amb. Pneumonie Otitis media, Sinusitis, Erysipel, Impetigo, Divertikulitis, Cholangitis, Gonorrhoe Auch in SS! Aminopenicilline + Beta-LaktamaseInhibitor Acylaminopeni-cilline + Beta-LaktamaseInhibitor Cephalosporine der 1. Generation Amoxicillin + Clavulansäure Ampicillin + Sulbactam Piperacillin + Tazobactam Cefazolin i.v. Cefachlor oral Wundinf. Weichteilinf., periop. Prophylaxe Cephalosporine der 2. Generation Cefuroxim oral Cefotiam i.v. OAW, HWI, Otitis media, Weichteilinf. Cephalosporine der 3. Generation (3a) Ceftriaxon Cefotaxim Cephalosporine der 3. Generation (3b) Ceftazidim Cefepim Meningitis, Sepsis, Borreliose, Otitis media, HWI, AW Nosokomiale Inf. Erregerspektrum Nur grampositiv: Streptokokken, Neisserien , Spirochäten + Staphylokokken Grampositiv Wenige gramnegative Erreger: Hämophilus influenzae! E.coli, Proteus, Enterokokken Grampositiv Zahlreiche gramnegative Erreger Grampositiv Fast alle gramnegativen Erreger Anaerobier Pseudomonas Grampositiv Wenige gramnegative Erreger Grampositiv Zahlreiche gramnegative Erreger: Hämophilus, E.coli, Moraxella, Proteus Grampositiv Zahlreiche gramnegative Erreger Grampositiv Zahlreiche gramnegative Erreger Pseudomonas Wirkung bakterizid Wirkmechanismus Beta-Laktam-Antibiotika: Hemmung der Zellwandsynthese Nebenwirkungen Herxheimer-Reaktion (Lues), Allergie, neurotox Beta-Laktam-Antibiotika: Hemmung der Zellwandsynthese + Inhibition der Betalaktamase bakterizid Beta-Laktam-Antibiotika: Hemmung der Zellwandsynthese + Unempfindlichkeit gegen einige Betalaktamasen KI: Niereninsuff, Nephrotox, Neurotox, Kreuallergie mit Penicillinen Alkoholintoleranz Enterokokken-lücke Carbapeneme Makrolide Tetrazykline Aminoglykoside Imipenem Meropenem Ertapenem Reserve, ESBL-Keime bakterizid Beta-Laktam-Antibiotika: Hemmung der Zellwandsynthese Resistenzen, Pilze, Sekundärinfekt, neurotox + Beta-Laktamasefest Erythromycin Azithromycin Roxithromycin Clarithromycin Ähnlich wie Penicillin, Atypische Pneumonie Intrazelluläre Erreger ohne Zellwand: Rickettsien, Chlamydien, Mykoplasmen Einige grampositive Erreger und gramnegative Erreger Helicobakter, Legionel. Keine Wirkung auf Enterobacteriaceae Bakteriostatisch Hemmung der bakteriellen Proteinsynthese Hepatotox, QT-Verlängerung, CYP3A4-Inhib. Doxycyclin Tetracyclin Atypische Pneumonie, Chlamydien, Borreliose KI: Kinder, SS v.a. lokal bei Otitis, Dermatitis, Konjunktivitis! Intrazelluläre Erreger: Rickettsien, Borrellien, Chlamydien,Legionellen, Mykoplasmen, Bakteriostatisch Hemmung der bakteriellen Proteinsynthese Gramnegativ Nur aerob: Synergistisch bei Enterokokken Pseudomonas Tuberkulose-Erreger Primär bakterizid + bakteriostatisch Hemmung der bakteriellen Proteinsynthese Bilden Komplexe mit Kalzium: Zahnverfärbung Nephrotox. Hepatotox. Anreichernd: Nephrotox, Ototox, Neurotox KI: Myasthenie Grampositiv aber keine Wirkung gegen Enterokokken Anaerobier Sehr gute Gewebegängigkeit Kreuzresistenzen mit Makroliden Bakteriostatisch Hemmung der bakteriellen Proteinsynthese Gentamicin Tobramycin Streptomycin Drug Monitoring Lincosamide Grampositiv Zahlreiche gramnegative Erreger Pseudomonas Clindamycin Osteomyelitis, Abszesse, Endokarditis, Aspirationspneumonie Alternative zu Penicillin + Schädigung der Zellwand GI-NW Pseudomembr. Kolitis Enterokokken-lücke Fluorchinolone Gruppe I, II Norfloxacin (I) Ciprofloxacin (II) HWI! Salmonellen Fluorchinolone Gruppe III, IV Levofloxacin (III) Moxifloxacin (IV) HWI, Pneumonie Glykopeptide Vancomycin Teicoplanin MRSA Pseudomembranöse Kolitis (oral) Nitroimidazole Metronidazol AnaerobierProtozoen-Inf. Divertikulitis, Fisteln Cotrimoxazol Trimethoprim + Sulfamethoxazol (Sulfonamid) HWI, Pneumocystis-P., Toxoplasmose Oxazolidinone Linezolid Rifampicin Rifampicin Chloramphe-nicol Vor allem gramnegativ: E.coli, Proteus, Pseudomonas, Salmonellen, Hämophilus influenzae Gramnegativ Grampositiv Anaerobier Nur(!) grampositiv: Staphylokokken, Streptokokken, Enterokokken, Clostridium difficile (o) Anaerobier!: Bacteroides, Gardnerella Cl. difficile Protozoen: Giardia lamblia, Entamoeba histolytica, Trichomonas vaginalis Zahlreiche grampositive Erreger Zahlreiche gramnegative Erreger Primär bakterizid Hemmung der bakteriellen Gyrase Neurotox, Nephrotox, Hepatotox. Knorpelschäden (KI: Kinder) Bakterizid Ggf. bakteriostatisch Hemmung der Zellwandsynthese Nephrotox, (KI: NI) Ototox bakterizid DNA-Strangbrüche Immunsupp! Neurotox. Alkoholintoleranz Metall. Geschmack teilweise bakterizid Sulfamethoxazol: Hemmung der bakteriellen Folsäuresynthese Hämolytische A., Hepatotox, Neurotox, Nephrotox Vancomycinresistente MRSA Grampositiv Bakteriostatisch Streptok: bakterizid Bakterizid (liquorgängig) Hemmung der bakteriellen Proteinsynthese . Tbc, Staphylok. Legionellen, Enterokokk. Malaria, Fleckfieber, Typhus, Ruhr, Anaerobier Grampositiv Gramnegativ Mykobakterien Intrazelluläre Erreger: Rickettsien, Chlamydien, Mykoplasmen,Borrellien, Legionellen, Primär bakterizid Hemmung der bakteriellen RNSPolymerase Roter Urin, CYP-Induktion Hepatotox. KM-tox! Grey-Syndrom Antimykotika Die Antimykotika sind hauptsächlich in vier Gruppen unterteilt und unterscheiden sich neben ihrer chemischen Struktur u.a. auch im spezifischen Wirkspektrum. Während i.v.-Breitband-Antimykotika (wie z.B. Fluconazol oder lipidformuliertes Amphotericin B) beinahe alle bekannten Pilze einschließen, sind topische Pharmaka (wie z.B. Clotrimazol) in ihrem Wirkspektrum häufig eingeschränkter. Substanzklasse Polyene Wirkstoffe Amphotericin B Nystatin Charakteristika Intravenös: sehr nebenwirkungsreich Auch als lipidformuliertes Amphotericin vorhanden Sehr breites Wirkspektrum Prophylaktische Gabe bei Immunsuppression Bevorzugte Einsatzgebiete Hefen: Invasive Candidose, Kryptokokkose Schimmelpilze: Aspergillose Applikationsformen lokal intravenös Hefen: Candidose lokal per os lokal lokal per os per os intravenös per os intravenös ImidazolDerivate Clotrimazol Ketoconazol Breitspektrum-Antimykotika zur lokalen Anwendung Hefen: Candidose Triazol-Derivate Fluconazol Voriconazol Itraconazol Caspofungin Breitspektrum-Antimykotika Hefen: Candidose, Kryptokokkose Echinocandine PyridonDerivate Candidose: Ciclopirox lokal Invasiv +ZNS Aspergillose: +ZNS Dermatophyten: Bessere Verträglichkeit als Amphotericin B bei ähnlicher Wirksamkeit Jedoch mangelnde Anreicherung im ZNS Weit verbreitetes lokales Antimykotikum (v.a. bei Onychomykosen) Besonders gut wirksam bei Dermatophytosen Hefen: Invasive Candidose Schimmelpilze: Aspergillose Hefen: Candidose Dermatophytosen lokal => Clotrimazol, Ketonazol, Ciclopirox lokal/(per os) (Nystatin-Prophylaxe lokal/per os) Imidazole, Pyridone => Fluconazol, Voriconazol (per os/iv), Caspofungin (iv), (Nystatin-Prophylaxe lokal/per os) Triazole, Echinocandin => Amphotericin B (lokal/iv) Polyene => Fluconazol, Voriconazol (per os/iv), Caspofungin (iv) Triazole, Echinocandin => Amphotericin B (lokal/iv) Polyene => Ciclopirox (lokal), Itroconazol (per os) Triazole, Ciclopirox Diuretika Thiaziddiuretika Thiaziddiuretika kommen insbesondere zur Behandlung der arteriellen Hypertonie sowie einer chronischen Herzinsuffizienz zum Einsatz. Die blutdrucksenkende Wirkung wird auf die Reduzierung des Kochsalzgehaltes (Natriumchlorid) im Körper zurückgeführt. Dies gelingt durch die Hemmung des Na+-Cl--Kotransporters im distalen Tubulus der Niere. Die vermehrte Ausscheidung von Natriumchlorid führt sekundär zu einer stärkeren Kalium- und Wasserausscheidung. Letzteres ist der gewünschte Effekt zur langfristigen Behandlung von kardialen Ödemen. Da die erhöhte Kaliumausscheidung die Entwicklung einer gefährlichen Hypokaliämie begünstigen kann, muss ein Monitoring der Elektrolyte erfolgen. Abb.Mechanismus der Na+-Rückresorption im frühdistalen Tubulus und Wirkungsweise der Thiazide.Graefe,Lutz,Bönisch, Duale Reihe Pharmakologie und Toxikologie, Thieme 2011 Schleifendiuretika Schleifendiuretika sind aufgrund ihrer schnellen und starken Wirkung ein potentes Mittel in der Akuttherapie jeglicher Art von Ödemen. Sie finden sich in jedem Notarztkoffer, da sie bei einer kardialen Dekompensation mit Lungenödem rasch eine Linderung bewirken. Weitere Indikationen sind die Niereninsuffizienz und die Induktion einer forcierten Diurese. Bereits in der Monotherapie, aber insbesondere bei der Kombination von Schleifendiuretika mit anderen Diuretika droht eine Hypokaliämie. Um lebensgefährliche Arrhythmien zu verhindern, ist ein strenges Monitoring der Elektrolyte erforderlich. Abb. Mechanismus der Na+-Rückresorption im dicken aufsteigenden Teil der Henle-Schleife und Wirkungsweise der Schleifendiuretika.Graefe,Lutz,Bönisch, Duale Reihe Pharmakologie und Toxikologie, Thieme 2011 Kaliumsparende Diuretika Aldosteron ist das wichtigste Mineralkortikoid im menschlichen Organismus. Es bewirkt in der Niere über die Expression von bestimmten Kanälen eine vermehrte Natrium- und Wasserresorption und steigert die Kaliumelimination. Neben einem primären Hyperaldosteronismus führen Herzinsuffizienz sowie Leberzirrhose zu einer sekundären Erhöhung dieses Hormons. Um einem dadurch auftretenden Bluthochdruck entgegenzuwirken bzw. Ödeme und Aszites auszuschwemmen, werden Aldosteronantagonisten verordnet. Im Rahmen der Herzinsuffizienz besitzt die Therapie sogar einen günstigen Effekt auf die Prognose der Erkrankung und ist daher bereits in frühen Stadien empfohlen. Führt das Standardpräparat Spironolacton zu Gynäkomastie bzw. Amenorrhö, wird auf das nebenwirkungsärmere Eplerenon umgestellt. Weiterhin muss der Serumkaliumwert regelmäßig kontrolliert werden, da die Gefahr einer Hyperkaliämie besteht. Die kaliumsparenden aldosteronunabhängigen Diuretika (Triamteren und Amilorid) werden in erster Linie in Kombination mit Thiaziddiuretika eingesetzt, da sie den kaliuretischen Effekt der Thiazide ausgleichen. Abb. Mechanismus der Na+-Rückresorption im spätdistalen Tubulus und im Sammelrohr und Wirkungsweise der kaliumsparenden Diuretika.Graefe,Lutz,Bönisch, Duale Reihe Pharmakologie und Toxikologie, Thieme 2011 renale Zielstruktur/Wirkung Thiaziddiuretika HCT, Xipamid, Chlortalidon Schleifendiuretika Furosemid Kaliumsparende Diuretika Aldonsteronantag. (Eplerenon, Spironolacton) Aldosteron-unabh. (Amilorid, Triamteren) Hemmung Na+-Cl--Kotransporter im distalen Tubulus Arterielle Hypertonie, chronischen Ödemen (kardial, renal) Sequentielle Nephronblockade Urolithiasis durch kalziumhaltige Steine bzw. Hyperkalzurie (Renaler Diabetes insipidus ) Hemmung Na+-K+-2Cl--Kotransporter im aufsteigenden Ast der HenleSchleife Furosemid iv: Venodilatation (Pgl)→ Vorlastsenkung Kardiale, renale, hepatische Ödeme (auch bei NI) Forcierte Diurese, sequentielle Nephronblockade (+Thiazide) Verminderte Natriumresorption (verminderte Expression/Blockade von Kanälen) im distalen Tubulus und proximalen Sammelrohr Aldonsteronantagonisten: Wirkungseintritt in >24h primärer und sekundärer Hyperaldosteronismus, HI, Aszites Amilorid/Triamteren: Wirkung sofort Kombination mit Thiaziden bei chronischen Ödeme Wirkung auf Serumelektrolyte Na K Ca ↓* ↓ ↑ H2OAussche idung ↑ ↓* ↓ ↓ ↑↑ ↓* ↑ - (↑) Osmodiuretika Mannitol, Glycerin, Sorbit osmotischer Effekt im Tubulussystem Intravenöse Applikation erforderlich Glomeruläre Filtration ohne Rückresorption → Osmotische Diurese Keine Salurese Hirnödem, akutes Glaukom, forcierte Diurese zur ANV-Prophylaxe (↑) - - ↑↑ CarboanhydraseHemmer Acetazolamid Hemmung der Carboanhydrase → Bikarbonatausscheidung↑ Kammerwasserproduktion↓ (akutes Glaukom) Geringer diuretischer Effekt, starke Bikarbonatausscheidung Liquorproduktion↓ (Pseudotumor cerebri) (↓) (↓) - (↑) Nebenwirkungen Hyperglykämieneigung, Elyte-Verlust Anstieg LDL-Cholesterin Hyperurikämie Lithiumwirkung verstärkt Schwartz-Bartter-Syndrom KI: NI (Wirkverlust außer Xipamid) Hyperglykämieneigung, Elyte-Verlust, Hyperurikämie, Ototox, Exsikkose KI: Anurie, Elyt-Störungen, Hypovolämie, Sulfonamid-Allergie (wirkt 6 Std -> morgens+mittags Gabe) Hyperkaliämie Nur Spironolacton: Endokrine NW ♂: Gynäkomastie, Impotenz ♀: Amenorrhoe, Hirsutismus KI: Schwere Niereninsuffizienz, Hyperkaliämie, Hyponatriämie Triamteren und Amilorid nicht mit ACEHemmern bzw. AT1-Rezeptorblockern kombinieren Exsikkose, initial Volumenbelastung (CAVE: Kardiale VE) Metabolische Azidose Zytostatikagruppe Alkylantien Untergruppen Oxazaphosphorine N-Lost-Derivate Hydrazine Platin-haltige Substanzen TopoisomeraseHemmstoffe DNA-Replikation↓ Anthrazykline Topoisomerase-I-Hemmer Mitosehemmstoff (Spindelgifte) → Stillstand Mitose in der Metaphase Antimetabolite → DNA-Replikation↓ Topoisomerase-II-Hemmer Vinca-Alkaloide Taxane Pharmaka Cyclophosphamid, Ifosfamid Busulfan Chlorambucil Melphalan Temozolomid Cisplatin Carboplatin Oxaliplatin Doxorubicin Daunorubicin Idarubicin Irinotecan Topotecan Etoposid Vincristin Vinblastin Docetaxel Paclitaxel Folsäure-Antagonisten • Methotrexat Pyrimidin-Antagonisten • • • • • • • • • • • • Purin-Antagonisten Andere • • • • • • • • • • • • • • • • • • • Ribonukleotidreduktase-Inh Antibiotika Enzyme Cytarabin 5-FU (5-Fluoruracil) Gemcitabin Capecitabin Azathioprin 6-Mercaptopurin Fludarabin Hydroxyurea (-carbamid) Bleomycin Actinomycin D Mitomycin L-Asparaginase Wirkmechanismus Alkylierung von DNA/RNA → Vernetzung und Strangbrüche → DNA-Synthese gestört Cross-Links zwischen beiden DNA-Strängen → DNA-Replikation↓ Interkalierung in die DNA → Hemmung der Topoisomerase II Hemmung der Topoisomerase I Hemmung der Topoisomerase II Bindung und Zerstörung von Tubulin der Mikrotubuli Mikrotubuli-Stabilisierung → Spindelapparat↓ Hemmung der Dihydrofolatreduktase → Bildung von Purinnukleotiden↓ U.a. Einbau einer falschen Base U.a. Einbau einer falschen Base Hemmung der Interkalierung und Alkylierung der DNA → Behinderung des Ableseprozesses → RNASynthese↓ Spaltung der Aminosäure L-Asparagin (für ALL-Zellpopulationen essentiell) Orale Antidiabetika Orale Antidiabetika stellen beim Diabetes mellitus Typ II effektive Pharmaka zur Regulation bzw. Senkung des Blutzuckerspiegels dar. Als wichtigstes Präparat und Mittel der 1. Wahl bei jedem Typ-II Diabetiker gilt Metformin, ein Biguanid. Es hat die günstigsten Effekte auf den Metabolismus und zeigte in Studien die deutlichste Senkung der diabetes-bezogenen Mortalität. Alternativ kommen einzeln oder in Kombinationstherapie Sulfonylharnstoffe, Glinide, αGlukosidasehemmer, Glitazone, Inkretinmimetika (subkutane Anwendung) und Dipeptidylpetidase-4-Hemmer zum Einsatz. Bei fortgeschrittener Leber- und/oder Niereninsuffizienz sind die Einsatzmöglichkeiten der oralen Antidiabetika begrenzt. Wenn nicht schon zuvor ein Therapieversagen aufgetreten ist, wird spätestens jetzt eine Behandlung mit Insulin notwendig. Biguanide Metformin Wirkmechanismus Insulinwirkung↑ → Sekretion↓ (bis zu 20%) Kohlenhydratumsatz↑ (BZ bis zu 40%↓) Hemmung der Glukoneogenese Resorption Kohlenhydrate im Darm↓ Sulfonylharn-stoffe Glibenclamid Glimepirid Verschluss von Kaliumkanälen der ß-Zellen des Pankreas → Insulinsekretion↑ Extrapankreatische Wirkung: Hepatische Glukoneogenese↓ und Insulinsensibilität↑ Charakteristika Keine erhöhte Hypoglykämiegefahr Eher Gewichtsreduktion (Lipolyse↑, appetitsenkender Effekt) Triglycerid- und LDL-Spiegel↓ (bis zu 25%) Vaskuläre Komplikationen↓ Mortalität durch mikro- und makroangiopathische Folgeerkrankungen↓ NW: Gastrointestinale Nebenwirkungen, Laktatazidose KI: • Niereninsuffizienz: Kreatinin >1,2mg/dL, Kreatinin-Clearance <60ml/min (Akkumulation → Gefahr der Laktatazidose) • Leberinsuffizienz: Katabole Stoffwechsellage → Gefahr der Laktatazidose • Schwangerschaft • Stillzeit (muttermilchgängig) • Herzinsuffizienz NYHA III und IV • Katabole Stoffwechsellage • Respiratorische Insuffizienz • Gleichzeitige Gabe mit Kontrastmittel i.v. • OP Gewichtszunahme Wirkungsverlust bei Dauertherapie Mortalität durch mikroangiopathische Folgeerkrankungen↓ NW: Lebensgefährliche Hypoglykämien Blutbildveränderungen (Granulozytopenie, hämolytische Anämien) KI: • Leber- und Niereninsuffizienz • Sulfonamidallergie • Schwangerschaft und Stillzeit, Operation Glinide Repaglinid αGlukosida sehemmer Acarbose Glitazone (Insulinsen sitizer) Pioglitazon Rosiglitazon Inkretinmimetika Dipeptidyl petidase-4Hemmer Exenatide Sitagliptin Vildagliptin Verschluss von Kaliumkanälen der ß-Zellen des Pankreas → Insulinsekretion↑ Glukoseresorption in Intestinum↓ durch Hemmung der α-Glucosidase am Bürstensaum Agonistische Wirkung am PPAR-Rezeptor im Fettgewebe → Insulinresistenz↓ → Insulinwirkung↑ Agonismus am GLP-1 Rezeptor (glucagon-like peptide) → Insulinsekretion↑, Glukagonsekretion↓ Subkutane Anwendung Hemmung der Dipeptidylpetidase4 → Verminderter Abbau und somit verstärkte Wirkung von GLP-1 → Insulinsekretion↑, Glukagonsekretion↓ Gewichtszunahme Einnahme vor dem Essen NW: Lebensgefährliche Hypoglykämien KI: • Leber- und Niereninsuffizienz • Sulfonamidallergie • Schwangerschaft und Stillzeit, Operation Gewichtsreduktion möglich Wird schlecht toleriert, einschleichende Dosierung NW: Gastrointestinale Nebenwirkungen (starke Blähungen möglich!) KI: • Chronisch entzündliche Darmerkrankungen • Malassimilationssyndrom • Schwangerschaft Gewichtszunahme Fettumverteilung von viszeral nach subkutan NW: • Ödeme • Frakturrisiko↑ (vor allem bei älteren Frauen) • Rosiglitazon: Kardiovaskuläre Komplikationen↑ • Pioglitazon: Vermutlich erhöhtes Risiko für Harnblasenkarzinome KI: Herzinsuffizienz, Leber- und Niereninsuffizienz Wirkung abhängig vom Blutzuckerspiegel → Vermutlich keine Hypoglykämiegefahr Vermutlich geringe Gewichtsabnahme NW: Gastrointestinale Nebenwirkungen, Pankreatitis KI: Niereninsuffizienz, Pankreatitis Wirkung abhängig vom Blutzuckerspiegel → Vermutlich keine Hypoglykämiegefahr Vermutlich geringe Gewichtszunahme NW: Gastrointestinale Nebenwirkungen, Pankreatitis KI: Niereninsuffizienz, Schwangerschaft und Stillzeit *AMP-aktivierte Proteinkinase Insuline Insulin ist ein anaboles Hormon und wird physiologisch bei Hyperglykämien freigesetzt. Durch die Bindung von Glukose oder GLP-1 (Glucagon-like Peptid 1) an entsprechende Rezeptoren kommt es kaliumabhängig zur Depolarisation der β-Zellen der Langerhans-Inseln des Pankreas. Die folgende Insulinfreisetzung senkt vorwiegend den erhöhten Blutzuckerspiegel im Blut und ermöglicht eine intrazelluläre Metabolisierung der Glukose. Viele Medikamente stehen als Ersatz oder zur Ergänzung des körpereigenen Insulins zur Verfügung, deren Charakteristika über das Einsatzgebiet entscheiden. Das subkutan zu applizierende Medikament ist essentieller Bestandteil der Therapie des Typ 1 und des fortgeschrittenen Typ 2 Diabetes mellitus. Jedes Therapieregime bedarf einer intensiven Schulung des Patienten, um beispielsweise eine potentiell lebensbedrohliche Hypoglykämie durch Überdosierung zu verhindern. Kurzwirksam (Wirkung bis zu 8 Stunden) Verzögert und langwirksam Wirkbeginn (min) 20 - 30 Wirkmaximum (h) 1-3 Wirkdauer (h) max. 8 Insulin Lispro, Insulin Aspart, Insulin Glulisin (kurz wirksame Insulinanaloga) Intermediärinsulin 5 - 15 (schnellster Wirkbeginn) 0,5 - 1 max. 5 45 - 90 3 - 10 max. 20 Langzeitinsulin 120 - 240 8 - 20 max. 36 5 - 15 ca. 24 Normalinsulin (auch Altinsulin) Insulin Glargin, Insulin Detemir (lang wirksame Insulinanaloga) Indikation Besonderheiten IKT*: Mahlzeiten bezogen Standardinsulin" Spritz-Ess-Abstand: 15-30 min Intravenöse Therapie (einziges Insulin!) Akut zur Senkung des Glukosespiegels Rasche Resorption, aufgrund sofortigem Zerfall in einzelne Insulinmoleküle → Kein Spritz-Ess-Abstand! Basalinsulin bei therapierefraktäre m DM Typ II IKT*: Basalinsulin Spritz-Ess-Abstand: 30-60 min Erreichen eines stabilen Insulin-Niveaus erst nach 3-5 Tagen Indikation • Typ 1 Diabetes • Typ 2 Diabetes, wenn Gewichtsnormalisierung und körperliche Aktivität sowie der Einsatz von oralen Antidiabetika nicht zufriedenstellend • Gestationsdiabetes, wenn eine Ernährungsumstellung nicht ausreicht • Intensivmedizinische Behandlung, akutes Nierenversagen oder perioperativ Resorptionszeit ist unter anderem abhängig von der Durchblutung des Gewebes Verlängerte Resorptionszeit: Kälte, Adipositas, Hohes Lebensalter, Injektionsort peripherer, Injektion ins oberflächliche sc-Gewebe Verkürzte Resorptionszeit: Zuvorige Manipulation des Gewebes, Injektion in tiefere Schichten des sc-Gewebes, Injektionsort zentral/periumbilikal Nebenwirkungen • • • • Hypoglykämien Gewichtszunahme Lipodystrophie Allergische Reaktionen Benzodiazepine Benzodiazepine werden wegen ihrer großen therapeutischen Breite im Rahmen mehrerer Krankheitsbilder eingesetzt. Sie wirken über eine Bindung am GABARezeptor anxiolytisch, hypnotisch, muskelrelaxierend und antikonvulsiv. Verwendet werden sie vorwiegend bei Angst- und Spannungszuständen, Schlafstörungen und Krampfanfällen, wobei ihre muskelrelaxierende Wirkung in der Orthopädie und die sedierenden Effekte perioperativ genutzt werden. Wichtige Nebenwirkungen sind Amnesien sowie Atemdepressionen. Im Alltag werden Benzodiazepine jedoch wegen ihres starken Abhängigkeitspotentials gefürchtet (strenge Indikationsstellung erforderlich). GABA ist ein inhibitorischer ZNS-Transmitter → Die α-Untereinheit des GABA-Rezeptors wird von den Benzodiazepinen gebunden → Öffnungsdauer von Chlorid-Kanälen↑ → GABA-Wirkung↑ Wirkungen: Anxiolytisch Hypnotisch Sedierend Zentral muskelrelaxierend Antikonvulsiv Wirkdauer kurz mittellang lang Wirkstoff • • • • • • • • • • • • Midazolam Triazolam Oxazepam Temazepam Lormetazepam Lorazepam Diazepam Clonazepam Bromazepam Chlordiazepoxid Flunitrazepam Nicht mehr zugelassen: Tetrazepam Indikationen Abhängigkeitspotential • • • • Narkose Einschlafstörungen Ein-/Durchschlafstörungen Angstzustände • sehr hoch • • • • • • Angst- und Panikattacken Spannungszustände Akute paranoide Episoden Muskelrelaxierung Epilepsien Alkoholentzugssyndrom • hoch • hoch bis sehr hoch NW: Affektabflachung Hang-over am Folgetag Atemdepression und Muskelschwäche Amnesie Paradoxe Erregung Rebound-Phänomen Appetitsteigerung Libidoverlust Benzodiazepin-Abhängigkeit, Benzodiazepinentzug (vegetativ, neurologisch, psychiatrisch) Rückfall: Wiederauftreten einer Symptomatik, die eine erneute Benzodiazepineinnahme notwendig macht Paradoxe Erregung Appetitsteigerung Libidoverlust Bei Benzodiazepin-Intoxikation meist Gabe von Kohletabletten und Laxantien ausreichend. Bei mangelnder Wirkung Gabe des Benzodiazepin Antidots Flumazenil. KI: Neuromuskuläre Erkrankungen (Myasthenia gravis) Ataxie Engwinkelglaukom Schwangerschaft Atemdepression (COPD, respiratorische Insuffizienz) Bekannte Abhängigkeit Alkohol-, Drogen- oder Medikamentenmissbrauch sowie Polytoxikomanie Laxantien Laxantien (Abführmittel) Wirkmechanismus "Stuhlweichmacher" Präparate • Docusat-Natrium • Paraffinöl Füll- und Quellstoffe • • • • Osmotisch wirkende Laxantien Stimulative (auch sekretorische) Laxantien Flohsamen Weizenkleie Leinsamen PEG=Polyethylenglykol (Macrogol®) • Salzhaltig: Natriumhydrogensulfat Magnesiumsulfat (Bittersalz) Natriumsulfat (Glaubersalz) • Unverdauliche Kohlenhydrate: Lactulose (Bifiteral®) Sorbitol, Mannit • Bisacodyl (Dulcolax®) • Natriumpicosulfat (Laxoberal®) • Rizinusöl Wirkung und Besonderheiten • Stuhlweichmacher emulgieren den Stuhl und weichen ihn auf, sodass er den Darm leichter durchqueren kann • Docusat-Natrium wird von rektal angewendet • Paraffinöl sollte wegen der Bildung von Fremdkörpergranulomen nicht mehr eingesetzt werden • Unverdauliche, nicht-resorbierbare Stoffe • Quellen im Darmlumen durch Wasseraufnahme auf → Dehnung der Darmwand führt zur Anregung der Peristaltik • Ziehen Wasser in das Lumen des Verdauungstraktes, wodurch dann wiederum die Darmmotilität angeregt wird • PEG zeichnet sich durch eine gute Wirksamkeit und Verträglichkeit aus • Salze werden zum Teil resorbiert und können Elektrolytverschiebungen bedingen (Hypernatriämie, Hypermagnesiämie) • Glaubersalz wird nicht mehr zur Therapie der Obstipation eingesetzt • Kohlenhydrate können durch bakteriellen Abbau zu starker Flatulenz führen • Laktulose wird auch zur Therapie der hepatischen Enzephalopathie eingesetzt • Sorbit und Mannit werden als Klysmen angewendet • Steigerung der Wassersekretion intraluminal durch Cl⁻ -Sekretion • Führen zu starken Wasser- und Kaliumverlusten und sollten daher nur kurzfristig angewendet werden • Bisacodyl und Natriumpicosulfat sind Anthrachinone und können zu einer Melanosis coli führen Antidepressiva Antriebssteigerung TZA Depression, KoAnalgetikum (Schmerztherapie) Amitriptylin-Typ --- Desipramin-Typ bei Suizidalität kontraindiziert Imipramin-Typ +(+) - SSRI Depression, Angststörungen, Zwangsstörungen, somatoforme Störungen + MAO-Hemmer + Tetrazyklische Antidepressiva (Präsynaptische α-Blocker) SSNRI Depression, Angststörungen, Zwangsstörungen, somatoforme Störungen, Belastungsinkontinenz SNDRI SNRI -+ Sedierung Sexualstörungen +++ +++ +++ +++ +++ + + + +++ ++ + ++ +++ + Gewichtszunahme ++ Übelkeit Anticholinerge Wirkung Überdosierungsgefahr ++ +++ ++ ++ ++ +++ Amitriptylin Trimipramin Doxepin Desipramin Nortriptylin Imipramin Clomipramin Citalopram, Escitalopram Sertralin Fluvoxamin, Fluoxetin Paroxetin Moclobemid Tranylcypromin Mirtazapin Venlafaxin Duloxetin Bupropion Reboxetin Atomoxetin Antipsychotika Typische Antipsychotika Dopaminantagonist am D2-Rezeptor Hochpotente Antipsychotika Mittelpotente Antipsychotika Niedrigpotente Antipsychotika Atypische Antipsychotika Dopaminantagonist an verschiedenen Rez. Substanzen Antipsychotische Wirkung • • • • • • • • • • • • Haloperidol Benperidol Flupentixol Fluspirilen Fluphenazin Melperon Chlorpromazin Perphenazin Levomepromazin Chlorprothixen Pipamperon Tiaprid ↑↑↑ • • • • • • • Clozapin, Olanzapin, Risperidon Quetiapin, Amisulprid, Ziprasidon, Aripiprazol Bessere Wirksamkeit gegen Negativsymptome Langfristige Therapie bei: Paranoider Schizophranie, Wahn, Tic, begleitend bei Zwang akut bei Delir, Wahn, Unruhe, Manie Sedierend + antiemetische (antihistaminerg), anticholinerg ↑ bevorzugt bei alten Menschen ↑↑ ↑↑ ↑ ↑↑↑ nicht antipsych., Therapie bei: Hyperkinesie, Tic Nebenwirkungen Extrapyramidal-motorische Störungen (EPS) (hochpotent > niedrigpotent): Frühdyskinesie: =>Biperiden • Zungen- und Schlundkrämpfe,Grimassieren • Torticollis, Blickkrämpfe Spätdyskinesie: =>Clozapin • Sterotype Kau- und Schmatzbewegungen • Choreatische Bewegungen Parkinsonoid: Rigor, Tremor, Akinese =>Biperiden Akathisie (Sitzunruhe) =>Propanolol (niedrigpotent > hochpotent): Anticholinerge Wirkung: Mundtrockenheit, Mydriasis, Obstipation und tachykarde Herz-Rhythmus-Störungen α-sympatholytische Wirkung: Orthostatische Dysregulation Kardiale Wirkung: QT-Zeit-Verlängerung Metabolische Wirkung: In der Regel Gewichtszunahme, gelegentlich aber auch Appetitverlust mit Gewichtsabnahme Agranulozytose, Metab. Syndrom, DM Metab. Syndrom, DM, anticholinerg, Hypotonie EPS, Prolaktinerhöhung Sedierung, metab. Syndrom, DM EPS, Prolaktinerhhöhung Malignes neuroleptisches Syndrom (MNS) Beim MNS handelt es sich um eine lebensbedrohliche neurologische Störung, die in den meisten Fällen mit der Einnahme von Antipsychotika assoziiert ist und sich in extrapyramidalmotorischen, vegetativen und psychopathologischen Symptomen äußert. Wichtigste therapeutische Maßnahme ist das Absetzen des auslösenden Wirkstoffes. Dopaminagonisten und Dantrolen werden supportiv eingesetzt. Meistens innerhalb von 4 Wochen nach Beginn der Einnahme von Antipsychotika (aber auch anderer ZNS-wirksamer Stoffe wie Carbamazepin, Lithium, Venlafaxin) => Dopaminmangelsituation: Vegetative Symptome: Hohes Fieber, Tachykardie, Tachypnoe Psychiatrische Symptome: Vigilanzminderung, Stupor, Verwirrtheitszustände, Mutismus (ähnlich wie katatoner Stupor) Extrapyramidal-motorische Symptome: Akinese, Tremor, Rigor FALTER: Fieber, Autonome Instabilität, Leukozytose, Tremor, Erhöhte Enzyme (CK, Transaminasen), Rigor Diagnostik: CK↑↑, Transaminasen↑, Leukozytose, metabolische Azidose, Myoglobinurie Therapie • Antipsychotika absetzen! • Dopaminagonisten: L-Dopa, Apomorphin, Amantadin, Bromocriptin • Dantrolen Parkinsonmittel Substanzklasse Wirkstoffe <70. Lebensjahr 1. Wahl >70. Lebensjahr Dopaminvorstufen • • • • • • • • • + Decarboxylasehemmer • Benserazid • Carbidopa COMT-Hemmer • Entacapon Bei starken motorischen Wirkungsfluktuationen NMDA-Antagonisten • Amantadin • PK Merz® Dopamina gonisten NonErgot Ergot Ropinirol Pramipexol Apomorphin Rotigotin Bromocriptin Pergolid Lisurid Cabergolin L-Dopa auch im fortgeschrittenen Stadium der Erkrankung, da keine präsynaptische Decarboxylierung durch die geschädigten Neuronen erfolgen muss Stärkste Wirkung auf Akinese, gefolgt von Rigor und Tremor 2. Wahl 2. Wahl Wirkung 1.Wahl MAO-B-Hemmer • Selegilin • Rasagilin Alternative bei Patienten mit milder Symptomatik Reduktion L-Dopa-induzierter Dyskinesien Alternative bei Patienten mit milder Symptomatik Anticholinergika • Biperiden • Budipin Nur supportiv bei Tremor Nicht gegen Minus-Symptome stärkste Wirkung auf Akinese, gefolgt von Rigor und Tremor L-Dopa Response Test L-Dopa wird optimalerweise zwischen den Mahlzeiten eingenommen, Eine hohe Eiweißbindung führt zu verminderter Wirkung bei Aufnahme mit der Nahrung! Periphere Decarboxylierung von L-Dopa wird durch Benserazid oder Carbidopa gehemmt Kombinationstherapie mit L-Dopa: Hemmung der Catechol-O-Methyltransferase → Dopamin-Abbau↓ → Dopaminwirkung↑ → L-Dopa-Bedarf↓ Antagonismus am Glutamat (NMDA)-Rezeptor mit folgender dopaminerger Wirkung Stärkere Wirkung auf Akinese und Rigor als auf Tremor Mittel der Wahl bei akinetischer Krise Hemmung des zentralnervösen Dopamin (und Katecholamin)-Abbaus → Verlängerung der Dopaminwirkung → Verminderung des Bedarfs an L-Dopa Angleichung der Acetylcholinspiegel an die erniedrigten Dopaminspiegel Nebenwirkung Vegetativ: Übelkeit, Erbrechen, Hypotonie Motorisch: Dyskinesien Psychisch: Unruhe, Halluzinationen,Manie, Impulskontrollstörung, Vermehrte Tagesmüdigkeit Ergot: Fibrosen Wirkungsverlust Vegetative Symptomatik: -Nausea und Emesis -Unruhe Psychosen Hypo- oder hyperkinetische Wirkungsfluktuationen A-/Dyskinesie, Freezing Akinetische Krise Malignes L-DopaEntzugssyndrom GI-NW, Dykinesien und psychische Störungen Ähnlich wie L-Dopa, leichter QT-Verlängerung! (nicht bei kardialen VE) Kopfschmerzen, Dyskinesien, psychische Störungen Mundtrockenheit, Tachykardie, Harnverhalt,.. Antikonvulsiva Antikonvulsiva dienen der Behandlung von Krampfanfällen, hemmen die neuronale Erregung und verstärken die neuronale Hemmung. Der dominierende Effekt ist hierbei die Hemmung spannungsabhängiger Na+-Kanäle, wobei es jedoch auch andere Mechanismen gibt. Bei allen Antikonvulsiva sind dosisabhängige zentralnervöse Nebenwirkungen beschrieben, während einzelne Pharmaka spezielle Nebenwirkungen haben (z.B. Phenytoin: Gingivahyperplasie). Die Mittel der Wahl bei fokalen und kryptogenen Epilepsien sind Lamotrigin und Levetiracetam, bei generalisierten Epilepsien Valproat. Substanz Valproat (Valproinsäure) Carbamazepin Indikation General. Fokal 1. Wahl 2. Wahl 2. Wahl Ethosuximid Phenytoin Lamotrigin Levetiracetam Gabapentin Pregabalin Vigabatrin Ausnahme 2. Wahl 1. Wahl 1. Wahl 2. Wahl 2. Wahl Wichtige Fakten Wenige Nebenwirkungen → Häufig verwendete Substanz Sehr gute Wirksamkeit als Phasenprophylaxe bei bipolaren Störungen Ausgeprägte CYP3A4- und CYP2C19-Induktion → Zahlreiche Interaktionen NW: ADH-ähnlich (Hyponatriämie, Ödeme), allerg. Reaktionen, Panzytopenie, Sedierung, teratogen Mittel der Wahl bei Absencen Unwirksam bei anderen Epilepsieformen Akuter Anfall: Aufsättigung mit Phenytoin nach initialer Diazepam/Clonazepam-Gabe, dann Narkotika Spezielle Nebenwirkungen: Gingivahyperplasie, Hypertrichose, Osteopathie Wenige Nebenwirkungen → Häufig verwendete Substanz Als Mono- und Kombinationstherapie einsetzbar Bei zahlreichen Epilepsieformien nicht wirksam (z.B. Absencen, Myoklonien, etc.) + neuropathische Sz Kombinationspräparat bei fokalen Anfällen Spezielle Indikation: West-Syndrom, NW: Gesichtsfeldausfälle Neuronale Erregung↓, Neuronale Hemmung↑ Hemmung spannungsabhängiger Na+-Kanäle Hemmung spannungsabhängiger Ca2+-Kanäle (T-Typ und L-Typ) Blockade exzitatorischer Glutamatrezeptoren Verstärkung der GABAergen, hemmenden Wirkung über verschiedene Wege Lithium Lithium wird hauptsächlich als Phasenprophylaxe bei bipolaren affektiven Störungen eingesetzt. Die Wirkungsweise der Lithiumsalze ist bisher nicht ausreichend geklärt, es zeigen sich jedoch antisuizidale und antimanische Effekte. Typische Nebenwirkungen einer Lithiumtherapie sind ein feinschlägiger Tremor und ein nephrogener Diabetes insipidus mit Polyurie und Polydipsie. Die geringe therapeutische Breite (Gefahr der Lithiumintoxikation) macht regelmäßige Kontrollen der Lithiumkonzentrationen unabdingbar (therapeutischer Bereich: 0,6-1,2 mmol/L). Bei einer Intoxikation kann es zu Übelkeit, Erbrechen und zentralnervösen Symptomen wie psychomotorische Unruhe, Schwindel und Dysarthrie kommen. • Mittel der ersten Wahl zur Phasenprophylaxe bei bipolaren affektiven Störungen • Akute manische Episode • Phasenprophylaxe schizoaffektiver Störungen • Zusätzliche Gabe (Augmentation) bei therapieresistenten Depressionen sowie zur Rezidivprophylaxe zur Reduzierung suizidaler Handlungen Spiegelbestimmung Ein gleichmäßiger Spiegel ist in der Regel nach 5 - 7 Tagen erreicht, Wirkung kann in der Regel nach frühestens 7 - 14 Tagen Zielbereich: Langzeitprophylaxe: 0,5 - 0,8 mmol/l, akute Behandlung 1,0 - 1,4 mmol/l Spiegelbestimmung: Alle 6 - 8 Wochen (bei Therapiebeginn: wöchentlich) Halbwertszeit: 12 - 24 Stunden → Blutentnahme sollte zur besseren Vergleichbarkeit der Ergebnisse kurz vor der Tabletteneinnahme erfolgen, bzw. 12 Stunden danach. Nebenwirkung Absolute KI: schwere NI/Herz-Kreislauf-Erkrankung ZNS und peripheres Nervensystem Relative KI: Kochsalzarme Diät, Diuretikatherapie Häufig feinschlägiger Tremor → Gabe von Propranolol GI-Erkrankung, Hypothyreose, Morbus Addison Hyperreflexie, Epileptogenes Potential↑ (bei vorbestehender Schädigung) Gewichtszunahme (appetitsteigernd) verminderte Wirkung in Kombination mit natriumreicher Kost Gastrointestinale Nebenwirkungen verstärkte Wirkung bei Natriumverlust (Konkurrenz!) Schilddrüse: Struma, Hypothyreose Niere: Lithium-Nephropathie: Nephrogener Diabetes insipidus (Hemmung der ADH-Wirkung) → Polyurie und Polydipsie, CNV Herz: Veränderungen im EKG Lithiumintoxikation: Ab einem Lithiumspiegel von >1,5–2,0 mmol/L ist eine Intoxikation sehr wahrscheinlich Überdosierung bei zu häufiger Einnahme Natriummangel bei natriumarmer Diät oder vermehrtem Schwitzen (z.B. bei großer Hitze, Sonnenbaden, Sauna), Durchfall Diuretikatherapie, Nierenfunktionsstörungen Initialsymptome: Faszikulationen Gastrointestinal/vegetativ: Nausea, Erbrechen, Durchfall, Inappetenz, Schwindel Neurologisch: Verwaschene Sprache, Ataxie, Downbeat-Nystagmus, Dysdiadochokinese, Tremor, Somnolenz Psychiatrisch: Apathie, psychomotorische Verlangsamung Schwerer Verlauf: Zusätzliche neurologische Symptome: Rigor, Hyperreflexie, generalisierte Krampfanfälle, Oligurie mit Niereninsuffizienz Beta-Blocker Beta-Blocker spielen eine zentrale Rolle in der Therapie des arteriellen Hypertonus sowie in der Behandlung von Herzerkrankungen, wie Herzinsuffizienz und KHK. Durch die Wirkung auf β1- und β2-Rezeptoren entfalten sie zahlreiche Effekte in unterschiedlichen Organen, wobei oftmals insbesondere eine Hemmung der β1-Rezeptoren gewünscht ist. Beispielsweise wird die Blutdrucksenkung vorwiegend β1-gesteuert über einen negativen inotropen Effekt am Herzen vermittelt, während β2-gesteuert Einfluss auf den Kohlenhydratstoffwechsel mit der Gefahr von Hypoglykämien genommen wird. Eine Gabe von β-Blockern ist bei Bradykardie und Hypotonie kontraindiziert. Ebenso ist eine Kombination von β-Blockern mit Kalzium-Antagonisten vom Diltiazem- und Verapamil-Typ kontraindiziert, da bradykarde Herzrhythmusstörungen und hypotone Krisen ausgelöst werden können. Kardioselektive Betablocker (Beta1-selektiv) Hauptindikationen: KHK, Arterielle Hypertonie, Chron. Herzinsuff., SV HrSt Wirkstoff Elimination Wirkdauer Metoprolol Atenolol Hepatisch Renal Bisoprolol Hepatisch Renal Hepatisch Renal Nebivolol Gut zu wissen ca. 12 Stunden ca. 18 Stunden PAA (ISA) - ca. 18 Stunden - ca. 24 -30 Stunden - Standardpräparat Besonders ausgeprägte β-1-Selektivität Besonders lange Wirkdauer → Bei schlechter Compliance sinnvoll Periphere Vasodilatation Standardpräparat Sinnvoll bei Leberinsuffizienz Unselektive Betablocker sind zur Therapie der arteriellen Hypertonie weniger geeignet! => Migräne, Tremor, Portale Hypertonie, Hyperthyreose Wirkstoff Propranolol Rezeptorprofil β1 β2 Elimination Hepatisch Wirkdauer ca. 12 Stunden PAA - Carvedilol β1 β2 α1 β1 β2 Hepatisch Renal ca. 18 Stunden - Renal ca. 24 -30 Stunden - Sotalol Gut zu wissen Spezielle Indikationen Thyreotoxische Krise Akute Aufregung und Unruhe Portale Hypertension Hybrid-Blockade α1: Periphere Vasodilatation β1: Negativ inotrope Wirkung am Herzen Früher bei HRST, heutzutage kaum mehr verwendet Die Wirkung adrenerger Substanzen (wie Adrenalin, Noradrenalin) an β-Rezeptoren wird kompetitiv gehemmt! β1-Rezeptoreffekte inhibiert Nebenwirkungen Herz: Negativ inotrop → Hypotension + Zunahme Herzinsuffizienz Negativ dromotrop → Block des Sinus-/AV-Knotens Negativ chronotrop → Bradykardie Lipoproteine und Triglyceride↑ renale Perfusion↓ Kopfschmerz, Schlafstörungen und Albträume Fett: Niere: ZNS: Negativ inotrop, dromotrop, chronotrop, → RR↓, antiischämisch Lipolyse↓ Renin↓ → Renale Perfusion↓ und RAAS↓ (RR↓) Sedation Die β1-Selektivität von kardioselektiven β-Blockern lässt mit steigender Dosierung nach! β2-Rezeptoreffekte inhibiert Nebenwirkungen Dilatation der glatten Muskulatur peripherer Gefäße↓ =>Kontraktion Glykogenolyse in Leber und Skelettmuskel↓ Pankreas: Insulinsekretion↓ Kalte Extremitäten, Potenzstörungen und Raynaud-Syndrom → Hypoglykämie → Hyperglykämie Bronchokonstriktion Eine β2-Hemmung kann zur Bronchokonstriktion und somit zur Zunahme der Symptomatik eines Asthma bronchiale führen Absolute Kontraindikationen: Deutliche Bradykardie, Hypotonie, Phäochromozytom, Dekompensierte Herzinsuffizienz, Asthma bronchiale Unselektive Beta-Blocker: Akutes Koronarsyndrom Relative Kontraindikationen: Psoriasis, Raynaud-Syndrom, pAVK, (Schwangerschaft) Keine Kombination von β-Blockern mit Kalziumantagonisten vom Diltiazem- oder Verapamil-Typ aufgrund möglicher Nebenwirkungen wie Bradykardie, AV-Block und Hypotonie! β-Blocker müssen ein- (neg inotrop) und ausgeschlichen (Rebound-Effekt) werden! (jeweils über 14 Tage) Sympathomimetika Sympathomimetika sind Substanzen, die ähnlich wie Adrenalin oder Noradrenalin zu einer Aktivierung des sympathischen/adrenergen Systems führen. Dem Wirkmechanismus nach werden direkte von indirekten Sympathomimetika unterschieden. Grundsätzlich vermitteln die Substanzen über α- und β-Rezeptoren eine Aktivierung des Körpers im Sinne einer "fight-or-flight"-Situation, wobei unter anderem Blutdruck, Herzfrequenz sowie die muskuläre Kontraktilität gesteigert und sowohl digestive als auch sekretorische Funktionen supprimiert werden. Bei Verabreichung sind hypertensive Krisen und tachykarde Herz-RhythmusStörungen zu berücksichtigen. Eine längere Gabe geht durch eine Down-Regulation der β-Rezeptoren erwartungsgemäß mit einem Wirkungsverlust der Medikation einher, was eine Dosissteigerung im Verlauf erforderlich macht. Agonismus an adrenergen Rezeptoren α-Rezeptoren Noradrenalin (sept. Schock) Adrenalin (Anaphylaxie, CPR) Dopamin Dobutamin (Kardiogener Schock) β1-Rezeptoren β2-Rezeptoren D1-Rezeptoren D2-Rezeptoren ↑↑↑↑ (Schock) ↑↑ ∅ ∅ ∅ ↑↑↑↑↑ (Anaphylaxie) ↑↑↑↑↑ (CPR) ↑↑↑ (Anaphylaxie) ∅ ∅ ↑↑ (in hoher Dosierung) ↑ ↑↑↑ (in mittlerer Dosierung) ↑↑↑↑ (kardiogener Schock) dosisabhängige Wirkung ↑↑ ↑↑↑ ∅ ↑↑↑ ∅ Mydriasis Fernakkommodation Kontraktion von renalen und dermalen Gefäßen Sphinkterkontraktion Sekretion↓ Herzfrequenz↑ Kontraktilität↑ Überleitung↑ Bronchodilatation Periphere Gefäßdilatation Peristaltik↓ Detrusorerschlaffung Kontraktion↑ Glykogenolyse↑ Downregulation von β-Rezeptoren bei dauerhafter Katecholamin-Gabe Notwendigkeit einer Dosissteigerung im Verlauf β-2-Sympathomimetika β2-Sympathomimetika werden in der Pulmonologie als Bronchospasmolytikum und in der Geburtshilfe als Tokolytikum eingesetzt. Die Wirkung erfolgt über eine Stimulation des β2-Rezeptors, während die Nebenwirkungen teilweise auch β1-Rezeptor-vermittelt sind. Im Alltag können nach Applikation neben Unruhe und Tremor auch lebensbedrohliche Nebenwirkungen wie ventrikuläre Herzrhythmusstörungen auftreten. selektive Stimulation am β2-Rezeptor • Bronchodilatation • Tokolyse • Dilatation der Gefäße • Hemmung der Histaminfreisetzung Eigenschaft Kurzwirksam Langwirksam Wirkstoff • Salbutamol • Fenoterol • Reproterol • Terbutalin • Formoterol • Salmeterol geringe Wirkung am β1-Rezeptor: Blutdrucksteigerung, AP, ventrikuläre HrSt Unruhe, Schlafstörungen oder Tremor Hyperglykämie (cAMP => Glykogenolyse) + Hypokaliämie => Reflextachykardie nach Gefäßdilatation Toleranzentwicklung Wirkungseintritt nach ca. 30 Sekunden nach ca. 30 Sekunden nach ca. 10 Minuten 4-8h Wirkdauer Spezielle Indikation und Applikation • Asthma bronchiale ab Stufe I als Bedarfsmedikation • Tokolyse: Fenoterol (Geburtshilfe i.v.) ≥12h • Asthma bronchiale ab Stufe III/I V Kontraindikation: Phäochromozytom, Glaukom, Ausgeprägte Hyperthyreose, Hypertrophe obstruktive Kardiomyopathie Antisympathotonika Antisympathotonika senken die aktivierende, noradrenerge Wirkung von Sympathomimetika auf den Sympathikus. Je nach Pharmakon wird die Synthese, Speicherung oder Freisetzung von Noradrenalin gehemmt. Ihr Einsatz ist vorwiegend die Kombinationstherapie der arteriellen Hypertonie, wobei alle Antisympathotonika zu einer orthostatischen Dysregulation führen können. Antisympathotonika finden, außer in speziellen Situationen (Schwangerschaft), in der Monotherapie der arteriellen Hypertonie kaum mehr Verwendung. Gleichzeitig gewinnt Moxonidin in der Mehrfach-Kombinationstherapie mit den Antihypertensiva der 1. Wahl aufgrund seiner guten Verträglichkeit zunehmend an Bedeutung. - Zentrale Drosselung der Aktivität der sympathischen Nervenfasern - Senkung der Produktion, Speicherung und Freisetzung der endogenen Katecholamine (vorwiegend Noradrenalin) Alle Antisympathotonika können in der Kombinationstherapie der Hypertonie eingesetzt werden! Moxonidin wird hierbei bei guter Verträglichkeit zunehmend bedeutsamer! Die allen Antisympathotonika gemeinsame und entscheidende Nebenwirkung ist die orthostatische Dysregulation! Medikament Reserpin Wirkung Noradrenalin- und Dopamin-Wiederaufnahmehemmer Urapidil Postsynaptische Blockade des α1-Rezeptors und gleichzeitige Stimulierung zentraler Serotoninrezeptoren, keine Reflextachykardie Verstoffwechselung zu α-Methylnoradrenalin, → Stimulation zentraler α2-Rezeptoren → Hemmung efferenter sympathischer Neurone → Peripherer Gefäßwiderstand und Herzzeitvolumen↓ → RR↓ Stimulation zentraler prä- und postsynaptischer α2-Rezeptoren → Hemmung efferenter sympathischer Neurone → → Peripherer Gefäßwiderstand und Herzzeitvolumen↓ → RR↓ Stimulation zentraler Imidazolin-Rezeptoren → Peripherer Gefäßwiderstand↓ → RR↓ Stimulierung peripherer präsynaptischer α1-Rezeptoren → RR↑ α-Methyl-Dopa Clonidin Monoxidin Tizanidin Stimulation zentraler Imidazolin-Rezeptoren→ Peripherer Gefäßwiderstand und Herzzeitvolumen↓ → RR↓ Stimulation zentraler α2-Rezeptoren → Senkung peripherer Muskelverspannungen und -krämpfe (z.B. bei Multipler Sklerose) NW Förderung einer Depression, Prolaktinerhöhung Kopfschmerzen und gastrointestinale Nebenwirkungen Müdigkeit Na+- und H20-Retention Müdigkeit, Sedierung Initialer Blutdruckanstieg (bei schneller i.v.-Gabe) Rebound-Hypertonie nach abruptem Absetzen Mundtrockenheit Asthenie Selten: Halluzinationen Besondere Indikation Hypertensive Krise bzw. Notfall (besonders bei Phäochromozytom) Chronische Hypertonie in der Schwangerschaft Alkoholentzugstherapie und Delirium tremens: Blutdrucksenkung und Sedierung Blutdrucksenkung bei hypertensiver Krise Glaukomtherapie Kombi bei arterieller Hypertonie Spastiken und Muskelverspannungen → Einsatz als zentrales Spasmolytikum Parasympathomimetika Parasympathomimetika können anhand ihrer Wirkungsweise in direkte und indirekte Formen unterschieden werden. Während die direkten Parasympathomimetika über eine Bindung an den M-Cholinorezeptor eine cholinerge Wirkung vermitteln, verlängern indirekte Parasympathomimetika über eine Hemmung der Acetylcholinesterase die Wirkung des körpereigenen Acetylcholins. Direkte Parasympathomimetika werden in der Augenheilkunde topisch zur Herstellung einer Miosis angewandt, während indirekte Parasympathomimetika neben der Therapie von postoperativen Darm-/Blasenatonien teilweise auch bei Myasthenia gravis verwendet werden. Direkte Parasympathomimetika Wirkmechanismus Bindung an M Cholinorezeptoren Wirkstoffe • Pilocarpin • Carbachol Indirekte Parasympathomimetika Hemmung der Acetylcholinesterase • Neostigmin • Pyridostigmin • Distigmin • Physostigmin (ZNS-gängig!) Antidementiva • Donepezil • Rivastigmin • Galantamin Wirkung Miosis → Erweiterung des Kammerwinkels (Glaukom) Nahakkommodation Antagonisierung von nichtdepolarisierenden Muskelrelaxanzien Myasthenia gravis (Pyridostigmin) Postoperative Darm- und Harnblasenatonie Antidot des anticholinergen Syndroms → reversible Hemmung der Acetylcholinesterase Leichte und mittelschwere Demenzen Nebenwirkung Sehstörung durch Miosis Bradykardie und Herzrhythmusstörungen AV-Block Diarrhoe Schweißausbrüche Vermehrter Speichel und Magensaft Übelkeit Bronchokonstriktion Zunahme der bronchialen Sekretion Parasympatholytika Parasympatholytika (Anticholinergika) heben über eine kompetitive Hemmung die Wirkung von Parasympathomimetika am M-Cholinorezeptor auf. Acetylcholin wird postganglionär verdrängt, wobei alle Parasympatholytika ähnliche Eigenschaften wie Atropin, dem Leitpharmakon der Medikamentengruppe, aufweisen. Unterschieden wird in lipophile (tertiäre, z.B. Atropin) und weniger lipophile Substanzen (z.B. Butylscopolamin), die schwerer resorbierbar und nicht ZNS-gängig sind. Die störendste Nebenwirkung der Parasympatholytika ist die Mundtrockenheit, während andere Nebenwirkungen wie Erhöhung der Herzfrequenz oder eine periphere Vasokonstriktion, außer im Falle einer Intoxikation, häufig nicht bemerkt werden. Substanz Atropin Scopolamin Chemische Eigenschaften Tertiäre Amine → Lipophil Gute orale Bioverfügbarkeit Liquorgängig Tropicamid Biperiden Oxybutynin, Darifenacin u.a. Butylscopolamin Ipratropiumbromid Quartäre Amine → Hydrophil Geringe orale Bioverfügbarkeit Keine Liquorgängigkeit Wichtige Fakten Leitsubstanz Bevorzugte Substanz bei Bradykardien während der OP-Einleitung Auge: Lange Wirkdauer → Nur zur therapeutischen, nicht zur diagnostischen Mydriasis (Augenhintergrundspiegelung) Wirkprofil ähnlich wie Atropin Besondere Wirkung: Ausgeprägte zentrale Dämpfung (teilweise mit Amnesien), Antiemetisch Indikation: Kinetosen Wirkprofil ähnlich wie Atropin, aber deutlich kürzere Wirkdauer Auge: Kurze Wirkdauer → Vor allem zur diagnostischen Mydriasis (Augenhintergrundspiegelung) Antidot bei Antipsychotika-induzierten extrapyramidalen Störungen (EPS) Therapieoption bei Morbus Parkinson Wirkung vor allem auf glatte Muskulatur → Spasmolyse Indikation: Imperativer Harndrang bei Überaktivität des M. detrusor vesicae Ausgeprägte Wirkung an glatter Muskulatur des Magen-Darm-Trakts und der Harnblase→ Bevorzugtes Spasmolytikum Gute Wirkung bei intravenöser Gabe, begrenzt bei oraler Gabe Indikation: Spasmolyse (z.B. bei Pankreatitis oder akuter Choledocholithiasis) Ausgeprägte Wirkung auf das Bronchialsystem und den Kreislauf Indikation: Inhalativ COPD (ab Stufe I), Asthma bronchiale (Akuttherapie bei therapierefraktärem Asthma) Wirkung Zunahme der Herzfrequenz Verkürzung der AV-Überleitung Der Blutdruck wird nur in höheren Dosierungen beeinflusst Antiemetisch, zentrale Dämpfung Mydriasis Akkommodationslähmung Verengung des Kammerwinkels Nebenwirkung Tachykardie Vasokonstriktion Mundtrockenheit Steigerung Magen-pH Hyperthermie und Hautrötung Glaukom Akkommodationsstörung Erregung bei ZNSGängigkeit Spasmolyse Miktionsstörung/ Harnverhalt Abnahme der Peristaltik Speichel- und Magensaftsekretion↓ Darmatonie/ Verdauungsstörungen Bronchodilatation Abnahme der bronch. Sekretion Anticholinerges Syndrom (Intoxikation) Tollkirschenvergiftung (Atropin) Medikamente - Trizyklische Antidepressiva mit anticholinerger Wirkung (vorwiegend Doxepin, Amitriptylin, Imipramin und Trimipramin) - Parasympatholytika - Antipsychotika - Antihistaminika der 1. Generation Klinik: Mundtrockenheit, heiße Haut, Tachykardie, Herzrhythmusstörungen, Mydriasis, zentrale Erregung Therapie: Antidot: Physostigmin Differentialdiagnose Drogenintoxikation "Feuerrot, glühendheiß, strohtrocken, total verrückt!" Anticholinerges Delir Insbesondere durch eine vermehrte Verwendung von trizyklischen Antidepressiva (aber auch aller anderen anticholinerg wirksamen Medikamente) kann es zu einem lebensbedrohlichen anticholinergen Delir mit Störungen von Bewusstsein und Wahrnehmung sowie zu psychomotorischen Auffälligkeiten kommen. Zusätzliche Symptome - Bewusstseinsstörungen: Verwirrtheit, Orientierungsstörungen - Wahrnehmungsstörungen: Halluzinationen Substanzen Indikation Sympathikomimetika Noradrenalin Adrenalin Dopamin Dobutamin β2 selektiv: Salbutamol Fenoterol Reproterol Terbutalin Formoterol Salmeterol „fight oder flight“ CPR (Adrenalin) Kardiogener Shock (Dobutamin) Sepsis (Noradrenalin) Anaphylaxie (Adrenalin) β2 seltektiv: Asthma bronch., COPD Tokolyse Rezeptoren α, β1, β2, D1, D2 Wirkung Mydriasis, Bronchodilat., HF↑, Sphinkterkontrakt., Peristaltik ↓, Detrusorerschlaffung, Glykogenolyse, Lipolyse, Tokolyse, ↓Histamin Hypertonie, Tachykardie, Hypergykämie, Hypokaliämie KI β2 seletiv: Phäochromozytom,HOCM, Glaukom, Hyperthyreose, Nebenwirkung Antisympathikotonia Reserpin Urapidil α-Methyl-Dopa Clonodin Monoxidin Tizanidin Doxazosin Alfuzosin Tamsulosin Prazosin Parasympathikomimetika direkt: Pilocarpin Carbachol indirekt: Neostigmin Pyridostigmin Physiostigmin Donepezil Rivastigmin Galantamin Parasympathikolytika tertiäre Amine (lipophil): Atropin Scopolamin Tropicamid Biperiden Oxybutynin Darifenacin quartäre Amine (hydrophil): Butylscopolamin Ipratropiumbromid Arterielle Hypertonie -Kombination -Schwangerschaft -Delirium tremens (Clonidin) -Glaukom (Clonidin) -therapierefraktär Spasmolyse (Tizanidin) BPH (Doxaz., Alfuz., Tamsul.) Dranginkontinenz (Prazosin) u.a. Stimulation zentraler α1, Blockade α2 Zentrale Drosselung der sympathischen Nervenfasern ↓Produktion, Speicherung und Freisetzung der endogenen Katecholamine (vorwiegend Noradrenalin) direkte: Glaukom: indirekte: Antagonisierung nicht-depol. Mukelrelaxantion, Myasthenia gravis (Pyridost.), postop. Blasen-Darm-Atonie, Anticholinerges S. (Physiost.) Donepezil, Rivast., Galantam: leichte/mittelschwere Demenz Bradykardien (Atropin) Kinetosen (Scopolamin) diagn. Mydriasis (Tropicamid) EPS, M. Parkinson (Biperiden) Imperativer Harndrang (Oxybutynin, Darifenacin) Spasmolyse (Butylscop. iv) COPD, Asthma (Ipratropiumbromid inhalativ) direkt: M-Cholinorezeptor indirekt: Hemmung AChE Miosis, Bronchokonstr., HF↓, RR↓, Peristaltik+Sekretion↑, Sphinkterrelaxation kompetetive Hemmung am M-Cholinorezeptor Mydriasis, Bronchodilat., HF↑, Sphinkterkontrakt., Peristaltik ↓, Detrusorerschlaffung, Vasokonstriktion Depression, Müdigkeit, Sedierung, Hypotonie, H2O + Na-Retention, direkt: Sehstörung (Miosis) indirekt: AV-Block, Bradykardie, Diarrhoe, Schwitzen, Übelkeit ↑Speichel + Magensäure, anticholinerge NW: Mundtrockenheit, Hyperthermie, Tachykardie, Harnverhalt, Darmatonie, Glaukom, psych. Erregung Kalzium-Antagonisten Kalzium-Antagonisten lassen sich in drei Gruppen unterscheiden: Während Kalzium-Antagonisten vom Nifedipin-Typ (Dihydropyridine) ihre Wirkung vorwiegend an der glatten Muskulatur von Gefäßen entfalten (Dilatation), haben Kalzium-Antagonisten vom Verapamil-Typ einen Effekt auf das Myokard sowie die Erregungsbildung und -leitung (negative inotrop, dromotrop und chronotrop). Diltiazem wiederum nimmt zwischen beiden Polen eine intermediäre Position mit gleichmäßigem Einfluss auf alle relevanten Zielorgane ein. Die Wirkung wird über eine Blockade von L-Typ Kalziumkanälen (gehemmter Ca2+-Einstrom) realisiert. Zentrale Nebenwirkungen sind Kopfschmerzen, Flush, periphere Ödeme sowie reflektorische Tachykardien. Kalzium-Antagonisten werden meist in der Therapie der arteriellen Hypertonie, stabiler Angina pectoris und des Raynaud-Syndroms (Nifedipin) eingesetzt, wobei sie u.a bei schwerer Herzinsuffizienz, Hypotension und schweren stenosierenden Herzvitien kontraindiziert sind. Auch bei einer kombinierten Gabe mit Nitraten ist die Möglichkeit von vitalbedrohlichen Hypotonien zu beachten. Ca2+Antagonist NifedipinTyp (Dihydropyri din-Typ) DiltiazemTyp VerapamilTyp Wirkstoffauswahl Myokard Kurzwirksam (HWZ <2h): Nifedipin Mittellang wirksam (HWZ 8 - 12h): Nitrendipin, Lercanidipin Lang wirksam (HWZ >24h): Amlodipin (Dauertherapie) Diltiazem (↓) SinusknotenWirkung ∅ AVÜberleitung ∅ Gefäßtonus ↓ ↓ ↓ ↓ Verapamil, Gallopamil neg inotrop, chronotrop, dromotrop ↓-↓↓ ↓ ↓↓ (↓) Nebenwirkung ↓↓ Vasodilatation: Kopfschmerzen, subjektive Überwärmung, Flush Herz-Kreislauf: Reflextachykardie Gefahr bzw. Verstärkung einer Angina pectoris-Symptomatik mit Steal-Phänomen Alle Nebenwirkungen wie bei Nifedipin- und Verapamil-Typ, jedoch in geringerem Ausmaß CYP3A4-Substrat Bradykardie AV-Block I (selten AV-Block III möglich) Obstipationen CYP3A4-Substrat Indikation • • • • Arterieller Hypertonus Stabile Angina pectoris HRST: Supraventrikuläre Tachykardie Raynaud-Syndrom (Nifedipin) Kontraindikation: Herzinsuffizienz im NYHA-Stadium III-IV, Hypotension, Akutes Koronarsyndrom, Schwere stenosierende Herzklappenfehler, SS Verapamil und Diltiazem: AV-Block III. Grades, Kombination mit Betablockern → Gefahr des AV-Blocks ACE-Hemmer und AT1-Rezeptorblocker Das Renin-Angiotensin-Aldosteron-System (RAAS) spielt eine wichtige Rolle bei der Regulation des Blutdrucks. In der Therapie der arteriellen Hypertonie stellt es einen Angriffspunkt für die ACE-Hemmer und Sartane dar. Durch Verminderung der Bildung oder Antagonisierung von Angiotensin II wird unter anderem der Blutdruck gesenkt - andere Indikationen sind die medikamentöse Therapie nach Myokardinfarkt und die chronische Herzinsuffizienz. Aufgrund ihrer nephroprotektiven Wirkung werden ACE-Hemmer und Sartane bei Vorschädigung der Nieren (v.a. bei Diabetes mellitus) eingesetzt, sind jedoch beispielsweise bei chronischer Niereninsuffizienz relativ kontraindiziert. Neben Hypotonien zeichnen sich ACE-Hemmer im Vergleich zu Sartanen durch häufigen, Bradykininbedingten Reizhusten aus, welcher eine Umstellung der Medikation erfordert. ACEHemmer Sartane Wirkstoffe Enalapril, Lisinopril, Ramipril, Captopril Valsartan, Candesartan, Losartan günstig • Diabetes mellitus (Nephroprotektiv) • Herzinsuffizienz • Z.n. Herzinfarkt • Junge Patienten • Metabolisches Syndrom ungünstig • Beids. NAST • Hyperkaliämie • fortgeschrittene NI absolute KI: Angioödem, SS, SZ Relative KI: NI, GFR<60, beids. NAST, Einzelniere Lithiumeffekt erhöht! Direkte ReninInhibitoren Aliskiren Zulassung bislang nur zur Therapie des arteriellen Hypertonus Keine Kombination mit Ciclosporin, Chinidin und Verapamil Sowie mit ACE-Hemmern/Sartanen Wirkung Hemmung des ACE) → Angiotensin I zu Angiotensin II↓ → Vasokonstriktion↓ → RR↓ Aldosteron-Sekretion↓ → Na+- und Wasseraufnahme↓ → RR↓ Nephroprotektion bei renalen Erkrankungen: Proteinurie↓ und Progress der Erkrankung↓ Remodeling↓ nach Myokardinfarkt Hemmung/Rückbildung der Myokardhypertrophie bei Hypertonie bei ACE-Hemmer-Unverträglichkeit Antagonismus am AT1-Rezeptor → Vasokonstriktion ↓ und Sekretion Aldosteron↓ → RR↓ (Remodeling↓) Direkte Hemmung des Renins → Angiotensinogen zu Angiotensin I↓ → Angiotensin II↓ → Vasokonstriktion↓ → RR↓ Aldosteron-Sekretion↓ → Na+- und Wasseraufnahme↓ → RR↓ Nebenwirkungen Hypotension Anstieg der Retentionsparameter bis Niereninsuffizienz und Nierenversagen Hyperkaliämie (Kombi mit Thiaziden) Angioneurotisches Ödem Allergische Reaktionen (Exanthem, Pruritus) ACE-Hemer: Reizhusten (Bradykinin), Geschmacks-, GI- Störung Sartane: Schwindel, Kopf-Sz Gastrointestinale Beschwerden, vor allem Diarrhö Herzglykoside Digitoxin und Digoxin sind Herzglykoside, die eine Hemmung der Natrium/Kalium-ATPase in den Kardiomyozyten bedingen. Dadurch steigt der intrazelluläre Natriumgehalt, wodurch sich der Wirkgradient des Natrium/Kalzium-Antiporters verringert und der Kalziumgehalt intrazellulär steigt. Dies führt zu einer Kontraktionskraftsteigerung (positiv inotrop) und einer Verlangsamung der Erregungsleitung im Herzen (negativ dromotrop). Da eine geringe therapeutische Breite besteht, muss der Blutspiegel streng kontrolliert werden. Eingesetzt werden Herzglykoside insbesondere zur Frequenzkontrolle bei tachykardem Vorhofflimmern sowie symptomatisch bei einer Herzinsuffizienz Stadium ≥ NYHA III. Hemmung der Natrium/Kalium-ATPase in den Kardiomyozyten → Steigerung des intrazellulären Natriumgehalts → Verringerter Wirkgradient des Natrium/Kalzium-Antiporters → Anstieg des intrazellulären Kalziumgehalts → Kontraktionskraftsteigerung (positiv inotrop) und Verlangsamung der Erregungsleitung im Herzen (negativ dromotrop) Wirkbeginn Charakteristika oral: 2 - 3h hydrophil Ausschließliche renale Elimination → Kumulation bei Niereninsuffizienz i.v.: 10-30min Therapie bei Digitalisintoxikation: Digitalisantikörper Digitoxin oral: 3 - 4h lipophil Hepatische Metabolisierung → Bevorzugter Einsatz bei Niereninsuffizienz i.v.: 30-120min Therapie bei Digitalisintoxikation: Digitalisantikörper, Cholestyramin, Hämoperfusion "Digit"-oxin wie "lipid" ist lipophil und wird daher hepatisch eliminiert! Digoxin ist hydrophil und wird ausschließlich renal eliminiert! Digoxin Indikation Geringe therapeutische Breite: Blutspiegel streng kontrollieren! • Frequenzkontrolle einer Tachyarrhythmia absoluta • Herzinsuffizienz Stadium ≥ NYHA III → keine Prognoseverbesserung, Linderung der Symptome, Verhinderung von Dekompensationen • Paroxysmale supraventrikuläre Tachykardie NW: • Gastrointestinale Nebenwirkungen (Erbrechen, Durchfälle) • Herzrhythmusstörungen • Neurotoxizität: Sehstörungen KI Elektrolyte: Hypokaliämie und Hyperkalzämie → verstärkte Wirkung Herz AV-Block ≥ II° Sick-Sinus-Syndrom Wolff-Parkinson-White-Syndrom Hypertrophische Obstruktive Kardiomyopathie (HOCM) Niere: Digoxin ist kontraindiziert bei Niereninsuffizienz Dosierungsempfehlungen Aufdosierung Loading dose Beispiel für schnellere Aufdosierung Erhaltungsdosis* Therapeutischer Wirkspiegel im Blut Digoxin Digitoxin Grundsätzlich wird bei der Frequenzkontroll-Therapie mit Digitalis zunächst zur Aufsättigung eine höhere Dosis verabreicht, welche dann im Verlauf (nach 2-5 Tagen) auf eine geringere Erhaltungsdosis reduziert und dann beibehalten wird. 1mg (Vollwirkdosis) 2x täglich 0,25 mg für 2-3 Tage 3x täglich 0,1 mg für 3-5 Tage 0,2-0,375 mg/d 0,5-0,8 ng/ml 0,07-0,1 mg/d** 10-20 ng/ml Wirkungsverstärkend Erythromycin Butylscopolamin Captopril Nitrendipin Wirkungsmindernd Anionenaustauscherharze (Colestipol, Colestyramin) Digitalisintoxikation Überdosierung, Hypokaliämie, Bei Digoxin: Niereninsuffizienz Symptome/Klinik: Übelkeit, Bauchschmerzen, Erbrechen, Durchfall, Sehstörungen (Gelb- und/oder Grünstich) EKG: Muldenförmige ST-Senkung, Herzrhythmusstörungen jeglicher Art (Extrasystolen bis totaler AV-Block oder Kammerflimmern) Therapie: Bei Digoxin und Digitoxin: Digitalis-Antitoxin, Magen-Darm-Spülung, Aktivkohlegabe, Kaliumwert hochnormal einstellen Bei Digitoxin: Einsatz von Cholestyramin, Hämoperfusion Nitrate und Molsidomin Nitrate gehören (z.B. in sublingualer Applikation) zur Standardtherapie in der Behandlung von Angina pectoris-Anfällen und des akuten Koronarsyndroms. Durch Relaxation der glatten Muskulatur und periphere Vasodilatation (insb. Vorlastsenkung) wird die Myokardperfusion entscheidend verbessert - eine Prognoseverbesserung in der Langzeittherapie ist jedoch nicht nachgewiesen. Zu den möglichen Nebenwirkungen gehören Nitratkopfschmerz, gastroösophagealer Reflux sowie Blutdruckabfälle bis hin zur Synkope, wobei das Risiko bei vorheriger Einnahme von Sildenafil deutlich erhöht ist. Molsidomin ist den Nitraten ähnlich, wird jedoch in der dauerhaften Therapie der Angina pectoris (nicht im Anfall) eingesetzt. Es führt über eine Dilatation der Kapazitätsgefäße und dem damit verbundenen venösen Pooling zu einer stärkeren Senkung der Vorlast als die Nitrate. Der Nitratkopfschmerz ist auch hier klassisch, doch bei Molsidomin ist, anders als bei den Nitraten, in der Dauertherapie eine deutlich geringere Toleranzentwicklung zu erwarten. Exogene Zufuhr von NO durch Nitrate oder Molsidomin → Aktivierung der Guanylatcyclase → cGMP → Intrazelluläres Kalzium ↓ → Relaxation der glatten Muskulatur → Verbesserte Myokardperfusion mit günstigerer O2-Bilanz Periphere Vasodilatation → Vorlastsenkung durch Weitstellung der Kapazitätsgefäße (venöses "Pooling") Nachlastsenkung erst in höherer Dosierung durch Weitstellung der arteriellen Gefäße Koronardilatation: Insgesamt kommt es dadurch zu einer verbesserten Myokardperfusion Indikation: Behandlung von Angina pectoris-Anfällen: Glyceroltrinitrat Molsidomin wird in der Therapie akuter Angina pectoris-Anfälle nicht eingesetzt. Es wird im symptomfreien Intervall verwendet. Keine prognoseverbessernde Wirkung bei Langzeittherapie (Nitratgewöhnung) Notfallsituation: Zumeist sublinguale Gabe (1-2 Hübe - nur Nitrate!) / Buccale, perkutane oder intravenöse Applikation Nebenwirkungen: Kreislaufdysregulation: Hypotonie, reflektorische Tachykardie → Nitratsynkope Nitratkopfschmerz: Hirngefäßdilatation → Intrakranieller Druck↑ Gastroösophagealer Reflux: Relaxation des unteren Ösophagussphinkters Toleranzentwicklung (Nitrate > Molsidomin) Nach Einnahme von Sildenafil: Mindestens 24-stündige keine Nitrate! => Lebensbedrohliche Blutdruckabfälle (Kontraindikation: RRsys < 90 mmHg) Phosphodiesterase-Hemmer Phosphodiesterase-Hemmer (PDE-Hemmer) werden nach ihrer spezifischen Enzymhemmung unterschieden. Während PDE-V-Hemmer bei erektiler Dysfunktion und pulmonal-arterieller Hypertonie zum Einsatz kommen, werden PDE-III-Hemmer in der Akuttherapie der schweren Herzinsuffizienz eingesetzt. Beide Gruppen haben eine periphere vasodilatatorische Wirkung gemein, während PDE-III-Hemmer auch eine positive Inotropie am Myokard bewirken. PDE-V-Hemmer sollten bei kardial vorbelasteten Patienten mit einer strengen Indikationsstellung rezeptiert werden, da in seltenen Fällen schwere Komplikationen (z.B. Myokardinfarkt) drohen. Eine Kombination aus PDE-V-Hemmern und Nitraten ist aufgrund der Möglichkeit einer vitalbedrohlichen Hypotension verboten. Phosphodiesterase-VHemmer Wirkstoffe • Sildenafil - Viagra® • Tadalafil • Vardenafil Indikation Erektile Dysfunktion Pulmonale Hypertonie werden nicht von der Krankenkasse bezahlt Phosphodiesterase-IIIHemmer • Milrinon • Enoximon Wirkmechanismus cGMP↑ durch Hemmung des abbauenden Enzyms → vermehrte NO-Freisetzung → Relaxation der glatten Muskulatur → Vasodilatation → Bluteinstrom ins Corpus cavernosum↑ → Zunahme der Erektion → Senkung des pulmonalen Gefäßwiderstandes Kurzzeittherapie bei schwerer akuter Herzinsuffizienz Erhöhung von cAMP durch Hemmung des abbauenden Enzyms Myokard: positiv inotrop Periphere Gefäße: Vasodilatation Nebenwirkungen Kopfschmerzen und Schwindel (Farb)-Sehstörungen Flush, Exanthem Schnupfen, verstopfte Nase Selten: Myokardinfarkt, Apoplex Positiv chrono- und dromotrop sowie arrhythmogen Hypotension Gastrointestinale Nebenwirkungen Nicht-orale Antikoagulation Die Hemmung der plasmatischen Blutgerinnung kann sowohl prophylaktisch als auch therapeutisch, z.B. zur Vermeidung und Behandlung von Thrombosen, erfolgen. Heparine spielen dabei im Rahmen der nicht-oralen Antikoagulanzien die größte Rolle, andere Medikamente kommen in der Regel erst bei Unverträglichkeiten zum Einsatz. Neben vermehrten Blutungskomplikationen ist die gefürchtetste Nebenwirkung die seltene Heparin-induzierte Thrombozytopenie Typ II (HIT II), bei der es Autoantikörper-vermittelt zur Aggregation von Thrombozyten mit bedrohlichen Thromboembolien kommt. Da diese Komplikation an einem starken Abfall der Thrombozyten erkannt werden kann, muss bei der sehr häufigen Verwendung von Heparin im klinischen Alltag eine Überwachung des Blutbildes erfolgen. Ausgewählte Wirkstoffe Unfraktioniertes Heparin (UFH) Applikation aPTT Subkutan ✓ Evtl FVIIa Bindung an ATIII → Faktor Xa-Hemmung Prothrombin zu Thrombin↓ Bindung an ATIII → Faktor Xa-Hemmung Prothrombin zu Thrombin↓ Zur Prophylaxe: Subkutan Akute HIT II: Intravenös mit Perfusor Nur intravenös ✓ Evtl FVIIa ✓ - Nur intravenös ✓ - Subkutan Heparinoid (Glykosaminoglyka n-Mischung) Danaparoid ✓ Nebenwirkung Alle: Blutungsrisiko partiell Dalteparin Enoxaparin Certoparin Fondaparinux Argatroban Anti-FXaAkt ✓ Fraktioniertes/ Niedermolekula-res Heparin (NMH) Synthetisches Heparin Synthetisches LArginin-Derivat Wirkung Bindung an ATIII und Thrombin → Verstärkte Thrombinhemmung durch Heparin-AT Zusätzlich Faktor Xa-Hemmung → Prothrombin zu Thrombin↓ Wirkung i.v. sofort, s.c. nach bis zu 60min Zur Prophylaxe: Subkutan Therapie: Iv mit Perfusor! Desirudin Lepirudin Antidot ✓ (Protamin) Heparin (-natrium) Rekombinantes Hirudin Monitoring Allergische Reaktionen Heparin-induzierte Thrombozytopenie: HITII-Risiko NMH:UFH = 1:9 Osteoporose Verminderung der Thrombozytenzahl Selten Asthmaexazerbation Direkte Thrombinhemmung (Wirkung unabhängig von Antithrombin-III) Allergische Reaktionen, Fieber Heparin-induzierte Thrombozytopenie (HIT) Eine Heparintherapie kann insbesondere bei der Therapie mit unfraktioniertem Heparin eine Thrombozytopenie zur Folge haben. Dabei unterscheidet man den harmlosen Typ I (HIT I) vom prognostisch ungünstigeren Typ II (HIT II), der auf einer Antikörperbildung beruht. Bei Heparin-Therapie ist eine regelmäßige Kontrolle der Thrombozytenzahl im Blut indiziert, bei UFH bereits vor(!) Therapiebeginn! HIT I HIT II Beginn der In den ersten 5 Tagen nach Therapiebeginn Ab 5. Tag nach Therapiebeginn (5.-14. Tag)* Thrombopenie Ausmaß der Eher moderat: >100.000/µl Massiver Abfall: <100.000/µl (bzw. unter 50% des Ausgangswertes) Thrombopenie Pathophysiologie Direkte Interaktion, keine Antikörper! Auto-Antikörper gegen einen Komplex aus Heparin und dem Plättchenfaktor 4 Häufigkeit Ca. 10-20% 1-5% bei UFH; Unter 1% bei NMH Komplikationen In der Regel keine Thromboembolische Ereignisse Diagnostik Ausschlussdiagnose Heparin-induzierter Plättchenaggregationsassay (HIPAA) Konsequenzen Therapie weiterführen, Normalisierung der Thrombozyten zu Sofortige Therapieumstellung, ggf. Lyse erforderlich erwarten Bei einer HIT II muss die bisherige Heparintherapie sofort abgesetzt und bspw. mit Hilfe von rekombinantem Hirudin oder Argatroban eine adäquate Antikoagulation hergestellt werden! *Bei Patienten, die schon zuvor Heparin erhalten haben, kann die HIT II auch direkt nach erneuter Applikation (aufgrund von vorbestehenden Antikörpern) auftreten! Prophylaxe (low-dose): Bei Bettlägerigkeit, peri- und postoperativ, Immobilität anderer Art Unfraktioniertes Heparin: Subkutane Anwendung alle 8-12 h Niedermolekulares Heparin: Bei niedermolekularen Heparinen reicht in der Regel die Gabe einmal pro Tag (subkutan) aus Menge richtet sich nach Risiko, Nierenfunktion und Körpergewicht Therapie (high-dose): Vorhofflimmern, Thrombose, Lungenembolie, ACS, Mechanischer Klappenersatz, bei Hämodialyse, Herz-Lungen-Maschine Unfraktioniertes Heparin: Intravenöse Applikation erforderlich, Bolus mit anschließender kontinuierlicher Gabe über Perfusor Niedermolekulares Heparin: Subkutane Anwendung Menge richtet sich nach Körpergewicht; Anpassung bei eingeschränkter Nierenfunktion, ggf. kontraindiziert Vor- & Nachteile Applikation Pharmakokinetik unddynamik Antagonismus Monitoring Nebenwirkungen Bevorzugter Einsatz Unfraktioniertes Heparin (UFH) Bei therapeutischem Einsatz Perfusor notwendig Schnellerer Wirkungseintritt durch Wirkung auf Thrombin Protamin antagonisiert Effekt Beendigung bei therapeutischem Einsatz zügig möglich Bei therapeutischem Einsatz regelmäßige PTT-Bestimmung notwendig Zielwert: 1,5-2,5fache Verlängerung Im Vergleich zu NMH HIT II ca. 10x häufiger Häufiger schwere Blutungsereignisse Notfallsituation Heparinisierung bei fortgeschrittener Niereninsuffizienz Niedermolekulares Heparin (NMH) Subkutane Anwendung für jede Indikation Renale Elimination: Anwendungsbeschränkung bei Niereninsuffizienz Kein vollständiger Antagonist verfügbar Wirkung dauert nach Applikation für ca. 12 Stunden an Nur bei eingeschränkter Nierenfunktion (und deutlichem Über- oder Untergewicht) notwendig F. Xa-Bestimmung 4h nach Applikation Thromboseprophylaxe, ambulantes Setting Wird zur Hepariniserung generell dem UFH vorgezogen (weniger Nebenwirkungen, einfachere Handhabung), sofern keine Kontraindikationen bestehen Der Einsatz von niedermolekularen Heparinen ist in der Schwangerschaft möglich (Mittel der Wahl), weder plazenta- noch muttermilchgängig Bei schwerer Niereninsuffizienz: Akkumulation von NMH → Erhöhtes Blutungsrisiko → Dosisanpassung oder Umstellung auf UFH Thrombozytenaggregationshemmer Lange Zeit war ASS das einzige Medikament, das zur Prävention von arteriellen Embolien sowie bei akutem Koronarsyndrom, Stentimplantation und diagnostischen, intraarteriellen Eingriffen eingesetzt werden konnte. In letzter Zeit werden zunehmend Medikamente (Clopidogrel, Abciximab) mit guter Wirksamkeit für vergleichbare Indikationen zugelassen, wobei ASS weiterhin die Standardmedikation unter den Thrombozytenaggregationshemmern bleibt. Alle Thrombozytenaggregationshemmer erhöhen das Blutungsrisiko. Eine seltene, aber gefürchtete Komplikation von ASS bei Kindern ist das Auftreten des ReyeSyndroms. Wirkstoffgruppe Irreversible Cyclooxygenase-1Hemmer (ASS) Wirkstoffe Acetylsalicylsäure (ASS) ADP-RezeptorHemmer Clopidogrel Ticlopidin Prasugrel Ticagrelor GlykoproteinIIb/IIIaAntagonisten Abciximab Eptifibatid Tirofiban • • • • • • • • • • • Indikation Akutes Koronarsyndrom Perkutane transluminale Angioplastie (PTCA) Stentimplantation Sekundärprophylaxe zerebraler Ischämien und der KHK Unsichere Indikation: Primärprophylaxe der KHK Clopidogrel, Prasugrel; Ticagrelor Z.n. ischämischem Apoplex und Myokardinfarkt, pAVK, akutes Koronarsyndrom in Kombination mit ASS Stentimplantation ASS-Unverträglichkeit Ticlopidin: Sekundärprophylaxe nach Insult bei ASS-Unverträglichkeit • PTCA mit hohem Risiko • Instabile Angina pectoris • Akutes Koronarsyndrom ohne ST-Hebung (Tirofiban und Eptifibatid) Irreversible Hemmung der COX1 Hemmung der Thromboxan-Synthese in Thrombos → Thrombozytenaggregation + Konstriktion↓ Hemmung der Prostazyklin-Synthese im Endothel → Dilatation↓ Relatives Überwiegen der Thromboxan-Hemmung über der Prostazyklin-Hemmung Die Dosis von ASS ist in der Pfortader sehr hoch nach dem first-pass Effekt in der Leber ist die Konzentration im systemischen Kreislauf gering Sofortiger Wirkungseintritt Wirkdauer 7-11 Tage (Lebensdauer Thrombozyt) In höherer Dosis analgetisch, antipyretisch und antiphlogistisch Wirkung über Hemmung der ADP-abhängigen Thrombozytenaktivierung Wirkungseintritt mit Verzögerung Blutungen Ulzera ANV Allergie Reye-S. Über eine Blockierung der GP-IIb/IIIa-Rezeptoren auf der Oberfläche der Thrombozyten gelingt eine Hemmung der Aggregation. Blutungen Allergie Thrombozytopenie Bei akuten Blutungen oder massiv erhöhtem Blutungsrisiko ist die Gabe von Thrombozytenaggregationshemmern generell kontraindiziert! Blutungen Reye-Syndrom Beim Reye-Syndrom kommt es ASS-assoziiert zu einer akuten Enzephalopathie und Leberfunktionsstörung. In der Regel geht der ASS-Einnahme eine Virusinfektion (Varizellen, EBV, Influenza) voraus. Die Erkrankung endet in 50% der Fälle tödlich. Bei Ausheilung verbleiben bei einem Drittel der Patienten neurologische und kognitive Störungen. • Ätiologie: Unklar. Tritt im Kindesalter bei Virusinfektion und Einnahme von Acetylsalicylsäure auf. • Das pathologische Korrelat ist eine diffuse Schädigung der Mitochondrien. • Klinik: Gastrointestinal: Übelkeit, heftiges Erbrechen Neuropsychiatrisch: Bewusstseinsstörungen, Persönlichkeitsveränderungen im Rahmen einer hepatischen Enzephalopathie • Diagnostik: Fettleberhepatitis, AST/ALT↑, Ammoniak↑ • Therapie: symptomatisch Bei Kindern unter 15 Jahren darf wegen der Gefahr eines Reye-Syndroms im Rahmen eines fieberhaften Infekts kein ASS gegeben werden! Phenprocoumon und neue orale Antikoagulantien In der Prophylaxe und Therapie embolischer Ereignisse spielten Cumarine lange Zeit die alleinige Rolle. Nebenwirkungen wie vermehrte Blutungskomplikationen und Cumarin-induzierte Nekrosen sowie ein kompliziertes Gerinnungsmonitoring wurden aufgrund der Alternativlosigkeit der Cumarine in Kauf genommen. Seit einiger Zeit werden aber vermehrt Medikamente zugelassen, die selektiv über eine Thrombin- oder Faktor-Xa-Hemmung in die Gerinnungskaskade eingreifen und keiner regelmäßigen Kontrolle der Gerinnungsparameter bedürfen. Aufgrund der noch geringen klinischen Erfahrung sind bei den neuen Medikamenten sichere Aussagen zum Nebenwirkungsprofil vorerst auf mögliche Blutungskomplikationen beschränkt. Vitamin-KAntagonisten (Cumarine) Wirkstoffe Phenprocoumon Warfarin Wichtige Fakten Wirkung: Kompetitiver Antagonist von Vitamin K Unselektive Synthesehemmung der Vitamin-Kabhängigen Gerinnungsfaktoren II, VII, IX und X Folgen bzw. Kontrolle: Quick-Wert (Thromboplastinzeit/Prothrombinzeit)↓, INR-Wert↑ Schlechte Steuerbarkeit (Cumarinwirkung hält mehrere Tage an) → Bridging vor geplanter OP Indikationen • Phlebothrombose • Vorhofflimmern • Mechanische Herzklappen • erworbene Herzfehler Standard-Ziel-INR: 2,0-3,0 (bei mechanischen Herzklappen 2,5-3,5; bei besonderen Risikokonstella-tionen auch höher) CAVE: Blutung (Gabe von Vit K + FFP) Cumarin-Nekrose kutan/sc Direkte ThrombinInhibitoren Dabigatran Direkte Faktor-XaInhibitoren Apixaban Rivaroxaban Wirkung: Reversibler Thrombin-Antagonismus Indikation: Vor allem als Thromboembolie-prophylaxe bei Knie- oder Hüftgelenksersatz CAVE: Blutungskomplikationen Wirkung: Direkte Hemmung von Faktor Xa, Verlängerung der aPTT und Thrombinzeit Besonderheit: Orale Applikation bei guter Steuerbarkeit CAVE: Blutungskomplikationen Thromboembolieprophylaxe bei: • Knie- oder Hüftgelenkersatz • Nicht-valvulärem Vorhofflimmern • (und erhöhtem Schlaganfallrisiko) Thromboembolieprophylaxe bei: • Knie- oder Hüftgelenkersatz • Nicht-valvulärem Vorhofflimmern • (und erhöhtem Schlaganfallrisiko) Therapie und Sekundär-prophylaxe einer • Tiefen Beinvenenthrombose • Lungenembolie Kontraindikationen Gerinnungsstörungen hämorrhagische Diathesen Leber- +Nierenfunktionsstörungen Verdacht auf oder erhöhte Gefahr für Gefäßläsionen Schwere arterielle Hypertonie, Aneurysmen, Endokarditis Frische kardiovaskuläre Ereignisse Gastrointestinale Blutungen OP, interventionelle Eingriffe mit erhöhter Blutungsgefahr (PE) Sturzneigung Teratogene Wirkung: SS GFR < 30 ml/min GFR < 15 ml/min Koagulopathien im Rahmen einer hepatischen Grunderkrankung (nur Apixaban kontraindiziert) Interaktion Phenprocoumontherapie Die Phenprocoumonspiegel müssen in regelmäßigen Abständen kontrolliert werden, da es zahlreiche Interaktionen gibt, die großen Einfluss auf die Gerinnungsneigung haben. Wirkungsverstärkung Hemmung des metabolischen Abbaus (Cytochrom P-450): Allopurinol, Paracetamol Verdrängung aus der Plasma-Eiweiß-Bindung: Sulfonamide, Sulfonylharnstoffe, NSAR Schädigung der Darmflora (z.B. durch antibiotische Therapie): Geringere bakterielle Vitamin-K-Synthese Wirkungsabschwächung Induktion des metabolischen Abbaus (Cytochrom P-450): Rifampicin, Carbamazepin, Johanniskraut Direkter Antagonismus: Vitamin K (Grünes Gemüse, Fleisch) Aufnahmehemmung: Magensäurehemmung (PPI, Antazida), Colestyramin Vitamin-K-haltige Lebensmittel Therapieempfehlungen Bridging: Da die Cumarinwirkung mehrere Tage anhält, muss z.B. bei geplanten operativen Eingriffen eine Umstellung auf Heparin (bevorzugt niedermolekulare Heparine) vorgenommen werden. Die Cumaringabe wird unter engmaschigen Kontrollen des Quick-/INR-Wertes unterbrochen. Bei einem INR von <2,0 erhält der Patient (niedermolekulares) Heparin in therapeutischer Dosis Beim Wiedereinschleichen des Cumarins erfolgt dieser Vorgang in umgekehrter Reihenfolge: Bis zum Erreichen des gewünschten Quick-/INR-Wertes wird Heparin verabreicht Aussetzen der Heparine direkt vor der Operation Wiederansetzen der Heparine direkt postoperativ und Wiedereinstellung auf Phenprocoumon CAVE! Zunächst erhöhte Gerinnungsneigung! Bei der Einstellung auf Phenprocoumon muss zunächst weiter heparinisiert werden, da sowohl die Synthese gerinnungsfördernder Faktoren (Faktoren II, VII, IX und X) als auch gerinnungshemmender (Protein C und S) Vitamin-K-abhängig ist. Die gerinnungshemmenden Faktoren Protein S und C weisen dabei eine kürzere Halbwertszeit (6-10h) als die Gerinnungsfaktoren II, VII, IX und X (2-4 Tage) auf. Amiodaron Amiodaron wird als Klasse-III-Antiarrhythmikum im Rahmen von akuten ventrikulären Tachykardien sowie bei Kammerflimmern (kardiopulmonale Reanimation) nach frustraner Defibrillation eingesetzt. In der Dauertherapie ist es bei therapieresistenten ventrikulären und supraventrikulären Herzrhythmusstörungen indiziert und sowohl in der Dauer-, als auch in der Akuttherapie Mittel der ersten Wahl bei eingeschränkter kardialer Ejektionsfraktion. Die Wirkung von Amiodaron ist vorwiegend auf die Blockade spannungsabhängiger Kaliumkanäle zurückzuführen. Aufgrund des hohen Jodanteils von Amiodaron sind allergische Reaktionen wie auch Beeinflussungen des Schilddrüsenstoffwechsels möglich, bei bekannten Schilddrüsenerkrankungen ist eine Gabe somit kontraindiziert. Eine seltene, aber gefürchtete Nebenwirkung ist die Lungenfibrose. Akuttherapie i.v.: Wirkungsbeginn nach wenigen Minuten und Verteilung in Fettgewebe nach ca. vier Stunden Therapie der 1. Wahl bei akuten ventrikulären Tachykardien sowie bei Kammerflimmern nach erfolgloser Defibrillation Behandlungsbedürftige supraventrikuläre Tachykardien bei Patienten mit Herzinsuffizienz (linksventrikulärer Pumpfunktion < 30%) Dauertherapie oral; Wirkungseintritt nach ca. 4-10 Tagen, maximale Wirkung erst nach einem Monat Bei therapierefraktärem, stark beeinträchtigenden Vorhofflimmern zur Rhythmuskontrolle → Wiederherstellung bzw. Erhalt eines Sinusrhythmus Blockade von spannungsabhängigen K+-Kanälen Zudem Inhibierung von β-Rezeptoren sowie Na+- und K+-Kanälen lipophil => Einlagerung im Fettgewebe => lange Wirkdauer durch die verzögerte Freisetzung Wirkungseintritt Maximale Wirkung Orale Therapie nach 4-14 Tagen nach ca. 4 Wochen I.V.-Bolusgabe wenige Minuten nach 15 Minuten, danach Umverteilung Häufige und starke Nebenwirkungen bei langdauernder Anwendung Einlagerung in die Kornea → reversible Beeinträchtigung des Sehvermögens (in ca. 90% der Fälle) Photosensibilität der Haut Lungenfibrose: eher selten KI: Lungenerkrankungen Periphere Neuropathie Geringe negative Inotropie sowie intraventrikuläre Leitungsverzögerung Schilddrüsenfunktionsstörungen (Hyperthyreose oder Hypothyreose), da 37% Iod KI: Hypo-/Hyperthyreose, Jodallergie Vor Therapie mit Amiodaron Schilddrüsenfunktion testen, Ggf. Einsatz alternativer Substanzen: Dronedaron Glukokortikoide Glukokortikoide sind die Medikamente mit den meisten Indikationen in der Medizin. Durch ihre multiplen Eigenschaften, deren Pathophysiologie häufig noch unbekannt ist, werden sie sowohl in der Akuttherapie (z.B. Anaphylaxie) als auch in der Langzeittherapie chronischer Erkrankungen eingesetzt. Zahlreiche Nebenwirkungen schränken den Gebrauch von Glukokortikoiden im klinischen Alltag jedoch ein. Tagesbedarf bzw. Cushing-SchwellenDosis (Cushingschwelle)* Cortisol (Hydrocortison) Prednisolon oder Prednison Dexamethason oder Betamethason Cortison 6-Methyl-Prednisolon Budesonid (inhalativ, topisch) Fluticason (inhalativ, topisch) relative glukokortikoide Wirkung relative mineralkortikoide Wirkung 30mg (physiologische Tagessekretion) 7,5mg 1 4 1 0,8 1mg 30 - 0,8 5 >30.000 0,8 unklar >90.000 unklar Relative Kontraindikationen • • • • • • Gastroduodenales Ulkus Osteoporose Infektionserkrankungen Glaukom Schwangerschaft Thrombose-Neigung Systemische Glukokortikoide (Akuttherapie) • Allergische Reaktionen und anaphylaktischer Schock • Antiemetische Therapie (z.B. perioperativ oder im Rahmen von Zytostatika-Behandlungen) • Akuter Asthma-Anfall (Asthma bronchiale) • Toxisches Lungenödem • Akuter Schub einer autoimmunogenen Erkrankung (z.B. multiple Sklerose) • Hirnödem Selbst wenn in der Akuttherapie im Rahmen eines anaphylaktischen Schocks beispielsweise sehr hohe Dosierungen von Glukokortikoiden gegeben werden (z.B. Prednisolon 250mg im Schuss), sind in der Regel keine relevanten Nebenwirkungen zu erwarten! Lokal wirksame Glukokortikoide: Inhalative Glukokortikoide Intraartikuläre Injektion mit Kristallsuspensionen von Hydrocortison, Prednisolon oder Triamcinolon → z.B. bei Arthrose Bei Tendinitis: Fächerförmige Infiltration in Sehnennähe Eine intratendinöse Injektion ist unbedingt zu vermeiden → Gefahr der Sehnenruptur! Nebenwirkungen: Candidabefall der Mundschleimhaut → Mundsoor, Atrophie der Stimmbandmuskulatur → Heiserkeit Prophylaxe: Mundausspülung nach jedem Glukokortikoid-Sprühstoß Systemische Glukokortikoide (Langzeittherapie) • • • • • Chronische, entzündliche Erkrankungen (z.B. Morbus Crohn, Asthma bronchiale) Rheumatologische Erkrankungen (z.B. Sarkoidose, Sjögren-Syndrom) Endokrine Orbitopathie bei Morbus Basedow Substitutionstherapie: Nebennierenrindeninsuffizienz (Morbus Addison), Adrenogenitales Syndrom Schwangerschaft: Betamethason-Therapie zur fetalen Lungenreife-Induktion Haut Elektrolyte Knochenstoffwechsel und Bewegungsapparat Kohlenhydrat- und Fettstoffwechsel Sexualhormone Hämatologie Gastrointestinal ZNS und Psyche Auge Bei Kindern Atrophie der Haut, Striae distaense, Hauteinblutungen (Ekchymosen, Hämatome),Wundheilungsstörungen Mineralokortikoide Wirkung (Aldosteronwirkung): Verstärkte Natrium- und Wasserresorption → Hypertonie, Ödeme Verstärkte Kaliumausscheidung → Hypokaliämie Hypokalzämie Knochenatrophie : Osteoporose-Prophylaxe mit Vitamin D und Kalzium notwendig Myopathie und Muskelatrophie Knochennekrosen (z.B. Hüftkopfnekrose) Katabole Wirkung: Lipolyse: Abbau des Fettgewebes → Hyperlipidämie und Umverteilung → Stammfettsucht Proteinolyse mit Erhöhung des Blutzuckerspiegels (diabetogene Wirkung → Glukokortikoid-induzierter DM) Störungen der Sexualhormonsekretion und des –abbaus: ♀: Menstruationsstörungen, Hirsutismus ♂: Impotenz Immunsuppression! Hemmung der Zytokinbildung und -freisetzung Lymphozytopenie, Eosinopenie und Monozytopenie Erythrozyten↑, Thrombozyten↑ → Erhöhtes Thromboserisiko Granulozyten↑ → Dadurch insgesamt Leukozytose Glukokortikoide alleine erhöhen das Risiko für einen Ulkus in Magen oder Duodenum vermutlich nicht CAVE: Die Kombination aus Glukokortikoiden und NSAR erhöht das Ulkusrisiko mit der Gefahr für gastrointestinale Blutungen oder Perforation etwa um den Faktor 10-15! Euphorie oder Dysphorie Depressive Episoden Katarakt Glaukom Wachstumshemmung Gabe möglichst einmalig morgens vor 8 Uhr , Keine i.m. Applikation Statine Statine sind die relevantesten Lipidsenker und kommen supportiv zum Einsatz, wenn eine Lifestyle-Änderung (Diät, Bewegung usw.) in der Therapie der Hyperlipidämie nicht ausreichend ist. Über eine Hemmung der HMG-CoA-Reduktase realisieren sie eine verminderte Bildung von LDL-Cholesterin bei gleichzeitiger Erhöhung des HDL-Cholesterins. Neben unspezifischen Symptomen dominiert im Nebenwirkungsprofil eine mögliche Myopathie (CK erhöht), die bis zur Rhabdomyolyse mit folgendem akuten Nierenversagen (Crush-Niere) führen kann. Bei einer isolierten Myalgie ohne Erhöhung der Kreatininkinase kann die Medikation im Vergleich zur Myopathie fortgesetzt werden. Statin Simvastatin Pravastatin Lovastatin Atorvastatin HWZ (h) 2 2 3 14 CYP-450 CYP3A4 ∅ CYP3A4 CYP3A4 Bioverfügbarkeit ca. 5% unabh. von Nahrungsaufnahme ca. 20% erniedrigt durch Nahrungsaufnahme ca. 5% erhöht durch Nahrungsaufnahme ca. 10% erniedrigt durch Nahrungsaufnahme Abendliche Einnahme (v.a. bei Simvastatin) Körpereigene Cholesterinsynthese: abends am höchsten Bei Atorvastatin zeigen sich kaum Unterschiede Kombinationstherapie mit Colestyramin Kompetitive Hemmung der HMG-CoA-Reduktase HDL-Cholesterin↑ (um etwa 6-12%) LDL-Cholesterin↓↓ (um bis zu 21-63%) Triglyzeridkonzentration↓ (um etwa 10-29%) Pleiotrope Effekte: C-reaktives Protein↓, Plaquestabilität↑ Indikationen: • Hypercholesterinämie • Dominierende Hypercholesterinämie bei Hyperlipidämie • Nach Myokardinfarkt ist eine Statintherapie unabhängig vom Cholesterinwert indiziert Allgemeine Nebenwirkungen: Häufig Kopfschmerzen und gastrointestinale Beschwerden Leber: Transaminasenanstieg, Quick-Wert kann sinken Muskel: Myalgie=Muskelschmerzen, Bei bis zu 10% der behandelten Patienten Bleibt eine CK-Erhöhung aus, ist eine Fortsetzung der Therapie möglich Myopathie=Häufig Muskelschmerzen, Muskelschwäche Anstieg der muskelspezifischen CK (Kreatinkinase) auf mehr als das 10-fache der Normwerte möglichRhabdomyolyse: Seltene, schwerwiegende Nebenwirkung, die zu einer Myoglobinurie führen kann → akutes Nierenversagen Erhöhtes Risiko durch Kombination von Statinen mit Fibraten, Ciclosporin, Nikotinsäure und Erythromycin! Kontraindikation: Lebererkrankungen, Muskelerkrankungen, Schwangerschaft, Stillzeit Lipidsenker 2.Wahl In der Therapie der Hyperlipidämie nehmen Statine eine zentrale Position ein. Andere Pharmaka wie Fibrate, Cholestyramin oder Nikotinsäure sind nur Mittel der 2. Wahl, können aber bei inadäquater fettsenkender Wirkung von Statinen teilweise mit diesen kombiniert werden. Aufgrund des Einflusses auf die Elimination der Gallensäuren wird Cholestyramin ferner in der Therapie anderer Indikationen (bspw. chologene Diarrhoe, Cholestase) eingesetzt. Fibrate (Fibrinsäurederivate): Bezafibrat, Fenofibrat und Gemfibrozil • • • • • Aktivierung des PPARα-Rezeptors (LDL 10-20%↓, HDL 5-20%↑, Triglyceride 20-40%↓) Nebenwirkungen: Gastrointestinale Beschwerden, Myalgie, vermehrte Cholelithiasis Indikation: Mittel der 2. Wahl bei Hyperlipidämie Kontraindikation: Niereninsuffizienz und Leberinsuffizienz, Gallenblasenerkrankungen, Schwangerschaft Interaktionen: Wirkungsverstärkung anderer Pharmaka (z.B. Sulfonylharnstoffe, Hemmer der Blutgerinnung) Cholestyramin (Colestyramin) und Colestipol • Austauscherharz (Bindung der Gallensäure im Darm), Unterbrechung des enterohepatischen Kreislaufes • Indirekte Steigerung der Gallensäurebildung aus körpereigenem Cholesterin → Zunahme der LDL-Rezeptoren mit erhöhter LDL-Elimination • Indikation: Kombinationstherapie mit Statinen bei Hypercholesterinämie, Digitoxin-Überdosierung (→Digitalisintoxikation) Pruritus auf dem Boden erhöhter Gallensäurewerte (Cholestase), Chologene Diarrhoe Nikotinsäure • Inhibition der Freisetzung von Fettsäuren → Triglyceride und LDL↓, HDL↑ • Nebenwirkungen: Treten häufig auf! Aufgrund Prostaglandinsynthese: Flush , Brennen, Pruritus, Durchfall, Flatulenz, Bauchschmerzen Verstärkte Glukoseintoleranz, Hyperurikämie, Myopathie • Kontraindikationen: Leberinsuffizienz, Gicht, Blutung, Magenulkus, Kreislaufinstabilität • Indikation: Mittel d. Reserve bei Hypercholesterinämie + Hypertriglyceridämie, wenn Unverträglichkeit/unzureichende Wirksamkeit von Statinen Antihistaminika Antihistaminika lassen sich in zwei Generationen unterteilen. Während die erste Generation aufgrund ihrer Lipophilie und der daraus folgenden ZNS-Gängigkeit mit einer sedierenden Nebenwirkung belastet ist, sind Antihistaminika der zweiten Generation vergleichsweise nebenwirkungsarm. Das Einsatzgebiet der H1Antihistaminika ist vorwiegend die Therapie allergischer Reaktionen (z.B. allergische Rhinitis), wobei sie auch bei Kinetosen und als Schlafmittel gegeben werden. H2-Antihistaminika wurden früher häufig bei der Behandlung der Refluxerkrankung zur Senkung der Magensäureproduktion verwendet, im Laufe der Zeit jedoch vermehrt durch Protonenpumpeninhibitoren ersetzt. Gruppe H1Antihistaminika Generation 1. 2. H2-Antihistaminika • • • • • • • • • Antihistaminikum Dimetinden Diphenhydramin Meclozin Promethazin Clemastin Loratadin Cetirizin Azelastin Fexofenadin • Ranitidin • Cimetidin Indikation Antiemetikum Schlafmittel Anaphylaktischer Schock Antiallergikum, Juckreiz Charakteristika Ausgeprägt sedierend Anticholinerge Nebenwirkungen Antiallergikum, Juckreiz Anaphylaktischer Schock Kaum sedierend Evtl. antiadrenerg (Hypotension) und antiserotonerg (Appetitzunahme) Nur Mittel der 2.Wahl Senkung der Magensäureproduktion, zus. bei anaphy-laktischem Schock Wirkung Kompetitiver Antagonismus am Histamin-H1-Rezeptor: Hemmung einer allergischen Bronchokonstriktion Hemmung einer Erhöhung der Gefäßpermeabilität Kompetitiver Antagonismus am Histamin-H2-Rezeptor: Senkung der Salzsäureproduktion im Magen KI Prostatahyperplasie mit Restharn Winkelblockglaukom Pylorusstenose SS, SZ Protonenpumpenhemmer Protonenpumpeninhibitoren haben die magensäurereduzierenden H2-Antihistaminika wie Ranitidin weitestgehend abgelöst. Grund hierfür ist die effektive (vollständige und irreversible) Hemmung der H+/K+-ATPase in den Parietalzellen des Magens. Der gastrale pH-Anstieg wird u.a. zur Therapie der Refluxkrankheit, des Ulcus ventriculi und duodeni sowie in der Kombination mit Antibiotika bei der Helicobacter pylori-Eradikation eingesetzt. Die vorwiegend gastrointestinalen Nebenwirkungen nehmen im Verlauf der Therapie ab. Da es bei intravenöser Gabe selten zu irreversiblen Sehstörungen kommen kann, sollte die orale Gabe bevorzugt werden. Nebenwirkung Indikation • Gastrointestinale Nebenwirkungen (in bis zu 10%) • Ulcus ventriculi und duodeni • Zentralnervöse Nebenwirkungen: Schwindel, Kopfschmerzen • Refluxkrankheit • Selten Sehstörungen • Kombinationstherapie bei der Eradikation von Helicobacter pylori • Exantheme • Zollinger-Ellison-Syndrom • Reaktive Hypergastrinämie • Gastropathien durch nicht-steroidale Antirheumatika Bisphosphonate Bisphosphonate (z.B. Alendronat, Ibandronat, Zoledronat) werden unter anderem in der Therapie der postmenopausalen Osteoporose sowie bei tumorbedingten Osteolysen eingesetzt. Über eine Hemmung der osteoklastischen Aktivität drosseln sie den Abbau der ossären Substanz. In Folge einer Komplexbildung mit Kalzium können Bisphosphonate zu einer Hypokalzämie führen und über eine glomeruläre Schädigung ein akutes Nierenversagen bedingen. Bei Hypokalzämie und eingeschränkter GFR sind sie somit kontraindiziert; eine weitere relevante Nebenwirkung einer Bisphosphonat-Therapie ist die Kiefernekrose. Neuere Medikamente mit ähnlicher Indikation (humane monoklonale Antikörper, z.B. Denosumab) sind derzeit in Erprobung, haben jedoch laut momentaner Studienlage vorerst eine niedrigere Relevanz. Wirkung: Hemmung der Osteoklasten Antiresorptive Freisetzung aus dem Knochen Indikation: • Osteoporose • Tumorinduzierte Hyperkalzämie • tumorbedingte Osteolysen • Supportive Therapie beim multiplen Myelom • Morbus Paget Nebenwirkung: Komplexbildung mit Kalzium => Mineralisationsstörung → Osteomalazie Intravenös gegeben besteht die Gefahr des Nierenversagens Ösophagitis, selten Aseptische Knochennekrose des Kiefers: Vor allem bei hochdosierter intravenöser Gabe bei Tumorpatienten. Vor der Gabe sollte prophylaktisch eine Sanierung der Zähne erfolgen. Atypische Frakturen Kontraindikationen: Alendronat: GFR unter 35ml/min Schwere Hypokalzämie Erkrankungen des Ösophagus (vorwiegend Alendronat) Schwangerschaft/Stillzeit Bisphosphonate sollten mindestens 30 Minuten vor dem Essen (Verhindern der Komplexbildung mit Kalzium) mit reichlich Wasser in aufrechter Körperhaltung (Verhindern von Ösophagitis) eingenommen werden! Thyreostatika Thyreostatika können im Wesentlichen in Thionamide und Perchlorate unterschieden werden. Während Thionamide über eine Hemmung der Schilddrüsenperoxidase die Schilddrüsenhormonsynthese hemmen, inhibieren Perchlorate die Aufnahme von Jod in Thyreozyten. Haupteinsatzgebiet der Thyreostatika ist die Behandlung der Hyperthyreose und thyreotoxischer Krisen, Perchlorate hingegen werden auch in speziellen Situationen mit erhöhter Jodbelastung (z.B. i.v.-Kontrastmittelgabe) protektiv verabreicht. Beide Medikamentengruppen können über die reaktive Erhöhung des TSH-Werts eine diffuse Struma bedingen, wobei Perchlorate allgemein über eine hohe Nebenwirkungsrate verfügen (Gastritis, Allergien). Wirkstoffe Thionamide (schwefelhaltig) Thiamazol Carbimazol Propylthiouracil Perchlorate Lithium Jodid (in Kombination mit Thionamiden) Wirkmechanismus Hemmung der Schilddrüsenperoxidase → Inhibierung der Jodisation => Inhibierung der Schilddrüsenhormonsynthese T4 -> T3 wird durch Propylthiouracil zusätzlich gehemmt (Wirkungseintritt mit einer Latenz von 6-8 Tagen) Indikation: • Hyperthyreose • Thyreotoxische Krise • Vor Radiojod-Therapie und Thyreoidektomie Inhibierung der Jodaufnahme in die Thyreozyten Indikation: • Hyperthyreose • Protektiv vor Kontrastmittelgabe oder Szintigraphie Inhibierung der Freisetzung von Schilddrüsenhormonen → offlabel-Einsatz bei thyreotoxischer Krise Hemmung der proteolytischen Abspaltung von T3 und T4 von Thyreoglobulin → Freisetzung von T3 und T4↓ Nebenwirkung diffuse Struma (durch hohe TSH-Werte) Geschmacksstörungen Allergie/Überempfindlichkeit (Exanthem, Pruritus) => Umstellung auf Propylthiouracil Reversible Knochenmarksuppression (aplastische Anämie, Thrombozytopenie) und Agranulozytose Transaminasen-, Cholestaseparameteranstieg, cholestatischer Ikterus, akutes Leberversagen Viele und häufige Nebenwirkungen wie Gastritis, Allergien, Struma oder Lymphadenopathie Antiemetika Antiemetika ist der Überbegriff für eine heterogene Gruppe von Pharmaka. Je nach Ursache der Übelkeit und des Erbrechens kommen verschiedene Medikamente zum Einsatz. Während Serotonin-Antagonisten hochpotente Antiemetika in der Behandlung der Zytostatika assoziierten Nausea sind, werden beispielsweise spezielle Anticholinergika und Antihistaminika in der Behandlung von Kinetosen verwendet. In der Klinik wird häufig Metoclopramid (MCP), ein Dopamin-D2-Antagonist, eingesetzt, der jedoch aufgrund seiner zentralen Wirkung nicht bei Morbus Parkinson gegeben werden darf. Entscheidend ist also die passende Wahl des Antiemetikums zur Ursache der Emesis und Nausea (siehe Übersicht). Pharmaka Metoclopramid (Prokinetikum) Domperidon (Prokinetikum) Ondansetron, Granisetron (Serotonin-Antagonist) Scopolamin (Anticholinergikum) Meclozin, Dimenhydrinat, Diphenhydramin (Antihistaminikum) Dexamethason (Glukokortikoid) Wirkmechanismus Dopamin-Antagonist → Blockade des D2Rezeptors im Zentralnervensystem Dopamin-Antagonist → Blockade des D2Rezeptors, vorwiegend peripher Periphere und zentrale Hemmung von 5HT3-Rezeptoren Antagonismus am M-Cholinorezeptor Indikation und Charakteristika Nausea, Emesis und Motilitätsstörungen, auch durch Zytostatika; diabetische Gastroparese Nausea und Erbrechen Antagonismus am Histamin H1-Rezeptor Kinetosen Wirkmechanismus nicht bekannt PONV, auch bei Zytostatika-Nausea und -Emesis Gesicherte PONV-Risikofaktoren • Weibliches Geschlecht • PONV in der Anamnese • Kinetosen in der Anamnese • Nichtraucherstatus • Erwartete postoperative Opioidgabe • Ggf. weitere Risikofaktoren Niedriges PONVRisiko Mittleres PONVRisiko Hohes PONVRisiko Übelkeit und Erbrechen durch Zytostatika, auch bei PONV Kinetosen PONVRisikofaktoren 0-1 Narkoseform Medikamentöse Prophylaxe Nicht notwendig 2-3 Inhalationsnarkose unproblematisch TIVA bevorzugen 4-5 TIVA bevorzugen Dexamethason + weiteres Antiemetikum (z.B. Ondansetron) Dexamethason Opioide Der Begriff Opioide beschreibt eine Substanzgruppe aus natürlichen und synthetischen Pharmaka, die alle als Referenzsubstanz das Opiat Morphin gemein haben. Unterschieden werden die Opioide untereinander vor allem nach ihrer analgetischen Potenz (niedrig- und hoch-potente Opioide). Das Haupteinsatzgebiet der Opioide ist die Schmerztherapie, wobei andere Indikationen (z.B. als Antitussivum) bestehen. Von den zahlreichen Nebenwirkungen sind vor allem die von vielen Patienten beklagten Obstipationen sowie das Abhängigkeitspotential, das die langfristige Gabe einschränkt, zu beachten. Bei Missbrauch von Opioiden kann es zur gefürchteten Opioidintoxikation mit der Symptomtrias Atemdepression, Koma und Miosis kommen. Bei dieser lebensbedrohlichen Situation sollten eine intensivmedizinische Betreuung und eine Antagonisierung mit Naloxon oder Naltrexon erwogen werden. Gebräuchliche Opioid-Analgetika in der Schmerztherapie niedrig-potente Opioide (WHO Stufe II) • Tramadol • Tilidin • Dihydrocodein Reine Agonisten Gemischte Agonisten/Antagonisten hoch-potente Opioide (WHO Stufe III) • Morphin • Oxycodon • Levomethadon • Fentanyl • Piritramid • Pethidin • Buprenorphin (höchste Rezeptoraffinität) Buprenorphin hat eine höhere Rezeptoraffinität als Opioide mit einer höheren Potenz (z.B. Fentanyl), so dass bei gleichzeitiger Gabe die Wirkung des höherpotenten Opioids ausbleiben würde! Naloxon und Naltrexon können Buprenorphin nicht antagonisieren, da es die höchste Rezeptoraffinität hat! μ-Rezeptor κ-Rezeptor δ-Rezeptor • • • • • • • • • • • • • • Starke Analgesie Atemdepression Obstipation Miosis Bradykardie Starke Abhängigkeit Euphorie Analgesie Dysphorie Sedierung Analgesie Atemdepression Toleranz Abhängigkeit Nebenwirkungen in therapeutischer Dosierung: In der Therapie des chronischen Schmerzsyndroms ist nicht mit einer klinisch-relevanten Atemdepression zu rechnen! • Atemdepression → CO2↑ Hirndruckanstieg • Sedierung • Opioid-Toleranz-Entwicklung und Opioidabhängigkeit • Orthostatische Dysregulation: RR↓ • Miosis • Übelkeit und Erbrechen (emetisch, besonders Tramadol wegen Serotoninfreisetzung)) • Kontraktion der glatten Muskulatur: Obstipation, Harnverhalt, Konstriktion des Sphincter oddi • Juckreiz (Therapie: Naloxon oder H1-Antihist) Opioid-Intoxikation Symptomtrias: Bewusstlosigkeit Beidseitige Miosis ("Steckis") Atemdepression und Bradykardie: Cheyne-Stokes-Atmung möglich Ggf. hämorrhagisches Lungenödem blutig-tingierter Schaumpilz und Abrinnspuren => Therapie mit reinen Opioidrezeptor-Antagonisten: Naloxon i.v. (Alternativ: Naltrexon ) => Bei Krämpfen: Diazepam Opioid-Analgetika in der Anästhesie Opioid Wirkdauer Wichtige Fakten Fentanyl Analgetische Potenz 125-fach 20-30 min Alfentanil 30-40-fach < 10 min Sufentanil 1000-fach 30-45 min Remifentanil 100-200-fach 3-4min Leitsubstanz der Opioid-Analgetika in der Anästhesie Starke Lipophilie Rasche Anflutung ins ZNS Deutliche Kumulation bei kontinuierlicher Zufuhr Applikation: Auch als Fentanylpflaster in der Therapie chronischer Schmerzen einsetzbar Geringere Lipophilie als Fentanyl Trotz geringer Lipophilie rasche Anflutung, da Alfentanil besser die Zellmembran passieren kann Geringere Kumulationsgefahr → Gute Steuerbarkeit Höchste analgetische Potenz aller Opioide Ähnliche Lipophilie wie Fentanyl mit ähnlicher Pharmakodynamik Die Kumulation ist etwas geringer ausgeprägt Inaktivierung durch unspezifische Esterasen im Blut Sehr kurze Wirkdauer Keine Kumulation, kein Überhang nach der Narkose Keine Dosisanpassung bei Leber-/Niereninsuffizienz notwendig Indikation • Schwere Schmerzzustände Intravenös: Z.B. Piritramid und Pethidin bei Harnleiterkoliken Oral: Z.B. Fentanyl-Sublingualtablette bei Tumordurchbruchschmerzen Transdermales Pflaster: Z.B. Fentanyl bei chronischem Schmerzsyndrom Stabile Plasmakonzentration wegen Hautdepot Verzögerung der maximalen Analgesie (ca. 12 Stunden) Konstante Wirkstoffabgabe bis zu 72 Stunden • Antitussivum: Dihydrocodein aufgrund starkem antitussivem Effekt in bestimmten Hustensäften enthalten • Sedierung: Remifentanil, Fentanyl i.v. • Notfallmedizin Wirkt schmerzlindernd, beruhigend und angstlösend (Akutes Koronarsyndrom, Lungenödem) Sufentanil (ca.1000) >Fentanyl (ca.125) >Levomethadon (2-4) >Oxycodon (2) >Morphin (1) >Codein (0,2) >Tramadol (0,1-0,2) CYP2C CYP2C19 CYP2C9 CYP2D6 CYP3A4 Inhibition Substrate/kompetitiver Antagonismus Protonenpumpeninhibitoren (PPI) Weitere Substanzen, z.B.: Clopidogrel Indometacin Citalopram Verschiedene NSAID Phenprocoumon Weitere Substanzen, z.B.: Orale Antidiabetika (z.B. Rosiglitazon) Cotrimoxazol (Sulfamethoxazol) Einige Betablocker (z.B. Metoprolol) Einige Antipsychotika (z.B. Haloperidol) CAVE: Haloperidol auch über CYP1A2 und CYP3A4 Einige SSRI, SNRI und SSNRI, weitere Antidepressiva Antiarrhythmika (z.B. Flecainid) Zahlreiche weitere Substanzen Statine außer Pravastatin Steroidhormone Orale Kontrazeptiva Immunsuppressiva: Ciclosporin, Tacrolimus Makrolide (z.B. Clarithromycin) Carbamazepin Benzodiazepine HIV-Virostatika Kalziumantagonisten (außer Nifedipin-Typ) Zahlreiche weitere Medikamente Neuroleptika Phenprocoumon Induktion Weitere Inhibitoren Antimykotika (Azole, z.B. Itraconazol) Cimetidin Prednison Carbamazepin Rifampicin Amiodaron Antimykotika (Azole, z.B. Itraconazol) Rifampicin Carbamazepin Amiodaron Zahlreiche Antipsychotika und Antidepressiva Rifampicin Dexamethason Amiodaron Antimykotika (Azole, z.B. Itraconazol) Einige HIV-irostatika Carbamazepin Rifampicin Johanniskraut Glukokortikoide Barbiturate Einige HIV-Virostatika Eine CYP-Induktion führt zu einer beschleunigten Umsetzung der Substrate, eine CYP-Inhibition zu einer verlangsamten Intravenöse Narkotika Intravenöse Anästhetika sind Pharmaka, die bei der Einleitung einer Narkose zur Herstellung eines hypnotischen Zustandes verwendet werden. Die Anzahl der dafür gebräuchlichen Medikamente ist übersichtlich: Während Propofol das Standardmedikament der Narkoseeinleitung darstellt, kommt bei kardiovaskulären Risikosituationen vor allem Etomidat zum Einsatz. Ketamin wird aufgrund seiner sympathomimetischen und ausgeprägten analgetischen Komponente bevorzugt in der Notfallmedizin verwendet. Das Barbiturat Thiozl kann den Hirndruck senken und ist deshalb bei erhöhtem kraniellen Druck von Nutzen. Alle Pharmaka weisen zwar spezifische Nebenwirkungen und Charakteristika auf, haben aber eine stark hypnotische Wirkung gemein. Propofol (HZV) ↓ (AMV) ↓-↓↓ Besonderheiten Angenehmes Einschlafen und Erwachen Standard Einleitung Wirkung Hypnotisch Keine Analgesie Keine Muskelrelax Etomidat ∅ - (↓) ∅ - (↓) Narkoseeinleitung bei kardioRisikopatienten Hypnotisch Keine Analgesie Keine Muskelrelax Ketamin ↑ ∅ - (↓) Dissoziative Anästhesie Sympathomimetisch Bronchodilatation Blutdruck- und frequenzsteigernd Barbiturate (Thiopental Methohexital) ↓ ↓ Starkes Analgetikum Dissoziative Anästhesie Erhaltene Atmung + Reflexe NMDA-Antagonist Sympathomimetisch Kurz/Notfallnarkose Status asthmaticus Senkung des Hirndrucks Crush-Intubation, Status epilepticus Hypnotisch Keine Analgesie Keine Muskelrelax Nebenwirkung Propofol-Infusions-Syndrom Hypotonie Myoklonien Atemdepression Sexuelle Phantasien Histaminausschüttung Injektionsschmerz (Opioid-Vorinjektion) Atemdepression Senkung Kortisolsynthese Hirndrucksenkung Myoklonien Histaminausschüttung Injektionsschmerz RR + HF Anstieg Hypersalivation Hirndruckanstieg Halluzinationen Skelettmuskeltonus erhöhung Kardiovask. Depression Zunahme vegetativer Reflexe Bronchospasmus, Laryngospasmus Atemdepression Histaminausschüttung Gefäßreizung Immunsuppressiva Immunsuppressiva senken auf unterschiedliche Arten die Immunabwehr des Körpers. Zur Immunsuppression kommen verschiedene Substanzen zum Einsatz, die mit uneinheitlichen Wirkmechanismen Einfluss auf die zelluläre und humorale Immunantwort nehmen. Einsatzgebiet sind vorwiegend Organtransplantationen, Autoimmunerkrankungen sowie die zytostatische Therapie. Eine erhöhte Infektanfälligkeit ist allen Immunsuppressiva als Nebenwirkung gemein. Wirkmechanismus Ciclosporin A Tacrolimus Sirolimus (Rapamycin) Mycophenolat-Mofetil Glukokortikoide Zytostatika Azathioprin (6-Mercaptopurin ) Methotrexat Cyclophosphamid Biologicals Immunsuppression: Hemmung der Interleukin-2-Produktion → Aktivierung zytotoxischer T-Lymphozyten wird gemindert Cytochrom-P450-abhängige Metabolisierung Zytostatische Therapie: Bindung an Multidrug Resistance Glykoprotein P-170 NW: Nephrotoxisch, RR↑, Neurotoxisch, Fibröse Gingivahyperplasie Diabetogene Wirkung (insb. nach Organtransplantationen) → Strenge Indikationsstellung bei: Hyperurikämie, Hyperlipidämie, Leberenzymerhöhungen Zunahme von Malignomen und Infektionserkrankungen Bindung an FKBP 12 → Hemmung von Calcineurin → IL-2-Freisetzung↓ → Aktivierung der T-Lymphozyten↓ NW wie Ciclosporin A => keine Kombi! Bindung an FKBP 12 → Hemmung von mTOR-Kinase → IL-2-Freisetzung↓ → Aktivierung der T-Lymphozyten↓ Hemmung der Inosinmonophosphat-Dehydrogenase → selektive Proliferationshemmung von Lymphozyten Akute Wirkung (Minuten) → nicht gänzlich geklärt, membranstabilisierender Effekt wird angenommen Langfristige Wirkung (Stunden und Folgezeit) → Direkter Einfluss auf Genexpression Azathioprin ist ein Prodrug → hepatische Metabolisierung zu 6-Mercaptopurin → Einbau in die DNA als "falsches" Nukleosid Zytostatischer Effekt in höherer Dosierung durch Hemmung der Zellproliferation Immunsuppressiver Effekt in niedriger Dosierung mit deutlicher Hemmung der Proliferation von Lymphozyten NW: Myelosuppressiv, Verstärkung (Kumulation) durch Interaktion mit Allopurinol (25% Dosis) genetischer Polymorphismus: langsamerer Abbau => Überdosierung Pankreatitis, Hepatitis Folsäure-Antagonist (Antimetabolit) → Purinnukleotid- und dadurch DNA-Synthese↓ NW: Myelosuppression, Stomatitis, Enteritis, Infektanfälligkeit, Hepatotox, Nephrotox, Lungenfibrose Alkylanz: Alkylierung von DNA/RNA → Vernetzung und Strangbrüche → DNA-Synthese gestört Spezifische Bindung an relevante Strukturen in der Immunkaskade zelluläre Immunantwort↓ ✓ humorale Immunantwort↓ ✓ ✓ ✓ ✓ ✓ ✓ ✓ (✓) ✓ ✓ (✓) ✓ (✓) (✓) Biologicals Rekombinant hergestellte Proteine, die gezielt in immunologische Prozesse eingreifen Meist Antikörper (seltener Proteine mit Bindungsfunktion) Einsatz bei Autoimmunerkrankungen und Malignomen Zwar teilw. aufwendig und kostspielig, stellt aber in einigen Fällen eine deutliche Steigerung des Behandlungserfolges dar Antikörper Infliximab chimär Typ Adalimumab human Target TNF-α-Hemmung Etanercept Fusionsprotein Rituximab chimär CD-20 humanisiert humanisiert humanisiert Maus-AK chimär humanisiert CD-52 α 4-Integrin IgE CD3 von T-Lymphozyten α-Kette (CD25-Antigen) des IL-2-Rezeptors von T-Lymphozyten Alemtuzumab Natalizumab Omalizumab Muromonab-CD3 Basiliximab Daclizumab Anwendung Therapierefraktäre chronisch-entzündliche Systemerkrankungen Rheumatoide Arthritis M.Crohn, Colitis ulcerosa Spondylitis ankylosans Psoriasis-Arthritis CAVE: Nebenwirkungen und Kontraindikationen einer Anti-TNF-α-Therapie B-Zell-NHL symptomatischer Morbus Waldenström CLL Eskalationstherapie der Multiplen Sklerose Schweres Asthma bronchiale (Stufe V) Steroid-resistente akute Abstoßungsreaktion nach Transplantation Prophylaxe von Nierenabstoßung nach Transplantation (Kombination mit Ciclosporin und Glukokortikoiden) Allgemeine Nebenwirkungen: Grippeähnliche Beschwerden, Leukozytose oder Leukopenie, Thrombozytopenie, Anämie, Allergische Reaktionen GPT, GOT und AP↑ Spezielle Nebenwirkungen und Kontraindikationen einer Anti-TNF-α-Therapie (Infliximab, Adalimumab, Etanercept): Schwangerschaft, Immunsupprimierte Personen, Akute klinisch-manifeste Infektion, Chronische Infektionen (insb. Tuberkulose), Multiple Sklerose, Malignome Zum Ausschluss einer latenten Tuberkulose bzw. um die Aktivierung zu vermeiden, muss vor Einsatz ein Quantiferon-Test (früher Tuberkulintest) durchgeführt werden! Indikationen: Erkrankungen mit autoimmuner Komponente Rheumatoide Arthritis, Kollagenosen (Dermatomyositis/Polymyositis, systemischer Lupus erythematodes), Vaskulitiden (Morbus Wegener) Chronisch-entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa), Autoimmunhepatitis, Lungenfibrose, Sarkoidose Multiple Sklerose, Myasthenia gravis, Glomerulonephritis Zytostatische Therapie / Immunsuppression nach Organtransplantation Chloroquin und Hydroxychloroquin Chloroquin wirkt über einen nicht ganz aufgeklärten Wirkmechanismus blutschizontozid und antirheumatisch. Das Medikament kann zur Therapie und Prophylaxe der Malaria und bei rheumatischen Erkrankungen eingesetzt werden. Eine gefürchtete Nebenwirkung ist der irreversible Visusverlust, weshalb vor und regelmäßig während der Therapie Untersuchungen durch einen Augenarzt erfolgen sollten. Indikation Therapie und Prophylaxe der Malaria Einsatz bei milden Verläufen folgender rheumatischer Erkrankungen: Rheumatoide Arthritis (Basistherapie) Systemischer Lupus erythematodes (ohne Organbeteiligung) Porphyria cutanea tarda (in geringer Dosierung, Chloroquin bindet Porphyrine) Nebenwirkung Irreversible Retinopathie → Schießscheibenmakulopathie (Bulls eye) → Ophthalmologische Kontrollen vor und während der Therapie Reversible Hornhauttrübungen Gastrointestinale Nebenwirkungen Neurotoxisch Photosensibilität und Juckreiz Hämatologisch (z.B. Thrombozytopenie, Leukopenie) Akzidentelle Vergiftungen Eine Vielzahl von Pflanzen, Medikamenten, Haushalts- oder Industriechemikalien kann bei oraler oder inhalativer Aufnahme zur Vergiftung führen. Im Zweifel sollte der Erste-Hilfe-Leistende, aber auch der behandelnde Arzt die Giftzentrale anrufen, um Handlungs- und Therapieempfehlungen zu bekommen. Bei verschiedenen Intoxikationen ergibt sich klinisch ein typisches Bild, so dass im Zusammenhang mit der Anamnese auf die ursächliche Substanz geschlossen werden kann. Je nach Giftstoff kann daraufhin mit einem Antidot reagiert werden. Medikamente Anticholinergika , z.B. TZA Barbiturate Benzodiazepine Lithium Lokalanästhetika Opioide Digitalis Heparin Paracetamol Phenprocoumon Weitere Gifte Alkylphosphate (Parathion, E 605) Blausäure (Zyanide) Metalle Lampenöl Nikotin (Zigaretten /Zigarren) Tenside (Shampoo) Klinik Obstipation, Mundtrockenheit, Tremor, Tachykardie Bei höherer Dosis: Tonisch-klonische Krampfanfälle Zunehmende Bewusstlosigkeit bis zum Koma, Kardiotoxizität Bewusstseinsstörungen, Koma, Atemlähmung Holzer'sche Blasen: An Stellen mit Druckbelastung: Blasen mit Barbiturat-Inhalt Bewusstseinsstörung, Atemdepression, Hypotonie Antidote/Therapie Physostigmin, Aktivkohle Wirkprinzipien Hemmung der Cholinesterase erhöht Acetylcholinspiegel forcierte Diurese, Natriumhydrogen-carbonat, Alkalisierung des Urins führt zu vermehrter Ausscheidung Flumazenil Reversibler, kompetitiver Antagonist an der Benzodiazepin-Bindungsstelle des GABAA-Rezeptors Ataxie, Krämpfe, Dysarthrie Forcierte Diurese Hämodialyse Lipidinfusion Adrenalin Diazepam Naloxon Digitalis-Antitoxin Protamin N-Acetylcystein Übelkeit, Schwindel, Metallischer Geschmack Benommenheit, Verwirrung, Koma Krämpfe, Herzrhythmusstörungen Miosis, Atemdepression, Koma, Hypothermie, Hypotonie Leberzellnekrosen Aspiration: Husten + Erbrechen, schwere Pneumonie, ZNS-S. Erbrechen, Blässe, Tachykardie, Schwitzen Hohe Mengen: Kreislaufdepression, Atemlähmung Erbrechen durch Schaumbildung Vitamin K ->Aufnahme durch Fette ->bei malignen HrSt ->bei ZNS-Störungen HWZ nur 30 min! Antikörperfragmente, die Digitalisglykoside binden Komplexbildung mit Heparin stellt notwendige SH-Gruppen zur Entgiftung von Paracetamol-Metaboliten zur Verfügung kompetitiver Antagonist Atropin, Obidoxim Abschwächung des parasympathomimetischen Effekts Methämoglobinbildner Chelatbildner Das Eisen des Methämoglobins bindet Zyanide Inaktivierung durch Chelatbildung >1 Zigarette: Aktivkohle bis 60min nach Ingestion unbedenklich Pharmakotherapie in der Schwangerschaft Im Medikamentendschungel gibt es nur wenige Medikamente, die auch in der Schwangerschaft verabreicht werden dürfen. Die Informationen hierzu sind zumeist empirischer Art und auf Einzelfälle zurückzuführen, da bei Schwangeren generell keine randomisierten Studien erlaubt sind. Substanzklasse Antihypertensiva Antikoagulantien Zu bevorzugende Substanzen - Mittel der 1.Wahl α-Methyldopa Betablocker (vor allem Metoprolol): Im 1. und 2. Trimenon => CAVE: Zu vermeiden im 3. Trimenon Dihydralazin: Bei hypertensiver Entgleisung Heparin Acetylsalicylsäure (ASS) in niedriger Dosierung => CAVE: ASS in höherer Dosierung (z.B. als Analgetikum oder Antiphlogistikum) ist vor allem im 3. CAVE: Zu vermeidende bzw. kontraindizierte Substanzen Diuretika Kalziumantagonisten ACE-Hemmer Phenprocoumon Neuere orale Antikoagulantien Trimenon zu vermeiden Analgetika Antiemetika Antidiabetika Thyreostatika Nicht-Opioidanalgetika: Paracetamol, NSAR: Nur im 1. Trimenon Opioidanalgetika: Fentanyl, Codein Antihistaminika (H1-Blocker): Meclozin, Doxylamin, Dimenhydrinat: Nur im 1. (und 2.) Trimenon => CAVE: Zu vermeiden im 3. Trimenon Metoclopramid: Insb. im 2. Trimenon Ondansetron, Promethazin: Nur bei Therapierefraktärität Insulin Propylthiouracil: Insb. im 1. Trimenon => CAVE: Eine fetale/neonatale Hypothyreose oder Struma unter Propylthiouracil in der Schwangerschaft NSAR im 2. und 3. Trimenon Metamizol Alle oralen Antidiabetika Carbimazol, Thiamazol ist möglich! Ein postpartales Monitoring der Schilddrüsenparameter wird empfohlen! Weitere Substanzen L-Thyroxin Ursodeoxycholsäure (UDCA) Antibiotika in der Schwangerschaft/Stillzeit und bei Kindern: Bisher keine Schädigungen in Studien nachgewiesen Penicilline: Ampicillin, Amoxicillin, Flucloxacillin, Penicillin V, Propicillin Cephalosporine Makrolide: Erythromycin Strenge Indikationsstellung Co-trimoxazol: Mögliche Teratogenität Fosfomycin Colestyramin Triptane Wirkstoffe: Sumatriptan, Almotriptan etc.; orale, nasale, rektale und subkutane Applikation möglich Wirkung: Agonist des 5-HT₁ -Rezeptors Im Bereich der Duraarterien wird die perivaskuläre aseptische Entzündung gehemmt (zentraler Effekt), zudem Vasokonstriktion Wiederkehrkopfschmerz (headache recurrence): Wiederauftreten nach primär wirksamer Therapie; erneute Gabe ist dann möglich Nebenwirkungen: Passagerer Blutdruckanstieg (häufig), koronare Ischämien (selten) Parästhesien und Kältegefühl der Extremitäten Schwindel, Müdigkeit, Flush Kopfschmerzen bei zu häufiger Anwendung (max. 10x/Monat) Kontraindikationen: Koronare Herzkrankheit pAVK Hypertonie Schwangerschaft und Stillzeit (muttermilchgängig → mindestens 12 Stunden Stillpause nach Einnahme) Inhalationsnarkotika Blut/GasVerteilungsko effizient Desfluran 0,45 Lachgas N2O (Stickoxydul) 0,47 Sevofluran 0,65 Isofluran 1,40 Charakteristika Geringste Metabolisierung, gut steuerbar Sympathikus-Stimulation Stechender Geruch mit Irritation der Atemwege Gute Analgesie bei geringer hypnotischer Wirkung, keine Muskelrelaxation Notwendigkeit eines ergänzenden Anästhetikums Milder Geruch und keine Atemwegsirritation Maskeneinleitung möglich (z.B. bei der Kinderanästhesie) Unangenehmer Geruch Relevante Vasodilatation Muskelrelaxierende Wirkung und gering negativ inotrop NW (emetogen, Exzitation, shivering, Vasodilatation) Sympathoadrenerge Reaktion → Blutdruckanstieg und Tachykardie Diffusionshypoxie (100% Sauerstoff bei Ausleitung) Interaktion mit Atemkalk → Bei zu niedriger Frischgaszufuhr entstehen nephrotoxische Abbauprodukte (Compound A – E) Senkung der Herzfrequenz → Blutdruckabfall in Abhängigkeit von der Dosierung Flurane N2O Hypnotisch Analgetisch Muskelrelaxierend Metabolisierung Kumulation Postoperative Analgesie +++ + + - (+) + ∅ - Intravenöse Anästhetika +++ + + + ++ + Steuerbarkeit ++ ++ + Erstrangmedikamente Tuberkulose Bis auf Ethambutol (bakteriostatisch) wirken alle Tuberkulostatika bakterizid. Wirkstoff Isoniazid Abk. INH Anwendung 6 Monate Rifampicin RMP 6 Monate Pyrazinamid PZA 2 Monate Ethambutol Streptomycin EMB SM 2 Monate Wichtige Nebenwirkungen • Hepatotoxizität • Akne • Neurotoxizität: Periphere Polyneuropathie Reduktion der Nebenwirkungen: Gabe von Vitamin B6 • Hepatotoxizität • CYP-Induktionen (v.a. CYP3A4, CYP2C9) • Rotfärbung des Urins • Hepatotoxizität • Hyperurikämie • Arthralgien • Myopathie • Optikusneuritis • Nephrotoxizität • Ototoxizität Intoxikationen Giftstoffe Stoff α-Amanitin (Knollenblätterpilzvergiftung) Phalloidin und Amanitin Fliegenpilzvergiftung (Pantherina-Syndrom) Schwarze Tollkirsche Atropa belladonna Phosphorsäureester (Alkylphosphate) wie Parathion (E 605) Blausäure, Zyanide (HCN, KCN, CN‑ ) Eisenvergiftung Wirkung Blockade der RNA-Polymerase → Hemmung von Transkription und Proteinbiosynthese Irreversible Bindung an F-Aktin → Hemmung Transportvorgänge Ibotensäure → Umwandlung in den Wirkstoff Muscimol Atropin → Verdrängung von ACh Folge: Kompetetive Hemmung der muskarinergen und nikotinischen Acetylcholinrezeptoren Irreversible Hemmung der AChE mit konsekutiver Erhöhung der Acetylcholinkonzentration und Wirkung an muskarinergen und nikotinischen Acetylcholinrez. Folge: Lebensbedrohliche Parasympathikusaktivierung Blockierung der Atmungskette durch Bindung an das dreiwertige Eisen der Zytochromoxidase Hemmung der Zellatmung Inneres Ersticken Eher selten, betroffen sind meist Kleinkinder (Ingestion von Eisentabletten) Klinik Nach ca. 12 Std. gastrointestinale Symptome (Diarrhoe, Erbrechen, Koliken) Später toxisches Nieren- und Leberversagen (nach ca. 3-10 Tagen) Toxische Dosis: 0,1mg/kg KG Erbrechen und Durchfall Anticholinerge Symptomatik (Mydriasis, trockene Schleimhäute, Tachykardie) Rauschzustand mit Halluzinationen Anticholinerges Syndrom (Leitsymptome: Trockene, gerötete Haut mit Fieber, Mydriasis, Tachykardie und Delir) Cholinerges Syndrom: Bradykardie, Miosis, GI-Symptome ZNS-Symptomatik Muskelzuckungen, die in Lähmungen übergehen → Periphere neuromuskuläre Atemlähmung!!! Knoblauch- oder lauchartiger Atemgeruch Blaue Farbe: Speichel, Schleimhäute 15-60 Minuten nach oraler Aufnahme Wenige Sekunden nach Inhalation Atemnot, Schwindel, Erbrechen, Kopfschmerzen Hellrote Schleimhautblutungen Nekrosen im Mund- und Ösophagusbereich Alkalisch reagierender Mageninhalt Krämpfe, Erregungsstörungen am Herzen, Atemlähmung, Tod Bittermandelgeruch der Ausatemluft Hellrote Totenflecken bei der Leichenschau Zunächst hämorrhag. Gastroenteritis, Schock Nach ca. 6h beschwerdearmes Intervall Im Verlauf: Gefahr des toxischen Leber- und Nierenversagens, Bewußtlosigkeit, Atemdepression Therapie Erbrechen auslösen/Magenspülung Aktivkohle Antidot: Silibinin Mittel der Wahl zur reversiblen Hemmung der Acetylcholinesterase (Antidot): ZNS-gängiges, indirektes Parasympathomimetikum (Physiostigmin) Physostigmin = Mittel der Wahl zur reversiblen Hemmung der AChE (Antidot) ZNS-gängiges, indirektes Parasympathomimetikum (Physiostigmin) Atropin Oxime (Obidoxim) Gabe von 100%igem Sauerstoff Methämoglobinbildner 4-Dimethylaminophenol i.v. (4-DMAP) Alternativ: Nitrit Im Anschluss: Natriumthiosulfat i.v. (Na2S2O3) =>Blausäure->Rhodanid Hydroxocobalamin: entgiftend Deferoxamin (Chelatbildner) Wirkstoffe Wirkung NW Vitamin-KAntagonisten (Cumarine) Phenprocoumon Warfarin Erhöhung des Blutungs-risikos Bei schweren Blutungen: Absetzen + Vit K + FFP Direkte ThrombinInhibitoren Dabigatran Direkte FaktorXa-Inhibitoren Apixaban Rivaroxaban Kompetitiver Antagonist von Vitamin K Unselektive Synthesehemmung der Vitamin-K-abhängigen Gerinnungsfaktoren II, VII, IX und X Folgen bzw. Kontrolle: QuickWert (Thromboplastinzeit/Prothro mbinzeit)↓, INR-Wert↑ Regelmäßige Kontrolle des INR-Werts bei vielen Interaktionen notwendig Reversibler ThrombinAntagonismus • Keine regelmäßige • Kontrolle der • Gerinnungsparameter • notwendig Selektive, direkte Faktor-XaInhibitoren • Keine regelmäßige • Kontrolle der • Gerinnungsparameter • notwendig, • trotz Verlängerung der • aPTT und • Thrombinzeit Blutungskomplikationen KI Indikationen • Generelle Gerinnungsstörungen Alle hämorrhagischen Diathesen Leber- und Nierenfunktionsstörungen • Verdacht auf oder erhöhte • Gefahr für Gefäßläsionen Schwere arterielle Hypertonie, Aneurysmen Endokarditis Frische kardiovaskuläre Ereignisse (z.B. ischämischer Insult) Gastrointestinale Blutungen Operative Eingriffe, interventionelle Eingriffe mit erhöhter Blutungsgefahr (PEs) Sturzneigung • Teratogene Wirkung: Schwangerschaft GFR < 30 ml/min • Phlebothrombose • Vorhofflimmern • Mechanische Herzklappen • und bestimmte erworbene • Herzfehler Standard-Ziel-INR: 2,0-3,0 (bei mechanischen Herzklappen tlw. 2,5-3,5; bei besonderen Risikokonstellationen auch höher) • • • • • Thromboembolieprophylaxe bei: Knie- oder Hüftgelenkersatz Nicht-valvulärem Vorhofflimmern (und erhöhtem Schlaganfallrisiko) • Therapie + Sekundärprophylaxe • einer TVT Lungenembolie GFR < 15 ml/min Koagulopathien im Rahmen einer hepatischen Grunderkrankung (nur Apixaban kontraindiziert) Thromboembolieprophylaxe bei: • Knie- oder Hüftgelenkersatz Nicht-valvulärem Vorhofflimmern (und erhöhtem Schlaganfallrisiko)