on mit dem Hepatitis-C-Virus (HCV) Genotypen
Werbung

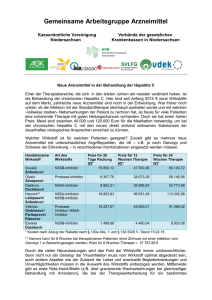
Presseinformation Presserechtlicher Hinweis Die folgenden Informationen sind ausschliesslich für Medienschaffende bestimmt. Die Firma Bristol-Myers Squibb SA weist an dieser Stelle ausdrücklich auf die werberechtlichen Bestimmungen der Heilmittelgesetzgebung hin (Art. 31 und 32 des Bundesgesetzes über Arzneimittel und Medizinprodukte [HMG; SR 812.21] sowie die Verordnung über Arzneimittelwerbung [AWV; SR 812.212.5]), insbesondere über das Verbot der Publikumswerbung für verschreibungspflichtige Arzneimittel. Daklinza® (Daclatasvir) zur Behandlung der chronischen Infektion mit dem Hepatitis-C-Virus (HCV) Genotypen 1, 3 und 4 zugelassen und bei Genotyp 3 und 4 rückerstattet • Daklinza® ist in Kombination mit Sofosbuvir ein ausschließlich orales, einmal tägliches Therapieregime und ermöglicht Hepatitis C Heilungsraten von bis zu 100 Prozent 1 • Mit der Zulassung von Daklinza® erhält die Schweiz nun die erste Interferon- und Ribavirin-freie Therapie für HCV Genotyp 3 Patienten Steinhausen, 3. August 2015 – Bristol-Myers Squibb SA gibt bekannt, dass die Swissmedic Daklinza® (Daclatasvir), einen hochwirksamen NS5A-Replikationskomplex-Inhibitor, zur Anwendung in Kombination mit anderen Arzneimitteln zur Behandlung der chronischen Infektion mit dem Hepatitis-C-Virus (HCV) vom Genotyp 1, 3 oder 4 bei Erwachsenen zugelassen hat. 2,3 Daklinza® (Daclatasvir) ist in Kombination mit Sofosbuvir ein ausschließlich orales, Interferon-freies Therapieregime, das in klinischen Studien Hepatitis-C Heilungsraten von bis zu 100 Prozent erreicht hat; dies gilt auch für Patienten mit fortgeschrittener Leberfibrose 1 und nach PI-Versagen*. Dieses Therapieregimen ist in der Schweiz die erste von der Swissmedic zugelassene Interferon- und Ribavirin-freie Therapie bei Patienten mit HCV Genotyp 3. Die SVR12 Raten bei Patienten mit HCV Genotyp 3 Infektion lagen bei therapienaiven bei 90 Prozent und bei vor4 behandelten bei 86 Prozent. . Daklinza® (Daclatasvir) in Kombination mit Sofosbuvir bietet mit 12 Wochen eine deutlich kürzere Interferon und Ribavirin-freie Therapiemöglichkeit für Patienten mit HCV GT3 Infektion.4 Bristol-Myers Squibb SA Public Affairs [email protected] 1 Seit 1. August wird Daklinza® (Daclatasvir) in Kombination mit anderen Medikamenten für Patienten mit HCV GT 3 und GT 4 auch von den Krankenkassen rückerstattet. „Mit der heutigen Zulassung wird Daklinza® in Kombination mit anderen Wirkstoffen eine wichtige Option bei der Behandlung von Hepatitis C sein und in der Schweiz vor allem eine besondere Rolle bei der Heilung der HCV-Genotyp 3 Infektion spielen. Die Prävalenz von Hepatitis-C des Genotyps 3 beträgt in der Schweiz 29%. 5 Diese Patienten waren bis zur heutigen Zulassung immer noch dringend auf neue Behandlungsmöglichkeiten angewiesen“ sagt Michelle Lock, Vice President und General Manager Bristol-Myers Squibb Schweiz und Österreich. Circa 54.3 Millionen Menschen weltweit sind von Hepatitis C mit Genotyp 3 betroffen und es ist dadurch die zweit-häufigste Form von Hepatitis C nach Genotyp 1 mit 83.4 Millionen. In der Schweiz sind etwa 29 Prozent der Hepatitis C Patienten mit Genotyp 3 infiziert.5 Der Genotyp 3 von HCV gilt heute als einer der am schwierigsten zu behandelnden HCVGenotypen. Seine aggressivere Natur zeigt sich in der Art, wie er die Leber schädigt. So ist er mit einer fortschreitenden Lebererkrankung, erhöhten Raten von Leberverfettung und einem erhöhten Risiko für ein Leberzellkarzinom assoziiert. 6, 7, 8, 9 Über die Studien Die Zulassung von Daclatasvir stützt sich auf die Ergebnisse verschiedener klinischer Studien. Ally 3 Diese Open-Label-Phase-III-Studie schloss 152 HCV-Patienten mit Genotyp 3 ein. 101 therapienaive und 51 vorbehandelte Patienten erhielten in zwei Kohorten jeweils 60 mg Daclatasvir und 400 mg Sofosbuvir einmal täglich über einen Zeitraum von 12 Wochen und wurden im Anschuss über 24 Wochen nachbeobachtet. Primärer Endpunkt waren die SVR12Raten, definiert als HCV-RNA-Wert unter der Nachweisgrenze 12 Wochen nach Ende der Behandlung, bei therapienaiven und vorbehandelten Patienten. Wie oben beschrieben lagen die SVR12 Raten bei Patienten mit HCV Genotyp 3 Infektion bei therapienaiven bei 90 Prozent und bei vorbehandelten bei 86 Prozent. Die SVR12 Raten bei HCV GT 3 Patienten ohne Zirrhose waren höher (96%), unabhängig von der Behandlungshistorie. Bei Patienten mit Zirrhose waren die SVR12 Raten geringer (63%). Allgemein wurde das Therapieregime aus Daclatasvir und Sofosbuvir gut vertragen. Todesfälle, therapiebedingte schwerwiegende unerwünschte Ereignisse oder Therapieabbrüche aufgrund unerwünschter Ereignisse traten nicht auf.4 Die häufigsten Nebenwirkungen (≥ 5 Prozent) waren Kopfschmerzen (19 Prozent), Erschöpfung (19.1 Prozent), Übelkeit (11,8 Bristol-Myers Squibb SA, Public Affairs [email protected] 2 Prozent), Diarrhö (8,6 Prozent), Schlafstörungen (5,9 Prozent), sowie Abdominal- und Gelenkschmerzen (beide 5,3 Prozent). Darüber hinaus kam es bei 17 Patienten (11,2 Prozent) zu einem Therapieversagen. Dabei handelte es sich bei 16 Patienten um einen Rückfall nach Therapieende (Relapse) und bei einem Patienten um einen Rebound am Ende der Behandlung. Virologische Durchbrüche traten unter diesem Ribavirin-freien Therapieregime nicht auf. AI444-040 Diese randomisierte Open-Label-Studie zu Daclatasvir in Kombination mit Sofosbuvir mit oder ohne Ribavirin bei Patienten mit Genotyp 1, 2 und 3 schloss auch Patienten mit Genotyp 1 Infektion ein, die nicht auf eine Therapie mit Telaprevir oder Boceprevir angesprochen hatten, sowie Patienten mit fortgeschrittener Leberfibrose.3 Ein anhaltendes virologisches Ansprechen (Sustained Virologic Response, SVR) nach 12 Wochen, das praktisch einer Heilung der Hepatitis C Infektion entspricht, erreichten unter der Kombinationstherapie von Daclatasvir mit Sofosbuvir:3 • 99 Prozent (125/126) der nicht vorbehandelten Patienten mit Genotyp 1 • 100 Prozent (41/41) der Genotyp 1 Patienten nach PI-Versagen* • 89 Prozent (16/18) der Patienten mit Genotyp 3 Darüber hinaus führte das Therapieregime zu niedrigen Abbruchraten (<1 %) aufgrund unerwünschter Ereignisse (Adverse Events, AEs). Auch die Rate der schwerwiegenden unerwünschten Ereignisse (Serious Adverse Events, SAEs) war niedrig (7.1 %). Die am häu1 figsten berichteten Nebenwirkungen waren Ermüdung, Kopfschmerz und Übelkeit. Daclatasvir war im Allgemeinen in allen untersuchten Therapieregimes sehr gut verträglich mit geringen Abbruchraten bei allen Patiententypen.1, 4 In laufenden und abgeschlossenen Studien wurde Daclatasvir bei mehr als 5.500 Patienten in einer Vielzahl ausschließlich oraler Therapieregimes – und zusätzlich mit dem derzeitigen Interferon-basierten Therapiestandard – untersucht. Die Verträglichkeit von Daclatasvir in der Behandlung der Hepatitis-C-Infektion konnte in unterschiedlichen Regimes mit verschiedenen Patientenpopulationen gezeigt werden. Dazu zählen auch ältere Patienten, Patienten mit fortgeschrittener Leberfibrose (AI444-040)4 und Zirrhose (ALLY-3)1. Die Monotherapie mit Daclatasvir wird nicht empfohlen. Die Fachinformation von Daclatasvir ist online abrufbar auf der Internetseite der Swissmedic (http://www.swissmedicinfo.ch). Bristol-Myers Squibb SA, Public Affairs [email protected] 3 Über Hepatitis C Weltweit sind etwa 170 Millionen Menschen mit HCV infiziert, geschätzte 9 Millionen von ihnen leben in der Europäischen Union (EU) 10 und etwa 88‘000 in der Schweiz 11. Das Hepatitis-C-Virus infiziert die Leber und wird durch direkten Kontakt mit kontaminiertem Blut oder kontaminierten Blutprodukten übertragen.Error! Bookmark not defined. Bei bis zu 90 Prozent der mit dem Hepatitis-C-Virus infizierten Personen kommt es nicht zu einer spontanen Ausheilung des Virus und die Infektion nimmt einen chronischen Verlauf.12 Laut Berichten der WHO (World Health Organization) entwickelt sich bei bis zu 20 Prozent der chronisch an Hepatitis C Erkrankten eine Leberzirrhose. Fünf bis sieben Prozent der Patienten können an den Folgen der Erkrankung versterben. 13 Das HCV-Portfolio von Bristol-Myers Squibb Bristol-Myers Squibb fokussiert seine Forschungsaktivitäten auf Substanzen in fortgeschrittenen Phasen klinischer Prüfungen, um Patienten mit Hepatitis-C-Infektion den größtmöglichen Nutzen zu bieten. Im Mittelpunkt steht Daclatasvir, ein hochwirksamer NS5AReplikationskomplex-Inhibitor. Daclatasvir wurde in Japan in der Kombination mit Asunaprevir (Sunvepra), einem NS3/4A Proteaseinhibitor, zugelassen. Das duale Therapieregime aus Daclatasvir und Asunaprevir ist in Japan das erste ausschließlich orale, Interferon- und Ribavirin-freie Therapieregime für die Behandlung von Patienten mit einer chronischen Hepatitis-C-Infektion vom Genotyp 1. Dies schließt auch Patienten mit kompensierter Zirrhose ein. Daclatasvir wurde im August 2014 in der Europäischen Union zur Anwendung in Kombination mit anderen Arzneimitteln zur Behandlung der chronischen Infektion mit dem Hepatitis-CVirus bei Erwachsenen zugelassen. 14 Darüberhinaus, ist Daclatasvir in Ländern Südamerika`s, des mittleren Osten und Asien zugelassen. Daclatasvir in Kombination mit Sofosbuvir wurde erst kürzlich auch von der FDA zur Behandlung der chronischen Hepatitis C bei Genotyp 3 zugelassen. Über Bristol-Myers Squibb Bristol-Myers Squibb ist ein weltweit tätiges BioPharma-Unternehmen, das sich die Erforschung, Entwicklung und die Bereitstellung innovativer Medikamente zur Aufgabe gemacht hat, die Patienten im Kampf gegen schwere Erkrankungen helfen. Weitere Informationen unter www.bms.ch. Bristol-Myers Squibb SA, Public Affairs [email protected] 4 Zukunftsgerichtete Aussagen von Bristol-Myers Squibb Diese Pressemitteilung enthält sogenannte „zukunftsgerichtete Aussagen“ entsprechend der Definition im „Private Securities Litigation Reform Act“ von 1995 zur Erforschung, Entwicklung und Vermarktung von pharmazeutischen Produkten. Derartige zukunftsgerichtete Aussagen beruhen auf den gegenwärtigen Erwartungen und beinhalten inhärente Risiken und Ungewissheiten, darunter auch Faktoren, die alle diese Prognosen verzögern, ablenken oder verändern könnten und die dazu führen könnten, dass die tatsächlichen Ergebnisse und Resultate maßgeblich von den derzeitigen Erwartungen abweichen. Eine Gewährleistung kann in keinem Fall für zukunftsgerichtete Aussagen übernommen werden. Neben anderen Risiken kann nicht garantiert werden, dass Daklinza ein kommerziell erfolgreiches Produkt wird. Die in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen sollten zusammen mit den zahlreichen Unwägbarkeiten, welche sich auf den Geschäftsverlauf von Bristol-Myers Squibb auswirken, bewertet werden; dies gilt insbesondere für jene, die in der Diskussion der „Cautionary Factors“ auf Formblatt 10-K im Jahresbericht von Bristol-Myers Squibb für das am 31. Dezember 2013 abgeschlossene Bilanzjahr, in unseren Quartalsberichten auf Formblatt 10-Q und in den aktuellen Berichten auf Formblatt 8-K dargelegt werden. Bristol-Myers Squibb verpflichtet sich keinesfalls dazu, zukunftsgerichtete Aussagen aufgrund neuer Informationen, zukünftiger Ereignisse oder aus sonstigen Gründen öffentlich zu aktualisieren. *** *Proteaseinhibitoren (Boceprevir oder Telaprevir). Kontakt: Bristol-Myers Squibb SA Anna Schmelcher, MSc. Hinterbergstrasse 16 6330 Cham Tel.: +41– (0)41 767 7258 Mail: [email protected] Quellen: 1 Sulkowski MS et al. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. NEJM. 2014;370:211-22. 2 Gao et al. Chemical genetics strategy identifies an HCV NS5A inhibitor with a potent clinical effect. Nature Vol 465, 6 May 2010, doi:10.1038/nature08960. 3 Fachinformation Daklinza, Juli 2015. www.swissmedicinfo.ch Bristol-Myers Squibb SA, Public Affairs [email protected] 5 4 Nelson DR et al. All-oral 12-week treatment with daclatasvir plus sofosbuvir in patients with hepatitis C virus genotype 3 infection: ALLY-3 phase 3 study. Hepatology 2015;61(4):1127–1135. 5 http://www.swisshcv.ch/pdf/Report_SCCS_March_31_2012.pdf 6 Bochud et al. Genotype 3 is associated with accelerated fibrosis progression in chronic hepatitis C. J Hepatol. 2009 Oct;51(4):655-66. 7 Tapper EB, Afdhal NH. Is 3 the new 1: Perspectives on virology, natural history and treatment for hepatitis C genotype 3. J Viral Hepat. 2013; 20:669-677. 8 Leandro et al. Relationship between steatosis, inflammation, and fibrosis in chronic hepatitis C: a metaanalysis of individual patient data. Gastroenterology. 2006 May;130(6):1636-42. 9 Nkontchou et al. HCV genotype 3 is associated with a higher hepatocellular carcinoma incidence in patients with ongoing viral C cirrhosis. J Viral Hepat. 2011 Oct;18(10):e516-22. 10 Vietri J et al. „The burden of hepatitis C in Europe from the patients' perspective: a survey in 5 countries.“ BMC Gastroenterology 2013, 13:16. 11 Bruggmann et al. Historical epidemiology of hepatitis C virus (HCV) in selected countries. J Viral Hepat. 2014 May;21 Suppl 1:5-33. doi: 10.1111/jvh.12247. 12 World Health Organizations (WHO). „Hepatitis C: About HCV Infection“, online verfügbar unter: http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index3.html.Zuletzt abgerufen am 19. August 2014. 13 World Health Organization (WHO). „Hepatitis C“, online verfügbar unter: http://www.who.int/csr/disease/hepatitis/Hepc.pdf, Zuletzt abgerufen am 19. August 2014. 14 EU-Fachinformation Daklinza®, August 2014. Bristol-Myers Squibb SA, Public Affairs [email protected] 6