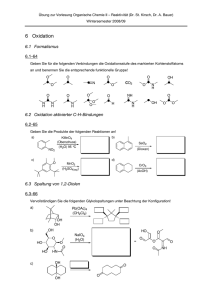
7. Oxidationsreaktionen Einschub: Oxidationszahlen
Werbung

7. Oxidationsreaktionen Oxidation • Entzug von Elektronen durch ein geeignetes Reagens, das Oxidationsmittel • entweder wird Wasserstoff aus dem Molekül entfernt oder Sauerstoff eingefügt • Industriell bzw. optimal: Oxidation mit Sauerstoff unter Katalyse Oxidationsarten • man kann die Oxidationen in folgende Klassen unterteilen: • Elektronenübertragungen (z.B. Oxidation von Verbindungen mit π− oder n-Elektronen, Bsp. Amine) • H-Übertragungen unter Abstraktionen von H-Atomen (z.B. Dehydrierung von Kohlenwasserstoffen oder Alkoholen) • Hydrid-Übertragungen unter Abstraktion von H• Addition von Sauerstoff (z.B. durch Sauerstoff, Ozon oder Persäuren) • Oxidative Addition (in Übergangsmetall-Komplexen, z.B. im Monsanto-Essigsäureverfahren) • Anodische elektrochemische Oxidation Einschub: Oxidationszahlen Oxidationszahlen • ein in der Organischen Chemie nur gelegentlich angewendetes, aber durchaus hilfreiches Konzept ist das der Oxidationszahlen • Kohlenstoff als zentrales Element tritt dabei in den Oxidationszahlen von +IV(CCl4, CO2) bis -IV (CH4) auf. • bei vielen Redoxreaktionen werden formal zwei Elektronen gleichzeitig übertragen • Einelektronenübertragungen werden in der Regel durch Metalle oder deren Ionen (Na, Cu(II), FeCl3, etc.) eingeleitet. Oxidationszahlen des Kohlenstoffs in unterschiedlichen Verbindungen -4 CH4 -3 CH3 -2 CH3 CH3OH CH3-CH3 CH2 H2C CH2 CH3Cl -1 HC CH R2CHOH 0 H2C O CH2Cl2 +1 RCHO CH3CHCl2 +2 HCO2H HCCl3 HCN +3 RCO2H RCOCl CH3CN +4 CO2 COCl2 RCH2OH CCl4 R = Alkyl (z.B. CH3) 1 Einschub: Oxidationszahlen Bestimmung der Oxidationszahlen • zur Bestimmung der Oxidationszahlen wendet man am besten die folgenden Regeln an: • Wasserstoff hat an Kohlenstoff gebunden immer die Oxidationszahl +I, nur als Hydrid hat er -I • Sauerstoff hat meist die Oxidationszahl -II (häufige Ausnahme: Peroxide) • Stickstoff hat meist die Oxidationszahl -III (häufige Ausnahme: Nitro- und Nitroso-Cruppen) • Halogene haben die Oxidationszahl -I (Ausnahmen: oxidierte Halogene, ClO4–) • benachbarte Kohlenstoffe verhalten sich neutral • die Summe der Oxidationszahlen muss die betreffende Ladung der Verbindung ergeben Änderung der Oxidationszahlen • Oxidation: Im Zuge der Reaktion erhöht sich die Oxidationszahl des Reaktionszentrum aus dem Substrat • oft werden Bindungselektronen einer σ-Bindung am Oxidationsmittel lokalisiert (El.-paar "klappt" dort hin) Einschub: Oxidationszahlen Beispiel 1 • Appel-Reaktion: Substitution (Oxidationszahl des C ändert sich nicht), im Zuge der Reaktion wird Tetrachlormethan zu Chloroform reduziert, im Gegenzug wird der dreiwertige Phosphor oxidiert H H C OH + CCl4 + PPh3 H -II +IV +III H H C Cl + HCCl3 + O PPh3 H -II +II +V Beispiel 2 • Keto-Enol-Tautomerie • aus Sicht der Oxidationsstufen des Kohlenstoffs eine Dis- bzw. Komproportionierung OH H H H -II 0 O H H H H -III +I 2 Leichtigkeit der Oxidation Oxidierbarkeit 1 • ein Substrat sollte unter Elektronenentzug um so leichter zu oxidieren sein, je energiereicher sein HOMO ist • entsprechend sollte ein Oxidationsmittel um so stärker sein, je energieärmer sein LUMO ist < R H R OH < R NH2 Oxidierbarkeit 2 • Energien von σ-Orbitalen sind i.a. niedriger als die von π- oder n-Orbitalen. Hieraus ergibt sich für die Oxidierbarkeit folgende Reihung: < C C < C C C C Oxidation von Alkanen Alkane • tagtäglich: Oxidation mit Luft im Verbrennungsmotor • präparativ: normale Alkane lassen sich schlecht oxidieren • Ausnahme: benzylische und allylische Kohlenwasserstoffe • technisch: viele Oxidationen laufen mit Sauerstoff in Gegenwart eines Katalysators • Bsp.: Methanol aus Methan Reaktivität • C-C- und C-H-Bindungen sind i. a. nicht durch Elektronenentzug oxidierbar, stattdessen durch HAbstraktion • bei Oxidationen, die als H-Übertragungen verlaufen, ist die Bindungsdissoziationsenergie bestimmend RCH2 H 410 kJ mol-1 R2CH H R3C H 390 380 O CH2=CH-CH2 H 370 H O R 370 Ph-CH2 H H 370 R H OH R 380 H 370 H H O H R 430 relativ leicht zu oxidieren (vergleichsweise schwache Bindung) CH2=CH H 452 3 Oxidation von Alkanen mit CrO3 oder KMnO4 • CrO3 und KMnO4 oxidieren Kohlenwasserstoffe zu Alkoholen sowie benzylische Kohlenwasserstoffe, oft sogar unter Bindungsspaltung zu Carbonsäuren • Bsp.: H CrO3 OH od. KMnO4 Mechanismus • diese Oxidationen verlaufen wahrscheinlich nach einem Radikalkettenmechanismus. Im Prinzip ähnlich der Autoxidation, bis auf den Unterschied, dass ein reduziertes Metallkation das Hydroperoxid reduktiv zum Alkoxyradikal spaltet, aus welchem letztlich die Hydroxyverbindung entsteht. • z.T. unlogisch, da das Metall hier oxidiert und nicht reduziert wird! R + O O R O O R R O O R + R H + O O H R O O + M2+ H R O R O + OH– + M3+ R OH + R + R H Oxidation von Alkanen Benzylische C-H-Bindungen • Oxidation benzylischer Positionen kann auch mit HNO3 durchgeführt werden (HNO3 ist allerdings weniger reaktiv als CrO3 od. KMnO4) • Bsp.: CH3 CO2H HNO3 CH3 CH3 CH3 CH3 CO2H CrO3 od. KMnO4 Oxidation beider Methylgruppen CO2H • auch Alkylgruppen in Nachbarstellung zu anderen Aromaten (z. Pyridin) können oxidiert werden CO2H CH3 2 KMnO 4 N + 2 MnO2 + 2 KOH N 4 Oxidation aktivierter C-H-Bindungen mit Selendioxid Diketone aus Ketonen • Methylen- und Methylgruppen, die einer Carbonylgruppe benachbart sind, lassen sich mit Selendioxid selektiv in Carbonylgruppen überführen. Es enstehen α-Diketone bzw. α-Oxoaldehyde • wahrscheinlich wird das Enol von der selenigen Säure oxidert, wobei sich elementares Selen abscheidet (elektrophiler Angriff von Selendioxid oder der selenigen Säure H2SeO3) • als Lösungsmittel dienen Xylol oder Dioxan. • zu beachten ist die Toxizität von Selenverbindungen O O Se O H H O O H H R1 R2 O R1 R1 O Se H O R2 H 1 R2 R O Se OH H R2 O O Se R1 H2O - Se, -H2O R2 HO O Se O R2 H R1 O O R1 R2 O O Bsp.: Oxidation von Acetophenon zu Phenylglyoxal H SeO2 O Dioxan/H2O (65%) Oxidation aktivierter C-H-Bindungen mit Selendioxid Allylische Oxidation mit SeO2 • Selendioxid ist ebenfalls ein nützliches Reagenz für die allylische Oxidation von Alkenen • der Mechanismus besteht aus den 3 Schritten: • a) elektrophile En-Reaktion (eine pericyclische Reaktion, 6 bewegliche Elektronen) mit SeO2 • b) einer sigmatropen Umlagerung (ebenfalls eine pericylische Reaktion, Verschiebung einer σBindung), die die ursprüngliche Lage der Doppelbindung wieder herstellt • c) dem Zerfall (Hydrolyse) der Selenverbindung • je nach Reaktionsbedingungen kann es auch zur Weiteroxidation zu Carbonylverbindungen kommen. • Selen wird im Zuge der Reaktion reduziert (+4 zu +2) • sehr wichtige Reaktion zur Funktionalisierung von Terpenen R H H SeO2 via: R CH3 O Se O R H H H2O H H H R H H HO Se O H H HO Bsp.: selektiv für das höher substituierte Ende der Doppelbindung Hinweis: allylische Oxidationen sind auch mit einem Komplex bestehend aus CrO3 und Pyridin möglich. R H R H H H O Se OH H H H HO Se O H H H OH + HO Se H H SeO2 (45%) O H 5 Haloform-Reaktion Abbau von Methylketonen • Methylketone werden durch Hypochlorit- oder Hyprobromit-Ionen unter Verlust eines C-Atoms zu Carbonsäuren abgebaut • der erste Schritt ist die basenkatalysierte Halogenierung. Da die Halogenketone reaktiver als ihre Vorläufer sind, erfolgt eine erschöpfende Halogenierung zu Trihalogenketonen. Diese Ketone sind wegen der Stabilisierung des resultierenden Carbanions durch die Halogenatome empfindlich gegenüber alkalischer Spaltung • dieser Abbau ist mitunter nützlich zur Synthese aromatischer Carbonsäuren über die Sequenz FriedelCrafts-Acylierung und Haloformreaktion (oder bei anderen gut zugänglichen Methylketonen) O H OH O H R H H R H schnell O O Br H H R OH O Br R H + OH O Br Br Br R Bsp.: Abbau von Pinakolon Br OH O R HO O O Br Br Br OH + R O NaOH O O OH Br2 (74%) Br Br Br + H R Br Br Br Spaltung von C-C-Bindungen Verschärfte Bedingungen • Oxidation organischer Verbindungen erfolgt unter Spaltung von C-C-Bindungen. Glykol-Spaltung • 1,2-Diole aus Alkenen durch Dihydroxylierung • als Reagenz wird oft Periodat verwendet. Die Fragmentierung erfolgt über ein cyclisches Addukt aus Glycol und dem Oxidationsmittel • Verwendung: Darstellung difunktioneller Verbindungen durch Ringspaltung • Verkürzung von Diolen (Zucker etc.) • Verwendung von Alkenen als stabile Vorstufen von Aldehyden IO4HO OH + O +7 O O O I O + O O I O O +5 O Bsp.: Spaltung von 1,2Cyclohexandiol OH Geht auch mit transCyclohexandiol OH NaIO4 H2O, MeOH O O Hinweis: Epoxidierung und Dihydroxylierung von Alkenen sind ebenfalls Oxidationsreaktionen 6 Oxidation von Alkoholen und Aldehyden • Oxidation von primären oder sekundären Alkoholen im Labor: meistens kommen Reagenzien aus der Tabelle zum Einsatz selektive Oxidation ? OH R1 OH 2 R R O Oxidationsmittel 1 R R 2 OH H H H R H O R O H Bezeichnung R OH K2Cr2O7, verd. H2SO4 ja nein ja CrO3, verd. H2SO4, Aceton ja zum Teil ja ja ja nein ja ja nein Pyridiniumdichromat (PDC) ja ja nein N H Cl CrO3 N H Cr2O72O H3C S O CH3 Cl Jones-Reagenz Pyridiniumchlorochromat (PCC) O NEt3 Swern-Oxidation Cl Oxidation von Alkoholen und Aldehyden Relativ problemlose Fälle • Oxidation von sekundären Alkoholen zu Ketonen • Oxidation von primären Alkoholen zu Carbonsäuren Bsp.: Jones-Oxidation OH H2CrO4 Aceton (92-96%) O OH H2CrO4 O Aceton (79-88%) schwieriger • Oxidation von primären Alkoholen zum Aldehyd • in wässrigem Medium besteht die Gefahr der Überoxidation zur Carbonsäure über das entsprechende Halbacetal • mit K2Cr2O7 in H2O nur möglich, falls der Aldehyd als leichtflüchtige Komponente aus dem Reaktionsgemisch destillativ entfernt werden kann 7 Oxidation von Alkoholen und Aldehyden Mechanismus • Wahrscheinlich aus drei Varianten bestehend • Oxidation durch +6-Chromsäurehalbester • Oxidation durch +4-Cr via Radikalzwischenstufe • Oxidation durch +5-Chromsäurehalbester, Ziel: +3-Cr (rel. stabile Ox.-Stufe des Cr) R1 R2 R1 +6 OH + HCrO4- R2 H OH O Cr O O β-Eliminierung R1 (cyclisch oder acyclisch) R2 HO Chromsäurehalbester Folgechemie des Cr(IV) +4 3 CrO(OH)2 +3 +6 Cr2O3 + CrO3 + 3 H2O Disproportionierung R1 R1 OH + CrO(OH)2 OH + 1/2 Cr2O3 + R2 H R2 R1 +6 OH + CrO3 R2 R1 R2 H R1 R2 +5 OH + CrO3H O O Cr + +4 OH Cr [Ar]3d54s1 1 1/2 H2O +5 O + CrO3H R1 R2 H +5 OH R1 Cr O OH R2 O OH +3 O + HO OH Cr Oxidation von Alkoholen und Aldehyden Zusammenfassung • wasserfreie Cr(VI)-Reagenzien (PCC, PDC): Aldehyde • wasserhaltige Cr(VI)-Reagenzien: Carbonsäuren Erklärung • Cr(VI) können Aldehyde an sich nicht angreifen • angreifbar sind die Aldehydhydrate, die sich in Gegenwart von Wasser in geringen Mengen ausbilden können • Bildung eines Chromsäurehalbesters und damit wird eine Oxidation möglich O R H2O H HO OH Cr(VI) R H Hydrat HO O Cr HO O O R H O R OH 8 Swern-Oxidation Verwendung von aktiviertem Dimethylsulfoxid • Kombination aus DMSO, Oxalylchlorid und Triethylamin (als Base) heißt Swern-Oxidation • zunächst wird aus dem DMSO ein Sulfonium-Ion (3) mit einer Abgangsgruppe erzeugt (durch fragmentierende Abspaltung des –O-C(=O)-C(=O)-Cl Restes • das Sulfonium-Ion reagiert mit dem Alkohol wobei an der OH-Funktion eine gute Abgangsgruppe etabliert wird • Zugabe von Base ergibt ein Ylid, aus dem durch β-Eliminierung mit cyclischem Übergangszustand die Carbonylverbindung (Aldehyd bzw. Keton) und Dimethylsulfid (geruchsbelästigend) entstehen O O H3C S H3C CH3 OH Cl H3C S R CH3 H3C O S R 5 3 O + S R 2 CH3 4 CH3 CH3 Cl O Cl- 1 S Cl O (COCl)2 CH3 3 + CO2 CO ClCH3 NEt3 Cl- H H H 6 NEt3 + HNEt3+ Cl- Ylid (Ladungen benachbart) O S H R H H H Hinweise: • viele andere Oxidationsmethoden sind bekannt • Oxidationen wurden in anderen Kapitel bereits besprochen (Epoxidierung, Dihydroxylierung) CH3 8 7 S Technisch wichtige Oxidationsreaktionen Kat. H3C OH + 0.5 O2 H2C O Kat. ΔT CH4 + NH3 + 1.5 O2 Kat. ΔT + 1.5 O2 + H2O H C N + 3 H2O CO2H + H2O Oxidation von Methanol zu Formaldehyd (4.9 × 106 jato, 1995) Andrussow-Verfahren zur Darstellung von Blausäure (1.5 × 106 jato, 1995) Acrylsäure aus Propen (2.0 × 106 jato, 1994) O + 3 O2 Kat. ΔT O + 3 H2O Maleinsäureanhydrid aus 2-Buten oder Benzol (8.7 × 105 jato, 1996) O O CH3 + 3 CH3 O2 Kat. ΔT O O Phtalsäureanhydrid aus Xylol (2.9 × 106 jato, 1995) CO2H Analog: Terephthalsäure aus pXylol (1.7 × 107 jato, Verwendung CO2H in PET-Flaschen) 9 Zusammenfassung – Oxidation • • • • • • Möglichkeiten einer Oxidation [Add. von O (Epoxidierung), Entfernung von H (Dehydrierung von Alkoholen od. Alkanen)] Oxidationszahlen Oxidation von Alkanen • i.d.R. über H-Abstraktion • Stabilität der C-H-Bindung ist entscheidend Oxidation mit SeO2 (En-Reaktion, sigmatrope Umlagerung, Hydrolyse der Se-O-RBindung) Glykol-Spaltung (IO4–) Oxidation von Alkoholen • formale Eliminierung von H-X entlang der C-O-Bindung (Bsp.: X = CrO(OH)2) • primäre Alkohole: je nach Bedingung: Aldehyd oder Säure als Produkt 10