Zucker und freie Aminosäuren - Fachrichtung Chemie und
Werbung

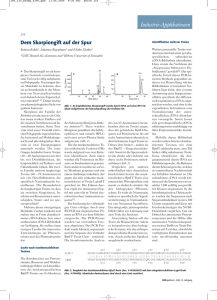
1 Institut für Lebensmittelchemie Nachweis freier Aminosäuren und Zucker in Kartoffeln Vorbemerkung: Bei der Verarbeitung und Zubereitung von Lebensmitteln finden zahlreiche chemische Reaktionen unter Beteiligung der Lebensmittelinhaltsstoffe statt. Diese Substanzen – es sind Kohlenhydrate, Lipide, Proteine, Nukleinsäuren, Vitamine, Mineralstoffe – reagieren entweder untereinander oder mit anderen Stoffen z.B. mit Sauerstoff. Die Reaktionsabläufe und Reaktionsprodukte sind ungeheuer zahlreich und stark abhängig vom Reaktionsmilieu, vor allem vom pH-Wert und von der Temperatur. Allein die Bräunungsreaktionen, die auf der Umsetzung von Kohlenhydraten und Proteinen beruhen, nehmen ein großes wissenschaftlich bearbeitetes Gebiet ein. Reaktionspartner bei diesen Reaktionen sind im engeren Sinne die monomeren Bausteine der Proteine, die Aminosäuren und reduzierende Zucker wie Glucose oder Maltose. Dass dabei nicht nur erwünschte Bräunungsprodukte und Aromastoffe entstehen, sondern auch unerwünschte Nebenprodukte, wurde erst in jüngster Zeit mit dem Nachweis von Acrylamid in erhitzten Getreide- und Kartoffelprodukten gezeigt. Nach ersten Erkenntnissen ist ein wichtiger Reaktionspartner bei der Entstehung dieses Nebenprodukts Aspargin – das Säureamid der Asparaginsäure. Die Asparaginsäure ist eine saure Aminosäure; sie besitzt eine zusätzliche Säuregruppe. Eine weitere sehr reaktive Aminosäure ist Lysin. Das Lysin ist eine basische Aminosäure; es besitzt eine zusätzliche Aminogruppe. Die Hauptmenge der Aminosäuren ist in Proteinen über Peptidbindungen gebunden. In pflanzlichen und tierischen Zellen kommen aber auch immer freie Aminosäuren vor. Die Reaktivität der freien Aminosäuren ist gegenüber den gebundenen sehr viel größer. Im Versuch soll untersucht werden, ob die Kartoffel neben reduzierenden Zuckern freies Asparagin und freies Lysin enthält. O O OH OH H2N O C C H2N CH CH H2N O O C C OH OH CH CH CH2 CH2 C CH2 NH2 O (CH2)3 C NH2 Abbildung: Asparaginsäure (Asp), Asparagin (Asn), Acrylamid, Lysin CH2 NH2 2 Prinzip: Die freien Aminosäuren werden nach intensiver Zerkleinerung der Kartoffeln aus dem Kartoffelsaft isoliert. Die Kartoffelproteine werden durch Ethanol oder durch Hitze gefällt und die freien Aminosäuren ionenaustauschchromatographisch von Zuckern und anderen löslichen Pflanzeninhaltsstoffen abgetrennt. Nach Elution der Aminosäuren vom Austauscher mit verdünnter Ammoniaklösung werden die Aminosäuren konzentriert und zu ihrer Identifizierung dünnschichtchromatographisch untersucht. Zur Dünnschichtchromatographie der Zucker wird entweder der Kartoffelsaft nach der Eiweißfällung direkt oder nach Absorption der freien Aminosäuren am Ionenaustauscher verwendet. Durchführung: Isolierung der freien Aminosäuren Eine mittelgroße Kartoffel (ca.180g) wird gewaschen und mit dem Messer in 1x1 cm große Stücke zerkleinert. Diese Stücke werden mit Hilfe einer elektrischen Saftpresse entsaftet. Man erhält ca. 20 mL Kartoffelsaft. Überprüfen Sie mit wenigen Tropfen Kartoffelsaft, ob Proteine/Aminosäuren, reduzierende Zucker und gelöste Stärke nachweisbar sind. Verwenden Sie dazu Ninhydrinreagens, Fehlingsche Lösung und Jodlösung. Diese Proben sollen auch in den einzelnen Eluaten der Aufarbeitung als Kontrolle durchgeführt werden. Zur Enteiweißung werden 10 mL Kartoffelsaft im 45-mL-Falconbecher mit Ethanol (96%ig, verg.) ad 35 mL versetzt und das gefällte Eiweiß durch Zentrifugation abgetrennt. Es wird in der Biofuge (Firma Hettich) 10 Minuten bei 12000 Min-1 zentrifugiert. Der klare alkoholische Überstand wird mit einer Pipette abgezogen und 25 mL davon werden auf eine vorbereitete Ionenaustauschersäule gegeben. Auf der Säule werden die Aminosäuren festgehalten und später wieder eluiert. Die durch die Säule laufende Lösung wird in einem Spitzkolben aufgefangen. Sie enthält Kohlenhydrate und andere lösliche am Kationenaustauscher nicht bindende Pflanzeninhaltsstoffe. Die „Säule“ wird mit 25mL wässriger ethanol. Lösung (15mL Wasser und 50mL Ethanol) gewaschen und anschließend werden die Aminosäuren mit 10mL Ammoniaklösung [10g konz. Ammoniaklösung (25%ig) mit Wasser zu 100mL] vom Ionenaustauscher abgelöst (mit 10 ml Dest Wasser nachspülen – sowohl die Ammoniaklösung, als auch das Wasser im Spitzkolben sammeln). Das Eluat wird am Rotationsverdampfer zur Trockne eingeengt und mit 6mL Wasser aufgenommen. Mit der vorgegebenen Wassermenge entspricht die Aminosäurekonzentration, dann etwa der im Kartoffelsaft. Die Lösung wird zur Dünnschichtchromatographie der Aminosäuren verwendet. Zur Dünnschichtchromatographie der Zucker wird der ethanolische Kartoffelsaft entweder vor der Ionenaustauschchromatographie oder die durch den Austauscher laufende Lösung eingesetzt Zur Vorbereitung der Ionenaustauschersäule: Es wird der stark saure Kationenaustauscher Amberlite IR 120 (Firma Merck) verwendet. Eine Glassäule (Innendurchmesser ca. 10mm) wird etwa 5 bis 6cm mit der 3 Harz-Wasser-Suspension gefüllt. Die Aktivierung erfolgt mit 25mL 2N Salzsäure. Anschließend wird die Säule mit destilliertem Wasser neutral gewaschen und ist zur Beladung bereit. Dünnschichtchromatographie Dünnschichtchromatographie der freien Aminosäuren. Aminosäurelösungen zum Vergleich: (stehen bereit) Die Aminosäuren werden in Wasser zu 2 mg/mL gelöst. Davon werden höchstens 1µL aufgetragen. Die Nachweisempfindlichkeit der Aminosäuren mit Ninhydrinreagens ist unterschiedlich. Für einige Aminosäuren ist eine Konzentration von 0,2mg/mL bei gleicher Auftragsmenge ausreichend. Folgende Aminosäuren dienen zum Vergleich: Asparagin (Asn), Asparaginsäure (Asp), Lysin (Lys), Leucin (Leu), Phenylalanin (Phe), Glutaminsäure (Glu), Arginin (Arg), Histidin (His), und Prolin (Pro). Arg, Asp und Leu kann als Mischung aufgetragen werden. Ebenfalls als Mischung kann Lys, Glu und Phe aufgetragen werden, da die Rf-Werte genügend weit voneinander entfernt sind. Asn sollte unmittelbar neben der Probe aufgetragen werden. Pro und Asn sind beide gelblich gefärbt und unterscheiden sich damit von allen anderen Aminosäuren. Als Trennmittel wird Kieselgel 60 Fertigglasplatten zur HPTLC Schichtdicke 0,20mm verwendet 10x20cm oder 10x10cm, Firma VWR (Merck) oder Macherey & Nagel (Nano-Sil-20). Der Auftrag der Probe erfolgt punktförmig (ca. 1cm). Die aufgetragene Menge sollte 3µL nicht übersteigen. Die Vergleichsaminosäuren können punktförmig aufgetragen werden. Die Ausdehnung des aufgetragenen Punktes soll in Laufrichtung möglichst klein sein. Die Entwicklung erfolgt in einer Vertikalkammer (Doppeltrogkammer) ohne Kammersättigung und Konditionierung. Laufmittel: Das Laufmittel (Reihenfolge beim Mischen beachten!) besteht aus Butanol, Methanol, einer 25%igen Ammoniaklösung und Wasser im Verhältnis: 8:7:2:3. Das Laufmittel sollte stets frisch aus den Lösungsmitteln hergestellt werden. In einer Camag- oder Desaga Doppeltrogkammer genügen für eine 10x20-cm-Platte ca. 10 mL Laufmittel. Die Laufhöhe beträgt ca. 5,5....6,0cm und dazu werden ca. 60min benötigt. Die mit dem Fön getrocknete Platte wird in einer Ninhydrinlösung getaucht. Von der Plattenrückseite wird mit Fließpapier die Tauchlösung entfernt und anschließend wird die Platte bei 105°C auf dem Plattenheizer 10 Minuten entwickelt. Ninhydrin-Tauchlösung: 80 mg Ninhydrin p.a. werden in 40 mL Aceton gelöst. Der Lösung werden 2,2 mL Eisessig zugegeben. Die Ninhydrinfärbung lässt sich durch folgendes Sprühreagens bei einer Aufbewahrung im Dunklen für eine kürzere Zeit konservieren: Zu 1mL gesättigter Kupfernitratlösung werden 200µL 10%ige Salpetersäure hinzugefügt und mit Ethanol zu 100mL ergänzt. 4 Dünnschichtchromatographie der Zucker Zucker zum Vergleich: Die Zucker werden in 50%igem wässrigem Ethanol zu 3mg/mL gelöst. Davon werden dann 1µL aufgetragen. Folgende Zucker dienen zum Vergleich: Glucose, Fructose, Maltose, Saccharose Als Trennmittel wird Kieselgel 60 Fertigglasplatten zur DC Schichtdicke 0,25mm verwendet 10x20cm oder 20x20cm, Firma VWR (Merck) oder Macherey & Nagel. Die Probe und die Vergleichssubstanzen werden punktförmig aufgetragen. Die aufgetragene Menge sollte 1µL nicht übersteigen. Die Entwicklung erfolgt in einer Vertikalkammer (Doppeltrogkammer oder Normalkammer) ohne Kammersättigung und Konditionierung. Die chromatographische Entwicklung wird als eindimensionale Zweifachentwicklung (oder Dreifachentwicklung) durchgeführt. Zwischen den „chromatographischen Läufen“ wird sorgfältig mit dem Fön im Kaltluftstrom getrocknet – das kann durchaus 20 Minuten dauern - und anschließend wird frisches Laufmittel verwendet. Laufmittel: Das Laufmittel besteht aus Acetonitril und Wasser im Verhältnis: 85:15 (v/v) . Achtung! Acetonitril ist giftig. Abzug benutzen. Das Laufmittel sollte stets frisch aus den Lösungsmitteln hergestellt werden. In einer Camag- oder Desaga Doppeltrogkammer genügen für eine 10x20-cm-Platte ca. 10mL Die mit dem Fön vorgetrocknete und anschließend im Trockenschrank oder auf dem Plattenheizer getrocknete Platte wird in eine Diphenylamin-Anilin-Lösung getaucht. Von der Plattenrückseite wird mit Fließpapier die Tauchlösung entfernt und anschließend wird die Platte bei 105°C auf dem Plattenheizer entwickelt. Werden die Platten überhitzt, so verfärbt sich der Untergrund deutlich. Bei sehr geringen Zuckerkonzentrationen ist es angebracht, die DC-Platte, nach einer Zwischentrocknung, ein zweites Mal zu tauchen. Zur Identifizierung sind in starkem Maße, neben den relativen Retentionsfaktoren, die Fleckenfarben heranzuziehen. Achtung! Diphenylamin und Anilin sind stark giftig. Diphenylamin-Anilin-Tauchlösung: 0,2g Diphenylamin in 10mL 96%igen Ethanol und 0,2mL destilliertes Anilin in 10mL 96%igen Ethanol werden gemischt und der Mischung 2mL 85%ige Phosphorsäure zugegeben. Die Lösung wird zum Tauchen 1+1 mit 96%igem Ethanol verdünnt. Man beachte, dass obige Mengen für eine 10x10-cm-Tauchkammer berechnet sind. Für ein 20x10-cm-Tauchkammer werden ca. 60mL Detektionslösung benötigt.