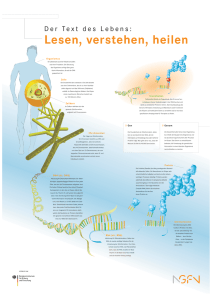
Anleitung zum Biochemischen Praktikum für Mediziner Universität
Werbung

2 Anleitung zum Biochemischen Praktikum für Mediziner Universität zu Köln 3 4 Inhaltsverzeichnis „Zehn Gebote“, Einführung, allgemeine Hinweise, Unfallverhütung, Pipetten, pHMeter Versuch 1: Aminosäuren und Proteine I Lambert-Beer'sches Gesetz Quantitative Biuret-Reaktion Titrationskurve von Aminosäuren Proteinstrukturen (Teil I) Versuch 2: Aminosäuren und Proteine II SDS-Polyacrylamidgelelektrophorese Western-Blot Proteinstrukturen (Teil II) Versuch 3: Enzyme Enzymkinetik der sauren Phosphatase Acetylcholinesterase-Bestimmung im Serum Hemmung des Enzyms mit (DIFP) Reaktivierung mit PAM Laktatdehydrogenase (opt. Test) Versuch 5: Immunologie ELISA (enzyme linked immunosorbent assay), Enzymgekoppelter Immunnachweis Western-Blot Test zur Schwangerschaftsfrüherkennung aus Urin Versuch 6: Blut Gelfiltration, Spektroskopie und die quantitative Bestimmung des Hämoglobins Dialyse-Versuch Enzymatische Bestimmung der Glucose Polarimetrie Versuch 7: Nukleinsäuren I Löslichkeit der Harnsäure Xanthinoxidase-Reaktion und ihre kompetitive Hemmung Bestimmung der Harnsäure mit Hilfe der UV-Spektroskopie Restriktionsendonukleasen Polymerasekettenreaktion (PCR) Versuch 8: Nukleinsäuren II Regulation der Gen-Aktivität am Beispiel des lac Operons DNA-Isolierung Versuch 4: Lipide Nachweisreaktionen von Lipiden DC-Trennung von Myelin-Lipiden Gaschromatographie von FSM-Estern DC von Steroidhormonen Analyse von Erbkrankheiten am Beispiel der Cystischen Fibrose 5 Die ZEHN Gebote ALLGEMEINE HINWEISE 6 1. Unfallverhütung: Beachten Sie bitte die Hinweise im Praktikumsbuch! Die vorliegende Anleitung für das biochemische Praktikum an der Universität zu 2. Es gibt keinen Fehltag! Bei Krankheit bringen Sie bitte ein Attest, und erfragen, wann der versäumte Versuch nachgeholt werden kann. Köln versucht, den Studenten mit einem breiten Spektrum biochemischer 3. Sollten Sie keine ausreichende Vorbereitung nachweisen können, müssen Sie den Versuch an einem anderen Tag wiederholen. 4. Analysen: Mindestens 6 von 9 Analysen müssen richtig sein. Die Analysen müssen von jedem Studenten einzeln durchgeführt werden und die Ergebnisse in die ausliegenden Listen eingetragen werden. (Die Menge der ausgegebenen Analysenlösung ist begrenzt). 5. 6. Sauberes Arbeiten: Bitte benutzen Sie nicht die Pipetten, um die Reagenzien aus der Vorratsflasche zu entnehmen. Die ungefähr benötigte Menge soll in ein Becherglas gegossen werden, und daraus pipettiert werden. Restlösungen bitte wegschütten und nicht in die Originalflaschen zurückgeben. Methoden von unterschiedlichem Schwierigkeitsgrad vertraut zu machen. Eine Beschreibung der theoretischen Grundlagen ergänzt die ausführlich beschriebenen Versuche. Jeder Versuch muss vom Studenten theoretisch gründlich vorbereitet und die Methodik vor Beginn genau durchdacht werden. Anders ist ein erfolgreiches Experimentieren nicht denkbar. Jedem Versuch ist eine Zusammenstellung der Wissensgebiete vorangestellt. Sie werden in der Vorlesung in Anlehnung an die Approbationsordnung ausführlich dargestellt. Diese Gebiete sollten die Studenten beherrschen. Jeder Versuch mit allen Experimenten muss an einem Praktikumstag beendet werden. Ausnahme ist der Versuch 2. Die verfügbare Zeit sollte daher Arbeitsplatz: Bitte hinterlassen Sie Ihren Arbeitsplatz abends sauber und ordentlich. Jede Gruppe meldet sich beim Assistenten ab, damit er den Platz abnimmt. zweckmäßig eingeteilt werden. Versuche mit langer Dauer sollten als erste 7. Ende des Praktikums 17.00 Uhr zügiger Durchführung verbleibt in allen Versuchen Zeit zur sorgfältigen Aus- 8. Protokollhefte (Meßdaten, Berechnungen, Diagramme) bitte knapp abfassen. Die Anleitung nicht abschreiben! Montagsgruppe: Do. einwerfen Mo. zurück Mittwochsgruppe: Fr. einwerfen Mi. zurück wertung der Ergebnisse und Besprechung der theoretischen Grundlagen. 9. Kleiderschränke in den Waschräumen können benutzt werden (eigenes Vorhängeschloß mitbringen!). 10. Die erfolreiche Teilnahme am Praktikum wird nur denjenigen bescheinigt, die alle Versuche absolviert haben und ein Referat gehalten haben. Andernfalls muss das Praktikum wiederholt werden begonnen werden; Wartezeiten bei länger laufenden Versuchen können für kürzere Experimente genutzt werden. Die Praktikumszeit ist einzuhalten. Bei Ein Versuch gilt als abgeschlossen, wenn die experimentellen Ergebnisse vom Assistenten überprüft und testiert, der Arbeitsplatz und die benutzten Geräte aufgeräumt und zur Reinigung vorbereitet sind. Über alle Versuche ist Protokoll zu führen. Das Protokollheft muss enthalten: 1) Datum und Bezeichnung des Versuchs. 2) Fragestellung, evtl. Reaktionsgleichungen 3) In knappem Stil, aber lückenlos, die experimentellen Ergebnisse (Chromatogramme, Beobachtungen, Meßzahlen) und die Auswertung dieser Ergebnisse (Diagramme, Berechnungen). Es sollten alle zum Nachvollziehen des Versuchs notwendigen Angaben, insbesondere Konzentrations- und Mengenangaben gemacht werden. 7 8 4) Abschätzung der Fehler mit anschließender Diskussion, inklusive Vergleich mit in der Klinik auftretenden Werten. Leistung der Vortragenden bewertet. Jeder Student hat im Verlauf des Es wird besonderer Wert auf eine übersichtliche und saubere Anordnung der Werte im Protokollheft gelegt. Chromatogramme, Diagramme sollen eingeheftet oder eingeklebt werden, "fliegende Blätter" werden nicht akzeptiert.. Die regelmäßige, erfolgreiche Teilnahme am biochemischen Praktikum wird ferner nach einem zufriedenstellend gehaltenen Referat (s.u.) bescheinigt. Lösungen werden in der benötigten Menge aus der Vorratsflasche in ein Reagenzglas oder in ein Becherglas gegossen; aus der Vorratsflasche sollen Lösungen nie mit einer Pipette entnommen werden. Feste Substanzen werden mit sauberem Spatel entnommen. Man arbeite grundsätzlich eigenständig vortragen. Anschließend wird 10 Minuten diskutiert und die mit möglichst kleinen Substanzmengen. Beim Arbeiten mit Eppendorfreaktionsgefäßen achten Sie bitte darauf, dass sich die Lösung am Boden des Gefäßes befindet (Gegebenenfalls kurz abzentrifugieren!) Die erforderlichen Geräte müssen sorgsam benutzt werden. Zentrifugen bitte nur betreiben, wenn sie vorher austariert worden sind. Die Glasgeräte sind nach dem Praktikum zu entleeren und kurz mit Wasser vorzureinigen; die Sauberkeit der Geräte ist Vorbedingung für zuverlässige Ergebnisse. Unvorbereitete Studenten müssen den Versuch wiederholen. Referate Neben den acht experimentellen Versuchsnachmittagen werden zusätzlich an drei Tagen Seminare abgehalten, in denen die Studenten jeweils vier Referate über zum Praktikumsabschnitt passende Themen halten. Die nicht mehr im Praktikum enthaltenen Versuchsthemen „Puffer“, „Bioenergetik“ und „Kohlenhydrate“ sind auch Bestandteil dieser Seminare. Die Referatthemen werden vorher von den Assistenten vergeben. Jedes Referat dauert 20 Minuten und wird von zwei Studenten gehalten, die beide ihren Teil Blockunterrichts ein Referat zu halten. Ohne Referat wird der Schein zur erfolgreichen Teilnahme am Biochemischen Praktikum nicht ausgestellt. 9 HINWEISE ZUR UNFALLVERHÜTUNG Im Labor ist das Tragen eines Baumwollkittels und einer Schutzbrille Pflicht! Pipettieren Die am Arbeitsplatz bereitliegenden automatischen Pipetten, Schliffpipetten, Pipettierhilfen oder Spritzen sollen zur Dosierung entsprechender Lösungen benutzt werden. Es darf auf keinen Fall mit dem Mund pipettiert werden! Konzentrierte Säuren wie z.B. HNO3, H2SO4, CH3COOH, HCl oder Laugen wie z.B. NaOH, KOH, NH4OH sowie giftige (Cyanid-Lösungen, DIFP) oder Gebrauch der automatischen Pipetten 10 Um auch im Mikroliter-Bereich genau und sicher pipettieren zu können, stehen Ihnen mechanische Pipettierhilfen (Abb. 1) der Firmen Gilson (PIPETMAN) oder Biozym (PreCision) zur Verfügung. Je nach Modell können Sie damit zwischen 2 und 5000µl pipettieren. Das unsachgemäße Arbeiten mit diesen Präzisonsgeräten führt zur Zerstörung der Pipettierhilfen, die hohe Kosten verursachen. Beachten Sie bitte diese Arbeitshinweise und üben Sie vor dem ersten Einsatz der Pipetten den Gebrauch mit entionisiertem Wasser. infektiöse Lösungen wie Serum, E. coli-Suspensionen können ein erhebliches Gefahrenpotenzial darstellen. Daher stehen automatische Pipetten s. u. und Pipettierhilfen zur Verfügung: Blaue Pipettierhilfen für 1 ml Glaspipetten, rote Pipettierhilfen für 5, 10 oder 20ml Glaspipetten. Die Pipetten werden vorsichtig in den Gummiadaptor gesteckt und die Flüssigkeit wird mit Hilfe des Rändelrads aufgezogen. Zum Ablassen der Flüssigkeit wird der seitlich angebrachte Schalter gedrückt. Vermeiden Sie unter allen Umständen, dass Flüssigkeit in die Pipettierhilfe gelangt. Tipp: Ziehen Sie zuerst einen Überschuss an Flüssigkeit auf, und stellen Sie dann das genaue Volumen mit Hilfe des Ablassschalters ein. Jeder Student ist angehalten, in eigener Verantwortung mit den Chemikalien umsichtig und fachgerecht so umzugehen, dass selbst verhältnismäßig ungefährliche Lösungen nicht auf den Körper oder in den Mund gelangen können. Essen, Trinken, Rauchen und die Anwendung von Kosmetika sind strikt untersagt. Der Umgang mit Chemikalien ist nicht narrensicher und verlangt Vorsicht, Verantwortungsbewußtsein und entsprechende Sachkenntnisse. Abb. 1 Automatische Pipettierhilfen Die Pipetten haben ein digitales Mikrometer, das das Volumen angibt. Das Volumen wird durch Drehen einer Einstellschraube (bei der PreCision identisch mit dem Druckknopf, bei PIPETMAN, schwarze geriffelte Schraube) eingestellt. Dabei dürfen die Einstellbereiche der einzelnen Pipetten auf keinen Fall überoder unterschritten werden: 11 Pipetman P20 Pipetman P100 Pipetman P 200 Pipetman P 1000 12 2 - 20µl 20 -100µl 50 - 200µl 200 - 1000µl Pipetman P5000 1000 -5000µl Precision rot 5 - 50µl Precision blau 100 - 1000µl Die Spitze durch Drücken des Spitzenabwerfers (P5000 nur manuell) abwerfen. Die Spitze muss nur gewechselt werden, wenn eine andere Flüssigkeit pipettiert oder die Volumeneinstellung geändert wird. Die Digitalanzeigen der PreCision Pipetten werden von links nach rechts abgelesen und zeigen den tatsächlichen Wert in µl an. Bei der Precision rot sind 0,5µl Schritte einstellbar. Die Digitalanzeige der Pipetman-Pipetten werden von oben nach unten abgelesen und bestehen aus 3 Ziffern. Bei P20, P100 und P200 bedeuten die schwarzen Ziffern Mikroliter und die roten Ziffern zehntel Mikroliter, bei P1000 und P5000 bedeuten die roten Ziffern Milliliter und die schwarzen Ziffern Mikroliter. Für Pipetman P20, P100, P200 und Precision rot werden gelbe, für Pipetman 1000 und Precision blau werden blaue und für Pipetman P5000 werden transparente Einwegpipettenspitzen aus Polypropylen verwendet. Die passenden Spitzen werden auf den Schaft der Pipette aufgesteckt und mit leichtem Drehen so fest angedrückt, dass eine absolute Dichtheit gewährleistet ist. Dabei fassen Sie die Spitzen immer nur am oberen Ende an, niemals an der Spitze. ACHTUNG: NIEMALS FLÜSSIGKEITEN OHNE SPITZE AUFNEHMEN! Füllen Den Druckknopf bis zum ersten Druckpunkt eindrücken (Abb. 2A). Die Pipette senkrecht halten, und die Spitze in die Probenflüssigkeit eintauchen. Den Druckknopf dann langsam und gleichmäßig zurückgleiten lassen (Abb. 2B) Eine Sekunde warten, und dann die Spitze aus der Flüssigkeit nehmen. Entleeren Das Ende der Spitze in einem Winkel von 10 - 40 Grad gegen die Innenwand des Gefäßes halten. Den Druckknopf langsam bis zum ersten Druckpunkt herunterdrücken (Abb. 2C). Eine Sekunde warten. Den Druckknopf bis zum zweiten Druckpunkt herunterdrücken, um restliche Flüssigkeit auszustoßen. (Abb. 2D) Die Pipette mit ganz gedrücktem Druckknopf herausnehmen. Den Druckknopf loslassen (Abb. 2E) Abb. 2 A-E Gebrauch der pH-Meter Die pH-Meter müssen vor Arbeitsbeginn geeicht werden (Versuch 1). Dazu stehen zwei Eichlösungen mit pH7 und pH4 zur Verfügung. Zuerst wird die Glaselektrode mit dest. Wasser gespült, dann (zerstörungsfrei) in die pH7-Lösung eingetaucht und der pH-Wert ggf. mit dem Assymetriedrehknopf auf 7 einstellt. Dann wird die Elektrode mit Wasser gespült und in die pH4-Lösung eingetaucht. Erreicht der abgelesene Wert 3,9 -4,1, ist die Genauigkeit ausreichend für die in diesem Praktikum durchgeführten Versuche. Nur wenn der pH-Wert darunter oder darüber liegt, muss die Steilheit (2. Drehknopf) entsprechend erniedrigt oder erhöht werden. Nach dem Anpassen der Steilheit wird die Eichung wie oben beschrieben erneut durchgeführt, zuerst bei pH7 dann bei pH4. 1-1 1-2 Aminosäuren und Proteine I Versuch 1: Aminosäuren und Proteine I Einführung Photometrie Versuche: Lambert-Beer'sches Gesetz Der Farbcharakter eines Farbstoffs kommt dadurch zustande, dass der Farbstoff die für ihn charakteristischen Wellenlängen des sichtbaren Lichts absorbiert. Je konzentrierter die Farbstofflösung ist, desto größer ist die Absorption oder Lichtschwächung. Quantitative Biuret-Reaktion Titrationskurve von Aminosäuren Analysen: 1. Bestimmung von unbekannten Aminosäuren durch Titration (Ausnahme: Gemeinsame Analyse) 2. Proteinbestimmung nach Biuret Das Prinzip der Photometrie beruht auf der Schwächung eines monochromatischen Lichtstrahls, der durch eine Lösung geschickt wird. Dabei ist die Abschwächung des monochromatischen Lichtstrahls proportional zur Konzentration des gelösten Stoffes und der Dicke der Schicht. Das einfallende Licht wird beim Durchtritt durch eine differentielle Schicht dx um dI geschwächt. Die Lichtschwächung gehorcht der Funktion Wissensgebiete Lambert-Beer'sches Gesetz, Photometrie -dI = K⋅I⋅dx Das bestimmte Integral lautet dann: Aminosäuren: Struktur, Kurzschreibweise, chemische Eigenschaften, essentielle I AS ⌠ 1 . dI = -K ⌡ I Enzymatischer Mechanismus der AS-Transaminierung, Decarboxylierung zu biogenen Aminen, oxidative Desaminierung Interpretation einer Titrationskurve, isoelektrischer Punkt, pK-Wert, pH-Wert, Dissoziation des Wassers Harnstoff-Zyklus und Harnstoff-Biosynthese Peptide und Proteine: Primär-, Sekundär-, Tertiär- und Quartärstruktur Bindungsarten in Proteinen: Peptidbindung, Disulfidbrücken Proteine des Blut-Serums, des Blut-Plasmas Serum-Normalwerte: Gesamtproteinmenge, prozentuale Zusammensetzung der Proteine Allgemeine und spezifische Nachweisreaktionen der Aminosäuren und Proteine (K = Substanzkonstante) Io d ∫ 1 . dx (d = Schichtdicke) x=0 Daraus folgt: ln I - ln Io = -K⋅ d I und: ln (I ) = ln D = -K⋅d (D=Durchlässigkeit) o Daraus ergibt sich das Lambert'sche Gesetz: I -K⋅d = 10-m⋅d Io = e (m = K⋅ln10) m ist ein für die absorbierende Materie und die Wellenlänge typischer Faktor, und ist in Lösungen in der Regel der Konzentration c proportional: m = ε⋅c. (SDS)- Gelelektrophorese Die Proportionalitätskonstante ε ist der molare Extinktionskoeffizient. Den Trennmethoden: reziproken Wert I Ionenaustauscher- und Affinitäts-Chromatographie, Gelfiltration. Io I bevorzugt man gegenüber der Durchlässigkeit I ,weil sein o Wert anwächst, je größer die Absorption wird. Dessen dekadischer Logarithmus wird als die Extinktion E bezeichnet: Einführung Io I 1-3 1-4 Aminosäuren und Proteine I = 10md = 10εcd Io log I = ε • c • d = E 0,6 Lambert-Beer'sches Gesetz Der molare Extinktionskoeffizient Ε ε = c•d [l × mol-1 × cm-1] 0,5 0,4 E = Extinktion c = Konzentration (mol/l) d = Schichtdicke (cm) Die Extinktion E, welche auch als Absorption oder optische Dichte bezeichnet wird, ist der Schichtdicke d und der Konzentration c proportional. Die Extinktion ist die Messgröße bei allen photometrischen Untersuchungen. Die Proportionalität zwischen Extinktion und Konzentration, die das Beer’sche Gesetz verlangt, gilt nicht in allen Fällen, vor allem nicht mehr in höheren Konzentrationsbereichen. Da das durchfallende Licht auch durch Reflexion an den Oberflächen der Küvettenwände geschwächt wird, unter Umständen auch durch das Lösungsmittel, muss zum Vergleich die Extinktion einer gleich großen, mit Lösungsmittel beschickten Küvette als Nullwert gemessen werden. Standardlösungen bekannter Zusammensetzung sind zur Anlage der Eichkurve bzw. zur Ermittlung von ε notwendig. Erstellen einer Eichkurve: Eine Reihe von Lösungen bekannter Konzentrationen werden gemessen und die erhaltenen Extinktionen auf der Y-Achse gegen die Konzentrationen auf der XAchse aufgetragen. An dieser Eichkurve lässt sich für jeden Wert von E die zugehörige Substanzmenge ablesen. Man kann auch aus jedem gemessenen Eichwert (Extinktion Ey und Y mg Substanz) mit Hilfe des Dreisatzes die zugehörige Substanzmenge X einer Probe mit der Extinktion Ex im Reaktionsansatz berechnen. E 0,3 0,2 0,1 0,0 0 1000 2000 mg/l 3000 Abbildung 1-1: Eichkurve für eine photometrische Analyse Die Abbildung 1-2 zeigt den schematischen Aufbau eines Photometers. Von einer Lichtquelle (hier eine Wolfram-Glühlampe für den sichtbaren und eine Deuteriumlampe für den UV-Bereich) werden, nachdem ein dünner Strahl durch eine Spaltblende ausgesondert wurde, bestimmte Wellenlängen durch einen Monochromator (Filter, Gitter oder Prismen) selektiert. Für z.B. orangefarbene Lösungen wird ein Filter der Komplementärfarbe blau verwendet. Diese monochromatische (einfarbige) Strahlung wird durch eine Linse gebündelt und gelangt durch einen Ausgangsspalt zur Küvette, einem quaderförmigen Gefäß für die zu bestimmende Lösung in der das durch die Lösung gehende Licht je nach Konzentration des Farbstoffes geschwächt wird. Je nach Wellenlänge werden unterschiedliche Küvetten verwendet, z. B Quarzküvetten für den UV-Bereich, Glas- bzw. Plastikküvetten für den sichtbaren Bereich (ca. 1-5 ml Inhalt, genau angegebenen Innenabmessungen, meist 1.0 cm "Schichtdicke"),. Das Licht gelangt schließlich zum Detektor (Photozelle oder Photodioden, die Licht in Strom wandeln) und das Messergebnis kann auf verschiedene Weise angezeigt werden (Amperemeter/ Display/ Computer/ Schreiber/ Drucker). Das im Praktikum verwendete Spektralphotometer ULTROSPEC1000 ist ein einfach zu benutzendes, mikroprozessorgesteuertes Gerät, das Sie zur Messung der Absorption von Lösungen bei von Ihnen vorgewählten Wellenlängen ver- Einführung 1-5 wenden. Die Geräte sind bei Beginn des Praktikums bereits eingeschaltetet und betriebsbereit. Drücken Sie die λ-Taste auf der Tastatur, geben Sie die gewünschte Wellenlänge ein und bestätigen Sie mit der F3-Taste (↵). Dann füllen Sie eine Küvette mit dem „Leerwert“ (z. B. Wasser oder ein Reagenzienmix ohne zu messende Substanz), stellen sie in den Strahlengang (Orientierung beachten!), schließen den Deckel des Geräts und drücken Sie die -Taste. Der Leerwert wird automatisch auf 0,000 eingestellt. Nehmen Sie zur Messung entweder dieselbe Küvette oder bestimmen Sie den Küvettenfehler, indem Sie die Messküvette ebenfalls mit dem Leerwert füllen und die Extinktion bestimmen. Stellen Sie dann die Küvette mit ihrer Messlösung in den Strahlengang und notieren Sie das Ergebnis. 1-6 Aminosäuren und Proteine I Aminosäuren Die meisten Aminosäuren sind α-Aminocarbonsäuren, z. B. Glycin oder Valin: H2N CH COOH H2N C H3 CH COOH CH H3C C H3 20 verschiedene Aminosäuren werden in ein Protein während der Synthese am Ribosom eingebaut. Sie werden in der Dreibuchstaben-Kurzschreibweise nachstehend angegeben: Ala Arg Asn Asp Cys Gln Glu Gly His Ile Leu Lys Met Phe Pro Ser Thr Tyr Trp Val Neben den zwanzig kodierten Aminosäuren enthalten viele Proteine noch andere Aminosäuren. Sie werden posttranslational enzymatisch verändert. Diese Proteine haben spezifische Funktionen. Überlegen Sie sich, welche der Aminosäuren Lampe Spalt Mono- Linse Spalt chromator Abbildung 1-2 Küvette Detektor Anzeige verändert sind und welche Funktionen diese Proteine erfüllen. Die Aminosäuren selbst unterliegen metabolischen Vorgängen im Körper. Überlegen Sie sich, welche Reaktionen diese sind und welche Produkte (u. a. Neurotransmitter) dabei entstehen. Die unterschiedlichen Seitenketten der Aminosäuren prägen neben den Aminound Carboxylgruppen ihre Eigenschaften. Sie entscheiden über ihre chemischen Eigenschaften, beispielsweise sauer, basisch oder neutral. Ferner klassifiziert man noch die aromatischen, die polaren bzw. apolaren Aminosäuren. Diese Unterschiede können zu ihrer Trennung genutzt werden. Im Teilversuch I lernen Sie die Eigenschaften der Aminosäuren kennen. In Proteinen treten dagegen die Summe der Eigenschaften der Seitenketten hervor. Im Teilversuch II werden Sie Plasmaproteine untersuchen, die wegen dieser unterschiedlichen Eigenschaften durch Ionenaustauscherchromatographie aufgetrennt wurden. Einführung 1-7 1-8 Aminosäuren und Proteine I Säure-Base-Eigenschaften von Aminosäuren: Isoelektrischer Punkt: Da die Aminosäuren mindestens eine Carboxylgruppe und eine Aminogruppe besitzen, liegt eine Monoamino-monocarbonsäure in wässriger Lösung in drei Ionisationsstufen vor: Der isoelektrische Punkt ist als derjenige pH-Wert definiert, bei dem die Summe der positiven Ladungen einer Substanz gleich der der negativen ist. H R C COOH K1 NH3 + H R C COO K2 H R C COO NH3 + + AS NH2 +- AS Gleichung 1 + + für die Aminogruppe: − Hieraus und aus den Gleichungen 1 und 2 folgt: AS Das Mengenverhältnis der drei Ionisationsformen ist abhängig von den pKWerten der beiden funktionellen Gruppen und dem pH-Wert. Für die Dissoziation der Carboxylgruppe gilt die Henderson-Hasselbalch'sche Gleichung: AS ± [ AS ] = [ AS ] - AS pH = pK1 + log Da das Zwitterion nach außen neutral ist, muss dann also gelten: pI = pK 1 + pK 2 2 Der pI von Monoaminodicarbonsäuren (Asp, Glu) ergibt sich aus: pI = pKR pK 1 + pK 3 2 der pI von Diaminomonocarbonsäuren (Lys, Arg) aus: − pH = pK2 + log AS± Gleichung 2 AS Die pK-Werte der Aminosäuren versieht man mit Indices: Dabei beziehen sich: der pK1 auf die α-Carboxylgruppe, der pK2 auf die α-Aminogruppe und der pKR pI = pKR pK 2 + pK 3 2 bezieht sich stets auf die funktionelle Gruppe der Seitenkette. Tabelle 1-1: pK-Werte der ionisierenden Gruppen von α-Aminosäuren bei 25 oC: Aminosäure pK1 -COOH pK2 -NH3+ pKR Seitenkette Glycin Asparaginsäure Glutaminsäure Arginin Lysin Tyrosin Histidin 2,35 1,99 2,10 1,82 2,16 2,20 1,82 9,78 9,90 9,47 8,99 9,18 9,17 9,11 3,90 4,07 12,48 10,79 10,13 6,00 Das Endprodukt des Aminosäurestoffwechsels. Harnstoff, das Endprodukt des Aminosäure-Stoffwechsels beim Menschen, wird durch Urease (kommt in Sojabohnen und Bakterien vor) hydrolytisch in CO2 und NH3 gespalten. Auf der Wirkung der Bakterien-Urease beruht die "ammoniakalische Gärung" von Urin. Für die Bestimmung von Harnstoff in biologischem Material (Blut, Harn) hat Urease große Bedeutung, da sie streng spezifisch ist und das entstehende Ammoniak nach verschiedenen Methoden genau bestimmt werden kann (keine Durchführung in diesem Praktikum). Biuret 2-9 I. Quantitative Biuret-Reaktion NH2 O C NH2 O C O C NH + NH 3 NH2 Cu2+-Ionen liegen gewöhnlich als Tetrahydrat vor. Diese vier Wassermoleküle werden durch Aminogruppen verdrängt. Es sind also mindestens zwei Peptidbindungen für den Komplex erforderlich: oder 2 Säureamidreste C NH2 O Als Ordinate wird die Extinktion, als Abszisse die mg Protein/Liter Lösung eingetragen. a) Bestimmen Sie aus der Eichkurve den Proteingehalt der Analysenlösung, indem Sie den zur gemessenen Extinktion gehörenden Wert in mg Protein/Liter ablesen, oder b) Berechnen Sie mit jedem Punkt, den Sie für die Erstellung der Eichkurve verwendet haben, durch Dreisatz den Proteingehalt der Probe. Vergleichen Sie den Mittelwert mit dem bei a) bestimmten Wert. NH2 O H C N Aminosäuren und Proteine I Auswertung: Proteine und Peptide bilden mit Cu2+-Ionen in alkalischer Lösung (Biuret-Reagenz) rot bis violett gefärbte Komplexverbindungen, freie Aminosäuren jedoch nicht. Die quantitative Biuret-Probe ist eine der häufigsten Proteinbestimmungsmethode. Der Name der Reaktion stammt von der einfachsten Verbindung, die mit dem Biuret-Reagenz (Cu2+ in alkalischer Lösung) die Komplexverbindung liefert, dem Biuret. Es entsteht durch trockenes Erhitzen von Harnstoff: 2 1-10 wie im Biuret c) Geben Sie das Ergebnis in mg Protein pro Liter Analysenlösung an. II. pH-Titrationskurve einer Aminosäure Durch schrittweise Zugabe von HCl oder NaOH wird in einer wässrigen Lösung + die Konzentration von H -Ionen erhöht oder erniedrigt. Durch die chemischen Eigenschaften der gelösten Aminosäure können diese Veränderungen zum Teil abgefangen werden. Der pH-Wert bleibt streckenweise relativ konstant (Pufferkapazität) und schlägt erst an charakteristischen Punkten um. Lösungen: Analyse unbekannte Proteinlösung Protein-Standardlösung 10 g/l Biuret-Reagenz (in PVC-Flasche): 1,5 g CuSO4⋅5 H2O + 6 g Kalium-Natrium-Tartrat in 500 ml Wasser lösen; dazu 300 ml 10 %ige NaOH. Auffüllen auf 1 l. Zur Herstellung einer Eichkurve werden sechs Proben (0,0 (Leerwert); 0,4; 0,8; 1,2; 1,6 und 2 ml) einer Standard-Proteinlösung in Reagenzgläser pipettiert, und mit dest. Wasser auf 2 ml aufgefüllt. In zwei andere Reagenzgläser werden je 2 ml der Analysenlösung pipettiert. Alle Proben werden mit 8 ml Biuret-Reagenz gut gemischt und zur Ausbildung der Farbe 30 min stehengelassen. Gemessen wird in 1 cm-Küvetten bei 578 nm gegen den Leerwert (2 ml dest. Wasser und 8 ml Biuret-Reagenz). Denken Sie immer daran Doppelbestimmungen durchzuführen: Einzelmessungen haben oft Lotteriecharakter! Bei der Titration einer Aminosäure findet man mindestens zwei Umschlagspunkte (NH4+, COO-), je nach Seitenkette auch einen dritten. Die Titrationskurven von Arginin, Glutaminsäure und Glycin sind hier dargestellt. Achtung Fehlerquelle: Die Umschlagspunkte von Gly und Glu liegen sehr nahe beieinander! Markieren Sie bitte die entsprechenden pK-Werte der drei Aminosäuren in der Kurve und machen Sie sich bitte Gedanken darüber, warum die Kurven wie in der Abbildung 1-2 aussehen. Titration 2-11 1-12 Aminosäuren und Proteine I Aufgabe: Titration von drei unbekannten Aminosäuren mit NaOH Ausführung: pH 12 10 30 ml einer unbekannten Aminosäure-Lösung (5 g/l) werden in ein 100 ml Becherglas gegeben. Diese Lösung wird langsam auf dem Magnetrührer gerührt. Mit dem pH-Meter (Eichung: siehe Einleitung) wird durch Eintauchen der Elektrode in die Lösung der pH-Wert bestimmt (Vorsicht: Tief genug, aber nicht zu weit eintauchen, damit der Rührfisch nicht die Elektrode beschädigt). Glu Gly Arg 8 Aus einer 50 ml-Bürette wird in 1 ml Schritten 0,1 m NaOH-Lösung zugegeben bis pH 11 erreicht ist, mindestens aber 30 ml. Der pH-Wert wird nach jeder Zugabe abgelesen und in einer Wertetabelle festgehalten. 6 4 2 ml NaOH Anschließend werden Becherglas und Rührfisch mit demineralisiertem Wasser ausgespült und der Versuch mit der nächsten unbekannten Aminosäure-Lösung wiederholt. Auswertung: Abbildung 1-2: Die Titrationskurven von Arg, Gly und Glu Geräte: pH-Meter mit Elektrode Magnetrührer mit Teflonrührer Becherglas: 100 ml Vollpipette: 20 ml Büretten: 2 x 50 ml Lösungen: 3 unbekannte Aminosäure-Lösungen (saure Lösungen, 5 g/l) 0,1 M NaOH Die Messwerte werden auf Millimeterpapier grafisch dargestellt. Vergleichen Sie Ihre Kurven mit denen in Abb. 1-2 und geben Sie an, welche Analysen welchen Aminosäuren entsprechen (Ergebnisse in Liste eintragen). Anhand der Kurve können pK-Werte und pI-Werte abgeschätzt werden, die ebenfalls Rückschlüsse auf die eingesetzten Aminosäuren ermöglichen. Wo liegen sie? Welche chemischen Eigenschaften haben diese Aminosäuren? Aufgaben 2-13 Übungsaufgaben: 1. Nur isoelektrisches Lysin, Lys°, ist Substrat der Lysindecarboxylase a) Formulieren Sie die Ionenpaare bei pKa1 = 2,18; pKa2 = 8,95; pKa3 = 10,54 b) Wie groß ist [Lys°] einer 10-3 M Lösung bei pH = 7,6? 2. Formulieren Sie die Struktur des Peptids H2N-Tyr-Arg-Trp-Ile-COOH a) zu welchem Pol wandert das Peptid in der Elektrophorese bei pH 4? b) Welche Form der Arg-Seitenkette liegt bei diesem pH vor? (pKa1 = 2,17; pKa2 (α-NH2) = 9,04; pKa3 (Seitenkette) = 12,48 3. Histidin hat einen pKa3 = 6,1 a) Formulieren Sie die beiden Ionenspezies bei pH 7,4, und b) Bestimmen Sie das Verhältnis von basischer zu saurer Form 4. a) γ-Aminobuttersäure entsteht aus _________ durch_____________ b) Ihr isoelektrischer Punkt beträgt 7,3. Eine Lösung von γ-Aminobuttersäure enthält bei pH 3,25 10 % Zwitterion.Wie groß sind die pK-Werte pK1 und pK2? 5. Zeichnen Sie die Titrationskurve von 0,05 M Alanin-Hydrochlorid in wässriger Lösung bei Zugabe von 0,1 M NaOH. (Anfangs-pH = 0,5). pKa1 = 2,35, pKa2 = 9,78. Ordinaten quantitativ bezeichnen! 6. Zeichnen Sie die Titrationskurve von 1 l 0,02 M Glycin-Hydrochlorid in wässriger Lösung, deren Anfangs-pH = 0,5 ist, unter Zugabe von 0,1 M NaOH. pK1 = 2,25, pK2 = 9,77. a) Bezeichnen Sie die Ordinate (pH) und Abszisse (ml 0,1 N NaOH) für jeden Punkt exakt. b) Berechnen Sie mindestens zwei Messpunkte links und rechts vom berechneten isoelektrischen Punkt. 7. Geben Sie den Bereich des isoelektrischen Punktes eines sauren bzw. basischen Proteins an. 8. Wieviele Protonen kann Lysin ausgehend vom pH 1 maximal abgeben? Wieviele saure bzw. basische Funktionen enthält Lysin? 9. Geben Sie die relative Lage der folgenden Peptide an, die in einer Papierelektrophorese bei pH 7 aufgetrennt werden. A: Phe-Met-Gly, B: Leu-Gly-Arg und C: Glu-Ile-Ala. 1-14 Aminosäuren und Proteine I 10. a) Wie groß ist der pH-Wert einer 0,1 N HCl; einer 0,1 N NaOH; einer 0,1 N Essigsäure? b) Der pH-Wert des Blutes sei 7,4. Wie groß ist die [H+]? c) Wieviele H+/ml hat eine Lösung mit einem pH-Wert von 1,2? 11. a) Wieviel ml einer 28 %-igen HCl (Gew. %, MG = 36,5 g/mol, Dichte 1,15 g/ml) benötigt man, um 2 l einer 0,4 M HCl herzustellen? b) Wieviel ml 0,15 M KOH sind zur Neutralisation 180 g H2SO4 erforderlich? MG H2SO4 = 98 g/mol; MG KOH = 56 g/mol c) Wieviel ml 0,025 M H2SO4 benötigt man, um 525 ml 0,06 M KOH zu neutralisieren? 12. Die Pufferkapazität ist definiert als die Anzahl mol H+, die den pH-Wert eines Liter Puffers um 1 verändert. Berechnen Sie die Pufferkapazität eines 0,3 M Acetatpuffers von pH = 5,0 in saurer Richtung. Ka = 1,9 x10-5 mol/l 13. Tris Puffer: H2N-C(CH2OH)3 → H3N+-C(CH2OH)3 Sie sollen 500 ml eines 0,1 M Tris-Puffers vom pH 7,4 aus fester Tris-Base (MG = 121 g/mol, pK = 9) und 33 %-iger HCl (Gew. %; Dichte 1,165 g/ml) herstellen. Wieviele g bzw. ml benötigen Sie von jeder Komponente? 14. Wieviel g Glycin und wieviel g NaOH benötigen Sie, um einen 5 Liter eines 0,05 M Glycin-Puffers mit einem pH-Wert von 9,6 herzustellen? (pK1 = 2,5; pK2 = 9,6) 2-1 Versuch 2: Aminosäuren und Proteine II Versuche: SDS-Polyacrylamidgelelektrophorese Western-Blot Proteinstrukturen (Teil I+ II) Analyse: Molekulargewichtsbestimmung eines Proteins Wissensgebiete Funktion von Proteinen: Enzyme, Transportmoleküle, Strukturelemente, 2-2 Aminosäuren und Proteine II Proteolytischer Verdau Medizinische Bedeutung: Proteolytische Prozesse sind für eine Vielzahl physiologischer Funktionen essentiell: z.B. wird die Blutgerinnung durch eine Kaskade von proteolytischen Schritten reguliert, durch die Enzyme (Zymogene) aktiviert werden und letztendlich aus Fibrinogen das unlösliche Fibrin entsteht. Hämophilie kann durch das Fehlen oder die Mutation eines der beteiligten Proteine, z.B. Faktor IX genannt, hervorgerufen werden. Ein weiteres Beispiel ist die Aktivierung von Prohormonen wie Proinsulin oder Wachstumsfaktoren durch Abspaltung eines Peptides. Proteasen besitzen mehr oder weniger breite Spezifitäten für gewisse Peptidbindungen. In diesem Versuch sollen Sie die entstehenden Spaltprodukte von Albumin aus Ei (Ovalbumin) und aus Serum nach Verdau mit Chymotrypsin analysieren. Ovalbumin (OV) und Serumalbumin (SA) wurden vom Assistenten mit Chymotrypsin verdaut. Die Proteinfragmente werden am heutigen Versuchstag mit Hilfe der SDS-Polyacrrylamidgelelektrophorese getrennt und die Gele mit Coomassie angefärbt. Antikörper, Hormone Proteasen: ihre Bildung, Vorkommen, pH-Optimum Spezifitäten: Warum spaltet Pepsin nicht bei pH7? Ionenaustauscherchromatographie von Proteinen Lipoproteine, Klassifizierung und Komponenten, Trennmethoden und Pathobiochemie Unter Ionenaustauscher-Chromatographie versteht man eine Methode, bei der ein Beispiele von Proteinen mit Kofaktoren (prosthetischen Gruppen) lösliches Ion gegen ein gleich geladenes Ion an einer unlöslichen Trägersubstanz Posttranslationale Modifikationen ausgetauscht wird. Die im Labor verwendeten Ionenaustauscher sind unter Sequenzanalyse anderen synthetische Träger, z. B. Polymere auf Polystyrolbasis (mit Quervernetzung). Häufig eingesetzt werden auch modifizierte Zuckerpolymere. Die Kationenaustauscher enthalten Sulfonsäure (–SO3H), Carboxyl- (–COOH) oder phenolische Gruppen als funktionelle Gruppe. Nach der Dissoziationskonstante (pK) der ionischen Gruppen unterscheidet man stark saure (–SO3H) und schwach saure (–COOH) Austauscher. Ionenaustauscherchromatographie 2-3 2-4 Aminosäuren und Proteine II Wirkungsweise von Ionenaustauschern: Die Affinität eines Ionenaustauschers für ein Protein hängt von der Natur der geladenen Gruppe auf dem Träger ab und von der Natur und Anzahl der geladenen Gruppen auf der Proteinoberfläche. Je größer die Zahl der Ladungen eines Ions, um so fester wird das Protein an den Austauscher gebunden. Kationenaustauscher: Die Konzentration der Ionen, die Ionenstärke, beeinflusst ebenfalls die Bindung. Die Anionenaustauscher enthalten basische Gruppen, z. B. –N+(CH3)3 (stark basisch) oder –N+H(CH3)2 (schwach basisch). In der Praxis spielen u.U. auch die Proteingröße und die Quervernetzung (Größe der Löcher im Träger) eine Rolle. Die Ionenstärke wird berechnet nach: Träger - SO 3 Na Träger + I= - + SO 3 Protein + Protein+ + Na+ Das auf die mit Kationenaustauscher (Na+-Form) gefüllte Säule gegebene positive Ion, in diesem Falle Protein+, wird gegen das Na+ ausgetauscht. Natriumionen erscheinen im Eluat der Säule. Anionenaustauscher: Träger Träger CH2 + H3C N CH3 OHCH3 + Protein- CH2 + H3C N CH3 Protein CH3 + OH Das OH- der quarternären Ammoniumbase des Austauschers wird z. B. durch Protein- ausgetauscht. 1 2 ∑ c⋅z2 (c = Konzentration; z = Ladungszahl) Ionenaustauscher werden für viele Zwecke in der Medizin, Biochemie und Technik verwendet: Als Medikament zum Natriumentzug; zur Herstellung Ca2+armer Milch in der Diätetik; als Diagnostikum zur sondenlosen Funktionsprüfung der Magensaftsekretion. In der Biochemie werden Ionenaustauscher zur chromatographischen Trennung einer Vielzahl von Molekülen verwendet, z.B. von Proteinen oder Aminosäuren. In großem Umfang werden Ionenaustauscher zum Entsalzen von Lösungen, insbesondere zur Wasserenthärtung, verwendet. Der pI von Peptiden und Proteinen ergibt sich aus dem Verhältnis aller dissoziierbaren Gruppen. Die pI-Werte von Proteinen mit einem überwiegenden Anteil an sauren Aminosäuren liegen im sauren pH-Bereich; Proteine mit einem größeren Anteil an basischen Aminosäuren haben ihre pI-Werte im alkalischen. Liegt der pH-Wert einer Pufferlösung unterhalb des pI-Wertes eines Proteins ist die Gesamtladung des Proteins positiv; liegt er oberhalb, ist die Summe der Ladungen negativ. Im folgenden Versuch werden humane Plasmaproteine (siehe Tabelle 2.2) verwendet, die durch Anionenaustausch-Chromatographie auf DEAE-Sephacel aufgetrennt wurden. (Versuch wurde bereits vom Assistenten durchgeführt). DEAE-Sephacel ist ein schwach basischer Anionenaustauscher aus Diethylaminoethyl (DEAE = -O-CH2CH2N+H(CH2CH2)2) substituierter Cellulose. Cellulose dient hier als Trägermaterial; die Trennung der Proteine erfolgt über ionische Wechselwirkungen mit den positiv geladenen DEAE-Gruppen in Abhängigkeit vom pH-Wert und der Ionenstärke des Puffers. SDS-PAGE 2-5 Unter den Startbedingungen der Chromatographie (pH 8,6) sind die Plasmaproteine negativ geladen und werden über elektrostatische Wechselwirkungen an den Ionenaustauscher gebunden. Die Elution der Immunglobuline (pI 8,3) erfolgt bei pH 7,0. Unter diesen Bedingungen bleiben die übrigen Plasmaproteine aufgrund ihrer niedrigeren pI-Werte (z.B. Albumin pH 5,6) an die Säule gebunden und können anschließend bei pH 4,2 eluiert werden. Die Analyse der Eluate) in der SDS-Polyacrylamidgel Elektrophorese (SDS-PAGE). I. SDS-Polyacrylamidgelelektrophorese Medizinische Bedeutung: Polyacrylamidgelelektrophorese (PAGE) gehört zu den wichtigsten biochemischen Untersuchungsmethoden. PAGE eignet sich sowohl zum Nachweis der Reinheit von Proteinen als auch zum Nachweis von Enzymmustern bzw. Proteinmustern. Desweiteren wird sie für Analyse der Größe von DNA-Fragmenten verwendet wie z.B. für Sequenzierung oder die Analyse von Mutationen in vererbbaren Krankheiten. Die hier durchzuführende SDS-PAGE ist eine spezielle Methode zur Analyse von Proteinen. Grundlagen: SDS (Sodiumdodecylsulfat) ist ein anionisches Detergenz, das die Proteine in der Probe denaturiert und an diese denaturierten Proteine bindet. Die Proteine werden somit unabhängig von ihrem pI-Wert negativ geladen und wandern zur Anode. Die Wanderung wird dann nur noch von der Größe der Proteine bestimmt, die durch den Molekularsiebeffekt des Polyacrylamidgeles zu einer unterschiedlichen Wanderungsstrecke führt. Acrylamid ist das Material der Wahl, um Proteine nach Größe elektrophoretisch zu trennen. Das Acrylamid bildet zusammen mit Bisacrylamid ein quervernetzes Netzwerk, wenn ein Radikalstarter zugesetzt wird. Bei Verwendung von hohen Konzentrationen an Acrylamid und Bisacrylamid erhöht man den Grad der Quervernetzung und verringert die Porengröße, so dass kleine Proteine gut aufgetrennt werden. Für große Proteine verwendet man niedrigprozentige Gele. 2-6 Aminosäuren und Proteine II Um eine optimale Auflösung der Proteine zu erhalten, werden zweischichtige Gele verwendet. Den unteren Teil nennt man Trenngel, den oberen Sammelgel. Letzteres hat eine geringe Konzentration an Acrylamid und einen anderen pHWert. Dies erlaubt es den Proteinen einer Probe sich in scharfen Banden zu „sammeln“, bevor sie im Trenngel aufgetrennt werden. Aussagen über intra- oder intermolekulare Disulfidbrücken in Proteinen kann man erhalten, wenn man die Proben vor Auftrag auf das Polyacrylamidgel mit βMercaptoethanol reduziert und mit nicht reduzierten Proben vergleicht. Geräte: Mighty Small Elekrophorese Kammer Materialien: SDS-Polyacrylamid-Gele, gebrauchsfertig, 10% Acrylamid Laufpuffer: 20 mM Tris, 192 mM Glycin, 0.1% SDS, pH 8.3 Probenpuffer nicht-reduzierend: (4fach): 8% SDS, 40% Glycerin, 0.1%Bromphenolblau, 250mM TRIS/HCl, pH 6.8, Probenpuffer reduzierend: (4fach): wie nicht-reduzierend, plus 10% β-Mercaptoethanol Coomassie-Färbelösung: 0.2%Coomassie Blue R250 in 50%MeOH, 5% HOAc Entfärbelösung: 40% MeOH, 7% HOAc Fixierlösung: 7% HOAc SDS-PAGE 2-7 Aufgaben: 1. Die Fraktionen der Ionenaustauscherchromatographie (vorbereitet) sollen im reduzierten und nichtreduzierten Zustand aufgetrennt und die Hauptbanden anhand ihres Molekulargewichtes identifiziert werden. 2. Als Analyse soll das Molekulargewicht eines unbekannten Proteines bestimmt werden. 3. Unbehandeltes und mit Chymotrypsin behandeltes Serumalbumin und Ovalbumin (vorbereitet) sollen aufgetrennt und die Molekulargewichte der auftretenden Banden bestimmt werden. 4. Milchproteine sollen aufgetrennt und identifiziert werden. 5. Plasma und zwei Fraktionen der Ionenaustauscherchromatographie der Plasmas sollen aufgetrennt werden, um sie für den immunologischen Nachweis von IgG in Versuch 5 auf Nitrocellulose zu blotten. Durchführung: 1. Probenvorbereitung: Jeweils 15 µl Probe werden mit 5 µl Probenpuffer (reduzierend bzw nicht reduzierend) in einem Eppendorf-Reaktionsgefäß versetzt (gelbe Pipettenspitzen verwenden), 5 min bei 100°C inkubiert und kurz abzentrifugiert. 2. Gelaufbau: Da nicht polymerisiertes Acrylamid toxisch ist, erhalten Sie gebrauchsfertige, auspolymerisierte Gele. Diese 1 mm dicken Gele wurden zwischen zwei Glasplatten auspolymerisiert und verbleiben während der Auftrennung auch zwischen den Glasplatten. Im Sammelgel befindet sich ein Kamm. Wird dieser aus dem Gel herausgezogen, ergeben sich Aussparungen, in die die Proteinproben aufgetragen werden. • Die Gele müssen Sie mittels zweier roter Klammern in die Laufkammern einsetzen, durchsichtige Seite nach vorne. Beachten Sie, dass zwei verschiedene Gele verwendet werden. Gel 1 hat eine Trenngelkonzentration von 10% Polyacrylamid, Gel 2 von 15%. • Die Gelkammern mit Laufpuffer befüllen. • Die Markierungsschablone auf der Glasplatte am Kamm ausrichten und den Kamm vorsichtig herausziehen. 2-8 Aminosäuren und Proteine II • Die vorbereiteten Proben werden mit den speziellen ausgezogenen Spitzen (farblos) langsam in die Taschen eingefüllt. Die Molekulargewichtsmarker können direkt, ohne Zugabe von Probenpuffer, aufgetragen werden (20µl). Beladung des Gels 1: (Fraktionen der Ionenaustauscherchromatographie) Gel 1, 10% 1 2 3 4 10 11 12 13 14 15 F0 F1 F2 F3 F4 F5 leer leer F0 F1 F2 F3 F4 F5 M nr nr r r r r r W nr nr 5 nr 6 7 8 9 nr r Beladung des Gels 2: Molekulargewichtsmarker MW, Analysen zur Molekulargewichtsbestimmung, proteolytische Verdaus von Serumalbumin (SA1, SA2) und Ovalbumin (OV1,OV2) und den Serum/Plasma Proben für den Westernblot. Achtung: Bis auf Proben Nr. 10-12 alle Proben reduzieren! Gel 2, 15% 1 2 3 4 5 6 7 8 9 10 F0 M Ana- Ana- S S O O Milch- leer W lyse lyse A A V V pulver 2 1 2 1 2 1 11 F5 12 F3 13 14 15 leer F3 M W r r r r r r r nr nr nr r • Gelkammerdeckel aufsetzen (auf die richtige Polung achten), Elektrophorese starten. 160 V, 200 mA, Dauer ca. 1 h, bis Blaumarker am unteren Ende des Gels angelangt ist. • Spannung abschalten, Deckel abnehmen. • Mit der grossen 50 ml Spritze Gelpuffer in der Kammer abziehen (Ausguss) und die Gele herausnehmen. • Seitliche Trennstücke herausziehen und Glasplatte vorsichtig vom Gel trennen. Das Gel 2 mit den Analysen und den Proben für den Westernblot mit einem Skalpell in Spur 9 durchschneiden. Die Verwendung des Gelstückes für den Westernblot wird unter B) beschrieben. Das Gelstück mit den Analyseproben SDS-PAGE 2-9 2-10 Aminosäuren und Proteine II 1 GSIGAASMEF CFDVFKELKV HHANENIFYC PIAIMSALAM VYLGAKDSTR 51 TQINKVVRFD KLPGFGDSIE AQCGTSVNVH SSLRDILNQI TKPNDVYSFS 101 LASRLYAEER YPILPEYLQC VKELYRGGLE PINFQTAADQ ARELINSWVE 151 SQTNGIIRNV LQPSSVDSQT AMVLVNAIVF KGLWEKAFKD EDTQAMPFRV 201 TEQESKPVQM MYQIGLFRVA SMASEKMKIL ELPFASGTMS MLVLLPDEVS • Entfärbelösung in entsprechende Recyclingflasche abgießen und Fixierlösung zugeben. 251 GLEQLESIIN FEKLTEWTSS NVMEERKIKV YLPRMKMEEK YNLTSVLMAM 301 GITDVFSSSA NLSGISSAES LKISQAVHAA HAEINEAGRE VVGSAEAGVD • Zusammen mit dem Assistenten das Gel mit der Videokamera fotografieren. 351 AASVSEEFRA DHPFLFCIKH IATNAVLFFG RCVSP Auswertung: Chymotrypsin schneidet normalerweise hinter aromatischen Aminosäuren. Wieviele Fragmente würden sie ausgehend von der Sequenz erwarten? Wie erklären Sie die im Gel aufgetretenen Banden? und das Gel 1 mit den Ionenaustauscherfraktionen wird in eine Plastikschale zu ungefähr 75ml (halbvolle Schale) Coomassie-Färbelösung gegeben und 15 min auf dem Schüttler gefärbt. • Dann das Gel ~1 h in Entfärbelösung entfärben. Dazu Coomassie-Lösung in entsprechende Recyclingflasche zurückfüllen, Gel kurz mit Wasser abspülen und Entfärbelösung zugeben. 1. Ionenaustauscherchromatographie von Plasma: Beschreiben Sie die Hauptbanden in den verschiedenen Fraktionen und wie sich das Molekulargewicht dieser Fraktionen bei Reduktion verhält. 2. Messen Sie die Laufstrecken der Markerproteine und ihres Analysenproteins exakt aus. Die Markerproteine sind: Phosphorylase B 97400 Da Serumalbumin 67000 Da Albumin aus Ei 45000 Da Carboanhydrase 29000 Da Lactalbumin 14200 Da Tragen Sie die Laufstrecke gegen der Logarithmus des Molekulargewichtes auf und verbinden Sie die Punkte. Berechnen Sie das Molekulargewicht ihres Analysenproteins. Wichtig ist, dass Sie alle Markerbanden auf dem Gel erkennen und eindeutig zuordnen können. Zwei Probleme können auftreten: 1. Das Lactalbumin kann aus dem Gel herausgelaufen sein. 2. Abbaubanden der übrigen Markerproteine entstehen. Bei Unklarheiten bitte Assistenten befragen. Tipp: Serumalbumin-Bande als Anhaltspunkt benutzen! 3. Verfahren Sie analog mit Ovalbumin und dem mit Chymotrypsin geschnittenen Ovalbumin. Die Aminosäuresequenz von Ovalbumin lautet: 4. Beschreiben Sie die Hauptproteinbanden der Milchproteine. Welche Funktion haben die Proteine der Milch? Tabelle 2-1: Ein-Buchstaben-Code der Aminosäuren A Ala Q Gln L Leu S Ser R Arg E Glu K Lys T Thr N Asn G Gly M Met Y Tyr D Asp H His F Phe W Trp C Cys I Ile P Pro V Val SDS-PAGE 2-11 Präalbumin) Albumin 0,15 - 0,30 Männer 0,20 - 0,30 Aminosäuren und Proteine II II. Blotting der Proteine auf Nitrocellulose (Vorbereitung für Versuch 5) Tabelle 2-2: Wichtige Proteine des Blutplasmas (g/l) Frauen 2-12 Kinder 0,04 - 0,12 38,00 -51,00 40,00 - 52,00 28,00 - 41,00 Grundlagen: Dieser Versuch ist die Vorbereitung für den immunologischen Versuch 5. Die medizinische Bedeutung ist dort erläutert. Proteine, die mittels SDS-PAGE getrennt wurden, werden in dem sogenannten Blotting-Verfahren auf Nitrocellulose übertragen, auf der dann immunologische Nachweise durchgeführt werden können. Die Übertragung erfolgt wie bei der SDS-PAGE elektrophoretisch, d.h. die mit SDS beladenen Proteine werden von einem elektrischen Feld aus dem Gel heraus auf die Nitrocellulose-Membran transferiert. Da die Proteine negativ geladen sind, ist beim Aufbau der Transfereinheit darauf zu achten, dass sich die Nitrocellulose auf den Anodenseite befindet. α1-Antitrypsin 0,95 - 1,85 0,85 - 1,85 0,60 - 1,60 Orosomukoid 0,50 - 1,00 0,55 - 1,15 0,10 - 0,40 α2-Makroglobulin 2,05 - 4,30 1,80 - 3,40 2,35 - 5,30 Haptoglobin 0,50 - 2,70 0,55 - 3,20 < 0,20 Ceruloplasmin 0,25 - 0,55 0,20 - 0,45 0,05 - 0,25 Nitrocellulose Transphor Blotting Kammer Transferrin 1,65 - 2,90 1,54 - 2,75 0,90 - 1,90 Lösungen: Hemopexin 0,60 - 0,95 0,65 - 0,95 0,04 - 0,30 C3-Komplementfaktor 0,80 - 1,85 0,90 - 1,90 0,70 - 1,15 C4-Komplementfaktor 0,20 - 1,00 0,30 - 1,25 Fibrinogen 1,90 - 4,70 1,80 - 4,50 IgG 7,20 - 15,50 6,70 - 14,70 5,50 - 12,70 IgA 0,50 - 3,00 0,50 - 3,00 < 0,10 IgM 0,20 - 2,10 0,15 - 1,20 0,02 - 0,12 Geräte: Transferpuffer: 50 mM Borsäure pH 8.5, 5% Methanol Ponceau S TBS + Tween TBS + 5% Milchpulver Durchführung: 1. Blotten: Nach Beendigung der Gelelektrophorese wird das für den Western-Blot vorgesehene Gelstück (Spur 10-15)-in eine Schale gelegt, die Transfer-Puffer enthält. Die Halterung für die Blotapparatur wird in eine Photoschale getaucht, die ebenfalls Transfer-Puffer enthält. Dabei ist auf folgende Anordnung zu achten: • Die Halterung wird mit der grauen Seite (zukünftige Anode) zuunterst in die Schale gelegt (Abb. 2-1). • Auf diese wird nacheinander ein Schwamm, ein Whatman-Papier, die Nitrocellulose-Membran (mit Namen beschriften!), das Gel, wieder ein Whatman-Papier, ein Schwamm und zuletzt die schwarze Seite (zukünftige Western-Blot 2-13 Kathode) der Halterung aufgelegt und eingerastet. Die einzelnen Schichten müssen jeweils luftblasenfrei aufgelegt werden. • Dieser Sandwichaufbau wird in die Blotkammer überführt (Anode zu Anode, Kathode zu Kathode) und eine Stunde lang bei 1000 mA geblottet. Abbildung 2-1: Schale mit schematischem Aufbau des Blot-Sandwiches 2-14 Aminosäuren und Proteine II III. Dreidimensionale Strukturen von Proteinen Dieser Teilversuch soll Ihnen einen Einblick in die dreidimensionale Struktur von Proteinen vermitteln. Die 3D-Struktur von Proteinen kann mittels Röntgenkristallographie oder Kernresonanzspektroskopie (NMR) gelöst werden. Für die Röntgenkristallographie muss man Proteinkristalle (ungefähr 1mm3) züchten, in denen die Proteine wie in einem Kochsalzkristall in einer definierten Anordnung sitzen. Diese Kristalle werden mit einem Röntgenstrahl bestrahlt und aus dem Beugungsmuster des Strahles kann man die exakten Koordinaten aller Atome des Proteins berechnen. Aufgrund der Wellenlänge des üblicherweise verwendeten Röntgenlichtes können Wasserstoffatome nicht detektiert werden. Die Kernresonanzspektroskopie erlaubt die Auflösung von Proteinstrukturen in wässriger Lösung. Die Proteine werden in ein Magnetfeld gebracht und mit einem Radiowellen bestrahlt. Die Strahlung regen die Atomkerne bei einer Resonanzfrequenz an. Die Resonanzenergie, die von den Atomkernen nach der Anregung wieder abgegeben wird, wird detektiert und zur Berechnung der Koordinaten der Atome verwendet. Zur Zeit ist die Anwendung der Kernresonanzspektroskopie auf Proteine mit einem Molekulargewicht kleiner 40 kDa limitiert. Auch Elektronenmikroskopie wird zur Strukturanalyse verwendet, die Auflösung ist jedoch wegen der geringeren Energie der Elektronen viel schlechter und nur die Umrisse von Proteinen können so sichtbar gemacht werden. Medizinische Bedeutung: 2. Ponceau S-Färbung (Zum Anfärben der Markerproteine): • Durch Zugabe von 10 ml Ponceau S werden die Proteine auf der Membran reversibel gefärbt, die Proteine des Markers werden mit Kugelschreiber vorsichtig markiert. • Die Membran wird mit 25 ml TBS/Tween wieder vollständig entfärbt. • Die Membranen werden eine Stunde lang in 5% Milchpulver geschüttelt, um alle noch freien Proteinbindungsstellen zu blockieren. • Das Milchpulver wird mit TBS abgewaschen und die beschrifteten Membranen bis zum Versuch 5 eingefroren. Einblicke in die Struktur von Proteinen tragen essentiell zum Verständnis molekularer Vorgänge bei. Viele vererbbare Krankheiten werden durch einzelne Punktmutationen in einem Gen hervorgerufen, die im Protein zum Austausch einer Aminosäure führen. Warum diese mutierte Aminosäure einen Phänotyp hervorrufen kann, kann oftmals nur anhand der dreidimensionalen Struktur verstanden werden. So sitzt z.B. die eingetauschte Aminosäure Valin im Sichelzellhämoglobin auf der Oberfläche des Proteins und passt in eine hydrophobe Tasche eines zweiten Hämoglobins. Dies führt zu einer Polymerisation des Hämoglobins und der charakteristischen Sichelzellform der Erythrozyten. Proteinstrukturen 2-15 Große Hoffnungen werden z.Z. auf das spezifische Design von Pharmaka anhand der Struktur der Zielproteine gesetzt, dies zeigt sich z.B. daran, dass alle großen pharmazeutischen Firmen Strukturlabors unterhalten. Man versucht z.B. spezifische Inhibitoren für Proteasen aus HIV zu entwickeln, indem man gewisse Aminosäuren eines bekannten, aber schwach bindenden Inhibitors am Computer austauscht und untersucht, ob so zusätzliche Bindungen zwischen der Proteinase und dem Inhibitor gebildet werden. Grundlagen: Die grundlegende Bindung in Proteinen ist die Peptidbindung zwischen der Aminogruppe und der Carbonsäuregruppe zweier Aminosäuren. Die Bindung zwischem dem Kohlenstoff und dem Stickstoff hat aufgrund ihres mesomeren Charakters Doppelbindungscharakter und deshalb sind alle Peptidbindungen planar (die vier Atome C, O, N und H liegen in einer Ebene). - O ¦ O | ←→ Aminosäuren und Proteine II Die Interaktion benachbarter Aminosäuren führt auf einer ersten Ebene zur Ausbildung von sogenannten Sekundärstrukturen, wie α-Helices, β-Faltblättern, βturns u.a.. Diese kommen durch Wasserstoffbrücken zwischen den Sauerstoff- und den Wasserstoffatomen der Peptidbindung zustande. Welche Sekundärstruktur dabei von einem Peptidstück angenommen wird, hängt von der Natur der Seitenketten (Größe, Ladung) ab, die die relativen Stellungen der Peptidbindungen zueinander bestimmt. Je nach Verdrehung der aufeinanderfolgenden planaren Peptidbindungen ergeben sich so α-Helices, β-Faltblätter usw. Die nächste Ebene, die Tertiärstruktur, beeinhaltet die räumliche Anordnung der Sekundärstrukturen. Diese wird durch die Wechselwirkung der Sekundärstrukturelemente bestimmt. An diesen Interaktionen sind sowohl das Peptidrückgrat als auch die Seitenketten beteiligt (ionische, van der Waals-, und Wasserstoff-Brücken-Bindungen). Im Falle von multimeren Proteinen, d.h. solchen die aus mehreren Untereinheiten aufgebaut sind, gibt es eine weitere strukturelle Ebene, die Quartärstruktur. Mit ihr wird die räumliche Anordnung der Tertiärstrukturen der Untereinheiten beschrieben. + -C-N| -C=N | H Denaturierung H Das sogenannte Rückgrat der Proteine ergibt sich aus der Abfolge der planaren Peptidbindungen, die jeweils durch das α-C-Atom, das die Seitenkette trägt, getrennt sind. Die Bindungen zum α-C-Atom sind drehbar: H O H O H O H O | ¦ | ¦ | ¦ | ¦ -N——C——C——N——C——C——N——C——C——N——C——C| | | | | | | | H R H R H R H R AS1 2-16 AS2 AS3 AS4 Sekundär-, Tertiär- und Quartärstrukturen der Proteine sind nicht unter allen Bedingungen stabil. Unter Denaturierung versteht man die Auflösung aller dieser Strukturen, so dass das Protein als ungefaltete Polypeptidkette vorliegt. Dies kann u.a. durch Temperaturerhöhung, pH-Wert-Änderung, Ionenstärkeänderung oder sogenannte chaotrope Reagentien wie z.B. Harnstoff geschehen. So ist eine der Hauptfunktionen der Salzsäure neben ihrer bakteriziden Wirkung die Denaturierung von Proteinen im Magen. Im ersten Teil dieses Versuchs werden Ihnen vom Assistenten verschiedene Sekundärstrukturelemente und einige Proteine mit Hilfe des Programmes Rasmol vorgestellt. Im zweiten Teil sollen Sie als Analyse eine Sekundär-, Tertiär- und wenn vorhanden - Quartärstruktur-Beschreibung eines kleinen Proteins vornehmen. Proteinstrukturen 2-17 Ausführung: Das Programm Rasmol ermöglicht es, 3-dimensionale Strukturen zu bewegen, zu drehen und einzelne Elemente getrennt anzuschauen. Beim Öffnen des Programmes öffnet sich zum einen das Fenster (Rasmol Version 2.6 in oberster Zeile), in dem die Struktur dargestellt wird und ein zweites Fenster (Rasmol Command Line), in dem man vordefinierte Programme erstellen und abrufen kann. Übersicht über die wichtigsten Befehle im Rasmol Version 2.6- Fenster (mit der Maus anzuwählen) Display-Modus: Rasmol erlaubt 7 Darstellungsformen, davon sind 3 interessant: alle Atome, Stabform 1. Sticks: 2. Spacefill: alle Atome in Kugelform: zeigt die Oberfläche eines Proteins 3. Cartoons schöne Darstellung der Sekundärstrukturelemente Colours: Hier sind drei Darstellungen wichtig: 1. CPK: Standardfärbung: O rot, N blau, C grau, S gelb, H weiß 2. Chain: färbt in multimeren Proteinen die einzelnen Untereinheiten verschieden 3. Structure: färbt α-Helices rot, β-Stränge gelb, β -turns (Schleifen) blau, random (ungeordnet) grau: 1. Öffnen einer Struktur: • Vom Assistenten erhalten Sie einen Dateinamen, unter dem das Protein, das Sie analysieren sollen, abgespeichert ist. • Mit der Maus: File Open, dann entsprechendes File auswählen. • Mit der Maus: Display Cartoon: • Mit der Maus: Colour Structure: • In dieser Darstellung sollen Sekundär-, Tertiär- und Quartärstruktur beschrieben werden. 2-18 Aminosäuren und Proteine II • Vor dem Öffnen einer neuen Struktur, alte Struktur schließen mit: File Close 2. Drehen einer Struktur: Mit linker Maustaste Struktur anklicken und mit festgehaltener Taste ziehen 3. Verschieben einer Struktur: Mit rechter Maustaste Struktur anklicken und mit festgehaltener Taste ziehen 4. Zoomen: a) Vergrößern: Shift-Taste gedrückt halten und mit linker Maustaste auf die Struktur klicken und nach unten ziehen. b) Verkleinern: Shift-Taste gedrückt halten und mit linker Maustaste auf die Struktur klicken und nach oben ziehen. Proteinstrukturen 2-19 Aufgabe: Bestimmung der Struktur eines Proteins Sie sollen die Sekundär, Tertiär- und -wenn vorhanden- die Quartärstruktur eines Proteines beschreiben. Sie erhalten vom Assistenten die Nummer eines Proteins und öffnen dies mit Hilfe des Programmes Rasmol. Durchführung (s.o.). Die Beschreibung der Strukturelemente im Protokollheft wird durch den Assistenten überprüft. 2-20 Aminosäuren und Proteine II Übungsaufgaben: 1. Wenn Sie ein Ei kochen, welche Art der Konformationsänderung der Proteine erfolgt dabei? 2. Geben Sie zwei Nachweismethoden für Proteine an. 3. Wie ist die Primär-, Sekundär-, Tertiär- und Quartärstruktur von Proteinen definiert? 4. Nennen Sie zwei Formen von Sekundärstrukturen von Proteinen. Beispielauswertung: Protein xxx: 5. Zwischen welchen chemischen Gruppen werden die Wasserstoffbrückenbindungen in der α-Helix von Proteinen gebildet? Sekundärstrukturelemente vom Amino- zum Carboxyterminus: 6. Zeichnen sie zwei aufeinander folgende Peptidbindungen einer Peptidkette. Welche Bindungen sind beweglich? H3N+-Helix-Schleife-Helix-Schleife-Faltblatt-Schleife-Faltblatt-Schleife-FaltblattCOO- 7. Was versteht man unter einem hydrophoben Kern eines Proteins? Welche Aminosäuren haben aromatische Reste? Tertiärstruktur: 8. Mit welchen Methoden kann man das Molekulargewicht eines Proteins bestimmen? Monomeres globuläres Protein, das aus zwei Helices und einem antiparallelen Faltblatt gebildet wird. Das β-Faltblatt besteht aus drei Strängen. 9. Nennen Sie je ein Protein aus dem Blutplasma mit: a) Transportfunktion, b) Abwehrfunktion, c) Enzymatischer Funktion 10. Wie wird Trypsin aktiviert? 11. Welche Rolle spielt Pyridoxalphosphat bei der Transaminierungsreaktion? 12. Welche zellulären Kompartimente sind am Harnstoffzyklus beteiligt? Welche beiden Möglichkeiten hat eine Aminosäure die Aminogruppe für die Harnstoffsynthese zur Verfügung zu stellen? Aufgaben 2-21 13. Sequenzanalyse eines Peptids: ↓ ↓ ↓ ↓ H2N-Ala-Met-Asp-Ile-Arg-Cys-Phe-Leu-COOH S ³ S H2N-His-Arg-Gly-Lys-Cys-Ser-Gly-COOH ↑ ↑ Schreiben Sie an den Pfeilen die zugehörigen Reagenzien. Mercaptoäthanol SH-CH2-CH2-OH Phenylisothiocyanat Phenyl-N=C=S Sangerreagenz: Fluoro-dinitro-benzol Dansylchlorid Bromcyan BrCN Proteasen: Trypsin, Chymotrypsin, Pepsin, Thermolysin, Thrombin, Carboxypeptidase, Aminopeptidase 14. Ein Peptid reagiert mit Dinitrofluorbenzol nur in der Seitenkette des Lysins des Peptids. Durch Thrombinspaltung (Thrombin schneidet zwischen ArgGly) entsteht ein Peptid der Stöchiometrie: Ala1 Tyr1 Gly1 Lys1 Ser1 Phe1 Arg1 Pro1 Mit dem Edman Reagenz wird aus diesem Gly PTH abgespalten. Schreiben Sie die Strukturformel des Derivats: Wird das Thrombin-gespaltene Peptid mit Trypsin behandelt, so entstehen zwei Peptide der Stöchiometrie: Ser1 Tyr1 Pro1 Arg1 und Phe1 Gly1 Ala1 Lys1 Chymotrypsin-Behandlung des Thrombin-gespaltenen Peptids liefert zwei Dipeptide mit der Zusammensetzung Gly1 Phe1 und Arg1 Ser1 und das übrige Tetrapeptid. Formulieren Sie die Sequenz des Peptids in der Dreibuchstaben-Schreibweise. 2-22 Aminosäuren und Proteine II 15. Die vollständige Hydrolyse eines Peptids ergibt: 1 Gly, 1 Ala, 2 Cys, 1 Lys, 1 Glu, 1 Ile, 1 Thr, 1 Phe, 1 Val Reduktion mit Mercaptoäthanol ergibt zwei kleinere Peptide A und B. A enthält: Ala, Cys, Glu, Gly, Ile, Lys Carboxypeptidase setzt Ile frei: Edman-Abbau mit Phenylisothiocyanat ergibt das PTH-Derivat von Gly im 1-Cyclus, Ala im 2-Cyclus. Trypsin setzt zwei Peptide frei: a) enthält Glu und Ile b) Ala, Cys, Gly, Lys B enthält: Cys, Phe, Thr, Val Carboxypeptidase setzt Val frei; Chymotrypsin: Val und ein Tripeptid mit Cys, Phe, Thr; Edman-Abbau ergibt PTH-Thr. Wie lautet die Sequenz des gesamten Peptids? 16. Ein Peptid hat die folgende stöchiometrische Zusammensetzung: 1 Ala, 1 Arg, 2 Asp, 2 Glu, 3 Gly, 1 Leu, 3 Val Die folgenden Peptide wurden nach partieller Spaltung isoliert: 1. Asp-Glu-Val-Gly-Gly-Glu-Ala 2. Val-Asp-Val-Asp-Glu 3. Val-Asp-Val 4. Glu-Ala-Leu-Gly-Arg 5. Val-Gly-Gly-Glu-Ala-Leu-Gly-Arg 6. Leu-Gly-Arg Wie lautet die Aminosäuresequenz des Ausgangspeptids? 3-1 Versuch 3: Enzyme Versuche: Enzymkinetik der sauren Phosphatase Acetylcholinesterase-Bestimmung im Serum Hemmung des Enzyms mit Diisopropylfluorophosphat (DIFP) Reaktivierung mit Pyridin-2-Aldoxim-Methyljodid (PAM) Laktatdehydrogenase (opt. Test) Wissensgebiete Einteilung der Enzyme in Enzymklassen Aktivierungsenergie Enzymsubstrat-Komplex Reaktionen 0. und 1. Ordnung, Reaktionsgeschwindigkeit, pH- und TemperaturEinfluss, Substrat- und Enzymkonzentrations-Diagramme, LineweaverBurk-Diagramme, kompetitive und nicht kompetitive Hemmung, Beispiele Km-Bestimmung, Substratspezifität, Hemmsubstanzen, Mechanismus der 3-2 Enzyme Einführung Bei reversiblen chemischen Reaktionen stellt sich ein Gleichgewicht ein. Im Gleichgewichtszustand ist die Geschwindigkeit der Hin- gleich der der Rückreaktion. Katalysatoren erhöhen die Reaktionsgeschwindigkeit und beschleunigen damit die Gleichgewichtseinstellung; sie beeinflussen aber nicht die Lage des Gleichgewichts. Enzyme sind Proteine, die als Katalysatoren fungieren. Die International Union of Biochemistry hat 1961 und 1964 Regeln für die Nomenklatur der Enzyme aufgestellt. Die Enzyme werden in sechs Hauptklassen eingeteilt, die jeweils gleiche chemische Reaktionstypen katalysieren. 1. Oxidoreduktasen übertragen Wasserstoff zwischen zwei Reaktionspartnern. Zu ihnen gehören die Dehydrogenasen, Hydroxylasen und Oxigenasen. 2. Transferasen katalysieren die Übertragung von Atomgruppen oder ganzen Molekülen zwischen zwei Reaktionspartnern. Untergruppen dieser Klasse sind die "Kinasen": Carboxyl-Transferasen, Amino-Transferasen, Glycosyl-Transferasen und Acyl-Transferasen. 3. Hydrolasen sind Ester-, Peptid- und Glycosylbindungen spaltenden Enzyme. Bekannte Enzyme wie Pepsin, Chymotrypsin, Trypsin, Renin und Papain gehören dazu. Hemmung, Wechselzahl Quantitative Bestimmung der enzymatischen Aktivität 4. Lyasen katalysieren die nichthydrolytische Spaltung kovalenter Bindungen: Decarboxylasen, Aldolasen, Dehydratasen. Einheit der Enzymaktivität: Katal (neu), Units (alt) Isoenzyme Multienzym-Komplexe und multifunktionelle Enzyme Regulation der Enzymaktivität, Allosterie, negative Rückkopplung, Beispiele 5. Isomerasen epimerisieren ein optisch aktives C-Atom oder racemisieren optisch aktive Verbindungen. Saure Phosphatase, Acetylcholinesterase, Neurotransmitter, Inhibitoren und Enthemmer Optischer Test (Formeln, optische Eigenschaften sowie Coenzymfunktionen von NAD+, NADP+ und FAD) Kombinierter optischer Test (Kofaktor-gekoppelte Reaktion) 6. Ligasen führen zur Verknüpfung zweier Substratmoleküle unter gleichzeitiger Spaltung von ATP in AMP und Pyrophosphat. Wichtige Vertreter dieser Gruppe sind die Synthetasen, z.B. Aminoacyl-tRNS-Synthetasen, Acyl-CoASynthetasen oder auch die Carboxylasen. Die Enzymaktivität bestimmt man, indem man Enzyme und Substrat bei bestimmter Temperatur, bestimmtem pH-Wert, definierter Substrat- und Enzymkonzentration sowie in Gegenwart erforderlicher Kofaktoren inkubiert und die Reaktion in Abhängigkeit von der Zeit verfolgt. Enzymkinetik der sauren Phosphatase 3-3 Bei einer Reaktion 1. Ordnung hängt die Reaktionsgeschwindigkeit nur von der Konzentration des Substrats ab. Bestimmung der Geschwindigkeitskonstanten k einer Reaktion 1. Ordnung v = − v k = k⋅[S] dt d[ S] dS konstanter Substratkonzentration S (Überschuss). = k⋅dt v = [S] t = Substratkonzentration = Zeit Wenn x die Substratmenge ist, die in der Zeit t umgesetzt wurde, und a die Substrat-Anfangskonzentration bei t = 0 ist, so gilt: ∫ a − d[ S] dS Die enzymatischen Reaktionen sind Reaktionen 2. Ordnung: Die Reaktionsgeschwindigkeit hängt von Konzentrationen zweier Komponenten ab. Man kann die Behandlung dieses Systems vereinfachen, indem man: 1. Substrat im Überschuss einsetzt oder 1. Die Reaktionsgeschwindigkeit ist proportional der Enzymkonzentration E bei = Reaktionsgeschwindigkeit = Geschwindigkeitskonstante a−x Enzyme 2. die Enzymkonzentration konstant hält. d[ S] − 3-4 t -d[S] dt = k⋅[E]⋅[S] = k '⋅[E] [E] = Enzymkonzentration (mg Protein) Nimmt man pro Enzymmolekül eine Wirkgruppe an, so bezeichnet man die Anzahl von Substratmolekülen, die pro Molekül Enzym in einer Minute umgesetzt werden, als Wechselzahl oder "turn-over number" des Enzyms. (z.B.: Fumarase 105, Acetylcholinesterase 2 x 107 mol Substrat/mol Enzym x Min). 2. Abhängigkeit der Reaktionsgeschwindigkeit von der Substratkonzentration ∫ = k⋅ dt a = Anfangskonzentration des Substrats x = umgesetzte Substratmenge in der Zeit t 0 Hält man die Enzymkonzentration [E] konstant und steigert die Substratkonzentration [S], so erhält man folgendes Bild: v0 ln (a - x) - ln a= k⋅(t - 0) k ⋅ t = ln Bei der Halbwertszeit t t 1 2 = a a-x 1 2 ln 2 k a ist x = , daraus ergibt sich 2 II I III [S] Abbildung 3-1: Reaktionsgeschwindigkeit bei konstanter Enzym- und variabler Substratkonzentration Enzymkinetik der sauren Phosphatase 3-5 3-6 Enzyme Mit steigender Substratkonzentration wird ein Plateau erreicht, d.h. das Enzym ist mit Substrat gesättigt. Die maximale Reaktionsgeschwindigkeit ist erreicht, und eine weitere Zugabe von Substrat bei konstanter Enzymkonzentration steigert die Umsatzgeschwindigkeit nicht mehr. Eine solche zweiphasige Kurve kann man erklären, wenn man eine Komplexbildung zwischen Enzym und Substrat (Enzym-Substrat-Komplex, ES) annimmt, bevor das Reaktionsprodukt gebildet wird. Die abnehmende Reaktionsgeschwindigkeit (III) erklärt man durch Substrathemmung: Zu viele Substratmoleküle vermindern die Effizienz der Enzym-Substrat-Wechselwirkung. In der Praxis sind jedoch die beiden Extremfälle selten anzutreffen. Die Berechnung der Interaktion wird dadurch komplizierter. Unter Voraussetzung einer konstanten Konzentration des Enzym-Substrat-Komplexes beschreibt eine Gleichung von Michaelis und Menten die Wechselwirkung: k1 E + S ES k2 E + P k4 P = Reaktionsprodukt k1⋅[E]⋅[S] - k2⋅[ES] = k3⋅[ES] - k4⋅[E]⋅[P] Nettogeschwindigkeit der = Nettogeschwindigkeit des Zerfalls von [ES] Die Einführung der Konstanten Km (der Michaelis-Konstanten), der maximalen Reaktionsgeschwindigkeit vmax und die Umformulierung nach vo ergibt: 1 vo (y = m⋅x + b) = Km 1 1 • + v max v max S 1 Vmax – 1 Km 1 [S] Abbildung 3-2: Lineweaver-Burk-Plot 1 1 als Ordinate gegen als Abszisse auf, resultiert eine Gerade vo S 1 und die (Lineweaver-Burk-Plot). Die Gerade schneidet die Ordinate bei v max Trägt man k3 Bildung von [ES] 1 v0 Abszisse bei - Km 1 , ihre Steigung ist . Experimentell erhält man die Km v max Gerade durch Messungen der Anfangsgeschwindigkeit bei verschiedenen Substratkonzentrationen und konstanter Enzymmenge. Die reziproken Anfangsgeschwindigkeiten werden gegen die reziproken Substratmengen aufgetragen. Eine andere Darstellungsart der Gleichung erhält man, wenn man beide Seiten der Gleichung mit [S] multipliziert. Zeichnet man vo gegen [S] auf, so erhält man eine Hyperbel. Bei dieser Darstellungsart wird die Bedeutung von Km deutlich, die bei der Ableitung der Gleichung eingeführt wurde. Km ist demnach die Substratkonzentration, bei der vo = 1 2 vmax ist. Enzymkinetik der sauren Phosphatase 3-7 3-8 Enzyme I. Der optische Test: Bestimmung von Pyruvat v0 1 Vmax 2 Km [S] Abbildung 3-3: Abhängigkeit der Reaktionsgeschwindigkeit von der Substratkonzentration Vorbemerkung: Die Pyridinnukleotide NAD+ und NADP+ können reversibel Wasserstoff aufnehmen. Diese Fähigkeit bedingt ihre Funktion als Coenzym vieler Dehydrogenasen (Oxidoreduktasen). Bei der Hydrierung wird der aromatische Charakter des Nikotinsäureamid-Ringsystems aufgehoben. Das entstandene Dihydropyridin-Ringsystem besitzt eine spezifische Lichtabsorption mit einem Maximum von 340 nm, die bei NAD+ fehlt. 1,2 E NAD+ NADH 1,0 Geräte: Wasserbad 37 °C, mit Kontaktthermometer Einsatz für Reagenzgläser Filter-Photometer Filter 623 nm , 2 × 1 cm Küvetten Reagenzgläser 30, im Reagenzglasständer Vollpipetten 5 ml Messpipetten 1 ml, 5 ml Lösungen Enzym: 1 mg saure Phosphatase in 100 ml Wasser Phenol-Standard-Lösung: 0,5 mM Dinatriumphenylphosphat (DPP): 0,005 M, mit 2 N HCl auf pH 5,3 eingestellt. Ethylendiamin-Zitratpuffer: 0,1 M, pH 5,9 (0,1 M Lösung von Ethylendiamin, pH mit fester Zitronensäure einstellen). Na2CO3-Lösung: 7 %ig Folin-Reagenz: 1:1 mit Wasser verdünnt 0,8 0,6 0,4 0,2 0,0 200 300 400 nm 500 Abbildung 3-9: Absorptionsspektren von NADH und NAD+ Man kann daher die Umwandlung von NAD+ in NADH und umgekehrt mit dem Photometer messen (optischer Test). Die Konzentration des gebildeten bzw. verbrauchten NADH oder die Konzentration der entsprechenden Reaktionspartner der Enzyme werden mit Hilfe des Lambert-Beerschen Gesetzes berechnet. Enzymkinetik der sauren Phosphatase 3-9 Enzyme notiert. Dann werden 0,1 ml LDH zur Probenküvette gegeben und sofort in Abständen von 1 min die Extinktionen bei 340 nm über eine Dauer von 10 min gemmesen und notiert. 0,4 Extinktion 3-10 0,3 0,2 0,1 0 5 10 Zeit [min] 15 A Abbildung 3-10: Pyruvat-Bestimmung mit dem optischen Test Prinzip: Pyruvat (Pyr) wird von NADH in Gegenwart von Laktatdehydrogenase (LDH) nach folgender Gleichung zu L+-Laktat (Lakt) reduziert. Berechnung: Bei photometrischen Bestimmungen wird die Menge der unbekannten Probe mit Hilfe eines in seiner Menge bekannten Standardwertes oder mit Hilfe einer Eichkurve ermittelt. Hier steht als Messergebnis nur die Extinktionsdifferenz der unbekannten Lösung zur Verfügung. Man braucht deshalb die Angabe des molaren Extinktionskoeffizienten und die Volumina des Reaktionsansatzes und der darin enthaltenen Probemenge. Die Berechnung geht vom LambertBeer'schen Gesetz aus. Berücksichtigen Sie bei der Berechnung der Pyruvatkonzentration c (Einheit: mol/l) den Verdünnungsfaktor. ∆E=ε·d·c (∆Ε=ΕΑnfang-EEnde; ε = 6,22⋅103 mol-1⋅cm-1⋅l; d=1cm) CH3-CO-COO- + NADH + H+ → CH3-CH(OH)-COO- + NAD+ Berechnen Sie die Pyruvatkonzentration in g/l (MW Pyruvat = 88 g/mol). Die Gleichgewichtskonstante dieser Reaktion ist bei 25 °C: Tragen Sie in einer Graphik die Pyruvatkonzentration gegen die Zeit (min) auf. K = [Lakt] • [NAD + ] [Pyr] • [NADH] • [H + ] = 3,6 • 1011 l/mol Pyruvat wird praktisch vollständig zu Laktat reduziert. Lösungen: Citrat-Puffer pH 6,0 Laktat-Dehydrogenase: 0,025 ml Konzentrat (10 mg/2 ml) ad 10 ml H2O NADH-Lösung 1 mM Pyruvat Analysenlösung Ausführung: Das Photometer wird mit Wasser als Leerwert bei 340 nm auf 0,000 eingestellt. In eine 1 cm-Küvette werden 1,5 ml Citrat-Puffer pH 6,0; 0,2 ml Natriumpyruvatlösung und 0,2 ml 1 mM NADH pipettiert. Nach Mischen mit dem Plastikspatel wird die Extinktion viermal in Abständen von 1 min gemessen und Enzymkinetik der sauren Phosphatase 3-11 Die saure Phosphatase spaltet organische Phospatester bei einem pH-Optimum zwischen pH 4,5 bis 6,0. Sie ist ein lysosomales Enzym und kommt in allen Organen vor. Die im menschlichen Blutplasma enthaltenen sauren Phosphatasen stammen aus den verschiedensten Organen oder Zellen. Sie unterscheiden sich durch ihre Hemmbarkeit durch bestimmte Substanzen. So wird z.B. die aus der Prostata stammende saure Phosphatase selektiv durch L-Tartrat gehemmt, während die aus Erythrozyten, Knochen oder Milz stammende saure Phosphatase nicht durch L-Tartrat gehemmt wird. Aus der Differenz zwischen der Gesamtphosphataseaktivität des Serums und der tartratgehemmten Phosphatase lässt sich der Anteil der Prostata-Phosphatase im Serum berechnen. Medizinische Bedeutung: Die Gesamtphosphatase ist erhöht bei akuter myeloischer Leukämie, bei Leberparenchymschäden, bei Lipidspeicherkrankheiten, bei denen die Niere betroffen ist (Lipideinlagerung). Die mit L-Tartrat hemmbare spezifische ProstataPhosphatase ist erhöht bei Erkrankungen der Prostata (Karzinom, Entzündung). Im folgenden Versuch wird die Michaelis-Menten-Konstante der sauren Phosphatase aus Kartoffeln bestimmt. Als Substrat dient Dinatriumphenylphosphat (DPP). Das freigesetzte Phenol wird mit dem Folin-Ciocalteu-Reagenz quantitativ bestimmt. O P O O 2- 2 Na+ saure Enzyme 1) Standardkurve mit Phenol II. Enzymkinetik der sauren Phosphatase O- 3-12 Ausführung: In sechs Reagenzgläser pipettiert man jeweils 0; 0,1; 0,2; 0,3; 0,4 und 0,5 ml der 0,5 mM Phenol-Standardlösung und ergänzt die Proben mit Wasser auf ein Volumen von 1 ml. Die Probe, die nur Wasser enthält, dient als Leerwert. Dann gibt man zu jeder Probe 5 ml einer 10 %igen Na2CO3-Lösung. Die Proben werden gut durchgeschüttelt, anschließend mit 1 ml Folin-Reagenz versetzt und nach dem Durchmischen 15 min. bei Raumtemperatur stehengelassen. Die Extinktion wird bei 623 nm im Photometer abgelesen. Ausführung: Die Werte werden in Tabelle 3-1 eingetragen. Berechnen Sie die Phenolkonzentration (Einheit: mM) unter Einbeziehung des jeweiligen Verdünnungsfaktors und tragen Sie die Werte gegen die Extinktionen auf. Tabelle 3-1: Messergebnisse zur Anfertigung der Abb. 4-4 und 4-5 Glas -Nr µmol DPP/ ml 1 1 2 3 4 5 6 % Hydrolyse nach InkuE bation Eichkurv e E(gemessen) nach Min. 5 ∆5-1 10 15 1 5 10 15 0,0 0,5 1,0 1,5 2,0 2,5 OH Phosphatase 2) Bestimmung der Michaelis-Konstanten + HPO 42- +2 Na + Ausführung: Vorbereitend beschriftet man 24 Reagenzgläser (Angaben im Seminar beachten!) und pipettiert in jedes 5 ml einer 10 %igen Na2CO3-Lösung. Für die Enzymreaktion gibt man in sechs weitere Reagenzgläser jeweils 0; 0,1; 0,2; 0,3; 0,4 und 0,5 ml der 5 mM DPP-Lösung. Die Proben ergänzt man mit Enzymkinetik der sauren Phosphatase 3-13 Wasser auf ein Volumen von 1 ml. Dazu pipettiert man 7 ml Citrat-Puffer. Die sechs Inkubationsansätze werden in ein Wasserbad von 37 °C gestellt. Nach 5 min pipettiert man nacheinander in jedes der 6 Gläser 2 ml der sauren Phosphatase-Lösung und mischt gut. Achtung: Ab jetzt läuft die Zeit! Je 1 ml wird nach genau 1, 5, 10 und 15 min aus den sechs Reaktionsansätzen entnommen und sofort in die entsprechend vorbereiteten Reagenzgläser mit 5 ml 10 %iger Na2CO3-Lösung pipettiert. Dadurch wird die Reaktion gestoppt. Zum Schluss wird je 1 ml Folin-Reagenz in alle Reagenzgläser gegeben, gut durchgeschüttelt und nach 15 min die Extinktion bei 623 nm gemessen und in Tabelle 3-1 eingetragen. Berechnungen: a) Abhängigkeit der Hydrolyse von der Inkubationszeit Die Extinktionen der Phenol-Eichkurve entsprechen einer 100 %-igen Hydrolyse des Substrates. Der Hydrolysegrad in Prozent wird nach der Formel: E gemessen E Eichkurve . 100 = % Hydrolyse 3-14 Enzyme b) Abhängigkeit der Anfangsgeschwindigkeit von der Substratkonzentration Die Anfangsgeschwindigkeit (Hydrolysegrad/Min.) kann man aus dem linearen Teil der Kurven in Abb. 3-4 ermitteln und auf µmol/Min. umrechnen. Einfacher ist es, die Extinktionsdifferenzen der ersten Messungen (zwischen ein und fünf Minuten), die den Anfangsgeschwindigkeiten vo entsprechen, zu verwenden. Diese Differenzen werden in der Tabelle 3-1 eingetragen und gegen die Substratkonzentration aufgetragen (vgl. Abb. 3-5). Bestimmen Sie aus Ihrem Graphen die Substratsättigungskonzentration. V0 0,04 ∆ E 5-1 0,03 0,02 0,01 0,05 berechnet, in die Tabelle 3-1 eingetragen und graphisch gegen die Inkubationszeit aufgetragen (Abbildung 3-4). % Hydrolyse 0,15µmol/min 0,25µmol/min 10 15 0,25 µMol DPP/ml Abhängigkeit der Anfangsgeschwindigkeit von der Substratkonzentration c) Zeichnen des Lineweaver-Burk-Diagramms 0,05µmol/min 5 Abbildung 3-5: 0,15 20 25 30 Die Michaelis-Menten-Konstante KM wird graphisch ermittelt. Tragen Sie dazu 1/v0 gegen 1/[S] auf und bestimmen Sie anhand des Graphen Vmax und KM. min Abbildung 3-4: Prozentuale Abhängigkeit der Hydrolyse von der Inkubationszeit Enzymkinetik der sauren Phosphatase 3-15 Tabelle 3-2: Wertetabelle für Lineweaver-Burk-Diagramm [S] 1/[S] 0,5 2,0 1,0 1,0 1,5 0,67 2,0 0,5 2,5 0,4 (∆E5-∆E1) vo Enzyme 3-16 III. Best. der Serum-Acetylcholinesterase-Aktivität 1/vo Synaptische Vesikel Synaptischer Spalt (50 nm) Postsynaptische Membran Axon 3) Einfluss steigender Enzymkonzentration: Präsynaptische Membran Vorbereitend pipettiert man in fünf Reagenzgläser je 5 ml einer 10%igen Na2CO3-Lösung. Dann werden nach Tabelle 3-3 die Reaktionsansätze in fünf Richtung des Nervenimpulses neue Reagenzgläser pipettiert. Abbildung 3-6: Schema einer Synapse Tabelle 3-3: Volumina der Reagenzien in ml Reagenzglas-Nr. 1 2 3 4 5 (Nullwert) Citratpuffer pH 6,0 [ml] 3 3 3 3 3 H2Odest [ml] 3 2,5 2 1 0 saure Phosphatase [ml] 0 0,5 1 2 3 Vorbemerkungen: Breitet sich die Erregung in Form eines Aktionspotenzials über ein Axon - kontinuierlich bei myelinfreien und saltatorisch über myelinisierte Neuriten - bis hin zu den terminalen Synapsen aus, so wird dort eine chemische TransmitterSubstanz, z. B. Acetylcholin, aus synaptischen Vesikeln in den Synapsenspalt freigesetzt. mischen und 5 min Inkubation im Wasserbad (37°C) 0,25 mM DPP-Lösung [ml] 0,5 0,5 0,5 0,5 0,5 mischen und 10 min Inkubation im Wasserbad (37°C) Nach der Inkubationszeit wird jeweils 1 ml aus den fünf Reagenzgläser entnommen und sofort in die vorbereiteten Reagenzgläser mit 5 ml 10%iger Na2CO3 pipettiert. Nach Zugabe von 1 ml Folin-Reagenz und gutem Durchmischen wartet man 15 min und misst die Extinktionen bei 623 nm. Dies entspricht direkt dem Hydrolysegrad in Prozent oder den Molen gebildeten Phenols. Tragen Sie bitte auf Millimeterpapier die Extinktionen gegen die Enzymmengen auf. + + + + + + + + + + polarisierte synaptische Membran, ∆ E ca. -75 mV hohe [K ], + niedrige [Na ] + K Na + Acetylcholin depolarisierte postsynaptische Membran, ∆ E ca. 0 mV Abbildung 3-7: Depolarisation der postsynaptischen Membran durch Acetylcholin Optischer Test 3-17 3-18 Enzyme Die am längsten bekannte und am besten untersuchte Transmittersubstanz ist das Acetylcholin, andere sind die γ-Aminobuttersäure und die Glutaminsäure. Der berühmte Versuch von Otto Loewi (1921) bewies am perfundierten Froschherzen, dass bei Vagusreizung Acetylcholin an den Endigungen postgang- Ser OH + (CH3)3-N-CH2-CH2-O-C=O lionärer präsynaptischer Nervenfasern entsteht. Dale und Feldberg (1930) zeig- E +AcCh EAc + H2O EAc + Ch E + AcOH CH3 ten, dass Acetylcholin an vielen Synapsen des peripheren Nervensystems der Säuger entsteht. Auch an den motorischen Endplatten des Skelettmuskels wird Acetylcholinesterase gehört, wie die Phosphatasen, zur Klasse der Hydrolasen. Acetylcholin freigesetzt. Man unterscheidet zwei Typen von Cholinesterasen. Wie aus der Tabelle her- Acetylcholin wird präsynaptisch in cholinergen Neuronen durch Cholin-Acetat- vorgeht, enthält vor allem Nervengewebe einen hohen Gehalt an echter Acetyl- Transferase nach folgender Gleichung synthetisiert: CH3-CO~SCoA + HO-CH2-CH2-N+(CH3)3 → CH3-COO-CH2-CH2-N+(CH3)3 + CoASH Das Acetylcholin wird dann in Vesikeln gespeichert und bei der Depolarisation der präsynaptischen Membran in "Quanten" in den Synapsenspalt ausgeschüttet. Nach Bindung an den Acetylcholinrezeptor der postsynaptischen Membran mit Öffnung der Natriumkanäle (Depolarisation) wird es durch die Cholinesterase hydrolysiert. Das Ruhepotenzial wird wieder aufgebaut. cholinesterase. Die Rolle der Pseudocholinesterase dürfte im intermediären Stoffwechsel des Cholins und verwandter Verbindungen sowie in Entgiftungsvorgängen (Procain-Esterase, Aspirin-Esterase) zu suchen sein. Tabelle 3-4: Eigenschaften der Cholinesterase-Typen Kriterium Synonym Vorkommen pH-Optimum Spezifität Acetylcholinesterase (E C 3.1.1.7.) echte Cholinesterase Gehirn, Nerven, Erythrozyten, Schlangengifte 7,8 spaltet nur Ester der Essigsäure (E C 3.1.1.8) Pseudo-Cholinesterase Leber, Pankreas, Blutserum 8,5 weiter Spezifitätsbereich CH3-COO-CH2-CH2-N+(CH3)3 + H2O → CH3-COOH + HO-CH2-CH2-N+(CH3)3 Das Enzym hat im aktiven Zentrum zwei charakteristische Wirkungszentren: 1) die anionische Bindungsstelle, an die der quaternäre Stickstoff des Cholins bindet, 2) die Esterase-Gruppe, die Elektronen auf den Acetatrest übertragen kann, wodurch ein acetyliertes Enzym entsteht, das anschließend hydrolysiert wird. Die Aktivität beider Cholinesterase-Typen kann durch spezifische Inhibitoren teilweise oder völlig gehemmt werden. Das Enzym mit Aktivitäten um 2000 U/l im Serum wird in der Leber synthetisiert. Daher sind bei schweren Lebererkrankungen die Werte im Serum erniedrigt. Pharmakologische und physiologische Studien haben zur Entwicklung vieler Enzym-Inhibitoren geführt, von denen einige sehr toxisch sind. Cholinesterasen werden von zahlreichen Insektiziden (z.B. E 605, p-Nitrophenyl-di-ethylester der Thiophosphorsäure) und von Physostigmin stark gehemmt. Praktische Bedeutung haben vor allem folgende Gruppen von Cholinesterase-Hemmern: Optischer Test H3C CH3 CH Enzym O CH2OH + F P H3C 3-19 H3C O CH Enzym O H2C P O O O CH CH CH3 H3C CH3 3-20 H5C 2 O + HF H5C 2 H5C 2 CH3 H5C 2 a) Medikamente, die auf Grund einer gewissen Strukturanalogie die Acetylcholinspaltung kompetitiv hemmen. Dazu gehören die als Parasympathikomimetika verwendeten Pharmaka wie Prostigmin, Biotin, Eserin. b) Organische Phosphorsäure- oder Thiophosphorsäure-Ester, welche als Insektizide in der Landwirtschaft verbreitet Anwendung finden, z. B. Parathion. Ähnlich in Bau und Wirkung sind die in der experimentellen Forschung verwendeten Cholinesterase-Blocker DFP oder DIFP (= Diisopropylfluorophosphat). Es handelt sich dabei um äußerst gefährliche Nervengifte. Enzyme O O P O O NO2 p-Nitrophenyl-diethylester der Phosphorsäure O S P O O NO2 p-Nitrophenyl-diethylester der Thiophosphorsäure: E 605 = Parathion O H3C HC O P O H3C CH3 CH Diisopropylfluorophosphat CH3 F O H2C O H3C H3C NH C O N c) Nervengifte vom Typ der Trilone, deren Verwendung als chemische Kampfstoffe (Sarin, Soman, Tabun) nach Genfer-Konvention verboten ist. H3C N C O O O N Physostigmin-Eserin C CH2 CH3 CH3 H2C CH2 H2C CH2 (H 3C) 3N N(CH 3) 3 + + Succinyldicholin CH3 C O H3C Enzym H2C O CH CH3 O O P O + HON CH + N H3C CH3 O H3C CH Prostigmin H3C CH3 Enzym CH CH3 H3C P O N C O H CH CH3 CH NOH Pyridin-2-aldoximmethojodid (PAM) Deblocker CH3 O CH2OH + O + N CH3 N+ CH3 + N CH3 Während die Wirkung von Stoffen der Gruppe a) auf einer reversiblen Veränderung beruht, kommt es bei denen der Gruppe b) zu einer festen Bindung des Blockers an das Serin des Enzymproteins. Die völlige Hemmung der Acetylcholinesterase im zentralen und peripheren Nervensystem durch solche "Blocker" führt zu einem stetigen Ansteigen der Acetylcholinkonzentration im Bereich der cholinergischen Synapsen und Nervenendigungen. Die Folge ist eine starke Parasympathikusreizung und eine Störung der neuromuskulären Reiz- Optischer Test 3-21 übertragung. Der Tod infolge Atemlähmung kann innerhalb einer Stunde eintreten. Die Formel einiger Cholinesterase-Substrate und Inhibitoren sowie des Deblockers PAM werden auf der Vorseite aufgeführt. Da Vergiftungsfälle durch Inhibitoren relativ häufig sind (Verwechslungen, Unachtsamkeit, Suizidversuche), sei kurz auf den biochemischen Aspekt von Diagnose und Therapie dieser Vergiftung eingegangen. Die Diagnose hat in erster Linie auf Grund des allgemeinen klinischen Bildes und des Augenbefundes (kleine, stecknadelkopfgroße, reaktionslose Pupillen!) zu erfolgen. Als Ergänzung vermag auch die Bestimmung der CholinesteraseAktivität des Serums im Schnelltest (Testpapierstreifen) wertvolle Hinweise zu geben. Bei der Behandlung derartiger Vergiftungsfälle sollen neben Atropin (in hoher Dosierung!) spezifisch auf den Cholinesterase-Inhibitor-Komplex einwirkende Substanzen wie Picolinhydroxansäure oder PAM (Pyridin-2-AldoximMethojodid) verwendet werden. Der therapeutische Effekt von PAM beruht auf einer Befreiung des Enzyms vom anhaftenden Inhibitor. Auch zur Erkennung der nicht allzu seltenen Fälle von Dyscholinesterasämie leistet die Bestimmung der Cholinesterase-Aktivität im Serum wertvolle Dienste. Bei dieser genetisch determinierten Anomalie wird eine atypische Variante von Cholinesterase mit einem unterschiedlichen Spezifitätsbereich synthetisiert. Die strukturanaloge Verbindung Succinyldicholin wird beispielsweise infolge einer etwa 100fach geringeren Affinität von dem atypischen Enzym kaum umgesetzt. Die Träger dieser Anomalie sind nicht in der Lage, Succinyldicholin zu spalten bzw. zu inaktivieren. Wird diese Substanz als Muskelrelaxans bei der Operationsvorbereitung injiziert, kommt es zu einem lebensbedrohenden Zustand (Apnoe). Die Untersuchung der Serum-Cholinesterase auf atypisches Verhalten gehört daher zu einer gewissenhaften Operationsvorbereitung, sofern die Verabreichung von Succinyldicholin beabsichtigt ist. Prinzip: Als Substrat dient Acetylthiocholinjodid und als Indikator für freigesetztes Thiocholin wird 5,5'-Dithio-bis-2-nitrobenzoesäure verwendet, die zur gelb gefärbten 5-Mercapto-2-nitrobenzoesäure reduziert wird. Zur Bestimmung der 3-22 Enzyme Pseudocholinesteraseaktivität wird der Thiocholinester der Buttersäure verwendet. HOOC S COOH S O2N SH + + H 2C CH2 N(CH 3) 3 NO2 5,5'-Dithio-bis-2-nitro-benzoesäure HOOC S S + CH2 CH2 N + HS (CH 3) 3 COOH O2N 5-Mercapto-2-nitrobenzoesäure NO2 In alkalischem Medium vertieft sich die gelbe Farbe der 5-Mercapto-2-nitrobenzoesäure unter Bildung der chinoiden Verbindung: S COOH Na+ N O O Geräte: Eppendorf-Pipetten, Hamilton-Spritzen Laborwecker Photometer, Filter 405 nm, 2 × 1 cm-Plastikküvetten Lösungen: Acetylthiocholiniodid 5 mM (CH3–CO–S–CH2–CH2–N(CH3)3+ I– 5,5'-Dithio-bis-(2-nitrobenzoesäure) in 50 mM Phosphatpuffer 0,25 mM, pH 7,2 Diisopropylfluorophosphat 0,1 mM PAM 10 mM Serum Optischer Test 3-23 Im Folgenden wird die Aktivität, Hemmung und Reaktivierung der Acetylcholinesterase bestimmt. Der Inhibitor DIFP ist eine hoch toxische Substanz. Achten Sie bitte darauf, dass die Haut nicht mit der Flüssigkeit in Berührung kommt. Ausführung: Nach gutem Mischen wird nach einer Minute und dann in einem Zeitraum von 30 min alle fünf Minuten die Extinktion der drei Reaktionsküvetten (2-4, siehe Tabelle 3-5) bei 405 nm gemessen (Achtung die Zeit läuft nach Zugabe des Substrats Acetylcholiniodid!). Vor jeder Messung muss der Leerwert mit Küvette-Nr. 1 erneut auf Null eingestellt werden, da das Serum mit dem Reagenz reagiert. Tragen Sie die Werte in Tabelle 3-6 ein. Tabelle 3-5: Durchführung der Aktivität, Hemmung und Reaktivierung der AChE Küvetten-Nr. 3-24 Geben Sie die Acetylcholinesterase-Aktivität in U/l an (1 U = 1 µMol/min). Tabelle 3-6: Wertetabelle für die Zeit-Umsatzkurve Zeit nach Substratzugabe 1 min [E(405nm)1] 3 min [E(405nm)3] 5 min [E(405nm)5] 10 min [E(405nm)10] 15 min [E(405nm)15] 20 min [E(405nm)20] 25 min [E(405nm)25] 30 min [E(405nm)30] 3 Hemmung 4 Reaktivierung 3 ml 3 ml 3 ml 3 ml 20 µl 20 µl 20 µl 20 µl 0,6 50 µl - 50 µl 50 µl 0,4 jeweils gut mischen! 50 µl - 100 µl 100 µl 50 µl 100 µl Tragen Sie bitte die abgelesenen Extinktionen gegen die Zeit auf (vgl. Abb. 38). Aus dem Graphen wird die ∆E/min. abgelesen (Steigungsdreieck). Berechnen Sie die Acetylcholinesterase-Aktivität c/min (Einheit: Mol/min) mit Hilfe des Lambert-Beer`schen Gesetzes. ε = 13,3 x 103 [l x mol-1 x cm-1] 1,2 1 1,0 0,8 3 2 0,2 - Werte für Hemmung E 2 Aktivität 5 min nach mischen: PAM (Enthemmer) 15 min nach mischen: 5mMAcetylthiocholinjodid (Substrat) Werte für Aktivität 1,4 1 Leerwert 0,25 mM 5,5‘-Dithio-bis-(2nitro-benzoesäure) in 50 mM Phosphatpuffer Serum (enthält Acetylcholinesterase) DIFP (Hemmstoff) Enzyme 0,0 0 10 20 30 Zeit [min] Abbildung 3-8: 1) Aktivität der Acetylcholinesterase 2) Hemmung mit DIFP 3) Reaktivierung mit PAM Werte für Reaktivierung Aufgaben 3-25 Übungsaufgaben: 1. Eine reine Enzymlösung (100 µg Enzym/ml) hat eine Aktivität von 50 U/ml. MG des Enzyms 80.000. Wie groß ist die Wechselzahl? 2 Hexokinase hat im Gehirn ein Km von 10-5 mol/l und in der Leber ein Km von 10-3 mol/l. a) In welchem der beiden Organe läuft bei ständig abnehmender GlcKonzentration die Reaktion länger mit maximaler Geschwindigkeit ab? b) Wie groß muss die Glucose-Konzentration in mg/ml intrazellulärer Flüssigkeit in beiden Organen sein, damit die Reaktion mit halbmaximaler Geschwindigkeit abläuft ? (MG der Glucose = 180) 3. 4. Formulieren Sie die Reaktionsgleichung der a) Alkoholdehydrogenase (ADH) mit Coenzym. b) Die Reaktion zeigte mit verschiedenen Konzentrationen Äthanol [S] folgende Geschwindigkeiten: [Äthanol] mM Vo (∆E340/5 min) 0,75 0,094 1,00 0,115 1,50 0,148 3,00 0,206 12,00 0,293 Ermitteln Sie graphisch Km für Äthanol und Vmax der ADH. c) Einen Umsatz von 0,356⋅105 µmol NADH/l⋅min⋅mg Protein errechnet man aus Vmax. 1 % der für die Messung verwendete Proteinfraktion war ADH. MG = 80.000. Berechnen Sie die Wechselzahl der ADH Eine Reaktion 1. Ordnung beginnt mit einer Anfangskonzentration des Substrates von 10-5 mol/l getestet. Sie ist eine Reaktion 1. Ordnung. Nach 6 Minuten ist die Hälfte des Substrates umgesetzt. a) Wie groß ist k; b) Wie groß ist die Konzentration nach 10 Minuten? 3-26 Enzyme 5. In einer Isomerase Reaktion werden 2,5 mg Enzym vom Molekulargewicht 125.000 eingesetzt. Km wurde zu 3⋅10-3 mol/l bestimmt und Vmax zu 275 µmol/Min. a) Wie groß ist die Wechselzahl? b) Berechnen Sie die Anfangsgeschwindigkeit bei einer Substratkonzentration von 7,5 mmol/l 6. a) Für welche Reaktion wird Vitamin K als Cofaktor benötigt? b) Für welchen physiologischen Vorgang ist diese Reaktion von Bedeutung? 7. a) Wie beinflusst ein erhöhter ADP-Gehalt die Umlaufgeschwindigkeit im Citratzyklus? b) Auf welche Enzyme des Citratzyklus wirkt ADP? 8. a) Welches Organell der Zelle enthält vor allem Hydrolasen? b) Nennen Sie drei Stoffklassen, die dort hydrolysiert werden. 9. Stellen Sie den Effekt, den ein Enzym auf die Aktivierungenergie einer Reaktion hat, in einer einfachen Graphik dar. 10. Wie beinflusst ein kompetitiver Inhibitor Vmax und KM einer enzymatischen Reaktion? 11. a) Nennen Sie einen Inhibitor der Acetylcholinesterase, der eine kovalente Bindung mit dem Enzym eingeht. b) Nennen Sie die betroffene Aminosäure. 4-1 Versuch 4: Lipide Versuche: Nachweisreaktionen von Lipiden DC-Trennung von Myelin-Lipiden Gaschromatographie von Fettsäuremethylestern Dünnschichtchromatographie von Steroidhormonen 2 Analysen: 1. Aceton in Wasser 2. Hormongemisch 4-2 Lipide I. Nachweisreaktionen von Lipiden 1) Fettsäuren Doppelbindungen in ungesättigten Fettsäuren können durch die Addition von Brom nachgewiesen werden: Zwei Tropfen Olivenöl werden in etwa 3 ml Chloroform gelöst und tropfenweise eine 2%-ige Bromlösung in Chloroform zugegeben. Die braune Farbe der Bromlösung entfärbt sich spontan. Überlegen Sie sich, in welchen Naturprodukten Doppelbindungen vorkommen und warum einige Fettsäuren essentiell sind. 2) Ketonkörper Im Urin eines Diabetikers erscheinen nicht nur Glukose, sondern durch die verstärkte Lipolyse auch Ketonkörper, u. a. Aceton, das auch über die Atemluft abgegeben werden kann (charakteristischer Geruch im Krankenzimmer!). Aceton-Nachweise: Wissensgebiete a) Natriumnitroprussidprobe Chemische Strukturen der gesättigten und ungesättigten Fettsäuren Allgemeine Struktur der Glyceride, des Cholesterins, der Cholesterinester, Natriumnitroprussidlösung bildet mit Aceton folgenden rot gefärbten Komplex: der Phospolipide, der Sphingolipide Membranbausteine, Aufbau von Membranen Lipasen und Phospholipasen Biosynthese der Fettsäuren und Lipide, β-Oxidation, Energiebilanz Biosynthese und Umwandlung des Cholesterins zu Gallensäuren und Steroidhormonen, Regulation der Cholesterin-Biosynthese Galle, Zusammensetzung und Funktion Prostaglandinfamilie: Prostaglandine, Leukotriene, Thromboxane Steroidhormone: allgemeine Struktur und Funktion Seifen und Verseifung Prinzip der Gaschromatographie, Dünnschichtchromatographie → CH3-CO-CH3 + [Fe2+(CN)5NO+] 2- + 2 OH[Fe2+(CN)5NO+CH-CO-CH3] 4- + 2 H2O Beim Ansäuern mit Eisessig wird ein Proton an den Komplex angelagert und die Farbe vertieft sich: [Fe2+(CN)5NO+ CH2-CO-CH3]3Ausführung: Zu 3 ml der Analysenlösung gibt man fünf Tropfen frische Nariumnitroprussidlösung und 1 ml NaOH. Anschließend wird mit wenigen Tropfen Eisessig schwach angesäuert. Lipidnachweisreaktionen 4-3 Der Nachweis von Aceton mit Hilfe von Natriumnitroprussidlösung kann aber durch andere Metaboliten gestört werden. Überlegen Sie sich, welche diese sein könnten. b) Jodoformprobe CH3-CO-CH3 + 3 I2 + 3 NaOH → CH3-CO-CI3 + 3 NaI + 3 H2O CH3-CO-CI3 + NaOH → CHI3 + CH3COONa Ausführung: Zu 3 ml Acetonlösung und 1 ml Jod-Jodkalium-Lösung gibt man tropfenweise 2 N NaOH, bis Entfärbung eintritt. Bei positivem Ausfall der Reaktion tritt ein gelber Niederschlag und typischer Jodoform-Geruch auf. Geräte: Reagenzglasgestell mit 10 Reagenzgläsern Spatel Chemikalien: Aceton 1%ig Brom 2% in Chloroform Eisessig Jod-Jodkalium-Lösung Natriumnitroprussidlösung 5%ig NaOH 2N Olivenöl 4-4 II. Lipide Trennung von Myelin-Lipiden durch DünnschichtChromatographie Geräte: 1 Dünnschichtplatte Entwicklungstrog 10 × 10 cm, beschichtet mit Kieselgel H Lösungen: Fließmittel: Chloroform/Methanol/Wasser = 65:25:4 Lipid-Extrakt aus Myelin Testlösungen (2 mg/ml) : Cholesterin, Lecithin, Kephalin, Cerebrosid, Sulfatid Normalwerte im Serum (pro 100 ml) Gesamtlipide 0,6-1 g Triglyceride 70-180 mg Gesamtcholesterin 160-230 mg Verestertes Cholesterin 120-180 mg Phospholipide 160-230 mg freie Fettsäuren 10-35 mg β-Lipoproteine bis 550 mg Bilirubin 0,5-1 mg Gesamtprotein 6-8 g Harnsäure 2-6,8 mg Glucose 60-100 mg Natrium 140 mVal pro Liter Kalium 5 Calcium 5 Magnesium 2 27 HCO3– Cl– 103 Protein– 17 Lipidzusammensetzung des Myelins des menschlichen Gehirns. PC, Phosphatidylcholin 10,0 % PE, Phosphatidylethanolamin 20,0 % PI, Phosphatidylinositol 1,0 % PS, Phosphatidylserin 8,5 % SPM, Sphingomyelin 9,0 % Cerebrosid 20,8 % Sulfatid 5,2 % Cholesterin 26,0 % Lysophosphatidylcholin Spuren Myelinlipid DC 4-5 Auf einer mit Kieselgel beschichteten Glasplatte werden nach dem Prinzip der Verteilungschromatographie verschiedene Lipide aufgetrennt und anschließend mit spezifischen Färbereagenzien nachgewiesen. Die Verteilung findet zwischen der stationären, polaren Hydrathülle des Kieselgels und dem mobilen, unpolaren Laufmittel statt. Daher laufen die unpolaren Lipide nahe der Laufmittelfront und je stärker der polare Charakter des Lipids ist, um so stärker ist ihre Wechselwirkung mit der polaren, stationären Phase und umso kürzer ist die Laufstrecke dieser Lipide. Die Phosphatgruppe der Phospholipide kann mit Hilfe von Molybdänblau (Zinzadse) nachgewiesen werden, Ninhydrin erfasst die Aminogruppen von Phosphatidylethanolamin und Phosphatidylserin, H2SO4Eisessig (Salkowsky) färbt Cholesterin und das Anthron-Reagenz Kohlenhydrate. Als Laufmittel dient Chloroform-Methanol-Wasser 65:25:4. 4-6 Lipide ist. Dabei ist darauf zu achten, dass die Auftragspunkte so weit vom unteren Rand der Platte entfernt sind, dass sie nicht im Laufmittel „ertrinken“. Aufgetragen werden: 1. Phosphatidylcholin (Lecithin) 2. Cerebrosid und Sulfatid (Probenlösung handwarm machen!) 3. Lipidextrakt aus Myelin 4. Cholesterin Pasteurpipette zwischendurch mit Aceton reinigen. Der Chromatographietrog wird verschlossen und die Chromatographie so lange durchgeführt, bis die Laufmittelfront bis auf ca. 1 cm Abstand den oberen Rand der Platte erreicht hat. Nachdem die Platten im Abzug getrocknet sind, werden sie nacheinander: 1. mit Ninhydrin-Lösung besprüht und 15-20 Min. bei Raumtemperatur liegen gelassen. 1 2 3 Salkowsky Cholesterin Anthron Cerebrosid Phosphor Ninhydrin Phosphor Ninhydrin 2. mit Zinzadse-Reagenz eingesprüht 4 PE Sulfatid Anthron Phosphor PC PS SPM Lyso-PC Auftragsstelle Abbildung 4-1: Dünnschichtchromatogramm der Myelinlipide Die Proben werden punktförmig mit der Spitze einer Pasteurpipette aufgetragen. Dabei sollte die Spitze 3 mal hintereinander mit jeweils 3-5 mm Probe gefüllt und so aufgetragen werden, dass der Durchmesser der Flecken nicht größer als 3-4 mm 3. mit konz. H2SO4-Eisessig 1:1 besprüht und bei 120°C im Trockenschrank über 15 min. erhitzt 4. mit Anthron-Reagenz besprüht und erneut 10-15 Min bei 90 °C im Trockenschrank erhitzt Notieren Sie jeweils nach jeder Färbung die Lage der Flecken. GC 4-7 III. Gaschromatographie der Fettsäuremethylester Triglyceride sind Energiespeicher des Körpers und kommen z. B. im Fettgewebe oder in Lipoproteinen vor. Den mit tierischer und pflanzlicher Nahrung aufge- 4-8 Lipide zu binden. Nach kurzer Zeit und wiederholtem Umschwenken wird die Lösung in einen 20 ml Erlenmeyerkolben filtriert und im Abzug auf einem ebenfalls elektrisch beheizten Wasserbad zur fast vollständigen Trockne eingedampft. nommenen Triglyceriden werden unterschiedliche Qualitäten zugeschrieben. Objektiv unterscheiden sie sich nur in der Zusammensetzung ihrer Fettsäuren. Die 2) Veresterung der freien Fettsäuren mit 2% Bortrifluorid-Etherat in Zusammensetzung der Fettsäuren lässt sich mit Hilfe der Gaschromatographie Methanol: quantitativ ermitteln. Überlegen Sie sich, warum man zunächst die Fettsäuren in Fettsäureester umwandeln muss. Geräte: Gaschromatograph, Erlenmeyerkolben 100 ml , 20 ml Wasserbad zur Verseifung und Veresterung Wasserbad zum Abdampfen von Lösungsmitteln, unter dem Abzug Chemikalien: Bortrifluorid/Methanol 1:5 Petrolether Na2SO4 wasserfrei NaOH 2N Olivenöl Methanolische KOH 20% HCL Chloroform 1) Verseifung von Triglyceriden: 0,1 ml Olivenöl oder ca. 0,1 g Speisefett aus dem Haushalt (Margarine, Butter, Salatöl, Speck usw., bitte von zu Hause mitbringen!) und 5 ml 15%-ige methanolische KOH (Methanol/Wasser = 9:1) werden in einem 100 mlErlenmeyerkolben mit Deckel 30 min in einem elektrisch beheizten, siedenden Wasserbad erhitzt. Der kugelförmige Deckel wirkt wie ein primitiver Rückflusskühler und verhindert das Verdampfen des Methanols. Anschließend kühlt man ab und säuert mit 10 ml ca. 20%-iger HCl an. Die freigesetzten Fettsäuren werden in einem Schütteltrichter mit 20 ml Petrolether ausgeschüttelt. Die untere Phase wird verworfen, dabei muss der Glasstopfen abgenommem werden. Die obere Phase (Petrolether) wird dann im Schütteltrichter 3 mal mit je 10 ml Wasser gewaschen und in einem 20 ml-Erlenmeyerkolben mit 2-3 Spatelspitzen wasserfreiem Na2SO4 versetzt („getrocknet“), um die Wasserreste • 1 ml der BF3-Methanollösung wird in den Erlenmeyerkolben gegeben, die eingedampften Fettsäuren durch Schwenken gelöst und sofort in ein Sovirelglas (=Reagenzglas mit Schraubverschluss) überführt. • Sovirelglas fest verschließen! 15 min. im siedenden Wasserbad erhitzen. • 2 ml H2O zugeben, anschließend mit 2 ml Petrolether durch Schütteln extrahieren. • Abhebern der Petroletherphase mit Pasteurpipette, Umfüllen in ein Reagenzglas und gegebenenfalls mit Na2SO4 trocknen. • In ein Reagenzglas filtrieren und im Wasserbad im Abzug zur Trockne eindampfen. • Rückstand in 0,5 ml CHCl3 lösen, ca. 0,1 µl aufspritzen. Die genau aufzuspritzende Menge muß jeweils ausgetestet werden. (Bei Verlusten während der Veresterung, CHCl3-Volumen verringern) GC 4-9 4-10 Lipide Den Flächeninhalt berechnet man durch Multiplikation der Peakhöhe (h) und der Peakbreite (b) auf halber Höhe. Abbildung 4-2: Schematische Darstellung eines Gaschromatographen Die Gaschromatographie ist eine Verteilungschromatographie. Verdampfbare Substanzen verteilen sich zwischen einer flüssigen und einer gasförmigen Phase. Als flüssige stationäre Phase werden für Fettsäuremethylester Polyester zwischen Dicarbonsäuren (z.B. Bernsteinsäure) und Glykolen oder Siliconöle und höhere Kohlenwasserstoffe verwendet. Die Trennphase wird auf ein inertes, feinkörniges Trägermaterial (z. B. Kieselgur 0,1-0,2 mm Ø) aufgetragen. Trägermaterial mit aufgezogener Trennphase ist das Füllmaterial der Gaschromatographiesäule. Sie wird von der gasförmigen Phase, dem Trägergas, durchströmt, wodurch die Substanzen der zu analysierenden Probe getrennt in den Detektor transportiert werden. Dort werden elektrische Signale erzeugt, die über einen Verstärker vom Schreiber aufgezeichnet werden. Die GC ist in der Lage, die Trennung komplizierter Gemische in µg-Mengen exakt qualitativ und quantitativ durchzuführen. Jede Verbindung hat eine charakteristische Retentionszeit (Verweilzeit in der Säule). Der Vergleich mit Testsubstanzen erlaubt die Identifizierung der Komponenten eines Gemisches, in unserem Fall der einzelnen Fettsäuremethylester. Das Gaschromatogramm wird quantitativ nach der Dreiecksmethode ausgewertet: F = h•b Abbildung 4-3: Gaschromatogramm eines Fettsäuremethylestergemisches Steroidhormon DC IV. 4-11 Dünnschichtchromatographie von Steroidhormonen. Die Steroidhormone Progesteron, Cortison, Testosteron, Östradiol und Cortexon sollen getrennt und parallel dazu die Komponenten eines Gemisches bestimmt werden. O O O Cortison CH3 CH2OH C O CH2OH CO OH C O 4-12 Ausführung: Mit Hilfe einer Pasteurpipette werden die Testsubstanzen und die Analysen in Abständen von 1 cm aufgetragen (siehe 4 II und Abb. 4-5). Die Spitze der Pasteurpipette sollte zwischendurch mit entionisiertem Wasser gespült werden. Als Laufmittel dient Chloroform/Aceton 9:1. Nach Lufttrocknung (Abzug) wird die Platte zuerst mit 50% H2SO4 in Methanol und dann mit 0,1% 2,4-Dinitrophenylhydrazin in Ethanol + HCl eingesprüht und zur Farbentwicklung 10 Min. in einem Trockenschrank von 120°C gelegt. Notieren Sie die Farben der Flecken und beobachten Sie ihre Fluoreszenz unter der UV-Lampe. Bestimmen Sie die beiden Steroidhormone in Ihrer Analyse. Berechnen Sie die Rf-Werte. O Cortexon Progesteron 1 OH HO Lipide 2 A1 3 A2 4 5 OH Front O Östradiol C 18 Testosteron C 19 8 cm Abbildung 4-4: Strukturformeln der untersuchten Steroidhormone Geräte: Chromatographietrog Dünnschichtplatten 10 × 10 cm mit Kieselgel H Sprüher zum Anfärben Teflonschläuche Trockenschrank 120 °C UV-Lampe Lösungen: Steroidhormonlösungen einzeln Laufmittel: Chloroform/Aceton 9:1 Sprühreagenzien: 1) 50% H2SO4 in Methanol 2) 0,1%ige 2,4-Dinitrophenylhydrazin in Ethanol + 1 ml konz. HCl 1,5 cm Abbildung 4-5: Auftrags -stelle Dünnschichtchromatogramm von Steroidhormonen 1 Östradiol 2 Cortexon A1 Analyse 1 3 Cortison A2 Analyse 2 4 Testosteron 5 Progesteron Aufgaben 4-13 Übungsaufgaben: 1. Wie kann der Abbau von Triglyceriden zur Glukoneogenese beitragen? 2. Wie beeinflusst der Prozentsatz der ungesättigten Fettsäuren der Membranlipide die Fluidität einer Membran? 3. Warum sind Plasmamembranen für geladene Moleküle undurchlässig? 4. Nennen Sie drei Substanzen, die aus Membranbausteinen entstehen und an der Übertragung von Signalen mitwirken. 5. N-Acetylneuraminsäure (Sialinsäure) ist Bestandteil von: a) ...........und b) .......... 6. a) Nennen sie das Schlüsselenzym der Biosynthese von Fettsäuren b) Formulieren Sie die von ihm katalysierte Reaktion (in Worten). c) Nennen Sie je ein positives und ein negatives Effektormolekül. 7. Nennen Sie Namen der drei Ketonkörper: 8. Wo sind in der Zelle die Rezeptoren für a) Insulin, b) Cortisol und c) die Schilddrüsenhormone T3/T4 lokalisiert? 5-1 Versuch 5: Immunologie Versuche: ELISA (enzyme linked immunosorbent assay), Enzymgekoppelter Immunnachweis Western-Blot Test zur Schwangerschaftsfrüherkennung aus Urin Analyse: IgG-Test mittels ELISA, 2 Proben (A und B) Wissensgebiete Allgemeine Struktur und grundsätzlicher Aufbau von Antikörpern 5-2 Immunologie Medizinische Grundlage: Antikörper sind Proteine, die vom Immunsystem des Körpers produziert werden, um eine hochspezifische extrazelluläre Abwehr gegen Infektionen aufzubauen. Außerhalb des Körpers, im Labor, sind Antikörper unentbehrliche Werkzeuge geworden, die in einer Vielzahl von Methoden die Bindungseigenschaften der Antikörper zur qualitativen und quantitativen Analyse von Antigenen nutzen. Im Praktikum werden Sie anhand von drei Beispielen einen ersten Einblick bekommen. I. ELISA Die Markierung von Antikörpern mit Enzymen ist eine weit verbreitete Methode zur Detektion der Antikörper und damit der daran gebundenen Antigene und hat die radioaktiven Markierungsmethoden mit dem Nachweis im RIA (radio immuno assay) in vielen Bereichen verdrängt. Der Aufbau eines ELISA kann auf verschiedene Art und Weise erfolgen und hängt von den Anforderungen ab, die an ihn gestellt werden. Generell kann man zwei verschiedene Verfahren unterscheiden: Klassen der Immunglobuline A: Direkt-ELISA, Polyklonale, monoklonale Antikörper B: Inhibitions-ELISA. Prinzip der humoralen und zellulären Immunantwort Wechselwirkung zwischen Antigen und Antikörper Komplementsystem Polyklonale und monoklonale Antikörper Prinzip der Herstellung monoklonaler Antikörper Prinzip von ELISA, RIA, Westernblot Blut, Serum, Plasma Blutgruppendeterminanten Im Praktikum werden Sie aus Zeitgründen die einfachste Form eines DirektELISA durchführen. Sie sollen humanes IgG mit Hilfe eines affinitätsgereinigten, mit Meerettich-Peroxidase gekoppelten Antikörpers aus Kaninchen nachweisen. Normalerweise wird zuerst ein nicht gekoppelter Antikörper eingesetzt, der dann mit Hilfe eines Enzym-gekoppelten Zweitantikörpers nachgewiesen wird. Alle Immunglobuline besitzen die gleiche Grundstruktur aus vier Untereinheiten, zwei leichten Ketten (je 23 kDa) und zwei schweren Ketten (je 53 -75 kDa). Die Untereinheiten lagern sich über Disulfidbrücken und hydrophobe Wechselwirkungen zusammen und bilden eine Y-förmige Struktur. Die sezernierten Immunglobuline des Menschen lassen sich in 5 Klassen einteilen, IgA, IgD, IgE, IgG und IgM, die sich im Typ ihrer schweren Ketten unterscheiden. IgD, IgE und IgG bestehen nur aus Monomeren, IgA besteht aus Monomeren, Dimeren und ELISA 5-3 Trimeren, während IgM aus Pentameren der Y-förmigen Struktur besteht. Die Multimere sind dabei sowohl untereinander als auch mit einer sogenannten J-Kette (J=joining) über Disulfidbrücken verbunden. In einem direkten ELISA sollen Sie IgG im Plasma nachweisen, als Leerwert dient TBS. In der Analyse sollen Sie ermitteln, ob in den beiden Proben, die Sie erhalten, humanes IgG vorhanden ist oder nicht. Dazu werden in einem ersten Schritt die Plasmaproteine irreversibel an eine ELISA-Mikrotestplatte gebunden. Nach dem Blockieren unspezifischer Bindungsstellen mit Milchproteinen wird ein in Kaninchen hergestellter Peroxidase-gekoppelter Antikörper zugegeben, der gegen humanes IgG gerichtet ist. Der Nachweis der gebundenen Antikörper erfolgt dann durch die enzymatische Reaktion. Als Substrat dient Tetramethylbenzidin, dessen Umsatz photometrisch bei 450 nm detektiert werden kann. 5-4 Immunologie Durchführung: 1. Beschichten Die Löcher einer 96-Loch (12x8) Microtiter-Platte werden mit jeweils 100 µl Antigenlösung beschichtet. Hierzu wird eine Plasma-Verdünnungsreihe in TBS-Puffer (siehe Tabelle) hergestellt, zusammen mit den unverdünnten Analysen A und B (ebenfalls je 100µl) wie folgt aufgetragen (alles in Doppelbestimmung) und eine Stunde bei Raumtemperatur (RT) inkubiert. Bitte benutzen Sie immer nur 3 nebeneinanderliegende Spalten und vermeiden Sie Proteinkontaminationen der freien Plätze. Die Platten werden in der nächsten Woche von Ihren Kommilitonen weiterverwendet. Zur Sicherheit lassen Sie jede 4. Spalte frei. Bitte markieren Sie die benutzten Spalten mit Filzstift. Also zu benutzen: Spalten 1,2,3 oder 5,6,7 oder 9,10,11. Materialien und Geräte: ELISA-Reader 96er Microtiter-Platte Pipetten: Precision rot/blau 500 ml Spritzflasche 15 ml Plastikgefäß mit Schraubdeckel Eppendorf-Reaktionsgefäße Lösungen: Plasma (für die Verdünnungsreihe) Protein-Analysen-Lösungen A und B TBS TBS/Tween 20, 0,02 %(Detergenz) 5% Milchpulver in TBS Kaninchen-Anti-Human-IgG Antikörper (Peroxidase gekoppelt; 1:40000) Citrat pH 6.0 10 mg/ml Tetramethylbenzidin-Lösung in DMSO (carcinogen) 3% ige H2O2-Lösung 20%ige H2SO4 Verdünnung Plasma (Doppelbestimmung) Analysen Leerwert AX1, 4 AX2 1:10 1:5x10 1:10 4 5 6 1:5x10 1: 107 BX1 BX2 1:5x105 1: 10 Student X AY1 AY2 6 Student Y BY1 BY2 2. Waschen Die Lösungen werden über dem Waschbecken ausgegossen und dann dreimal mit TBS/T-Puffer gewaschen. Man füllt die Löcher mit dem Waschpuffer aus einer Polyethylen-Spritzflasche, und schüttet sie ebenfalls über dem Waschbecken aus. Anhaftende Tropfen können durch Ausklopfen entfernt werden. ELISA 5-5 3. Blockieren Um die restlichen Proteinbindungsstellen am Plastik zu blockieren, inkubiert man 30 Minuten lang bei RT mit 200 µl Blockierungsreagenz (5% Milchpulver in TBS). 4. Waschen Blockierungslösung entfernen und dreimal (s. o.) mit TBS/T waschen. 5. Peroxidase-gekoppelter Antikörper je 100 µl Antikörper (Anti-human IgG, 1:40.000 in TBS) pro Loch auftragen und 45 Minuten lang bei RT inkubieren. 6. Waschen Antikörperlösung entfernen, dreimal (s. o.) mit TBS/T und anschließend zweimal mit H2O (entsalzt) waschen. 7. Detektion Ansetzen von Substratlösung in 15 ml Plastikgefäßen: 4,5 ml aqua dest., 0,5 ml 1M Na-Actat Puffer (pH 6), 31 µl Tetramethylbenzidin-Lösung (10 mg/ml DMSO), 5 µl 3 %ige H2O2-Lösung. jeweils 100 µl Substratlösung werden in jedes Loch pipettiert. Danach mindestens 5-10 Minuten lang inkubieren, bis eine Blaufärbung zu sehen ist. 8. Stoppen der Farbentwicklung je 100 µl 20%ige H2SO4 pro Loch hinzugeben. 9. Messen im ELISA-Reader bei 450 nm (mit Hilfe des Assistenten) 10. Auswerten Tragen Sie die gemessenen Absorptionswerte gegen den Logarithmus der Antigenverdünnung auf. Diskutieren Sie den Kurvenverlauf. Geben Sie das Ergebnis der Analyse an (positiv oder negativ), im Vergleich mit dem Standard aus der Plasmaverdünnungsreihe Immunologie 5-6 II. Western Blot Prinzip: Die Trennung von Proteinen über SDS-Gelelektrophorese ist eine Standardmethode zur Analyse von Proteinen. Um eine spezifische Antigenbindung der getrennten Proteine nachzuweisen, überträgt man die Proteine durch Anlegung eines elektrischen Felds auf eine Nitrocellulose-Membran. Diese kann dann mit einem spezifischen Antikörper gegen ein bestimmtes Protein inkubiert werden und durch die gekoppelte enzymatische Aktivität eines ersten oder zweiten Antikörpers nachgewiesen werden. Damit wird nicht nur wie beim ELISA eine Antigen-Antikörper-Bindung nachgewiesen, sondern zusätzlich auch noch eine Information über die Größe des Proteins erhalten. Der Western Blot dient z. B. als Bestätigung des Nachweises einer HIV-Infektion, wenn in einem ELISA Antikörper gegen HIV nachgewiesen wurden. Im Western Blot werden virale Proteine im SDS-Gel der Größe nach aufgetrennt und auf dem Blot die Antikörper der Patienten gegen die verschiedenen Proteine nachgewiesen. Beim Immuno-Blotting kann die Trennung eines Proteingemisches mittels SDSPAGE mit der Spezifität vom immunologischen Nachweis gekoppelt werden. Dabei unterscheidet man folgende sechs Schritte: 1. Proteingemisch in Probenpuffer 2. Trenunng der Proteine durch Gelelektophorese 3. Transfer auf Nitrocellulose 4. Blocken unspezifischer Bindungen 5. Antikörperaddition 6. Detektion Western-Blot 5-7 Dieses Experiment schließt sich an Versuch 2 (Aminosäuren und Proteine II) an. Die Blotprozedur wird dort beschrieben. Materialen und Geräte: geblottete Nitrocellulose (Versuch 2) Plastikschale Schüttler Lösungen: TBS-Puffer: 0.15 M NaCl, 50 mM Tris pH 7.4 TBS/T (0.01 % Tween 20 in TBS) TBS/T + 5% Milchpulver Kaninchen-Anti-Human-IgG Antikörper (Peroxidase gekoppelt; 1:15.000) 30%ige H2O2-Lösung 0.3 % 4-Chloronaphtol (in Methanol) (carcinogen!) Durchführung: − die Membran wird eine Stunde lang mit 10 ml Kaninchen-Anti-Human-IgG (Peroxidase gekoppelt) (1:15.000) inkubiert und dann − dreimal für 5-10 min mit jeweils 10 ml TBS/T gewaschen. − zweimal kurz mit Wasser gewaschen − Farbreaktion: Der Antikörper ist mit Peroxidase gekoppelt, die ein farbloses Substrat (4-Chloronaphtol) zu einem Farbstoff umsetzen kann. Hierzu stellt man kurz vor Gebrauch folgende Lösung her: 0,3 ml 0.3% 4-Chloronaphtol 4,7 ml TBS 5 µl 30%ige H2O2-Lösung Nach Zugabe dieser Lösung erscheint auf der Membran eine farbige Bande, die selektiv die Lage und damit die Existenz des Antigens anzeigt. Die Färbereaktion wird anschließend mit TBS-Puffer abgestoppt. Auswertung: Die Beobachtungen nach der Detektion mit Chlornaphthol werden festgehalten und im Vergleich zur Poinceau S-Färbung kommentiert. Hierzu werden, vom unteren Rand der Nitrocellulose ausgehend, sowohl die Markerbanden ausgemessen, als auch die Lage der prominentesten Proteinbanden. Immunologie 5-8 III. Test zur Schwangerschaftsfrüherkennung aus Urin Medizinische Grundlage: HCG, humanes Choriongonadotropin, ist ein Glykoproteinhormon, das bereits kurz nach der Befruchtung von der Eizelle sezerniert wird. HCG regt den Gelbkörper (corpus luteum) dazu an, sich nicht zurückzubilden, sondern weiterhin Progesteron zu produzieren, so dass keine Menstruation stattfindet. Bei normalem Schwangerschaftsverlauf kann HCG im Serum bereits 7 Tage nach der Befruchtung nachgewiesen werden. HCG ist daher ein hervorragender Indikator zur Früherkennung einer Schwangerschaft, es kann auch im Urin nachgewiesen werden. Die Konzentration steigt während der Frühphase der Schwangerschaft rasch an. Ein positives Ergebnis kann außer durch eine Schwangerschaft nur durch ein sehr selten vorkommendes Chorionkarzinom entstehen, bei dem ebenfalls große Mengen HCG sezerniert werden. HCG besteht aus zwei Untereinheiten, α und β. Die α Untereinheit hat eine große Homologie zu den α-Ketten der Hypophysenhormone LH, FSH und TSH, außerdem sind 94 der 115 Aminosäuren der β-Untereinheit mit denen des β-LH identisch. Daher ist es unmöglich einen immunologischen Nachweis mittels eines polyklonalen Antikörpers durchzuführen, da Kreuzreaktivitäten der Antikörper eine sichere Bestimmung der Hormone unmöglich machen würde. Nur ein monoklonaler Antikörper, der gegen das für HCG spezifische Epitop in der βKette gerichtet ist, kann zur Diagnostik eingesetzt werden. Prinzip Der Versuch wird mit einem hochempfindlichen kommerziell erhältlichen Test („STORCH-TEST“ oder „SCHWANGER JA:NEIN“) durchgeführt. Es handelt sich hierbei um einen Sandwich-Immun-Assay, der aus einer Kombination von monoklonalen und polyklonalen Antikörpern besteht. Durch einen chromatographischen Schritt werden die beiden Antikörper mit dem Antigen zusammengebracht und die Aggregation durch die Goldmarkierung sichtbar gemacht. Die Kontrolle für eine korrekte Testdurchführung ist durch die Reaktion des markierten Antikörpers mit einem weiteren Antikörper gewährleistet. Die Nachweisgrenze des Tests liegt bei 10 IU HCG/l Urin. Schwangerschaftstest 5-9 Aufbau Auf einer hydrophilen Membran sind drei verschiedene Bereiche zu unterscheiden: 1. der Kontrollbereich (C), beschichtet mit polyklonalem Ziegen-Antimaus-IgG Antikörper (IgG), 2. der Testbereich (T), beschichtet mit polyklonalem Ziegen-Anti-HCG-Antikörper (IgG) und 3. der Probenauftragsbereich (P). Dieser Bereich enthält den getrockneten, mit kolloidalem Gold konjugierten monoklonalen Maus-Anti-HCG-Antikörper auf Papierstreifen, der mit der Membran verbunden ist. Kontrolle (C) Testergebnis (T) Probenauftrag (P) Durchführung: Stellen Sie das Testkit mit den Sichtfenstern nach oben auf den Labortisch. Füllen Sie die Pipette mit dem Testurin. Geben Sie exakt fünf Tropfen Testurin (ohne Luftbläschen) in das Probenauftragsloch. Warten Sie eine Minute und lesen Sie das Testergebnis im Sichtfenster ab. Der Test ist nicht verwertbar, wenn sich keine bzw. später als nach 5 Minuten eine Linie im Sichtfenster zeigt. Aufgaben: Protokollieren Sie das Testergebnis 1. Erklären Sie genau, wie Ihr Testergebnis zustande gekommen ist. Warum ist der T-Bereich positiv bzw. negativ? Warum ist der C-Bereich positiv? 2. Erklären Sie, warum bei einer nur mit LH versetzten Probe keine Reaktion im T-Bereich festgestellt werden kann, obwohl die dort vorhandenen polyklonalen Antikörper auch mit LH reagieren. 6-2 6-1 Versuch 6: Blut Versuche: Gelfiltration, Spektroskopie und die quantitative Bestimmung des Hämoglobins Dialyse-Versuch Enzymatische Bestimmung der Glucose Polarimetrie Analysen: 1. Hämoglobin-Bestimmung 2. Bestimmung von Glukose, Fruktose, Saccharose oder Xylose mittels I. Blut Gelfiltration, quantitative Bestimmung und Spektroskopie von verschiedenen Formen des Hämoglobins Die Funktion des Hämoglobins besteht im Transport von O2. Hämoglobin enthält als prosthetische Gruppe Häm, das im Zentrum eines Porphyrinrings ein Fe2+-Ion in Chelatform gebunden hält. Dieses Fe2+-Ion ist in der Koordination mit sechs Liganden am stabilsten. Vier davon werden von den Pyrrol-Stickstoffatomen des Porphyrinrings und ein weiterer durch einen Histidin-Stickstoff aus der Polypeptidkette der Globine geliefert. Die sechste Position kann durch verschiedene Liganden besetzt werden und bestimmt das Absorptionsspektrum des Hämoglobins. Im Oxihämoglobin z. B. ist die sechste Position mit molekularem Sauerstoff besetzt. Neben den für die unterschiedlichen Liganden Polarimetrie 1. Oxihämoglobin ____ 2. Desoxihämoglobin ........ 3. CO-Hämoglobin Wissensgebiete ------ Puffersysteme des Blutes, Azidose, Alkalose Hämoglobin als Puffer, 2,3-Bisphosphoglycerat Sauerstoff-Transport, Kohlendioxidtransport Myoglobin-, Hämoglobin-Struktur, Biosynthese, Porphyrin-Strukturen Katabolismus des Hämoglobins, Bilirubin-Chemie Transport, Glucuronidierung, Ikterusformen Kolloid-osmotischer Druck, Dialyse Enzymatische Grundlage des GOD-Testes (Coenzyme von GOD und POD, Funktion und Coenzym von Katalase) Optische Aktivität, Polarimetrie Abbildung 6-1: Absorptionscharakteristika von Hämoglobin mit unterschiedlichen Liganden. Spektralphotometrie 6-3 charakteristischen Absorptionsbanden zwischen 500 und 600 nm besitzen alle Hämoglobine eine gemeinsame Soret-Bande bei 415 - 430 nm. Charakteristika der einzelnen Hämoglobinarten: 1. Cyan-Methämoglobin ([CN-Hb(III)]): Das Fe2+ wird mit Hexacyanoferrat(III) zum Fe3+ oxidiert. Diese Form transportiert keinen Sauerstoff und besitzt eine braune Farbe eine Absorptionsbande bei 541 nm und ist eine stabile Verbindung 2. Oxihämoglobin ([O2-Hb(II)]): scharlachrot, zwei Absorptionsbanden im gelbgrünen bei 576 - 540 nm 3. Desoxihämoglobin oder "reduziertes" Hb ([Hb(II)]): purpurrot, eine Absorptionsbande bei 555 nm 4. Kohlenmonoxid-Hämoglobin ([CO-HB(II)]): kirschrot, Absorptionsbanden bei 570 nm und 541 nm Geräte: Glas-Chromatographiesäule, gefüllt mit Sephadex G25, grob Gummibällchen, Pasteurpipette Messpipetten 5 ml, 1 ml Reagenzglasständer mit Reagenzgläsern Spektralphotometer, Glasküvetten Lösungen: Transformationslösung (=Drabkin'sche Lösung) : 1 g NaHCO3, 50 mg KCN und 200 g K3[FeCN6]/l Heparin-Gesamtblut wird als Hämolysat zur Verfügung gestellt. Kaliumhexacyanoferrat(III) 5% in Puffer Natriumdithionit 1% in Puffer Phosphat-Puffer 20 mM, pH 7,0 6-4 Blut 1) Gelfiltration Prinzip: Gelfiltration trennt Substanzen nach Molekulargewicht. Für die Gelfiltration werden quervernetzte Polymere als Gelfiltrations-Medien verwendet. Wegen eines Ausschlußeffekts eluieren große Moleküle vor kleineren. In unserem Experiment wird das Hämolysat mit Dithionit reduziert und das aus dem Methämoglobin entstandene Desoxihämoglobin wird bei der Passage über die Säule durch die Größenfraktionierung vom überschüssigen Dithionit abgetrennt. Das Desoxihämoglobin wird durch Luftsauerstoff oxigeniert und als Oxihämoglobin eluiert. Ausführung: Eine vorbereitete 25 ml-Säule wurde an ihrem Ausfluss mit Glaswolle abgedichtet und mit einer Suspension von gequollenem Sephadex G25 bis zu einer Höhe von 8 cm gefüllt. Überpüfen Sie, ob die gepackte Säule frei von Luftblasen ist! Die Säule wird zuerst mit 10 ml Phosphat-Puffer gewaschen. Die Oberfläche der Säulenfüllung sollte eben sein. Wenn der Pufferspiegel gerade bis auf die Höhe des Säulenmaterials abgesunken ist, wird eine frisch hergestellte Mischung aus 0,2 ml Natriumdithionit-Lösung und 0,5 ml Hämolysat auf die Säule aufgetragen, ohne Säulenmaterial aufzuwirbeln. Man lässt die Lösung in das Säulenmaterial einsinken. Dann wäscht man zunächst mit 1 ml Puffer nach und füllt anschließend die Säule mit Puffer (ebenfalls möglichst verwirbelungsfrei). Die rotgefärbte Oxihämoglobin-Fraktion wird in einem Minimum Puffervolumen, ausreichend für eine Küvettenfüllung, aufgefangen. 2) Spektralphotometrie des Hämoglobins Ausführung: Das Oxihämoglobin, Methämoglobin und das Desoxihämoglobin werden für spektroskopische Messungen verwendet. a) Für das Oxihämoglobin wird das Eluat der Gelfiltration verwendet b) Methämoglobin: ca. 0,5 ml Hämolysat mit 1,5 ml Hexacyanoferrat c) Desoxihämoglobin: 0,5 ml Hämolysat mit 1,5 ml Dithionit-Lösung Die Farbe des Hexacyanoferrats und die der drei Formen des Hämoglobins sollten beobachtet werden. Die drei Lösungen werden unter Anleitung in einem mit einem Drucker verbundenen ULTROSPEC 1000 zwischen 600 bis 450 nm gegen Wasser Spektralphotometrie 6-5 gemessen und die Ergebnisse in 5 nm Schritten ausgedruckt. Zeichnen Sie die Spektren auf Millimeterpapier. 3) Bestimmung von Carboxihämoglobin Ausführung: Zu 0,5 ml Hämolysat werden 1 ml Phosphat-Puffer und 1 ml Dithionitlösung zugefügt. Dann mischen und innerhalb von 30 Sekunden in einer Küvette die Extinktionen im Spektralphotometer bei 555 und 480 nm messen. 0,2 ml CO- 6-6 Blut II. Dialyse-Versuch Prinzip: Niedermolekulare Stoffe lassen sich durch Diffusion durch eine semipermeable Membran in Richtung des Konzentrationsgefälles von kolloidalen Stoffen trennen. Die Kolloide können wegen ihrer Größe die Membranporen nicht passieren. Die Dialysegeschwindigkeit ist abhängig von: gesättigter Phosphatpuffer pH 7 werden zu der Probe gegeben. Sofort die Ex- 1) dem Verhältnis Membranoberfläche zum Flüssigkeitsvolumen tinktionen bei 555 und 480 nm messen! Trotz der 200-fach höheren Affinität des 2) dem Konzentrationsgefälle der niedermolekularen Stoffe auf beiden Seiten der Kohlenmonoxids zum Hb sollte eine Äquilibrierung mit Luftsauerstoff vermieden werden. Charakteristisch für den CO-Gehalt im Hb ist das Extinktionsverhältnis E555/E480. 100 % Desoxi-Hb: E555/E480 = 3,15 ± 0,05 100 % CO-Hb: E555/E480 = 1,94 ± 0,05 Nichtraucher haben 0,21-2 %, Raucher 0,7 %-6,5 % CO-Hb. 4) Quantitative Bestimmung des Hämoglobins als Hämoglobin-Cyanid Ausführung: In zwei Reagenzgläser legt man je 5 ml dest. Wasser vor. Mit einer 50 µl Spritze werden 0,05 ml Blut dazugegeben und sorgfältig vermischt. Die Spritze sofort mit dest. Wasser spülen. Danach gibt man 5 ml Transformations-Lösung dazu (gut umschütteln). Die Extinktion der Doppelbestimmung wird nach genau 30 min gegen den Leerwert (5 ml Wasser + 5 ml Transformationslösung) bei 546 nm gemessen. Auswertung: Berechnen Sie die Konzentration des Hämoglobins in g/100 ml Blut! MG = 68.000 Da; Extinktionskoeffizient: ε = 44⋅103 l⋅mol-1⋅cm-1 Membran. Die Dialyse findet nicht nur im biochemischen Laboratorium zur Entsalzung von Proteinen Anwendung. Ihre klinische Bedeutung liegt in der Anwendung der Dialyse in der künstlichen Niere. Geräte: Rührmotor, 250 ml Becherglas, Magnetrührfisch Vollpipette 25 ml Pasteurpipette Bürette Lösungen: Hg(NO3)2 (171,3 mg/l) 0,001 N Jod-Jodkaliumlösung 0,1 N Stärke-NaCl-Lösung: 200 ml Stärkelösung (0,5 %ig) + 50 ml 1 M NaCl (58,44 g NaCl/l) Ausführung: 5 ml Stärke-NaCl-Lösung werden in einen zuvor in Wasser eingeweichten Dialyseschlauch pipettiert. Die Enden des Schlauchs werden dabei mit Plastikklammern verschlossen. Danach wird der Schlauch insgesamt eine Stunde dialysiert. Als Dialysebad wird ein mit 250 ml dest. Wasser gefülltes Becherglas verwendet. Mit einem Magnetrührer wird das Dialysat gerührt. Nach 5, 10, 15, 20, 30, 45 und 60 Min. werden je 5 ml Dialysat entnommen und die Cl–-Menge im Dialysat nach Zugabe von sechs Tropfen Diphenylcarbazon- Glucosebestimmung 6-7 lösung durch Titration mit 0,001 N Hg(NO3)2-Lösung bestimmt. Die lachsrote Farbe des Indikators schlägt in tiefviolett um. Die mmol-Menge des Rest-Chlorids im Schlauch wird daraus berechnet. Nach Beendigung der Entnahmen werden Schlauchinhalt bzw. 5 ml des Dialysats mit zwei Tropfen Jod-Jodkaliumlösung versetzt. Beobachtung? Zeichnen Sie ein Diagramm: Abszisse: Zeit (Minuten), Ordinate: Restmenge Cl– im Schlauch in mmol. 6-8 Blut Lösungen Glucose-Standard: 100 mg Glucose in 100 ml H2O, bereitgestellt wird die Mischung von 1 ml Glucose Standard + 10 ml Perchlorsäure Glucose-Reagenz: 2 mg Peroxidase, 18 mg Glucose-Oxidase und 100 mg 2,2'-Azino-di[3-ethyl-benzthiazolinsulfonsäure-6]-diammoniumsalz (H2-Donator) in 100 ml 0,1 M Phosphatpuffer (pH 7). Perchlorsäure: 0,33 M, 47 g 70 %ige HClO4 in 1000 ml H2O III. Enzymatische Bestimmung der wahren Glucose Durchführung: Eine schnelle, sichere und spezifische Bestimmungsmethode der Blutglucose im Serum beruht auf folgender Reaktion: Die Glucoseoxidase (GOD), ein FADEnzym aus Penicillium notatum, katalysiert die Oxidation von D-Glucose zum Gluconolacton, das mit Wasser zu Gluconsäure hydrolysiert: 1 ml Blut wurde mit 0,1 ml Citratlösung versetzt, um die Gerinnung zu verhindern. Danach wurden 10 ml 0,33 M Perchlorsäure zugesetzt, die Lösung in ein Zentrifugenglas umgefüllt und 20 Minuten zentrifugiert. Der Überstand wurde vorsichtig in ein Reagenzglas überführt. GOD → Glucose + H2O + O2 1. Die Enteiweißung wurde vom Assistenten wie folgt vorbereitet: Gluconsäure + H2O2 Das dabei entstehende H2O2 wird in einer gekoppelten Indikatorreaktion weiter Das Reagenzglas mit dem Überstand steht dann für Sie am Arbeitsplatz bereit! 2. Bereiten Sie folgende Ansätze in fünf Reagenzgläsern vor: umgesetzt, indem es durch Peroxidase (POD) katalytisch einen Wasserstoff- 1 Reagenzien-Leerwert 0,1 ml Wasser donator 2 Serumproben je 0,1 ml Zentrifugenüberstand 2 Glucose-Standardwerte je 0,1 ml Glucose-Standardlösung wie z. B. das 2,2'-Azino-di-[3-ethyl-benzthiazolinsulfonsäure-6]- diammoniumsalz oxidiert. + – NH4 O 3S je 5 ml Glucose-Reagenz dazugeben, sofort schütteln! Die Proben werden S =N–N= N C 2H 5 S SO –3 NH4 + N C 2H5 35 Minuten bei Raumtemperatur stehengelassen und dann die Extinktionen im Photometer bei 436 nm gegen den Reagenzien-Leerwert gemessen, d.h. Sie stellen zuerst die Extinktion des Leerwerts auf 0,000 und messen dann Ihre Proben. Wenden Sie zur Ergebnisberechnung den Dreisatz an und berücksichtigen Sie dabei, dass der Glucosestandard (100 mg/100 ml), wie das Blut, mit dem gleichen Ammoniumsalz der ABTS: 2,2'-Azino-di-[3-ethyl-benzthiazolinsulfonsäure-6] Volumen Perchlorsäure versetzt wurde. Geben Sie das Ergebnis in mg Glucose/100 ml Blut und mmol Glucose/l Blut an. Polarimetrie 6-9 Berücksichtigen Sie dabei, dass das Blut vor der Enteiweißung durch Zugabe von 6-10 Blut planpolarisiertes Licht Citratlösung ungerinnbar gemacht wurde (Verdünnungsfaktor!). Vergleichen Sie das Ergebnis mit den Normalwerten. optisch aktive Substanz IV. Polarimetrie Prinzip: Von vielen biochemisch wichtigen Verbindungen (z.B. Aminosäuren, Zucker) gibt es theoretisch zwei räumlich nicht identische, stereoisomere Formen, die sich wie Bild und Spiegelbild verhalten (vgl. rechter und linker Schuh). Grund hierfür ist in der Regel ein im Molekül vorhandenes Kohlenstoffatom mit vier unterschiedlichen Substituenten, das dem Molekül eine Asymmetrie verleiht. In der Natur kommt aber nie das Gemisch beider Formen, das sogenannte Racemat vor, sondern immer nur eine der beiden Formen (Enantiomere), z. B. die LAminosäuren oder D-Glukose. Die Bezeichnungen D-, L- (nach Emil Fischer), beziehen sich nur auf die sterische Konfiguration der Moleküle und keinesfalls auf optische Eigenschaften; denn eine solche asymmetrische Verbindung kann die Ebene des polarisierten Lichtes nach rechts oder links drehen. Eine Substanz, die das planpolarisierte Licht im Uhrzeigersinn dreht, nennt man rechtsdrehend (+). Linksdrehende Substanzen (-) drehen die Ebene nach links. Die Größe und Richtung der Drehung sind spezifisch für jede Verbindung. Der spezifische Drehwinkel einer Substanz [α]D20 errechnet man aus derm gemessenen Drehwinkel α, der Schichtdicke l (in Dezimetern!) und der Konzentration c (in g/100 ml Lösung!): [α]D 20 = α • 100 l • c grad • 100 dm • g / 100ml Ebene des planpolarisiertes Lichts ist gedreht Abbildung 6-2: Schematische Veranschaulichung der Drehung der Ebene des planpolarisierten Lichtes durch eine optisch aktive Substanz. Der spezifische Drehwinkel ist von der Wellenlänge, der Temperatur und dem Lösemittel abhängig. Diese Parameter müssen immer mit angegeben werden. Als Lichtquelle wird die D-Linie einer Natriumspektrallampe (589 nm) benutzt. Der Drehwinkel wird mit Hilfe des Polarimeters bestimmt. Das Nicolsche Prisma besteht aus zwei in einer bestimmten Ebene geschnittenen und durch Kanadabalsam verkitteten Flussspatkristallen, die nur den ausserordentlichen Strahl als planpolarisiertes Licht durchlassen, während der ordentliche Strahl durch Totalreflexion an der Kittschicht ausgelöscht wird. Nach Durchgang des auf dieser Weise am Polarisator-Prisma planpolarisierten Lichts durch die optisch aktive Substanz in der Küvette trifft es auf das Analysator-Prisma, das nun gedreht werden muss, um im Einstellfeld des Okulars wieder gleichen Lichtdurchgang wie bei der Nulleinstellung und Eichung des Polarimeters gegen das reine Lösungsmittel zu bekommen, also die gleiche Helligkeit in den beiden äußeren und dem mittleren Feld. Den Drehwinkel und die Richtung liest man an der graduierten Drehscheibe ab, die mit dem Analysator gekoppelt ist. Polarimetrie 6-11 6-12 Blut mit Hilfe des Nonius der Drehwinkel auf 0,05 Grad genau abgelesen. Aus dem gemessenen Wert wird der spezifische Drehwinkel berechnet. 1 2 3 4 5 6 rechts links Abbildung 6-3: Schematische Zeichnung eines Polarimeters 1) Lichtquelle mit Farbfilter (Natriumdampflampe/D-Linie) 2) Polarisator (Nicolsches Prisma) 3) Küvette mit Lösung der optisch aktiven Substanz 4) Analysator, versehen mit graduierter Drehscheibenskala 5) Okular 6) Beobachterauge Ausführung: Die spezifischen Drehwinkel der beiden Testlösungen (Glukose und Fruktose) und der Analysenlösung sollen ermittelt werden. Eine Substanz oder Lösung ist rechtsdrehend, wenn die beiden Außenfelder des dreigeteilten Einstellfeldes dunkler als das mittlere Feld sind. In diesem Fall dreht man die Skala so, dass sie bei der Einstellung auf eine gleiche Helligkeitsstufe nach links wandert. Bei Linksdrehung erscheint das mittlere Feld dunkler. Hier erfolgt beim Abgleich der Helligkeit eine Verschiebung der Skala nach rechts. a) Die Nulleinstellung (gleiche Lichtstärke der drei Felder) wird am Polarimeter an der Analysator-Skala geprüft. b) Das Polarimeterrohr wird mit der zu bestimmenden Lösung luftblasenfrei gefüllt. Ein luftblasenfreies Rohr bekommt man am einfachsten dann, wenn sich der Flüssigkeitsspiegel der Lösung etwas über dem plangeschliffenen Ende des Rohres wölbt. Nun wird das Deckglas aufgezogen und das Rohr verschlossen. Es ist darauf zu achten, dass das Polarimeterrohr sauber und trocken in das Gerät eingelegt wird! c) Durch Drehen des Analysators in der oben angegebenen Richtung wird das Hell-Dunkel-Feld auf die gleiche Helligkeitsstufe gebracht und an der Skala Abbildung 6-4: Im Okular sichtbare Einstell- und Ablesefelder Analyse: Berechnen Sie mit Hilfe der Formel auf Seite 6-9 den spezifischen Drehwinkel und geben Sie im Vergleich mit den in der Tabelle 6-1 angegeben Werten an, um welchen Zucker es sich handelt. Die Konzentrationen der Analysenlösungen betragen 9 g/100 ml. Tabelle 6-1 Spez. Drehwinkel 20 [α]D Xylose Glucose Fructose Saccharose +18,7 +52,8 -92 +66,5 Aufgaben 6-13 Übungsaufgaben: 1. Wie beeinflusst 2,3-Diphosphoglycerat die Sauerstoff-Affinität des Hämoglobins? 2. Welche Funktion erfüllt Glutathion im Erythrocyten? 3. Zeichnen Sie die O2-Sättigungskurve von Hämoglobin in Abhängigkeit von pO2 und ihre Veränderung durch 2,3-Bisphosphoglycerat. 4. a)Welches Endprodukt des Porphyrinabbaus wird in der Leber gebildet? b)Wie verändert sich der Serumgehalt dieser Verbindung bei: A) einem Gallengangsverschluss B) bei massiver Hämolyse? 5. Warum entstehen Ödeme bei längerem Hungern? 6. Welche Porengrößen einer Membran wären für die Dialyse eines Nierenkranken geeignet: 500 Da, 50.000 Da oder 500.000 Da ? 7. In welcher Reihenfolge eluieren Carboanhydrase (29000 Da), Lactalbumin (14200 Da), Phosphorylase B (97400 Da), Albumin aus Ei (45000 Da) und Serumalbumin (67000 Da) von einer Gelfiltrationssäule? 8. Die Glukosekonzentration im Serum eines Patienten beträgt 6 mmol/l. Berechnen Sie die Konzentration in mg/100 ml. 7-1 Versuch 7: Nukleinsäuren I Versuche: Löslichkeit der Harnsäure Xanthinoxidase-Reaktion und ihre kompetitive Hemmung Bestimmung der Harnsäure mit Hilfe der UV-Spektroskopie 7-2 Nucleinsäuren I Grundbestandteile der Nukleinsäuren sind die Nukleotide, die wiederum aus folgenden Bestandteilen aufgebaut sind: a) Pentose b) Phosphat c) N-haltige heterozyklische Basen: Purinreihe: Adenin, Guanin Pyrimidinreihe: Cytosin, Uracil (RNA), Thymin (DNA). Restriktionsendonukleasen Polymerasekettenreaktion (PCR) OH NH2 N Analyse: HO Hypoxanthin in 50 mM Phosphatpuffer pH 7,5 Ribose - RNA- und DNA-Struktur Biosynthese der Pyrimidin- und Purinbasen, Salvage Pathway Purin-Abbau, Harnsäure, Xanthinoxidase, Uricase, kompetitive Hemmung, Gicht Stickstoffbilanz Restriktionsendonukleasen, rekombinante DNA PCR O P O -O O O OH OH UMP N AMP O N N HO Ribose P OH N N N O Wissensgebiete N N N NH2 H2N N N Ribose Ribose - O P OH CMP O O -O P O OH GMP Die Nukleotide sind in DNA und RNA durch Phosphorsäurediesterbindungen verknüpft. Die geringe Löslichkeit von Nukleinsäuren in Wasser-Alkohol-Gemischen bzw. ihre Löslichkeit in konzentrierter Kochsalzlösung nutzt man zu ihrer Isolierung. Während die Endprodukte des Pyrimidinstoffwechsels, β-Alanin und β-Aminoisobutyrat, Aminosäuren sind und verstoffwechselt werden können, ist Harnsäure beim Menschen und den anderen Primaten das Endprodukt des Purinstoffwechsels (also auch des mit der Nahrung als Nukleinsäuren aufgenommenen Purins). Harnsäure entsteht durch schrittweise Oxidation der Purinbasen Hypoxanthin und Xanthin mit molekularem Sauerstoff unter der Wirkung von Xanthinoxidase. Harnsäure und Mononatriumurat sind schwer löslich. Bei Stoffwechselstörungen kann diese geringe Löslichkeit zu Ablagerungen (Gicht, Nierensteine) führen. Harnsäure Interessant ist unter 7-3 diesem Gesichtspunkt die pH-Abhängigkeit der Harnsäurelöslichkeit (Abb. 7-1 Schema nach E. Aebi). Bei Vermeidung von Fleischkost und Verwendung von Pflanzen-, sog. Basenkost, wird weniger Harnsäure gebildet, und außerdem verschiebt sich der pH-Wert des Urins nach rechts, es kann mehr Harnsäure ausgeschieden werden. Zur Therapie der Gicht wird u.a. Allopurinol (1H-Pyrazolo-(3,4-d)-pyrimidin-4-ol), ein kompetitiver Hemmstoff der Xanthinoxidase, angewandt. 7-4 Nucleinsäuren I I. Harnsäure Geräte: Messpipetten Plastikküvetten Spektralphotometer 1 ml, 5 ml 2 × 1 cm Lösungen: Natronlauge, HCl Na2CO3-Lösung 2N 2N Natrium-Allopurinol -Lsg. Boratpuffer Serum Substratpuffer-Lösung: 1,5 mM 0,1 M; pH 9,5 50 mM Phosphatpuffer pH 7,5; 100 µM EDTA Hypoxanthin (ist 10 min. mit Sauerstoff durchperlt) 1,8 kU/l 1 g/l Uricaselösung: Xanthinoxidaselösung: 1) Löslichkeit von Harnsäure Die Harnsäure ist in Wasser fast unlöslich, in Na2CO3-Lösung gering löslich als Mononatriumsalz, und in NaOH-Lösung gut löslich bei Erwärmen unter Bildung des Dinatriumsalzes. Abbildung 7-1: Abhängigkeit der Harnsäurelöslichkeit vom pH-Wert Ausführung: Je ca. 3 ml dest. Wasser, Na2CO3-Lösung und Natronlauge werden mit einer Spatelspitze Harnsäure versetzt. Während sich Harnsäure in Lauge in der Hitze (Wasserbad, Schutzbrille) unter Bildung von Dinatriumurat löst, ist dies in dest. Hyperurikämie von Bedeutung. Bei den meisten Säugetieren (nicht beim Menschen!) wird die Harnsäure durch das Enzym Uricase unter gleichzeitiger Bildung von Wasserstoffperoxid weiter zu Allantoin abgebaut: Harnsäure-Normalwerte beim Erwachsenen: Urin: 500 - 580 mg/Tag Serum: 3,3 - 7,6 mg/100 ml (Mann) 1,7 - 6,2 mg/100 ml (Frau) O O Der Gehalt des Serums an Harnsäure ist für die Diagnose und Überwachung der N HN N 1 N HN NH O Hypoxanthin O NH Xanthin NH 2 HN O NH O NH NH Harnsäure O 3000 - 3500 µmol/d 200 - 450 µmol/l 100 - 360 µmol/l 1 und 2: Xanthinoxidase HN Allopurinol N N N H Harnsäure 7-5 Wasser und Na2CO3-Lösung nicht der Fall. Die Dinatrium-Urat-Lösung wird anschließend mit wenigen Tropfen HCl versetzt. Die Harnsäure fällt als weißer, flockiger Niederschlag aus. 7-6 Nucleinsäuren I den ersten 5 Minuten wird die Extinktion wird alle 30 s gemessen und anschließend noch nach 10, 15 und 20 Minuten. 2) Xanthinoxidase-Reaktion und ihre kompetitive Hemmung Der Versuch wird wiederholt, jedoch werden vor dem Start mit Xanthinoxidase 100 µl Allopurinol-Natrium-Lösung in die Küvette pipettiert und gut gemischt (Abb. 7-2, Kurve 2). Prinzip: Die Oxidation von Hypoxanthin zu Xanthin und weiter zu Harnsäure durch die Xanthinoxidase in Gegenwart von Sauerstoff wird spektrophotometrisch bei 297 nm verfolgt. Urate haben in alkalischer Lösung einen spezifischen Extinktionskoeffizienten von ε297 = 11,8 l/mmol.cm. Aus der Differenz der gemessenen Endextinktion zur Anfangsextinktion lässt sich die Hypoxanthinmenge berechnen. Auswertung: Die gemessenen Extinktionen werden in einem Diagramm gegen die Zeit aufgetragen. Aus den Zeitumsatzkurven für Xanthinoxidase werden die µmol Hypoxanthin/l Lösung, die Enzymkonzentration (U/l) und der Hemmungsgrad (%) berechnet. 3) Bestimmung der Harnsäure mit Hilfe des UV-Tests Extinktion 1,4 1,2 Prinzip: Die Umwandlung von Harnsäure zu Allantoin durch Uricase wird spektralphotometrisch verfolgt. 1 1,0 0,8 O 0,6 2 0,4 0,2 O 0,0 0 10 20 NH HN 30 40 Zeit [min] Abbildung 7-2: 1) Bildung von Harnsäure durch Oxidation von Hypo-xanthin mit Xanthinoxidase 2) Hemmung der Xanthinoxidase mit Allopurinol Ausführung: 3 ml einer sauerstoffgesättigten Hypoxanthinlösung werden in eine 1 cm-Plastikküvette pipettiert. Die Extinktion wird zweimal gegen dest. Wasser bei 297 nm gemessen. Durch Zugabe von 100 µl Xanthinoxidase startet man die Reaktion. In O NH NH Harnsäure O NH2 Uricase O NH NH O NH H Allantoin Ausführung: 200 µl Serum und 3 ml 0,1 M Boratpuffer pH 9,5 in einer Plastikküvette werden bei 297 nm gegen dest. Wasser gemessen. Danach werden 200 µl Uricaselösung eingerührt und der Extinktionsabfall verfolgt. Messwerte werden in Abständen von 30 Sekunden bis zur Konstanz genommen. Aus der Differenz der Anfangsextinktion und des konstanten Endwertes wird die Harnsäurekonzentration in µmol/l Serum berechnet. Restriktionsendonukleasen II. 7-7 Restriktionsendonukleasen: Charakterisierung eines Plasmids Restriktionsendonukleasen (RE) kommen in fast jedem Mikroorganismus vor und spalten doppelsträngige DNA unter Bildung von Restriktionsfragmenten. Ein DNA-Strang wird von einem RE spezifisch gespalten und liefert reproduzierbare DNA-Fragmente. Ein Genom kann so in kleine DNA-Stücke, von denen jedes ein ganzes Gen oder Teile davon enthält, zerlegt werden. Sie können isoliert, kloniert und in ihrer Nukleotidsequenz analysiert werden. Die Bakterien-DNA wird durch Methylierung von Basen vor dem Angriff durch die eigene RE geschützt. Fremd-DNA, die durch Infektion, Konjugation oder Transformation in die Zelle eindringt, wird abgebaut, falls sie nicht durch Methylierung (katalysiert durch Methylasen mit S-Adenosylmethionin als Methyldonator) modifiziert wird. Typ I-Endonukleasen, die an der Wirts-Restriktion und –Modifikation beteiligt sind, sind große multimere Enzymkomplexe, die DNA unter ATP-Verbrauch spalten und methylieren. Vom Typ II, kleinen monomeren Proteinen, die Mg2+ für die enzymatische Aktivität benötigen, sind mehr als 250 RE bekannt. Sie erkennen spezifische Nukleotidsequenzen von 4 bis 8 Basenpaaren, die palindromartig angeordnet sind. Die Nomenklatur der Enzymbezeichnungen sind aus dem Anfangsbuchstaben des Genus und den ersten zwei oder drei Buchstaben der Spezies zusammengesetzt, aus der sie isoliert wurden. Die römische Zahl deutet die Reihenfolge der Entdeckung des Enzyms in diesem Stamm an: EcoRI: Escherichia coli Stamm R: Palindrom aus Hexanukleotid 5' 3' GAATTC CTTAAG 3' Dyaden-Symmetrie 5' (zweifache Rotationssymmetrie) Es entstehen 3'-überstehende Enden an der Schnittstelle, (sticky ends). HinfI: Haemophilus influenzae Stamm f: Pentanukleotid 5' 3' GANTC CTNAG (sticky ends) HaeIII: Haemophilus aegypticus: Tetranukleotid 5' 3' GGCC CCGG liefert glatte Enden (blunt ends) 7-8 Nucleinsäuren I Statistisch gesehen treten diese Palindrome mit einer Häufigkeit von 1:44, 1:45, 1:46, d. h. in einem von 256, 1024 bzw. 4096 Fällen. 1:4N N = Länge der Restriktionssequenz Medizinische Bedeutung: Jedes Gen kann in charakteristische Restriktionsfragmente gespalten werden, wobei ein spezifisches Restriktionsmuster entsteht. Mutationen des Gens sind am Verschwinden oder der Längenveränderung eines oder mehrerer Fragmente, dem Restriktionsfragment-Längenpolymorphismus (RFLP) erkennbar. Die Analyse der genomischen DNA von Patienten oder auch des Föten in der pränatalen Diagnostik ist eine wichtige Methode bei der Diagnostik von Erbkrankheiten. Man geht dabei folgendermaßen vor: Aus Blut oder beliebigen anderen Körperzellen wird DNA isoliert. Aliquots werden mit verschiedenen Restriktionsenzymen geschnitten und die entstandenen Fragmente gelelektrophoretisch aufgetrennt. Als Vergleich dient eine analog behandelte Probe von DNA eines gesunden Individuums. Die Fragmente werden aus dem Gel auf eine Nylonmembran übertragen (Southern blotting). Sie wird dabei denaturiert, so dass sie einzelsträngig vorliegt. Die Nylonmembran wird mit einem ebenfalls einzelsträngigen, radioaktiv markierten DNA-Fragment inkubiert, das zu einer Region des Gens komplementär ist und daher mit diesem Bereich paart (hybridisiert), und so die zu dem untersuchten Gen gehörigen Fragmente radioaktiv markiert. Auf einem Röntgenfilms werden sie durch die Autoradiographie sichtbar gemacht. DNA von verschiedenen Patienten werden auf strukturelle Änderungen des Gens hin verglichen. Im folgenden Versuch werden Restriktionsenzyme zur Analyse der DNA eines Plasmids eingesetzt, das als Insert die cDNA des menschlichen Apolipoproteins AI trägt. Apo AI (243 AS) aktiviert die Serum-Lecithin-CholesterinAcyltransferase (LCAT) und ist ein Hauptstrukturprotein des Serum-HDLs, das für den reversen Cholesterin-Transports aus den peripheren Geweben hin zur Leber verantwortlich ist. Restriktionsendonukleasen 7-9 Tabelle 7-1: Restriktionsenzyme und Fragmentlängen in Basenpaaren (bp) Enzym Fragmentlänge (bp) HindIII EcoRI 905 246 5016 892 2130 2650 7-10 Nucleinsäuren I Nach der Isolierung des pSV2 cat-AI-Plasmids kann das Plasmid durch die kombinierte Anwendung der Restriktionsenzyme EcoRI und HindIII charakterisiert werden. Es sollten die DNA-Fragmente entstehen, die in der Tabelle 7-1 aufgelistet sind. Sie werden in einem 1-%igen Agarosegel getrennt und durch Ethidiumbromid (Hautkontakt vermeiden!), das mit DNA fluoreszierende Komplexe bildet, in UV-Licht sichtbar gemacht. Die Fragmentgrößen werden durch Eichung mit DNA-Längenmarkern ermittelt. Die Rf-Werte der Markerbanden werden gegen den dekadischen Logarithmus der Basenpaarzahl aufgetragen und die Größe der aus dem Klon entstandenen Fragmente mit Hilfe der Eichgeraden bestimmt. M H E kb -21,6 15 4 3 0,2 - Abbildung 7-3 : pSV2 cat AI - Plasmid Der menschliche Apo AI-cDNA-Klon wurde aus einer menschlichen LebercDNA-Bank isoliert. Der Klon kodiert 18 N-terminale Aminosäurereste der Signal- (Prä-) Sequenz, gefolgt von sechs Resten der Pro-Sequenz und 243 Aminosäureresten des reifen Apo AI. Die an beiden Enden mit der EcoRI-Restriktionssequenz versehene cDNA wurde über Adaptoren an beiden Seiten in die HindIII-Restriktionsstelle des Plasmis pSV2 cat kloniert, wie in der Abb. 7-3 schematisch angedeutet. 0,5 Abbildung 7-4 : Agarosegelelektophorese des mit Hilfe von HindIII oder EcoRI verdautem pSV2 cat AI - Plasmids. M: Längenmarker, H: HindIII-Fragmente, E: EcoRI-Fragmente Restriktionsendonukleasen 7-11 Geräte: Agarosegel, 1 % mit 0,5 µg Ethidiumbromid/ml Elektrophorese-Puffer: Tris-Borat pH 8,5 Flachbettelektrophoresekammer mit Spannungsgerät Saranfolie UV-Lampe Lösungen: 10 × Restriktionspuffer: Indikator-Probenpuffer: 0,25 % Bromphenolblau, 20 % Ficoll 400 Restriktionsenzyme: EcoRI und HindIII Marker-DNA Ausführung (Demonstration vom Assistenten): Die Enzyme sind stets im Eisbad aufzubewahren. Lösungen oder Geräte, die mit DNA in Kontakt kommen, sollten nicht mit den Fingern berührt werden. In ein 1,5 ml Eppendorf-Röhrchen werden folgende Komponenten pipettiert: 2 µl 10 x Restriktionspuffer 14 µl H2O 2 µl DNA pSV2 cat AI-Lösung 2 µl EcoRI bzw. HindIII enthaltenden Enzymlösung, gut gemischt, und eine Stunde lang bei 37 °C inkubiert. 5 µl Indikator-Probenpuffer werden zugefügt und der Ansatz in die Probentasche des Agarose-Gels vorsichtig mit einer Eppendorf-Pipette eingefüllt. Ein Gemisch von 10 µl H2O, 5 µl Indikator-Probenpuffer und 5 µl Längenmarker wird in die Nachbartasche aufgetragen. Der Puffer in der Kammer schließt gerade mit der Oberkante des Agarosegels ab. Die Elektrophorese wird bei 90 V durchgeführt, bis die Bromphenolblaubande etwa 1 cm vom kathodischen Ende des Gels entfernt gewandert ist. Das Spannungsgerät wird ausgeschaltet und das Gel, eingewickelt in Saranfolie, unter dem UV-Licht betrachtet. Mit Hilfe eines Videoaufzeichnungsgerät (siehe Versuch 2) wird das Gel dokumentiert. Die Abstände der fluoreszierenden Banden zum Start werden gemessen und die Größe der DNA Fragmente durch eine halblogarithmische Auftragung bestimmt. 7-12 Nucleinsäuren I III. PCR Kary B. Mullis, Nobelpreisvortrag 1993: „And again, EUREKA!!!! I could do it over and over again. Every time I did it I would double the signal. For those of you who got lost, we're back! I stopped the car at mile marker 46,7 on Highway 128. In the glove compartment I found some paper and a pen. I confirmed that two to the tenth power was about a thousand and that two to the twentieth power was about a million, and that two to the thirtieth power was around a billion, close to the number of base pairs in the human genome. Once I had cycled this reaction thirty times I would be able to the sequence of a sample with an immense signal and almost no background“ Die Polymerasekettenreaktion („polymerase chain reaction“) ist eine einfache Methode zur Vervielfältigung von DNA in vitro und ist heute im molekularbiologischen Labor unverzichtbar geworden. Mit Hilfe einer vorgeschalteten ReversenTranskriptase-Reaktion ist auch die Vervielfältigung von RNA möglich (RTPCR). Die Anwendung der PCR in der Medizin ist inzwischen Routine bei der Diagnostik von Infektionskrankheiten (Bakterien, Viren, Einzeller, Pilze), von genetisch bedingten Erkrankungen und in der Forensik. Die PCR ist eine DNA-Replikation im Reagenzglas, bei der eine DNA-abhängige DNA-Polymerase eingesetzt wird. Als Matrize dient dabei jeweils einzelsträngige DNA, die durch thermische Denaturierung doppelsträngiger DNA gewonnen wird. Das Besondere dieser Methode ist der Einsatz einer thermostabilen Polymerase, die einen raschen zyklischen Reaktionsablauf ermöglicht, durch den sich der DNA-Gehalt pro Zyklus verdoppelt. Es ist also theoretisch möglich, aus einem 35 10 einzigen DNA-Fragment in 35 Zyklen 2 = 3,4x10 Moleküle (34 Milliarden!) zu generieren. Damit ist die Möglichkeit gegeben, einzelne Moleküle nachzuweisen. Welches Stück DNA amplifiziert werden soll, hängt von der Auswahl der Primer ab, die die 5’- und 3’-Enden der amplifizierten DNA bilden. Zumindest die in den Primer enthaltene Sequenz der zu amplifizierenden DNA (RNA) muss daher bekannt sein. In späteren Zyklen entstehen nur noch Fragmente mit der genau gewünschten Länge, die von den 5’-Enden der Primer festgelegt wird. Als Primer werden chemisch synthetisierte, einzelstängige Oligonukleotide eingesetzt, die eine Länge von ca. 20 Basen haben. PCR 7-13 Bereich der Zielsequenz 5' 3' 1. Denaturierung 2. Anlagerung der Primer 5' 3' 3. Kettenverlängerung 1. Zyklus 21 = 2 5' 3' 3' 5' Wiederholung von 1. und 2. 5' 3' 5' 3' 2 Wiederholung von 3. 5' 3' 3' 2. Zyklus 2 = 4 5' 5' 3' 5' 3' Wiederholung von 1. bis 3. 5' 3' 3' 3' 5' 5' 3' 5' 3. Zyklus 23 = 8 5' 3' 5' 3' 5' 3' 5' 3' vielfache Wiederholung von 1. bis 3. 5' 3' Abb. 7-5: PCR-Schema PCR-Produkt, 2N Moleküle N. Zyklus 2N=X 7-14 Nucleinsäuren I Im Einzelnen läuft eine PCR wie folgt ab (Abb.7-5): Die Matrizen-DNA (template) wird zusammen mit den spezifischen Primern, dem Substrat, den Desoxinukleotiden (dNTPs), der thermostabilen Polymerase (z.B. aus Thermus 2+ aquaticus) und einem Mg -Ionen enthaltenden Puffer in ein Eppendorfgefäß gegeben. Der PCR-Ansatz wird dann in einem sogenannten Thermocycler einem Programm mit einer Wiederholung von spezifischen Temperaturen für Denaturierung, Anlagerung der Primer und Kettenverlängerung unterworfen. Die Denaturierung findet bei 95°C statt, einer Temperatur, bei der die Polymerase eine für die Versuchsdauer ausreichende Stabilität aufweist. Eine Dauer von 30-60 s ist normalerweise ausreichend; nur die erstmalige Denaturierung zu Beginn der Reaktion sollte 5 min betragen. Zur Anlagerung der Primer (Annealing) wird die Temperatur soweit abgesenkt, dass sich nur spezifische Primer mit der komplementären Sequenz anlagern können. Die Temperatur sollte 5°C unter der sogenannten Schmelztemperatur liegen, die man näherungsweise mit Hilfe der Formel Tm=(ΣA+ΣT)x2°C+(ΣG+ΣC)x4°C berechnen kann. Auch hier sind 30-60 s ausreichend. Die Kettenverlängerung findet dann im Temperaturoptimum der Polymerase bei 72°C statt. Die Dauer dieses Schrittes hängt von der Länge des zu amplifizierenden DNA Fragments ab. Als Faustregel gilt: 1 min pro 1000 Basenpaaren (bp). Der finale Kettenverlängerungsschritt wird üblicherweise auf 5-10 min ausgedehnt, um zu gewährleisten, dass auch alle DNA-Moleküle, die dann in maximaler Menge vorliegen, vollständig verlängert werden. Die Anzahl der Zyklen richtet sich nach der vorhandenen Menge der zu amplifizierenden DNA und beträgt normalerweise 25-40 Zyklen. Die Länge der Fragmente ist limitiert. Generell gilt: Je kürzer die Fragmente, umso unkomplizierter die PCR Reaktion. Bis zu einer Länge von ca. 3000 bp ist in den meisten Fällen die oben beschriebene Standardmethode erfolgreich, Fragmente bis zu 10.000 bp können durch die Anwendung spezieller Polymerasen und die Optimierung der spezifischen Reaktionsbedingungen hergestellt werden. Auch die Herstellung von Fragmenten >10.000 bp ist beschrieben worden. DNA, die in der PCR eingesetzt wird, kann aus den unterschiedlichsten Quellen stammen. Es werden nur geringste Mengen an Gewebe, Blut, Speichel oder Sperma benötigt, um genomische DNA zu amplifizieren. DNA von Erregern kann Aufgaben 7-15 auch noch in einem großen Hintergrund von Fremd-DNA nachgewiesen werden. Im Extremfall ist dadurch ein einziger Erreger unter 106 eukaryotischen Zellen nachweisbar. Der Nachweis der DNA erfolgt normalerweise durch Elektrophorese in Ethidiumbromid-gefärbten Agarosegelen. 7-16 Im vorliegenden Versuch sollen Sie mit Hilfe der PCR Ihr Geschlecht bestimmen. Dazu soll ein repetitives DNA-Fragment amplifiziert werden, das auf dem YChromosom liegt und daher nur in „männlicher“ DNA und nicht in „weiblicher“ DNA nachgewiesen werden kann. Da ein repetitives DNA-Fragment (= in mehreren Kopien vorliegend) amplifiziert wird, reichen 25 Zyklen aus, um genügend DNA für eine Analyse mittels Agarosegel zu erhalten. • Verwenden Sie den Überstand für die PCR. Geräte : Thermocycler BIOZYM PTC 200 Agarosegel-Flachbettkammer, Spannungsgerät Lösungen: PBS 0,1 MNaOH PCR-Mix Endkonzentration: 50 mM KCl; 10mM Tris, pH 8,3; 1,5 mM MgCl2; 0,2 mM dNTP’s; 0,2 µM Primer Y1/Y2; 1 U Taq-Polymerase pro Ansatz. Primer Y1: 5’ TCCACTTTATTCCAGGCCTGTCC 3’ Primer Y2: 5’ TTGAATGGAATGGGAACGAATGG 3’ 1) Schnellpräparation von DNA aus Zellen der Mundschleimhaut • Spülen Sie Ihren Mund mit Leitungswasser aus und verwerfen das Wasser. • Spülen Sie anschließend den Mund sehr sorgfältig für 10s mit 10ml phosphatgepufferter physiologischer Kochsalzlösung (PBS) und sammeln die Probe in einem 15ml Zentrifugenröhrchen. Nucleinsäuren I abkühlen und geben Sie 400 µl dest. Wasser dazu. (Vorsicht beim Öffnen, Schutzbrille tragen!) • Zentrifugieren Sie für 2min in einer Mikrozentrifuge bei voller Geschwindigkeit. 2) PCR Pipettieren Sie 20µl des PCR-Mix auf den Boden eines 250µl-PCR-Eppendorfgefäßes. (Vorsicht: Das Gefäß ist sehr dünnwandig und leicht zu beschädigen!). Geben Sie dann 5µl der DNA-Lösung so zu den 20µl PCR-Mix, dass eine einheitliche Lösung entsteht und verschließen Sie vorsichtig das Gefäß (evtl. kurz zentrifugieren). Stellen Sie das Gefäß in den Thermocycler. Das Programm wird dann vom Assistenten gestartet. Programm (Dauer ca. 70min.): Start 5min 95 °C 30s 95 °C 25 Zyklen 30s 58 °C 30s 72 °C Auffüllen 2min 72 °C 3) Agarose-Gelelektrophorese • Gießen Sie den Überstand ab und resuspendieren Sie das Zellpellet mit ca. 10ml PBS. Die Ansätze werden nach Beendigung der PCR mit 5µl Beladungspuffer vermischt und mit Unterstützung des Assistenten auf ein mit Ethidiumbromid versetztes, 2%iges Agarosegel aufgetragen. Zum Vergleich wird eine positiver und ein negativer PCR-Ansatz mit aufgetragen. Die Elektrophorese wird bei 90 V durchgeführt. Nachdem der Farbmarker ca. 1-2 cm ins Gel eingelaufen ist, wird das Gel zur Dokumentation im UV-Durchlicht fotografiert. • Zentrifugieren Sie erneut 10min bei 2000 U/min. Gießen Sie den Überstand ab und ziehen Sie den verbleibenden Überstand mit der Pipette ab. Auswertung • Zentrifugieren Sie die Zellen 10min. bei 2000 U/min. ab. Ein Zellpellet sollte eindeutig erkennbar sein. • Resuspendieren Sie die Zellen mit 100µl 0,1M NaOH und überführen die Suspension in ein 1,5ml Eppendorfgefäß. Verschließen Sie das Gefäß und inkubieren Sie 5min bei 100°C im Heizblock. Lassen Sie das Gefäß kurz Beschreiben Sie das Ergebnis und diskutieren Sie mögliche Fehler! Aufgaben 7-17 Übungsaufgaben: 1. Erklären Sie kurz den biochemischen Hintergrund für den Einsatz von Allopurinol bei Gicht. 2. Warum ist der Schmelzpunkt einer GC-reichen DNA höher als der einer ATreichen DNA? 3. Berechnen Sie, wieviele Kopien aus einem Molekül doppelsträngiger DNA nach 25 Zyklen PCR entstanden sind. 4. Berechnen Sie die Schmelztemperatur der im Versuch eingesetzten Primer. 5. Wie viele DNA-Fragmente entstehen bei einem Restriktionsverdau, wenn 3 Erkennungssequenzen vorhanden sind: a) bei einer zirkulären DNA (Plasmid) b) bei einem linearen DNA-Fragment? 6. Welche RNA zeichnet sich durch einen hohen Gehalt an modifizierten Basen aus? 7. In der DNA-Replikation wird die folgende Sequenz repliziert: 5’ A T T G C CT T G A G 3’. Geben Sie die komplementäre Sequenz (mit 5’ und 3’ Orientierung) an. 8. Wie ist ein Nukleotid aufgebaut (Bausteine und Anordnung)? Durch welche Art von chemischer Bindung sind die Nukleotide in Nukleinsäuren kovalent miteinander verbunden? Welche C-Atome der Ribose können in Nukleotiden mit einem Phosphatrest verbunden sein? 9. Nennen Sie die beiden Hauptaufgaben des Pentosephosphat-Shunts. 8-1 Versuch 8: Nukleinsäuren II Versuche: Regulation der Gen-Aktivität am Beispiel des lac Operons DNA-Isolierung Analyse von Erbkrankheiten am Beispiel der Cystischen Fibrose Wissensgebiete DNA-Struktur, Replikation, Gen-Aufbau RNA-Struktur, Transkription, reverse Transkription tRNA-Struktur, Ribosomenstruktur Proteinbiosynthese, Translation Genetischer Code Eukaryontische und prokaryontische Transkriptionskontrolle Mutationen (Wildtyp, konstitutive Mutanten) Enzym-Induktion und -Repression, Repressormolekül, Induktoren Bakterienwand-Struktur und Biosynthese 8-2 Nukleinsäuren II I. Regulation der Genaktivität am Beispiel des lac operons Einführung: Eine fein abgestimmte, sehr komplexe Kontrolle der Transkription bei Eukaryonten ermöglicht es, bestimmte Gene sehr selektiv zu exprimieren oder abzuschalten. Die Mechanismen der Expressionskontrolle bei Prokaryonten sind sehr viel einfacher, so dass auch reprimierte Gene immer noch eine basale Expression zeigen. Die Promotoren, die durch die eukaryontische RNA-Polymerase II erkannt werden, sind erheblich länger und vielfältiger, als die Promotoren prokaryontischer Gene, ebenso beeinflussen Enhancer und Silencer, die weit entfernt vom Promotor liegen können, die Expression bei Eukaryonten. Die Grundmechanismen der Expressionssteuerung ähneln sich aber, da sowohl bei Eukaryonten, wie auch bei Prokaryonten Proteine selektiv an regulatorische GenSequenzen binden und so die Geschwindigkeit verändern, mit der die Transkription initiiert wird. Das vorliegende Experiment soll an einem einfachen Beispiel demonstrieren, welche Mechanismen in Bakterienzellen wirksam sind. Sie garantieren, dass die für den Anabolismus und Katabolismus erforderlichen Enzyme, sowie die zelleigenen Bausteine koordiniert und kontrolliert synthetisiert werden. Wirkung von Antibiotika auf Transkription (Rifamycin und Actinomycin) und Translation (Streptomycin, Chloramphenicol, Tetracycline, Puromycin, Erythromycin) Die Regulation der Enzymaktivität bei der Synthese von kleinen Molekülen kann z.B. über den "feed back"-Mechanismus kontrolliert werden. Hier reguliert das Endprodukt die Aktivität des in einer Folge von Reaktionen am Anfang des Synthesewegs stehenden allosterischen Enzyms. ↓ A Enzym1 → B Enzym2 → C Enzym3 → D Induktion des lac Operons 8-3 Die feed-back-Hemmung stellt die Feinregulierung, die Enzymsynthesehemmung eine Grobregulierung dar. Die Synthese wird über die Mechanismen der Repression und Induktion der Proteinsynthese reguliert. Die Synthese eines Enzyms kann so gesteuert werden, dass das Endprodukt einer multienzymatischen Synthese die Synthese des ersten an einer Reaktionssequenz beteiligten Enzyms und damit aller am Syntheseweg beteiligten Enzyme unterdrückt. Man nennt dies Repression oder koordinierte Enzym-Repression. Man findet sie vorwiegend bei der Synthese von Enzymen anabolischer Reaktionen. Als Enzym-Induktion bezeichnet man den Mechanismus, der eine beträchtliche Steigerung der Enzymsynthese nur in Gegenwart des Substrats bewirkt. Hierbei handelt es sich meist um Enzyme katabolischer Reaktionen. Enzyme, die weder reprimierbar noch induzierbar sind, sondern ständig synthetisiert werden, nennt man konstitutive Enzyme. Die Induktion der Synthese von Enzymen katabolischer Reaktionen soll am Beispiel des Laktose-Operons von E. coli erläutert werden. Die E. coli-Zelle kann ihren Energiebedarf durch die Aufnahme vieler C-Quellen aus dem Nährmedium decken, u.a. durch Laktose und Glukose. Für die Verwertung von Laktose werden die erforderlichen Enzyme erst synthetisiert, wenn der Zelle β-Galaktoside angeboten werden. Die β-Galaktosidase, die die Laktose zu Galaktose und Glukose hydrolysiert, wird damit zu einem wesentlichen Enzym. Wächst E. coli auf anderen C-Quellen, enthält die Bakterienzelle nur wenige β-GalaktosidaseMoleküle, auf Laktose wachsend synthetisiert sie dagegen Tausende von Enzymmolekülen. β-Galaktosidase (z) ist also ein induzierbares Enzym. Gleichzeitig werden noch zwei weitere Enzyme synthetisiert: die β-Galaktosid-Permease (y), die für den Transport durch die Zellmembran erforderlich ist, und die β-Galaktosid-Transacetylase (a), deren physiologische Rolle unbekannt ist (in vitro überträgt sie den Acetylrest von Acetyl-CoA auf C6 des Thiogalaktosids). Der physiologische Induktor ist die Allolaktose, die durch Transglycosylierung von Laktose durch die wenigen vorhandenen β-Galaktosidase-Moleküle synthetisiert wird. Einige Induktoren sind Induktoren, ohne selbst Substrat der Galaktosidase-Reaktion zu sein. Ein solcher ist das Isopropylthiogalaktosid (IPTG). 8-4 Nukleinsäuren II Die Information (Erbanlage) für die Primärstruktur der drei Enzyme der LaktoseVerwertung (Laktose Operon) ist linear als "cluster" angelegt. An dieser Stelle soll darauf hingewiesen werden, dass bei Eukaryonten die Gene in der Regel einzeln angelegt sind und häufig Introns enthalten. Regulatorgen Steuerelemente i p Repressor Laktose Operon Strukturgene o z Promotor Operator y a z: ß-Galaktosidase y: ß-Galaktosid-Permease a: ß-Galaktosid-Transacetylase Die Information der DNA wird in die mRNA transkribiert. Die mRNA-Synthese wird durch die RNA-Polymerase katalysiert, die an die Promotor (p)-Region bindet und die RNA-Synthese startet, wenn der Operator, (o)-Region, frei ist. Durch ein "Schlüsselprotein", den Repressor, kann der Operator blockiert werden. Der Repressor ist das Produkt des Regulatorgens (i), der auf einem völlig anderen DNA-Abschnitt lokalisiert sein kann. Repressorprotein (R) Ribosomen Bindungsstelle für Induktor mRNA m-RNS Bindungsstelle für Operator i p o z y a Induktion des lac Operons 8-5 Strukturelemente und Strukturgene stellen hier die funktionelle Einheit, das Operon, dar. Die am Operon synthetisierte mRNA ist ein polycistronischer (die Information mehrerer Gene enthaltender) Messenger. Der Repressor hat zwei spezifische Bindungsstellen, eine für den Operator und eine für den Induktor. 8-6 Nukleinsäuren II Die Repression der Synthese von Enzymen anabolischer Reaktionen durch ein biosynthetisches Endprodukt lässt sich analog erklären. Freie Repressormoleküle besitzen eine Konformation, die keine Bindung an den Operator erlaubt. Die Transkription kann stattfinden: Repressor (inaktive Form) Induktormolekül i i p o z y a p o p o z y a Korepressor-Repressor-Komplex i i y Häuft sich das biosynthetische Endprodukt im Medium an, wirkt es als Korepressor, indem es mit dem Repressor komplexiert: Wenn Induktormoleküle anwesend sind, binden sie an die Induktorbindungsstelle, wodurch die Konformation des Repressors verändert wird (allosterisches Protein). Der Repressor wird frei, die Strukturgene sind nun frei für die Transkription. Galaktosidase wird gebildet: Induktor-Repressor-Komplex z p o z y a Dieser Komplex hat die geeignete Struktur, um an das Operatorgen zu binden. Die Transkription wird blockiert, die Enzymsynthese reprimiert: aktiver Korepressor-Repressor-Komplex a ¾ m-RNA ¾ Ribosomen ¾ Enzyme i p o z y a Induktion des lac Operons 8-7 Es gibt also zwei Klassen von Repressor-Molekülen: Die eine ist an der Kontrolle der Induktion, die andere an der Kontrolle der Repression durch Endprodukte beteiligt. 8-8 trophenol (ONP), hydrolysiert wird. Das ONP vertieft seine gelbe Farbe (436 nm) bei alkalischem pH. NO2 Der Beginn der Transkription selbst wird durch ein anderes Protein, das sogenannte CAP-Protein (Catabolic Activating Protein) um das zwanzigfache beschleunigt. In Form eines cAMP-CAP-Komplexes bindet dieses Protein an die DNA direkt vor der Anheftungsstelle der RNA-Polymerase. Das PolymeraseEnzym allein kann offenbar die Startstelle nicht schnell genug binden. H C H3C CH S C H C H HO C H HO C H HO C H O ONP gelb + Galactose CH2OH o-Nitrophenyl-ß-galactosid (ONPG) Geräte: Bakterienwachstumsröhrchen mit Belüftungsvorrichtung Laborwecker Spektralphotometer Glasküvetten Pipetten 10 ml, 5 ml, 2 ml, 1 ml Reagenzgläser 36 Schüttelwasserbad 37 °C Whirlmix Lösungen: OH HO C OH OH H C entweder im Regulatorgen (i-), so dass kein aktiver Repressor gebildet werden kann, oder im Operatorgen (o) (z.B. E. coli lac i+ocz+a+; oc = constitutiv), so dass der Operator nicht vom aktiven Repressor blockiert werden kann. H3C NO2 O C Beim Wildstamm E. coli K12 ist das Enzym induzierbar. Es gibt Mutanten, die das Enzym β-Galaktosidase auch ohne Induktor ständig bilden. Es handelt sich hier um eine konstitutive Mutanten (E. coli lac i-o+z+a+) Die Mutation liegt Im folgenden Experiment wird gezeigt, dass die Enzymsynthese der β-Galaktosidase im Wildstamm E. coli K12 (W), der normalerweise kaum mehr als ein Molekül β-Galaktosidase pro Zelle enthält, durch das Galaktosid Isopropylthiogalaktosid (IPTG) induziert wird. Diese Enzymsynthese wird mit der Synthese in einer konstitutiven Mutante E. coli lac i-o+z+ verglichen. Nukleinsäuren II O H C CH2OH Isopropylthiogalaktosid (IPTG) Die Induktion wird mit IPTG als Substrat durchgeführt. Der Nachweis der gesteigerten Synthese des Enzyms β-Galaktosidase wird mit einem einfachen, empfindlichen photometrischen Test mit dem Substrat o-Nitrophenyl-β-Galaktosid (ONPG) geführt, das vom Enzym zu einem farbigen Produkt, o-Ni- 200 ml von wachsenden Bakterienkulturen: W: (Wildstamm) E. coli K12 C: (Constitutive Mutante) E. coli (lac i–o+z+) Beide Kulturen wachsen in synthetischem M9-Medium mit 4⋅10-2 M Glycerin als Kohlenstoffquelle. Titer ca. 3⋅108 Bakterien/ml bei einer OD von 1,0 (623 nm). Medium: Bactotryptone 20g Yeastextrakt 5g NaCl 0,5 g aqua dest. ad 1 l Vor Gebrauch 20 ml 1 M MgSO4 zusetzen BME-Puffer (450 ml H2O, 50 ml 0,25 M Natriumphosphatpuffer pH 7 und 1 ml Mercaptoethanol) Isopropylthio-β-Galaktosid (IPTG) 0,01 M Na2CO3 1M Induktion des lac Operons o-Nitrophenyl-β-Galaktosid (ONPG) in 0,25 M Natriumphosphatpuffer pH 7 Toluol in Tropfflaschen 8-9 8-10 Nukleinsäuren II 0,003 M 1) Induktion Ausführung: Zu 6 verschiedenen Zeiten (Tab.: 8-1) sollen den wachsenden Bakterienkulturen jeweils 2 Proben (2 x Wildstamm, 2 x Constitutive Mutante; je 1 ml) entnommen werden. Eine Probe dient der Bestimmung der Bakterienzahl, die andere Probe wird für die Messung der Enzymaktivität benötigt. Zur Vorbereitung der Aktivitätsbestimmung werden in 12 Reagenzgläser jeweils 1 ml BME-Puffer pipettiert und 1 Tropfen Toluol zugefügt. Die Menge des zugegebenen Toluols sollte auf einen Tropfen beschränkt sein, andernfalls sind wegen auftretender Trübungen keine sinnvollen photometrischen Messungen möglich. Die Reagenzgläser werden mit den Nummern W0-W5 und C0-C5 beschriftet. Zwei Erlenmeyerkolben mit je 200 ml einer Suspension von E. coli, Stamm W und Stamm C, werden in einem 37 °C warmen Wasserschüttelbad inkubiert. Nach 15 min. (Zeit: –5, Leerwert) wird vom Assistenten jeweils ein Aliquot dem Kulturmedium entnommen, von dem Sie dann jeweils 1 ml der Kulturen W und C in die vorbereiteten Röhrchen W0 und C0 geben, gut mischen (Whirlmix) und gleichzeitig 1 ml für die Bestimmung der Bakterienzahl entnehmen (siehe I, 2). Der eigentliche Versuch beginnt dann 20 Minuten nach dem Start der Inkubation. Wir bezeichnen die zu dieser Zeit (0 Min.) entnommenen Proben als W1 und C1. Die weitere Entnahme von je 1 ml der Kulturen, das Überführen in die Reagenzgläser W1-W5 bzw. C1-C5 und die Zugabe von 10 ml Induktorlösung zur E. coli-Suspension geschieht sofort nach der Entnahme durch den Assistenten, nach dem Zeitplan der Tabelle 8-1. Beachten Sie bitte, dass zu allen Zeiten (-5, 0, 5, 10, 20 und 40 Minuten) ebenfalls Proben für den Teilversuch 2 (Bestimmung der Bakteriendichte) entnommen werden müssen! Tabelle 8-1 min -5 0 2 5 10 20 40 Arbeitsvorgang Glas Nr. 1 ml Entnahme und Überführen in Wo 1 ml Entnahme und Überführen in W1 Induktion: 10 ml 0,01 M IPTG zur Kultur W 1 ml Entnahme und Überführen in W2 1 ml Entnahme und Überführen in W3 1 ml Entnahme und Überführen in W4 1 ml Entnahme und Überführen in W5 Co C1 C2 C3 C4 C5 2) Bestimmung der Anzahl der Bakterien der Kulturen W und C Ausführung: Je 1 ml Kulturmedium wird gleichzeitig zu den Zeiten -5, 0, 5, 10, 20 und 40 min. entnommen, mit 4 ml H2O verdünnt, und sofort bei 623 nm die optische Dichte (OD) gemessen (Leerwert: 1 ml M9-Medium + 4 ml H2O). Die Werte werden graphisch aufgetragen (Protokollheft, Beispiel in Abb.8-1, „Wachstum“). Die Messung dient zur Bestimmung der Anzahl der Bakterien; OD = 1 entspricht 3⋅108 Bakterien. Die Bedienung der Photometer ist in Versuch 2 beschrieben. 3) Enzymbestimmung: Ausführung: Alle Reagenzgläser der Tabelle 8-1 werden nach Zugabe der Bakterien kräftig auf dem Whirlmix geschüttelt. Nach 40 Minuten, wenn in alle Gläser Bakterien gegeben wurden, gibt man 2 ml 1 M Na2CO3-Lösung in die Reagenzgläser Wo und Co, um einen Reagenzien-Leerwert zu erhalten. Dann wird 1 ml ONPG-Lösung der Reihe C0-C5 zugesetzt, kräftig geschüttelt, und die Uhrzeit der ONPG-Zugabe notiert. Nach 10 Minuten wird hier die Reaktion durch Zugabe von 2 ml Na2CO3-Lösung in die Gläser C1-C5 gestoppt. In der Zwischenzeit pipettiert man ebenfalls 1 ml ONPG in die Reagenzgläser W0-W5. Auch hier wird der Zeitpunkt der ONPG-Zugabe notiert. Nach Induktion des lac Operons 8-11 60 Minuten wird die Reaktion in den Proben durch Zufügen von 2 ml Na2CO3Lösung in die Gläser W1-W5 gestoppt. Tabelle 8-2 Zeit Glas- Nr. (min) -5 0 5 10 20 40 Wildtyp Wo W1 W2 W3 W4 W5 Const. Mut. Co C1 C2 C3 C4 C5 OD 436 nm Verd. 1:5 W. C. U/min W. C. Constitutive Mutante Wildtyp 10 Wachstum 0 -10 0 10 20 30 Zeit (Minuten) 40 Bestimmung der β-Galaktosidase in den E. coli-Stäm men W und C. Induktion des Enzyms im Wildstamm durch Zugabe eines β–Galaktosids (IPTG). Nukleinsäuren II Auswertung: Aus allen Reagenzgläsern (W1-W5 und C1-C5) entnimmt man 1 ml und verdünnt, wenn nötig, mit 4 ml H2O. Die Extinktionen werden bei 436 nm gegen Wo bzw. Co als Leerwert gemessen. Bitte keine Plastikküvetten benutzen. Das eingesetzte Toluol greift den Kunststoff an. Eine Extinktion von 0,0075 entspricht der Hydrolyse von 1 nmol ONPG. (Bedienung des Photometers wie in Versuch 6) Die Einheit des Enzyms definieren wir hier als diejenige Menge, die 1 nmol ONPG in 1 min. bei Zimmertemperatur und pH 7 hydrolysiert. Die Einheiten (U/min) des Enzyms (Abb. 8–1) werden gegen die Zeit aufgetragen. U 20 8-12 Abbildung 8-1: W DNA-Isolierung 8-13 II. DNA-Isolierung Das gesamte Genom eines Organismus ist in der DNA jeder kernhaltigen Körperzelle als Kopie enthalten. Zur Analyse eines beliebigen Gens kann also DNA aus leicht zugänglichen Zellen, wie Fibroblasten, Lymphozyten oder Epithelzellen, herangezogen werden. (Schnellpräparation, mit Proteinen verunreinigt, siehe Versuch 7, PCR) Um eine größere Menge relativ sauberer DNA zu gewinnen, sind einige zusätzliche Schritte nötig. Wir wollen hier der Einfachheit halber bakterielle chromosomale DNA isolieren. Bakterien enthalten häufig neben der genomischen DNA noch zusätzlich Plasmide, ringförmige DNA-Moleküle, die z. B. Gene für Antibiotika-Resistenzen tragen. Da Plasmide leicht künstlich in Bakterien eingeschleust werden können, werden sie häufig in der rekombinanten DNATechnologie eingesetzt (siehe Versuch 7). Die Zellwände der Bakterien werden zuerst mit Lysozym angedaut und anschließend werden die Zellen durch Detergenzien aufgeschlossen. Proteine werden durch Chloroform denaturiert und durch Zentrifugation abgetrennt. Material: Glasstab Schliffmesspipette UV-Spektrometer Vollpipette Wasserbad Zentrifugen Zentrifugengläser 10 ml Quarz-Küvette 2 ml 37 °C, 60 °C 2 ein 50 ml-Glas und zwei 10 ml-Gläser Lösungen: Bakterienkultur 50 ml Chloroform-Isoamylalkohol 24:1 Isopropanol NaCl 0,15 M, enthält 0,1 M Na2EDTA, pH 8,0 Lysozym-Lösung 10 mg/ml NaClO4 3M Natriumdodecylsulfat-Lösung (SDS) 12,5 %ig 8-14 Nukleinsäuren II 1) Isolierung Ausführung: Bakterien einer 50 ml-Kultur (stehen bereit) werden in der Zentrifuge 10 min. bei höchster Umdrehung abzentrifugiert. Der Überstand wird verworfen und die sedimentierten Bakterien in 5 ml 0,15 M NaCl, 0,1 M Na2EDTA suspendiert. 0,5 ml Lysozymlösung wird hinzugefügt, gut gemischt und 30 min. bei 37 °C inkubiert. Durch Umschwenken wird die Suspension zwischenzeitlich gemischt. Zur Vervollständigung der Lysis wird 1 ml 12,5% SDS-Lösung zugefügt und 10 min. bei 60 °C inkubiert. Schließlich werden 2 ml 3M NaClO4 und 8 ml Chloroform/Isoamylalkohol (24:1) zugefügt. Es wird gut geschüttelt, die Emulsion auf 2 Zentrifugenröhrchen verteilt und die Phasen durch 10-minütige Zentrifugation getrennt. Anschließend wird die klare obere Phase abgenommen und unter gelegentlichem Umrühren mit einem Glasstab in 50 ml Isopropanol gegossen. Die DNA fällt aus und kann mit dem Glasstab herausgefischt werden. Überschüssiges Isopropanol wird durch kurzes Halten in der Luft getrocknet. 2) Konzentrationsbestimmung der DNA Ausführung: Die DNA wird in 1 ml Wasser gelöst. 0,1 ml davon werden mit 5 ml Wasser verdünnt und die Absorption in einer Quarzküvette im Spektralphotometer bei 260 nm gemessen. Falls die Extinktion größer als 1 ist, muss die Probe verdünnt werden. Zur Reinheitsbestimmung wird die Extinktion bei 280 nm gemessen. Reine DNA hat ein Verhältnis der Extinktionen von E260/E280 von 2. Ein kleineres Verhältnis zeigt die Verunreinigung mit Proteinen an, die bei 280 nm absorbieren. Berechnung der Ausbeute: OD260 = 1 entspricht 50 mg DNA/l Molekulare Medizin 8-15 III. Analyse von Erbkrankheiten am Beispiel der cystischen Fibrose Die cystische Fibrose ist eine autosomal-rezessive Erbkrankheit der exokrinen Drüsen und der Schweißdrüsen. Die Krankheit beginnt bereits im Kindesalter. Primär werden Verdauungs- und Atmungstrakte befallen. Die Hauptsymptome sind chronische Infektionen des Atmungstrakts, Pankreasinsuffizienz, ausgesprochen viskose Schleimsekretionen und eine Empfindlichkeit für Hitzebelastung. Jeder 25.-30. ist heterozygoter Träger der Erbanlage, jedes 3000. Neugeborene ist erkrankt. Das bei der cystische Fibrose betroffene Gen ist seit 1989 bekannt und seit dieser Zeit sind viele Mutationen entdeckt worden, die die Krankheit verursachen. Das Genprodukt wird als "Cystic Fibrosis Transmembrane-Conductance Regulator" (CFTR) bezeichnet. Das membranständige Protein (170 kDa) ist an der Regulation eines Chlorid-Ionenkanals beteiligt. Die Schwere der Erkrankung ist abhängig von der Lokalisation der Mutation in bestimmten Domänen des Proteins. Neben vielen transmembranalen Bereichen wurden durch Sequenzvergleiche auch zwei nukleotidbindende Bereiche postuliert. 70% der Mutationen betreffen eine drei Basenpaare umfassende Deletion, die einen Verlust des Phenylalanins an Position 508 bewirken (∆F508). Die restlichen 30 % der Mutationen sind über das Gen verteilt. Für die exakte Bestimmung dieser Mutationen ist es notwendig die kodierenden Bereiche des Gens, die der mRNA entsprechen, zu sequenzieren. Der anschließende Vergleich der daraus abgeleiteten Primärstruktur des Proteins mit der Primärstruktur des Wildtyps ergibt die genaue Lokalisation der Mutation. Computer und Datenbanken sind wichtige Werkzeuge in der molekularen Medizin geworden. Am Beispiel der cystischen Fibrose sollen Sie einen Einblick in deren Einsatz bekommen. Im Zentrum für Angewandte Informatik der Universität zu Köln (ZAIK) steht das „Wisconsin Sequence Analysis Program“, ein Sequenzanalyseprogramm, allen Angehörigen der Universität zur Verfügung. Von allen am UKLAN (Local Area Network der Universität zu Köln) angeschlossenen Rechnern kann man über das Netz seine Arbeit am gendb-Server durchführen. Alternativ kann die Analyse auch über das Internet erfolgen. Hier stehen z.B. die Server am NCBI (National Center for Biotechnology Information, USA oder EBI, 8-16 Nukleinsäuren II European Bioinformatics Institute, zur Verfügung. (http://www.ncbi.nlm.nih.gov/blast/blast.cgi oder http://srs.ebi.ac.uk/) Aufgabe: Die CFTR cDNA-Sequenz eines CF-Patienten (unter der Gruppennummer) wird Ihnen zur Verfügung gestellt. Diese sollen Sie 1. in die Proteinsequenz translatieren, 2. mit der Sequenz des Wildtyps vergleichen, die Sie in einer Proteinsequenzdatenbank abgerufen haben und 3. die Art der Mutation angeben. Durchführung: Nach dem Einloggen in das WindowsNT-System (login liegt aus) des Computers erscheint ein Auswahlmenü. Mit Hilfe der Maus wählen Sie Start - Praktikum Biochemie - gendb. Automatisch wird die Verbindung zum gendb-Server hergestellt. Es wird nach dem USERNAME (akc37) gefragt. Das PASSWORT wird Ihnen vom Assistenten mitgeteilt. Nach der Eingabe erscheint die Begrüßungsseite des gendb-Servers und Sie befinden sich in Ihrem Arbeitsbereich im gendb. Der Rechner ist bereit, Ihre Anweisungen entgegenzunehmen, wenn in der letzten Zeile folgendes erscheint: akc37@campfire% Alle im folgenden fettgedruckten Befehle werden durch Drücken der RETURNTaste abgeschlossen und ausgeführt. Mit dem Befehl: akc37@campfire% cd 37xx (xx ist Ihre Gruppennummer, 01, 02, 03, usw.) gelagen Sie in Ihr Arbeitsverzeichnis. Mit: akc37@campfire% dir können Sie die vorhandenen Dateien Ihres Arbeitsbereichs auflisten. Unter dem Namen cftr_gruppex.dna ist in einer Datei die cDNA Sequenz des CF-Patienten abgespeichert. Die Datei können Sie sich mit den Befehlen: akc37@campfire% pg cftr_gruppex.dna Molekulare Medizin 8-17 am Bildschirm anschauen. Bitte notieren Sie sich den Beginn und das Ende der DNA-Sequenz, die die Proteinsequenz oder einen Teil davon kodieren. Diese werden in einer Zeile: FT CDS nnn..nnnn angegeben. Die Zeile ist eine „Feature Table“-Zeile und enthält den Beginn und das Ende des Protein-kodierenden Bereichs. Diese beiden Zahlen werden Sie noch für die Translation benötigen. Mit dem Befehl: akc37@campfire% names swiss:cftr* durch Drücken der RETURN-Taste. Unter dem Eintrag cftr_human ist die menschliche Proteinsequenz in der SWISS-Proteindatenbank gespeichert. Das Programm „names“ gibt alle zur Zeit bekannten CFTR-Gene an, auch die anderer Organismen. Mit: cftr_human.swnew Zuerst erscheint eine Literaturliste, dann eine kurze Beschreibung der Krankheit. Außerdem ist eine Internetadresse angegeben, bei der weitere Informationen abgerufen werden können. In den Zeilen: 13 Mit dem Befehl: pg cftr_gruppex.pep kann die CFTR-Sequenz des Patienten angesehen werden. Diese Sequenz wird mit Hilfe des Programms bestfit mit der Sequenz des Wildtyps verglichen. 13 S -> F. bestfit cftr_human.swnew cftr_gruppex.pep Die abgefragten Einstellungen werden wieder mit der RETURN-Taste bestätigt. Das Vergleichsergebnis wird als cftr_human.pair-Datei abgelegt. Schauen Sie sich die Datei an: pg cftr_human.pair Mit dem Befehl: akc37@campfire% lpr –P cipm1ps cftr_human.pair kann die Datei gedruckt und im Protokollheft abgeheftet werden. Die Sitzung beenden Sie mit: anschauen. VARIANT cftr_gruppex.dna die cDNA des CF-Patienten in die entsprechende Proteinsequenz. Die abgefragten Einstellungen werden ohne Veränderungen durch die RETURN-Taste bestätigt. Den Anfang und das Ende der Translation geben Sie entsprechend Ihrer Notizen (s.o.) an. Als cftr_gruppex.pep wird die Proteinsequenz des Patienten abgespeichert. akc37@campfire% swiss:cftr_human kopieren Sie dann die Sequenz aus der Datenbank in Ihren Arbeitsbereich. Sie können sich jetzt den Eintrag mit dem Befehl: FT akc37@campfire% translate akc37@campfire% output file (*TERM*) akc37@campfire% pg Nukleinsäuren II akc37@campfire% suchen Sie dann in einer Proteindatenbank nach dem Wildtyp des CFTR-Gens. Das Sternchen bedeutet, dass alle Einträge, die in der Swiss-Protein-Datenbank im Namen die Buchstabeanfolge „cftr“ enthalten, auf dem Bildschirm aufgelistet werden sollen. Bestätigen Sie die Frage nach dem: akc37@campfire% fetch 8-18 usw. werden einige der fast 900 gefundenen Mutationen angegeben, hier die SerinPhenylalanin Substitution (Austausch) in Position 13. Nun translatieren Sie den kodierenden Bereich der CFTR-cDNA mit: akc37@campfire% exit Aufgabe: Bitte markieren Sie die Mutationsstelle und geben die Art der Mutation an. Benutzen Sie den genetischen Code und schlagen mögliche Basenaustausche vor. Aufgaben 8-19 Übungsaufgaben: 1. Durch welchen Mechanismus kann ein einziges Gen die Expression von Proteinen unterschiedlicher Größe bewirken? 2. Woran binden Transkriptionsfaktoren? Was bewirken sie? 3. Durch welche strukturelle Komponente eines Proteins wird festgelegt, ob es sezerniert wird? 4. Geben Sie Mechanismen an, die der Entstehung der Antikörpervariabilität zugrundeliegen. 5. Zeichnen Sie auf DNA-Ebene drei prinzipiell unterschiedliche Beispiele für eine Mutation. 6. Formulieren Sie eine aus 6 Nukleotidpaaren bestehende Palindromstruktur. 7. Geben Sie Beispiele für folgende Mutationen an: Substitution, Deletion und Insertion. 8. Wie beeinflusst Penicillin den Metabolismus von Escherichia coli?