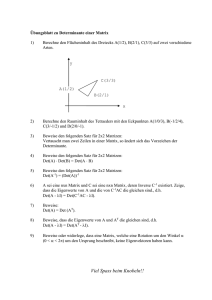
1. Indledning - PURE
Werbung

Cand.ling.merc speciale Tyske indlægssedler – den letlæselige og forståelige tekst Handelshøjskolen Aarhus Universitet Februar 2012 Institut for Erhvervskommunikation Udarbejdet af: Thea Haubenreisser Pedersen Vejleder: Peter Kastberg Indhold 1. Indledning ...................................................................................................................................................... 5 1.1 Problemformulering ................................................................................................................................ 5 1.2 Afgrænsning............................................................................................................................................. 5 1.3 Videnskabsteori ....................................................................................................................................... 6 2. Indlægssedlen ................................................................................................................................................ 8 3. Forståelighedsforskning ................................................................................................................................ 9 4. Groeben ....................................................................................................................................................... 10 4.1Lesbarkeit og Leserlichkeit ..................................................................................................................... 10 4.2 Dimensionen der Verständlichkeit ........................................................................................................ 11 4.2.1 Den deduktive fremgangsmåde ..................................................................................................... 11 4.2.2 Stilistische Einfachheit .................................................................................................................... 11 4.2.3 Semantische Redundanz................................................................................................................. 11 4.2.4 Kognitive Strukturierung ................................................................................................................ 11 4.2.5 Kongnitiver Konflikt ........................................................................................................................ 12 5. Das Hamburger Verständlichkeitsmodell .................................................................................................... 12 5.1 Kritik af das Hamburger Verständlichkeitmodell .............................................................................. 14 6. Das Karlsruher Verständlichkeitskonzept .................................................................................................... 15 6.1 Die kommunikative Funktion ................................................................................................................ 15 6.2 Zweck ..................................................................................................................................................... 16 6.3 Adressaten ............................................................................................................................................. 16 6.4 Sender .................................................................................................................................................... 17 6.5 Textproduktions-Eckdaten .................................................................................................................... 17 6.5.1 Mentales Denotationsmodell ......................................................................................................... 17 6.5.2 Mentales Konventionsmodell......................................................................................................... 18 6.5.3 Medium .......................................................................................................................................... 18 6.6 Juristische und redaktionelle Richtlinien ............................................................................................... 18 6.7 Die Verständlichkeitsdimensionen ........................................................................................................ 18 6.7.1 Struktur (Gliederung- Ordnung) ..................................................................................................... 19 6.7.2 Prägnanz ......................................................................................................................................... 20 6.7.3 Motivation ...................................................................................................................................... 21 2 6.7.4 Simplizität ([sprachliche] Einfachheit) ............................................................................................ 21 6.7.5 Korrektheit...................................................................................................................................... 22 6.7.6 Perzipierbarkeit .............................................................................................................................. 22 6.8 Kritik af das Karlsruher Verständlichkeitskonzept ................................................................................. 22 7. Fagsprog ...................................................................................................................................................... 23 8. Analyse af indlægssedlerne ......................................................................................................................... 25 8.1 Indlægsseddel nr.1 ................................................................................................................................ 26 8.1.1 Zweck .............................................................................................................................................. 26 8.1.2 Adressaten ...................................................................................................................................... 27 8.1.3 Sender ............................................................................................................................................. 27 8.1.4 Textproduktionseckdaten............................................................................................................... 28 8.1.5 Das mentale Denotatsmodell ......................................................................................................... 28 8.1.6 Das Mentale Konventionsmodell ................................................................................................... 28 8.1.7 Medium .......................................................................................................................................... 29 8.1.8 Juristische und redaktionelle Richtlinien ........................................................................................ 29 8.2 Verständlichkeitsdimensionen .............................................................................................................. 30 8.2.1 Struktur ........................................................................................................................................... 30 8.2.2 Prägnanz ......................................................................................................................................... 32 8.2.3 Motivation ...................................................................................................................................... 34 8.2.4 Simplizität ([sprachliche] Einfachheit) ............................................................................................ 35 8.2.5 Korrektheit...................................................................................................................................... 37 8.2.6 Perzipierbarkeit .............................................................................................................................. 39 8.3 Delkonklusion ........................................................................................................................................ 43 8.4 Indlægsseddel nr.2 ................................................................................................................................ 44 8.4.1 Zweck .............................................................................................................................................. 44 8.4.2 Adressanten .................................................................................................................................... 44 8.4.3 Sender ............................................................................................................................................. 45 8.4.4 Textproduktionseckdaten............................................................................................................... 45 8.4.5 Das mentale Denotatsmodell ......................................................................................................... 46 8.4.6 Das mentale Konventionsmodell.................................................................................................... 46 8.4.7 Medium .......................................................................................................................................... 48 8.4.8 Juristische und redaktionelle Richtlinien ........................................................................................ 49 8.4.9 Verständlichkeitsdimensionen ....................................................................................................... 50 3 8.4.10 Struktur .................................................................................................................................... 50 8.4.11 Prägnanz ....................................................................................................................................... 53 8.4.12 Motivation .................................................................................................................................... 54 8.4.13 Korrektheit.................................................................................................................................... 56 8.4.14 Simplizität ([sprachliche] Einfachheit) .......................................................................................... 57 8.4.15 Perzipierbarkeit ............................................................................................................................ 58 8.4.16 Delkonklusion ............................................................................................................................... 60 9. Konklusion ................................................................................................................................................... 61 8.1 Perspektivering ...................................................................................................................................... 62 10. Litteraturliste ............................................................................................................................................. 63 11. Deutsches Resümee .................................................................................................................................. 68 12. Bilag ........................................................................................................................................................... 70 4 1. Indledning 1.1 Problemformulering Ud fra den antagelse, at indlægssedler i diverse medikamenter er svært-forståelige tekster for de egentlige modtagere, vil tekstgenren og udvalgt teori blive beskrevet. Et korpus på to indlægssedler vil hernæst blive analyseret ud fra Göpferichs analysemodel i et forsøg på at identificere, hvad der gør indlægssedlerne svære at forstå og hvilke ændringer, der ville kunne forbedre forståeligheden heraf. 1.2 Afgrænsning Dette speciales fokus er at undersøge forståeligheden af tyske indlægssedler. Da der findes en uendelig stor mængde indlægssedler, ville det være umuligt for mig at analysere dem alle, eller blot alle inden for et bestemt medikament. Grundet specialets omfang og på baggrund af at jeg ikke har mulighed for at undersøge alle indlægssedler på markedet, har jeg valgt at koncentrere mig om to indlægssedler, som begge informerer om det samme medikament ”Carvedilol”, et blodtrykssænkende middel. Jeg har valgt en indlægsseddel fra hvert af de følgende medicinalfirmaer ratiopharm GmbH og HEXAL AG med henholdsvis Carvedilol-ratiopharm® 12,5 mg Filmtabletten og Carvedilol HEXAL® 12,5 mg. Disse firmaer er udvalgt, da det var vigtigt for mig at finde indlægssedler fra tyske firmaer. Hovedsagligt af den grund, at indlægssedler forfattet hos tyske firmaer er skrevet på tysk i originalversionen. Hos firmaer fra andre lande er det muligt at den oprindelige version af indlægssedlen er forfattet på engelsk eller andet sprog for derefter at blive oversat til tysk. Havde indlægssedlerne været oversat fra et andet sprog, skulle den kendsgerning tages i betragtning i forhold til forståelsen af teksten. I en oversættelsessituation vil der allerede fra oversætterens side kunne forekomme oversættelsesfejl, hvilket ville resultere i forståelsesfejl hos den endelige bruger af indlægssedlen. Med henblik på at besvare ovenstående problemformulering vil jeg først gennemgå forskellige teorier og modeller, som kan findes inden for forståelighedsforskningen, såsom Groeben, Thun von Schulz et al. og Göpferich. Derefter vil jeg bruge Göpferichs model til at analysere de udvalgte indlægssedler for at fastslå om indlægssedlerne er forståelige for den intenderede modtager, om afsenderen har formået at vurdere modtagers viden inden for det medicinske fagområde – og sprog. I de tilfælde, hvor jeg finder at en anden løsning havde været mere hensigtsmæssig, vil jeg give enkelte forslag til optimering af teksten. Grundet specialets omfang vil jeg udvælge enkelte passager i teksterne til optimering og dermed ikke optimere hele indlægssedlen. Til sidst vil jeg konkludere på mine analyser af de to indlægssedler. Jeg vil kommentere, hvilke forståelsesforstyrrende elementer jeg har fundet i indlægssedlerne og hvad afsenderne kan gøre op, for at påvirke modtagernes forståelse af indlægssedlerne positivt. 5 1.3 Videnskabsteori En afhandling som denne forudsætter at man anvender en speciel metode til at analyse og belyse det valgte emne samt de valgte tekster. For at vælge den rette videnskabsteori, er det nødvendig at forstå, hvad tankerne bag de forskellige teorier er. I dette afsnit behandles ikke alle videnskabsteorier, men udelukkende positivismen og hermeneutikken, da de er hinandens modsætninger. Begge giver et godt billede af den samfundsvidenskabelige verden kontra den naturvidenskabelige verden og hvori forskellene mellem disse består. Arbejder man efter den positivistiske metode, er den grundlæggende tanke, at man formår at være observatør uden at tillægge ens objekter følelser eller tanker. Ved denne metode er det udelukkende handlinger, der skal observeres. Undersøger man en virksomheds kommunikation er det vigtigt at undersøge forskellige kommunikationssituationer i virksomheden f.eks. leder >< ansatte og virksomhed >< kunde, uden at blive påvirket af ens fordomme eller forventninger1. Positivisme er dominerende i naturvidenskabelige henseender, da der her er én sandhed eller ét resultat. To plus to er fire og dette resultat vil ikke ændre sig, om det er en dansker, tysker eller franskmand der lægger tallene sammen. I positivismen skal man være fordomsfri, som i det ovenstående eksempel med kommunikation. Man skal kunne være i stand til at betragte objektivt. I de samfundsteoretiske videnskabsteorier er man uenig i denne påstand om at være neutral. For teoretikerne inden for hermeneutikken er det ikke muligt at arbejde med humaniora og samfundsvidenskabelige tekster som en kultur – og historieløs iagttager, da hele grundlaget for disse videnskaber er kultur og historie.2 Man taler typisk om, at der er to tilgange inden for den hermeneutiske videnskabsteori, den grammatiske - og den psykologiske fortolkning. Den grammatiske fortolkning forsøger at forstå teksten ved hjælp af tekster fra samme tid og kultur, hvor den psykologiske fortolkning forsøger at forstå teksten ud fra forfatterens tanker3. Disse to fortolkninger går hånd i hånd, og sammen danner de den hermeneutiske cirkel. Den hermeneutiske cirkel står for den opfattelse, at vi kun forstår en teksts helhed ud fra dens dele og delene kun ud fra helheden. Ud fra denne cirkel kommer flere spørgsmål, f.eks. Hvornår er vi nået til den ”rigtige” forståelse, hvis forståelse er cirkulær?4 Der er forskellige opfattelser af, hvad forståelsen forudsætter. Wilhelm Dilthey mener, at man må forstå tekstens samtid og at man skal sætte sig i forfatterens sted5. Hans Georg Gadamer mener derimod, at vi besidder den viden, vi har behov for, da den er blevet overleveret gennem generationer. Han kalder dette fordomme, og ikke i negativ forstand, som vi 1 Holm, Andreas Beck (2011) s.42ff Holm, Andreas Beck (2011) s. 83 3 Holm, Andreas Beck (2011) s. 85 4 Holm, Andreas Beck (2011) s. 87 5 Holm, Andreas Beck (2011) s. 89ff 2 6 forstår ordet fordomme i dag6. For at bruge Holms eksempel, så har de fleste en forestilling om, hvad ”Hamlet” handler om, uden at have læst stykket.7 Det der er vigtigt, er at vi formår at ændre vores fordomme, når vi indser at de ikke er korrekte. Selvom Dilthey og Gadamer har forskellige tilgange til hermeneutikken, kan man se en faktor som går igen i hos begge. Hermeneutikken er den klare modsætning til positivismen, hvis mål var en endegyldig sandhed, dette stræber man ikke efter i hermeneutikken: ”… mens førstnævnte[positivismen red.] er rettet mod et endemål, nemlig den fuldkomne forståelse af deres genstandsområder, er det human- og samfundsvidenskabelige fortolkningsarbejde en i princippet uendelig proces”8 I hermeneutikken findes ingen endegyldig sandhed, da det ikke er muligt at være en objektiv iagttager uden fordomme og traditioner. Det er ikke fortolkningens formål - for i henhold til hermeneutikkerne er der, når man arbejder med mennesker ingen facitliste og ikke alle tolkninger er lige gode, men igennem flere tolkninger, hvor del og helhed sammenlignes, arbejder man sig konstant hen imod en bedre forståelse. I henhold til det ovenstående er den metodiske tilgang i dette speciale præget af den hermeneutiske videnskabsteori. Der tales i specialet om forståelsen af tekster. Forståelse er en subjektiv størrelse, som er svær at sætte en skala på. Dog har flere teoretikere forsøgt at fremsætte modeller til måling af forståelsen af tekster. Ved at læse og forstå disse teoretikeres arbejde skal det forsøges at finde frem til de udvalgte indlægssedlers grad af forståelse. Som nævnt i det ovenstående citat er der ingen endegyldig sandhed, når man har med mennesker at gøre, hvorfor resultaterne i dette speciale ikke endegyldige. Med andre fokuspunkter ville andre analyser af samme indlægssedler medføre andre resultater. Verden er i konstant forandring, og det er ud fra det faktum at metoden er valgt. Når verden er i forandring er menneskene i den også, hvilket vil betyde at de forventninger der eksisterer i dag er foranderlige. Disse forandringer må der tages højde for i et speciale som dette, hvor baggrunden for undersøgelser til dels består af disse menneskers forventninger og fordomme. 6 Holm, Andreas Beck (2011) s. 89ff Holm, Andreas Beck (2011) s. 91 8 Holm, Andreas Beck (2011) s.95 7 7 2. Indlægssedlen Indlægssedlen er et sammenfoldet ark, der er vedlagt enhver medicinpakke. Indlægssedlen beskriver anvendelsesmetode, bivirkninger og dosering. Ifølge Rådets direktiv 92/27/EØF af 31. marts 1992 om etikettering af og indlægssedler til humanmedicinske lægemidler9 skal der medfølge en indlægsseddel til ethvert lægemiddel. Indlægssedler er en tekstgenre, hvor der fra lovens side bliver stillet mange krav til indlægssedlens indhold, de skal som EUROPA-PARLAMENTETS OG RÅDETS DIREKTIV 2001/83/EF af 6. november 2001 om oprettelse af en fællesskabskodeks for humanmedicinske lægemidler foreskriver10, omfatte forklaringer af lægemidlet, hvornår det anvendes, hvad man skal være opmærksom på, hvordan lægemidlet reagerer med andre lægemidler, kontraindikationer, advarsler, om dosering, om fejlagtigt brug eller overdosering af lægemidlet, bivirkninger, holdbarhed, format og pakkens indhold, det virksomme stof i lægemidlet og dato for seneste version af indlægssedlen.11 Som det ses i nedenstående eksempel, er der udover krav til indholdet også opstillet retningslinjer for, hvordan disse informationer skal fremstilles over for læseren. ”Indlaegssedlen skal vaere let laeselig og vaere affattet i udtryk, der er klare og forstaaelige for patienterne, paa det eller de officielle sprog i den medlemsstat, hvor laegemidlet markedsfoeres”12 Ud over retningslinjerne fra det europæiske direktiv, er der i den tyske Arzneimittelgesetz13 også opstillet krav om, hvordan indlægssedlen skal forfattes. ” folgende Angaben in der nachstehenden Reihenfolge allgemein verständlich in deutscher Sprache, in gut lesbarer Schrift und in Übereinstimmung mit den Angaben nach § 11a enthalten muss:”14 I dette speciale undersøges, hvorvidt medicinalfirmaerne opfylder disse lovkrav, og om retningslinjerne fra EU og den tyske AMG er tilstrækkelige, til at skabe forståelige indlægssedler for læseren. 9 Rådets direktiv 92/27/EØF af 31. marts 1992 Rådets direktiv 92/27/EØF af 31. marts 1992 11 Beipackzettel.info, http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CELEX:31992L0027:DA:HTML 12 Rådets direktiv 92/27/EØF af 31. marts 1992 s.44 13 gesetze-im-internet.de § 11 14 gesetze-im-internet.de §11 stk.1 10 8 3. Forståelighedsforskning Forskningen inden for ”Textverständlichkeit” adskiller sig fra forskningen inden for ”Textverständnis” på den måde at, den hovedsageligt koncentrerer sig om analysen og optimering af teksten. Dog går man i denne forskning ud fra, at tekstens forståelighed ikke kan ses som uafhængig af læserens konkrete tekstforståelse. Målet for forståelighedsforskningen var så bredt som muligt at identificere forståelighedsfremmende kendetegn i tekster og bekræfte deres effektivitet ved hjælp af empiriske undersøgelser. Herudfra stammer to forskellige teorier; den empirisk-induktive og den teoretisk-deduktive. Den empirisk-induktive teori, som også er kendt som ”Das Hamburger Verständlichkeitsmodell”, er udarbejdet af Langer et al. Denne teori har inddelt tekster af forskellig sværhedsgrad i fire forståelighedsdimensioner.15 Sprachliche Einfachheit Gliderung/Ordnung Kürze/Prägnanz Zusätzliche Stimulanz Teksterne blev bedømt ud fra en 5-trins vurderingsskala. Slutværdierne bestemte en tekst forståelighedsgrad. Denne teori vil blive gennemgået yderligere specialets afsnit 5. Den teoretisk-deduktive teori ,om at fastsætte relevante forståelighedsdimensioner er hovedsageligt blevet gennemgået af Groeben. I denne teori er der på baggrund af sprogpsykologiske, lære-teoretiske og motivationpsykologiske ansatser blevet opstillet følgende fire forståelighedsdimensioner og forståelighedsfremmende tekstkendetegn. Stilistische Einfachheit Semantische Redundanz Kognitive Strukturierung Kognitiver Konflikt Hvis disse teorier sammenlignes, ser man at de ofte er enige i deres forståelighedsdimensioner. Dimensionerne”Sprachliche Einfachheit”, ”Kognitive Gliederung”, ”Kürze/Prägnanz” og ”Motivationale Stimulanz“ er af størst betydning for tekststrukturen. Den største forskel består i at dimensionen ”Sprachliche Einfachheit” er den vigtigste i den induktive teori, men derimod er den mindst vigtige i den 15 Franzmann, Bodo et al.: 1999s.180 9 deduktive teori. Dog er det påvist at denne dimension tidligere er blevet henholdsvis overvurderet og undervurderet.16 Udover disse to teorier er der også ”Das Karlsruher Vertändlichkeitkonzept”. Dette koncept er udarbejdet af Göpferich på baggrund af de to ovennævnte teorier. Jeg vil komme nærmere ind på Göpferichs teorier i afsnit 6. 4. Groeben Når man taler om tekster, der videreformidler information, er forståelighed det centrale målkriterium for udformningen og vurdering af teksten.17 4.1Lesbarkeit og Leserlichkeit Som tidligere nævnt bygger Groeben sin forståelighedsforskning på principperne fra ”Lesbarkeit” og ”Leserlichkeit”. ”Lesbarkeit” tematiserer kendetegnene ved en teksts overfladestruktur, som bidrager til let – og hurtigheden af tekstforståelse i henhold til identificering af ord-for-ord- betydningen.18 Ifølge Groeben er ”Leserlichkeit” trinnet før ”Lesbarkeitforschung”, her tematiseres de grafiske kendetegn i en tekst, hovedsageligt de typografiske. Andre forskere tager denne del med ind under ”Lesbarkeit”. Dog mener Groeben at den bør være en kategori for sig selv. ”Leserlichkeit” af informationstekster19 Skrifttype: Form, bredde, højde, styrke etc. – allerede eksisterende teksttyper er som regel af samme læselighed. Fremhævet tekst fremmer genkendelse af de enkelte tegn, men generer læseren. Kursiv påvirker læsehastigheden negativt, men generer ikke læseren. Udelukkende brug af versaler hæmmer læsehastigheden meget. Skriftstørrelse 11 er optimal. Linjelængde: Lang eller kort Linjeafstand: - der er lavet ”sikkerhedszoner”, der som regel bliver efterfulgt af industrien. Farve og kontrast Afstand eller størrelse Belysning eller papirkvaliteten 16 Groeben, Norbert: 1982 s.182 Groeben, Norbert: 1982 s.173 18 Groeben, Norbert: 1982 s.174 19 Groeben, Norbert: 1982 s.174 17 10 4.2 Dimensionen der Verständlichkeit Konceptet forståelighed skal udvikles på en sådan måde at de sproglige-stilistiske og de kognitiveindholdsmæssige dimensioner forenes. Disse dimensioner skal kunne henvise tilbage til indordnede kendetegn i teksten. Et så struktureret koncept ses opstillet på hovedsagelig to forskellige måder. Der er den induktive fremgangsmåde og den deduktive fremgangsmåde.20 Den induktive fremgangsmåde er blevet udarbejdet af psykologer fra Hamburg, denne teori vil blive behandlet i specialets afsnit 5. 4.2.1 Den deduktive fremgangsmåde Groeben har ud fra sprogpsykologiens teoretiske ansatser, den kognitive læreteori og motivationspsykologien hypotetisk postuleret de relevante dimensioner og udledt de tilhørende tekstkendetegn. 4.2.2 Stilistische Einfachheit Korte Sætninger Brug af aktiv Aktiv, positive formuleringer Ingen nominaliseringer Possessive pronominer Ingen komplicerede sætningskonstruktioner 4.2.3 Semantische Redundanz Ingen gentagelser af ord Derimod: meningsgentagelser af vigtige informationer Må ikke være langtrukken 4.2.4 Kognitive Strukturierung 20 Brug af advanced organizers Fremhævelser Sammenfatninger Eksempler Forskelle og ligheder Franzmann, Bodo et al.: 1999 s.187 11 4.2.5 Kongnitiver Konflikt Nye informationer og overraskelser Inkongruens Alternative problemløsninger Spørgsmål 21 5. Das Hamburger Verständlichkeitsmodell ”Das Hamburger Verständlichkeitsmodell” blev udarbejdet i 1970’erne af Reinhard Tausch, Inghard Langer und Friedemann Schulz von Thun. Formålet med ”Das Hamburger Verständlichkeitskonzept” var at opstille objektive kriterier for teksters forståelighed. Konceptet bygger på principper fra ”Lesbarkeitsforschung”22. Som nævnt tidligere består ”Das Hamburger Verständlichkeitmodell“ af fire forståelighedsdimensioner. Sprachliche Einfachheit Gliderung/Ordnung Kürze/Prägnanz Zusätzliche Stimulanz Tekstkendetegnene blev fastsat ud fra eksperters vurdering, derfor taler man også om ”Rating-Verfahren”. Disse kendetegn blev delt ud på de fire dimensioner, som blev til 18 modsætningspar, som de skulle vurdere teksten efter.23 Enkelte af disse modsætningspar kan ses nedenfor. Interessant >< kedelig For kort >< for lang Konkret >< abstrakt Langtrukken >< begrænset til det væsentlige 21 teachsam.de Wikipedia.org 23 Groeben, Norbert: 1982 s.189 22 12 Figur 1.24 Ovenfor i figur 1 ses, hvordan dimensionerne og de forskellige modsætningspar er sat ind i en model, hvor eksperterne skulle vurdere teksterne. De nævnte eksperter, der blev brugt af Langer et al. til vurdering af teksterne er f.eks. studerende og lærer, som i et af Hamburger psykologernes træningsprogrammer har øvet det at skelne mellem teksterne, ved hjælp af konkrete kendetegn og disse kendetegns sammenfatning til en bestemt dimension.25 Schulz von Thun bruger selv en del af en tekst fra ”Grundlagen der Sexualität” som eksempel på anvendelse af deres model og også en optimeret tekstversion.26 Vurderingen af tekstens forståelighedsgrad forudsætter en empirisk forbindelse med nogle effekter, som kan bruges som kriterier til optimering af teksten. For at sikre sig disse effekter, har Hamburger psykologerne brugt forskellige metoder til at måle med; f.eks. fri gengivelse af teksten, multiple choicespørgsmål. Da psykologerne foretog disse tests, umiddelbart efter læserne var færdig med teksten er det ikke kun en hukommelsestest, men mere et spørgsmål om, om læseren har forstået teksten. Derfor kalder psykologerne dette kriterium for ”Verstehen-Behalten”. Flere genrer er blevet undersøgt af Langer et al. F.eks. retstekster, skolebogstekster og videnskabelige offentliggørelser. Tekster fra alle genren blev optimeret, derefter blev to parallelle grupper af testlæsere bedt om at vurdere både den originale - og den optimerede tekst.27 Ud fra vurderinger kunne der ses sammenlignelige forbedringer i teksterne. Det blev muligt for psykologerne at udlede et niveau for optimal forståelighed i de enkelte dimensioner.28 INDSÆT MODEL FRA GROEBEN S.196 24 Langer et al.:1990 s.16 Groeben, Norbert: 1982 s.190 + s.193 26 Groeben, Norbert: 1982 s193 27 Groeben, Norbert: 1982 s.194-195 28 Groeben, Norbert: 1982 s.196 25 13 Ved hjælp af disse resultater, fandt Hamburger psykologerne frem til, at den vigtigste dimension for teksters forståelighed er ”Einfachheit”, derefter kommer ”Gliederung/Ordnung” mens ”Kürze/Prägnanz” er af mindre betydning. Den sidste dimension ”Zusätzliche Stimulanz” er, som det allerede ligger i navnet ”bare” et tillæg til evt. ”Gliederung/Ordnung”.29 5.1 Kritik af das Hamburger Verständlichkeitmodell Der er visse punkter ved Hamburger psykologernes model, som kan kritiseres. F.eks. er metoden, hvor teksten vurderes ud fra allerede fastsatte adjektiver, en subjektiv måde at bedømme teksten på. Det bliver de enkelte testpersoners mening om, om teksten er kedelig, spændende, for kort eller for lang. Disse meninger er forskellige fra person til person, hvilket betyder at man ikke får en bred bedømmelse af teksten. En mere objektiv vurdering af teksten, havde været en opstilling af antal nominaliseringer, adjektiver og længde af sætningerne. Derudover er testpersonerne ikke på samme niveau, som den almindelige læser. De udvalgte testpersoner har gennemgået et træningsforløb hos Langer et al. Dette træningsforløb gør, at de har lært at bruge modellen for vurdering af tekster. Der er positive aspekter i ”das Hamburger Verständlichkeitsmodell”, da psykologerne gør brug af forskellige modeller og figurer, hvor de viser og giver eksempler på, hvordan deres analysemodel skal anvendes. F.eks. den ovennævnte figur 1. 29 Groeben, Norbert: 1982 s.197 14 6. Das Karlsruher Verständlichkeitskonzept Das Karlsruher Verständlichkeitskonzept er udarbejdet af Susanne Göpferich. Göpferich, som er en tysk forsker, der på baggrund af andre teoretikeres offentliggørelser om forståelighedsforskning har videreudviklet og tilføjet flere parametre til hendes egen analysemodel for forståelighed. I det følgende vil forklares og uddybes Göpferichs analysemodel, som leder op til en analyse af to forskellige indlægssedler senere i opgaven. Figur 230 6.1 Die kommunikative Funktion31 Ifølge Göpferich kan en teksts kvalitet og forståelighed kun vurderes, hvis man ser på, hvordan det lykkes teksten at opfylde ”die kommunikative Funktion”. ”Die kommunikative Funktion” skal ses som en helhed sammensat af Zweck, Adressaten og Sender, eller oversat til dansk, tekstens formål, modtager og afsender. 30 31 Göpferich, Susanne (2005) slide 12 Göpferich, Susanne (2001) s.117ff 15 Figur 332 6.2 Zweck ”Zweck” eller formål er et svagt udtryk, da det kan angives med forskellig præcision. For at man skal kunne anvende dette begreb i forbindelse med tekstproduktion, vurdering af tekster og tekstoptimering skal formålet opfylde en bestemt præcisionsgrad. Göpferich giver forskellige eksempler på, hvad der kan kategoriseres som værende brugbare formål. F.eks. forklare modtageren, hvordan man ringer fra en mobiltelefon, eller gøre modtageren i stand til at forstå sin værkstedsregning mht. reparation af koblingen.33 6.3 Adressaten Modtageren er ud over ”die kommunikative Funktion” det der bestemmer, hvordan en tekst skal udformes. Det er ikke kun terminologien, der bestemmes af modtageren. Udførligheden af tekstens indhold er også i stor stil præget af modtageren. Göpferich nævner eksempler på, hvilke kendetegn man skal være opmærksom på i forbindelse med fastsættelse af en målgruppe. F.eks. alder, køn, social status, uddannelse, hobbyer, forudgående viden og fordomme om det omhandlede emne, kultur, receptionssituation, målgruppens omfang, målgruppens homogenitet.34 32 Göpferich, Susanne (2005) slide 12 Göpferich, Susanne (2001) s.117ff 34 Göpferich, Susanne (2001) s.117ff 33 16 6.4 Sender De nævnte kendetegn, som er væsentlige for modtageren gælder også for afsenderen. Derudover er følgende kendetegn også af betydning i forbindelse med afsenderen; afsendersituationen, individualitet kontra institutioner, social relation til modtageren.35 Det ovennævnte formål, modtager og sender er det der danner ”die kommunikative funktion”. ”Die kommunikative Funktion” er så igen det, der definerer ”Textproduktions-Eckdaten”. 6.5 Textproduktions-Eckdaten I begrebet ”Textproduktions-Eckdaten” er samlet ”mentales Denotationsmodell”, ”mentales Konventionsmodell” og ”Medium”. I det følgende vil beskrives disse tre underbegreber, som Göpferich har udlagt dem. Figur 436 6.5.1 Mentales Denotationsmodell ”Mentales denotationsmodell” er det billede, der gerne skulle opstå i hovedet på modtageren, når denne læser teksten og som skal gøre at ”die kommunikative Funktion” bliver opfyldt. Dette billede skulle gerne opstå igennem de anvendte tegn og den Top-Down37 proces (erfaringer, behov, forventninger og den viden, vi møder objekterne med.) som tegnene sætter i gang. ”Mentales Denotationsmodell” forestiller samtidig afsenderens mentale repræsentation af indholdet, som det er i hans hukommelse, og hvordan han omsætter det til tegn. Det vigtigste for den ”mentales Denotationsmodell”, som man ønsker at få frem i teksten er tekstens ”kommunikative Funktion”.38 35 Göpferich, Susanne (2001) s.117ff Göpferich, Susanne (2005) slide 12 37 Larsen, Ole Schultz (2010) s.11 38 Göpferich, Susanne (2001) s.117ff 36 17 6.5.2 Mentales Konventionsmodell I kodningen af ”mentales denotationsmodell” i produktionsfasen er afsenderen ikke fuldstændig fri, han er bundet til de konventioner, der er forbundet med den egnede tekstgenre, hvilket er afhængigt af tekstens ”kommunikative Funktion”. Disse konventioner, som hører under ”mentales Konventionsmodell” er ikke nedskrevet, ligesom de ”juristische und redaktionelle Richtlinien”, de har slået sig fast som et ”sproganvendelses - og tekstproduktionsmønster”39. Disse mønstre sætter sig fast i hukommelsen hos kompetente sprogbrugere, hvis de er fortrolige med den pågældende tekstgenre. Den ”mentales Konventionsmodell” bestemmer ikke kun, hvordan afsenderen skal udfærdige sin tekst, den har også indflydelse på, hvordan modtageren, særligt en, der er fortrolig med genren, forstår informationerne i teksten. Den ”mentales Konventionsmodell” kommer derfor til at fungere som en form for Advanced Organizer, der gør det lettere for modtageren at sætte de modtagede informationer i en sammenhæng. 6.5.3 Medium Medium bliver også til dels bestemt af ”die kommunikative Funktion”. Det er dog også afhængigt af ”mentales Denotationsmodell”, idet der kan gøres brug af Computer-Based-Training, hvis indholdet er for svært til udelukkende at blive forklaret verbalt. Det kan dog også være modsat, så medium har betydning for ”mentales Denotationsmodell”, da der ved brug af multimedie, vil være færre grænser for modtagerens mentale kreativitet.40 6.6 Juristische und redaktionelle Richtlinien ” Juristische und redaktionelle Richtlinien” er retningslinjer for, hvordan en tekst skal være. Mange firmaer laver sådanne retningslinjer for at få tekster, der er lettere at oversætte. Der er retslige retningslinjer, f.eks. er der et EU-direktiv, der beskriver, hvilke informationer der er obligatoriske i en brugsanvisning, hvordan det skal struktureres og i hvilken stil det skal formuleres. ”Mentales Konventionsmodell” og ” Juristische und redaktionelle Richtlinien” har indvirken på hinanden. f.eks. har de allerede eksisterende ”mentale Konventionsmodellen” betydning for, hvad der bliver fastsat i de skriftlige retningslinjer.41 6.7 Die Verständlichkeitsdimensionen Herunder gennemgår jeg de seks dimensioner hver for sig. De er hver især vigtige for analysen af tekstens forståelighed, idet dimensionerne kommer tættere ind på teksten end de forudgående elementer af Göpferichs analysemodel. 39 Egen oversættelse Göpferich, Susanne (2001) s.117ff 41 Göpferich, Susanne (2001) s.117ff 40 18 Figur 542 Figuren ovenfor viser, hvordan de enkelte dimensioner hører sammen med de forskellige ”Textproduktionseckdaten”. Derudover vises det også med pile at dimensionerne har direkte relationer til teksten. 6.7.1 Struktur (Gliederung- Ordnung) Punktet struktur, som hos Göpferich er afledt af Hamburgpsykologerne og Groebens ”Gliederung-Ordnung” og ”kognitive Gliederung”, omhandler i Göpferichs udlægning kun den indholdsmæssige struktur. Denne indholdsmæssige struktur bliver undersøgt på to forskellige niveauer, nemlig makroniveau og mikroniveau. Disse to niveauer skelnes ved, at makroniveau betegnes som værende mere end to sammenhængende sætninger og mikroniveau som værende mindre end to sammenhængende sætninger.43 På makroniveau analyseres følgende punkter: Er opstillingen af komplekse handlinger tilpasset modtagerens kendskab til emnet? Er der i starten af teksten en slags disposition, der giver modtageren en ”grov mentales Denotatsmodell”? Er der brugt advanced organizers? (et værktøj, der bruges til at få læseren til at genkalde og videreføre viden til forståelsen af de nye informationer) På mikroniveau analyseres følgende punkter: 42 43 Göpferich, Susanne (2005) slide 12 Göpferich, Susanne (2001) s.117ff 19 Nævnes oplysningerne i den rækkefølge som modtageren har brug for dem? Begynder sætningerne med det af laveste nyhedsværdi og slutter med nye informationer? (temarema) 6.7.2 Prägnanz Med ”Prägnanz” analyserer man to aspekter af teksten, nemlig den ønskede ”mentale Denotatsmodell” og tekstens kodering. Det ideale er, når en teksts ”mentale Denotatsmodell” tager hensyn til ”die kommunikative Funktion”, ”Textproduktionseckdaten” og de øvrige forståelighedsdimensioner, samtidig skal teksten på samme tid kunne opfylde det ovennævnte på en sådan måde, at teksten ikke gøres umiddelbart længere end egentlig nødvendigt, teksten skal være tegnøkonomisk. Man kan bruge Göpferichs eget eksempel for en sprogøkonomisk tekst. ”Mit Hilfe der vorhandenen Unterfunktion SETUP ist es möglich, die standardmäßig eingestellten Vorgaben auf andere Werte einzustellen.” Optimeret version: ”Mit (der Unterfunktion) SETUP können Sie die Standardwerte ändern.” 44 I begge sætninger forklares, hvordan man kan ændre standardindstillingerne for en bestemt genstand. I den øverste sætning, er der valgt en længere og mere kompliceret forklaring, som for brugeren af genstanden kan besværliggøre det, der bliver forklaret relativt simpelt i den nederste sætning og som er mere relevant for teksten. I en tekst skal man passe på, at man, når man tager hensyn til både ”die kommunikative Funktion” og ”das mentale Denotatsmodell”, ikke skaber huller i forklaringen eller giver overflødige detaljer. På trods af at overflødige oplysninger ikke umiddelbart fører til at læseren ikke forstår teksten, medfører det en højere sværhedsgrad.45 Göpferich ser på 4 brud på anbefalingerne for Prägnanz. Manglende eller overflødige detaljer i henhold til ”das mentale Denotatsmodell” For lange formuleringer i forhold til, hvad der er passende for teksten Tautologier (hvor det samme siges flere gange f.eks. kvindelig gudinde) Redundans46 44 Göpferich, Susanne (2001) s.117ff Göpferich, Susanne (2001) s.117ff 46 Göpferich, Susanne (2001) s.117ff 45 20 I analyse senere i specialet undersøges det, om disse anbefalingerne bliver overholdt eller om en eller flere af de fire ovenstående punkter kan findes i de to indlægssedler. 6.7.3 Motivation Man skelner mellem to forskellige motivationer; den motivation, som læseren selv har for at læse teksten, og den motivation, som teksten skal bringe frem hos læseren igennem tekstens indhold.47 Den første form for motivation er ikke relevant i denne opgave for at undersøge forståeligheden af de anvendte indlægssedler. Motivationen kan være fremkaldet af læserens egen lyst til at læse teksten, men også af en undervisers krav om, at tekstens læses. Ud fra det må man konstatere, at denne motivation ikke er relevant for forståelighedsforskningen. Kravet til den motivation, som ligger i teksten selv, er først og fremmest at skaffe læserens opmærksomhed. For tekstgenren brugsanvisninger, som indlægssedler er en del af, opstår motivationen til at læse teksten som regel i behovet for at blive vejledt i anvendelse af et produkt. Som de andre forståelighedsdimensioner, skal kravene for motivation også stilles i forhold til den ”mentale Denotationsmodell”. Hvis motivationen skal appellere til læserens ”mentale Denotationsmodell” er der mulighed for at give eksempler og illustrere tekstens indhold på en måde, der kan kobles til læserens erfaringer. 6.7.4 Simplizität ([sprachliche] Einfachheit) Både Hamburger-psykologerne og Groeben baserer deres dimensioner ”Einfachheit” og ”sprachliche Einfachheit” på ordvalgets - og sætningskonstruktionens lethed, de er disse dimensioner Göpferich afleder ”Simplizität”. For at kunne bestemme, hvilke ord og sætningskonstruktioner der er lette, er der behov for en model. i Göpferichs model bliver der lagt vægt på det, der indirekte og direkte har indflydelse på teksten, dvs. ”die kommunikative Funktion” og ”die Textproduktions-Eckdaten”. Man kan stille nogle spørgsmål for at komme tekstens ”Simplizität” nærmere; 47 Er ordvalget passende? Er syntaxen passende? Opnås der på tekstgenrens illokutionære niveau en passende grad af direkthed? Er de valgte ord og konstruktioner tilstrækkeligt præcise? (er der undgået tvetydigheder?) Opnås der med leksik og syntax en passende konsistensgrad? Göpferich, Susanne (2001) s.117ff 21 6.7.5 Korrektheit Korrektheit er et af de parametre, som Göpferich har tilføjet til sin model. Hamburg-psykologerne og Groeben tog ikke hensyn til dette i deres analysemodel, da de gik ud fra, at hver eneste tekst der skulle optimeres og som var optimeret var fuldstændig uden fejl, hvilket sjældent er tilfældet.48 Korrektheden i en tekst skal ses i sammenhæng med ”das mentale Denotatsmodell” og tekstens kodering. Man kan se forskellige former for fejl i korrektheden i en tekst. Ved uøvede afsendere kan der have været en korrekt ”mentales denotatsmodell”, hvor det går galt for afsenderen i skrivefasen og han mister overblikket. Det ses også, at ”das mentale Denotatsmodell” fra starten ikke har været hensigtsmæssig i forhold til modtagerne af teksten. En tekst med fejl kan gøre det svært for modtageren at danne ”das mentale Denotatsmodell” eller gøre det helt umuligt. Hvis teksten kommer i konflikt med læserens ”mentale Konventionsmodell” kan det føre til en fejlfortolkning af afsenderens hensigt.49 Her kan man se på følgende punkter i analysen: Har afsenderen vurdering af modtagerens kendskab til emnet Uegnet metales Denotatsmodell, Konventionsmodell og medium Sproglige fejl i teksten 6.7.6 Perzipierbarkeit ”Perzipierbarkeit” omhandler nogle af de ting, der ikke bliver nævnt i de øvrige kategorier, og som kan gøre teksten lettere eller svære at forstå. F.eks. skitser, optællinger, layout osv. 6.8 Kritik af das Karlsruher Verständlichkeitskonzept Göpferichs ”Karlsruher Verständlichkeitskonzept” er valgt til analyse og gennemgang af de udvalgte indlægssedler, da det er den teori, der kommer ind på flest aspekter af en tekst. Den ser på tekstens afsenders intentioner og evner til at formidle information, men samtidig giver den også mulighed for at se på modtagerne og deres viden og evner til at modtage en tekst. Göpferichs teori er samlet i en model (se figur 2), som gør det nemt at få overblik over hvilke dimensioner og hvilke ”Textproduktionseckdaten”, der hører sammen og hvilke aspekter der skal analyseres i teksten. 48 49 Göpferich, Susanne (2001) s.117ff Göpferich, Susanne (2001) s.117ff 22 7. Fagsprog Fagsprog ”… er en sprogbrug, som er målrettet mod at løse faglige kommunikationsopgaver, og hvis udseende er formålsbestemt af disse faglige kommunikationsopgaver”50 og ”er et kommunikationsredskab, der anvendes, når specialister taler med hinanden om det, de er specialister i”51. Fagsprog er som Engberg beskriver i det ovenstående, et sprog, der bruges i forskellige fagområder. Men fagsprogene er intet uden fagfolk, som behersker disse fagsprog. Fagfolk og fagsprog er to størrelser, som er afhængige af hinanden, uden fagfolk var der ingen fagsprog og uden fagsprog ville der være flere fagfolk, da det at tillære sig informationer om et bestemt område ville være lettere, hvis læseren ikke først skulle afkode det anvendte fagsprog. Fagsprog opstår, når mennesker specialiserer sig inden for et bestemt område. For at bruge samme eksempel som Engberg, brugte man for mange år tilbage også et bestemt sprog inden for agerdyrkningen, men da størstedelen var agerdyrkere på daværende tidspunkt, kan man ikke tale om dette som et fagsprog.52 Men i og med at befolkningen blev større og vi hver især udvikler forskellige kompetencer, vil vi have forskellige niveauer af forståelse af forskellige fagområder. Der er et utal af fagsprog, som hver dækker deres fagområde og som tales og forstås af fagfolk, men hvis man skulle skabe et informationsmæssigt optimalt fagsprog, kan man ifølge Engberg bruge Hans-Rüdiger Flucks fire kriterier.53 Entydighed Kun ét ord per genstang. På samme måde som lægevidenskaben har ét ord for hver enkelt knogle. Præcision Sproget skal opdele verden efter det pågældende fagområdes behov. Eksempel fra Engberg, en slagter og en biolog opdeler en ko på forskellige måder. Biologen ser sener, muskler og knogler, mens slagteren ser inderlår, spidsbryst og tykkam.54 Økonomi Der skal refereres til genstande og relationer mellem dem på en kort og klar måde. Let håndterbarhed Skrivning og forståelse af tekster skal være så let som muligt. Målgruppe skal defineres.55 Dog er det svært at få et fagsprog til at passe ind i alle fire kategorier. Kategorierne økonomi og let håndterbarhed kan i mange tilfælde være hinandens modsætninger. Man kan tage et sprog som f.eks. det 50 Engberg, Jan: (2003) s.25 Engberg, Jan: (2003) s.25 52 Engberg, Jan: (2003) s.25 53 Engberg, Jan: (2003) s.29 54 Engberg, Jan: (2003) s.29 55 Engberg, Jan: (2003) s.30 51 23 medicinske fagsprog, her kan man som læge eller som sygeplejerske kommunikere med andre fagfolk på et kort og præcis sprog, hvor sygdomsbetegnelser o. lign. bliver forkortet ned til latinske betegnelser, fordi de bekendte med disse betegnelser. Dette gør, at kategorien økonomi bliver overholdt i disse tekster, dog kommer problemerne med disse tekster, når man ser på den næste kategori, hvor tekster skrivning og forståelse af disse tekster skal være så let som muligt. Det er også her, at problemerne opstår for indlægssedler. Folkene bag hele Danmark og Tysklands medicinske produkter skal have tilladelse til at sætte deres produkter på markedet56. Før de kan få denne tilladelse, skal de udarbejde et såkaldt produktresumé. Et produktresumé indeholder omtrent de samme informationer som indlægssedlerne, men er skrevet i et andet sprog. Der bliver hovedsagligt anvendt latinske betegnelser og de bliver ikke beskrevet. Eksempel fra dansk produktresumé for Hexal AGs danske udgave af Carvedilol; ”Hjerteinsufficiens. Behandling af moderat til svær hjerteinsufficiens udover konventionel grundbehandling med diuretika, ACE-hæmmere, digitalis og/eller vasodilatorer. Patienten skal være klinisk stabil (ingen ændring i NYHA-klasse, ingen indlæggelse på grund af hjerteinsufficiens), og grundbehandlingen skal være stabiliseret i minimum 4 uger inden behandlingen. Desuden skal patienten have en reduceret uddrivningsfraktion for venstre ventrikel, en hjertefrekvens på > 50 slag/min. og et systolisk blodtryk på > 85 mm Hg (se 4.3 "Kontraindikationer").”57 I ovenstående eksempel ser man, hvordan der er brugt latinske betegnelser og medicinske begreber såsom ”diuretika”. ”ACE-hæmmere” og ”en reduceret udrivningsfraktion”. Der er kun et begreb, ”klinisk stabil”, der beskrives i dette tekstuddrag. Dette tekstuddrag passer ind i Flucks kategorier, entydighed, præcision og økonomi. Der bliver skrevet i et entydigt, præcist, økonomisk og let håndterbart sprog. Modtagerne er folk, som besidder lignende viden som afsenderen. I forbindelse med det område som undersøges, nemlig forståeligheden af indlægssedler, vil dette fagsprog få problemer, når produktresumeerne skal omdannes til indlægssedler. Her er målgruppen en helt anden heterogen målgruppe. I dette tilfælde er det en fordel stadig at kigge på Flucks fire kategorier. Dog skal afsenderen ændre brugen af fagsproget, da den nye målgruppe ikke har samme forhåndsviden til det medicinske fagområde. 56 57 laegemiddelstyrelsen.dk PRODUKTRESUMÉ for Carvedilol ”HEXAL”, tabletter s.2 24 8. Analyse af indlægssedlerne Indlægssedlers tekst kan ud over at blive analyseret med Göpferichs model også vurderes ved hjælp Brinker58 og Engberg et al.s59 begreber. Brinker inddeler tekster i forskellige funktioner f.eks. Informationsfunktion og appelfunktion. Engberg et al. har assertiv funktion og direktiv funktion. Assertiv funktion og direktiv funktion bliver igen inddelt i to underfunktioner. Assertiv funktion Bruges til at få læseren til at forstå en bestemt sammenhæng i verden. o Transmitterende funktion Bruges til at videregive et enkelt sagsforhold om at noget forholder sig på en bestemt måde. o Forklarende funktion Bruges til at videregive komplekse sagsforhold, hvor man også ønsker at præsentere og forklare sammenhænge.60 Direktiv funktion Bruges til at få læseren til at udføre en handling eller undlade at udføre en handling. o Bindende direktiv funktion Læseren er forpligtet til at udføre handlingen. o Ikke-bindende funktion Læseren er ikke forpligtet til at udføre handlingen, som afsenderen opfordrer ham til.61 Brinkers informationsfunktion ses i tekster, hvor afsenderen, som ordet antyder, vil formidle en bestemt viden eller informere læseren om noget62. Man kan sidestille denne funktion med Engbergs assertive funktion. En informativ tekst er en informerende tekst, der oplyser læseren om et emne f.eks. hvordan en kobling på en bil er opbygget. Appelfunktionen forsøger, at få læseren til at have en bestemt holdning til et emne eller at udføre en bestemt handling. En direktiv tekst har også det formål, at få læseren til at opføre sig på en bestemt måde og udføre en handling på netop den måde, der bliver nævnt i teksten f.eks. hvordan selvsamme kobling skal bruges til at føre en bil. Indlægssedlen hører til en genre af tekster, som hovedsagligt har to funktioner nemlig informativ/assertiv forklarende og appel/direktiv ikke-bindende. En indlægsseddel informerer i det omfang, at læseren bliver 58 Brinker, Klaus: (2005) s.110ff Engberg et al.: (2007) s. 70ff 60 Engberg et al.: (2007) s. 70ff 61 Engberg et al.: (2007) s. 70ff 62 Brinker, Klaus: (2005) s.113 59 25 klogere på hvilke virkestoffer, der udgør produktet og hvor stor en mængde, der er af disse. Læseren bliver også informeret om mulige bivirkninger. Appelfunktionen er også en stor del af indlægssedlen, da den opfordrer læseren til at anvende deres produkt på en bestemt måde. De forklarer, hvordan man skal forholde sig i tilfælde af overdosering. Den informative funktion i indlægssedlen er ikke bindende, da afsenderen ikke kan tvinge læseren til at gøre som beskrevet. De har kun mulighed for at opfordre, men samtidig advare om følgerne, ved ikke at følge deres anvisninger. Hvorimod man f.eks. i en rykker kan true modtageren med skrappere midler, hvis de ikke følger opfordringen om at betale. 8.1 Indlægsseddel nr.1 8.1.1 Zweck Som tidligere beskrevet i afsnit 2 er det indlægssedlens formål at informere om indholdet i det foreliggende lægemiddel, og orientere patienten om den korrekte brug og eventuelle bivirkninger og advarsler. I denne tekst skal patienten vejledes i brugen af Carvedilol HEXAL® 12,5 mg, som afhjælper et forhøjet blodtryk. Under teksten formål kommer også ”die kommunikative Funktion”63. Da en indlægsseddel som tidligere beskrevet både skal informere om lægemidlet og få patienten til at anvende lægemidlet på en bestemt måde, er teksten både informativ og appellativ64. Med konkrete eksempler fra teksten kan de informative passager ses på denne måde: ”Carvedilol HEXAL® 12,5 mg gehört zur Stoffgruppe der unselektiven Beta- und Alpha-1-Rezeptorenblocker“ ” Carvedilol HEXAL® 12,5 mg kann die Symptome und Zeichen einer Schilddrüsenüberfunktion verschleiern oder abmildern.” De ovennævnte eksempler er informative i og med de beskriver for læseren, hvilke beta- og alfablokkere dette medikament hører til. De forklarer, hvordan medikamentet kan sløre symptomer og tegn på en overaktiv skjoldbruskkirtel. Hvorimod de nedenstående er eksempler på, hvordan teksten vil have læsere til at udføre en speciel handling. De vil have læseren til ikke at tage ekstra medicin, i det tilfælde der er blevet glemt en tidligere dosis. Desuden får læseren besked på at medicinering med Carvedilol HEXAL® 12,5 mg ikke må stoppes uden nedtrapning. Direktive eksempler 63 64 Göpferich se model Brinker, Klaus: (2005) s.110 26 ” Nehmen Sie nicht die doppelte Dosis, wenn Sie die vorherige Einnahme vergessen haben, sondern fahren Sie wie gewohnt mit der Einnahme fort.” ” Wie andere Betablocker sollte Carvedilol HEXAL® 12,5 mg nicht abrupt abgesetzt werden. Dies gilt insbesondere, wenn Sie an Durchblutungsstörungen des Herzmuskels leiden. Die Therapie mit Carvedilol HEXAL® 12,5 mg muss innerhalb von zwei Wochen schrittweise abgesetzt werden, z. B. durch Reduktion der Tagesdosis alle drei Tage auf die Hälfte” 8.1.2 Adressaten En teksts forståelighed er baseret på to forskellige parametre, nemlig selve tekstens udformning og læserens måde at læse og modtage teksten indhold på. En tekst kan opfattes på lige så mange måder, som der er modtagere. Derfor er det i forbindelse med analyse af de valgte indlægssedler vigtig også at kigge på modtagerne. Modtagerne af denne indlægsseddel er patienter, der har behov for betablokkere til at nedsætte deres forhøjede blodtryk. Forhøjet blodtryk kan opstå af flere årsager. Det kan være arveligt betinget, eller komme som bivirkning pga. anden medicin. Dog rammes mange af forhøjet blodtryk pga. deres livsstil. Overvægt, alkoholmisbrug, fed og saltholdig mad og mangel på motion65 er nogle af synderne, der kan føre til forhøjet blodtryk. Umiddelbart vil der kunne argumenteres for, at mennesker med ingen eller kort uddannelse vil være mere tilbøjelighed til at blive ramt af forhøjet blodtryk grundet manglende viden om følgerne ved denne levevis. Dog viser årsagerne til forhøjet blodtryk også, at alle kan være i farezonen. Ud fra den konstatering må medicinalfirmaerne se på deres modtagere af indlægssedlerne, som en heterogen gruppe af mennesker, som kan være alle uanset køn, alder, sociale status og uddannelsesniveau og med forskelligt kendskab til det medicinske sprogbrug. Da man ikke kan indkredse målgruppen nærmere må indlægssedlen tilpasses denne brede, homogene gruppe af modtagere. Modtagerne kan uanset deres sociale status ses som lægfolk inden for det medicinske fagområde og fagsprog. 8.1.3 Sender Da det er medicinalfirmaerne selv, der står på udarbejdelsen af indlægssedlerne til deres medikamenter, er afsenderen af indlægssedlen for Carvedilol HEXAL® 12,5 mg Hexal AG. Producenterne og folkene, de har ansat til at udforme indlægssedlerne er fagmænd, hvilket vil sige at de har stor viden inden for de område de beskæftiger sig med. I dette tilfælde medicin og det medicinale fagsprog. Forholdet mellem afsender og modtager er asymmetrisk i og med afsenderen besidder en meget større viden om emnet end modtageren, som er lægmand. Dette asymmetriske forhold gør at afsenderen er 65 netdoktor.dk 27 nødsaget til at tilpasse sin tekst til en modtager, som ikke forstår fagsproget. Det asymmetriske forhold mellem afsender og modtager gør, at afsender får svære ved at fremstille en simpel ”mentales Denotatsmodell” for modtageren. 8.1.4 Textproduktionseckdaten I det ovenstående er de grundlæggende informationer om indlægssedlen for Carvedilol HEXAL® 12,5 mg blevet fastslået. I det følgende vil gåes der dybere ind i teksten og der ses på tekstens ”Textproduktionseckdaten”. 8.1.5 Das mentale Denotatsmodell Afsenderens ”mentale Denotatsmodell“ får det frem i teksten, som ”die kommunikative Funktion” ønsker, hvilket er at informere læseren om Carvedilol HEXAL® 12,5 mg og vejlede dem i brugen af dette medikament. De hjælper læseren på vej til selv at danne en ”mentales Denotatsmodell”, ved i starten af teksten at indsætte en disposition. Ud fra dispositionen kan læseren danne sig et billede over de informationer, der vil komme i løbet af teksten. 8.1.6 Das Mentale Konventionsmodell Eftersom indlægssedler i løbet af årene er blevet underlagt forskellige love f.eks. AMG § 11 (Arzneimittelgesetz) og Rådets direktiv 92/27/EØF af 31. marts 1992 om etikettering af og indlægssedler til humanmedicinske lægemidler, vil udformningen af indlægssedler nærme sig hinanden og modtagerne vil danne sig et billede af, hvordan en indlægsseddel skal se ud. Ud over de nævnte love er der i Tyskland også blevet udarbejdet forskellige skabeloner, som medicinalfirmaerne har mulighed for at anvende(Liste over skabeloner)66, selvom der ikke findes nogen skabelon direkte beregnet til Carvedilol, har medicinalfirmaerne stadig mulighed for at bruge den overordnede del af de andre skabeloner, til at skabe deres egen for netop ”Carvedilol”. De skal ikke gøre brug af skabelonerne, men det er en god mulighed for medicinalfirmaet for at kunne skabe en indlægsseddel, der opfylder forventningerne fra modtagernes side. Indlægssedlen for ”Carvedilol HEXAL® 12,5 mg Tabletten” opfylder de forventninger, man som modtager har til en indlægsseddel opbygningsmæssigt. Teksten er opbygget på en måde, så læseren nemt kan finde en specifik oplysning f.eks. er der i starten af teksten følgende indholdsfortegnelse: ”Diese Packungsbeilage beinhaltet: 1. Was ist Carvedilol HEXAL® 12,5 mg und wofür wird es angewendet? 2. Was müssen Sie vor der Einnahme von Carvedilol HEXAL® 12,5 mg 66 https://sunset-clause.dimdi.de/Mustertexte/BStationServlet;jsessionid=FF2D14131A4FB05B5BE62AAF5E519A75 28 beachten? 3. Wie ist Carvedilol HEXAL® 12,5 mg einzunehmen? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Carvedilol HEXAL® 12,5 mg aufzubewahren?“ Denne form for indledning til indlægssedlen er brugt i mange indlægssedler, eksempelvis er den brugt i begge indlægssedler, som undersøges i dette speciale. Det, at denne form for indledning er anvendt så ofte, gør at læseren ser den som en del af en indlægsseddel og den bidrager derfor til læserens ”mentale Konventionsmodell”. 8.1.7 Medium Denne indlægsseddel er tilgængelig for alle på internettet, der har interesse i at læse om præparatet. Derudover fås den i papirsform i inde i pakningen, efter patienten har fået recept fra lægen og de har købt medikamentet. I nogle tilfælde kan det være en hjælp for læseren, hvis der i indlægssedlen er anvendt illustrationer. F.eks. i et tilfælde, hvor forældre skal give deres børn øjendråber, og det er vigtigt at de bliver dryppet korrekt ind i øjet, kunne det være relevant med en illustration af den korrekte anvendelse. Da indlægssedler har begrænset plads til at videregive de ønskede informationer, er der som regel ikke plads til illustrationer og læseren må nøjes med skriftlige forklaringer. Dette kunne man tage hensyn til i udgave på internettet, da der ved dette format ikke er samme pladsbegrænsninger, som ved papirsudgaven. Selvom indlægssedlerne er tilgængelige på internettet, er de ikke yderligere uddybet, på trods af ubegrænset plads til illustrationer og forklaringer. 8.1.8 Juristische und redaktionelle Richtlinien Indlægssedler er som beskrevet i tidligere afsnit underlagt love, som foreskriver hvordan indlægssedlen skal opbygges og udformes. Loven foreskriver også, hvilket sprog der skal anvendes i udformningen af indlægssedler. Nemlig at indlægssedlen skal være skrevet ”allgemein verständlich in deutscher Sprache, in gut lesbarer Schrift” ifølge den tyske Arzneimittelgesetz67. Derudover nævnes sproget også det europæiske direktiv ”Indlaegssedlen skal vaere let laeselig og vaere affattet i udtryk, der er klare og forstaaelige for patienterne, paa det eller de officielle sprog i den medlemsstat, hvor laegemidlet markedsfoeres”.68 Indlægssedlen for ”Carvedilol HEXAL® 12,5 mg Tabletten” er også tydeligt bygget op omkring den tyske 67 68 Arzneimittelgesetz §11 Rådets direktiv 92/27/EØF af 31. marts 1992 om etikettering af og indlægssedler til humanmedicinske lægemidler 29 Arzneimittelgesetz. Dog mangler der i indlægssedlen for ”Carvedilol HEXAL® 12,5 mg” enkelte punkter fra Arzneimittelgesetz. ”6 einen Hinweis auf das auf der Verpackung angegebene Verfalldatum sowie a) Warnung davor, das Arzneimittel nach Ablauf dieses Datums anzuwenden, b) soweit erforderlich besondere Vorsichtsmaßnahmen für die Aufbewahrung und die Angabe der Haltbarkeit nach Öffnung des Behältnisses oder nach Herstellung der gebrauchsfertigen Zubereitung durch den Anwender, c) soweit erforderlich Warnung vor bestimmten sichtbaren Anzeichen dafür, dass das Arzneimittel nicht mehr zu verwenden ist…“69 I den valgte indlægsseddel ses der ingen henvisning til angivelse af sidste anvendelsesdato, advarsel om brug af produktet efter denne dato, holdbarhed efter åbning, eller beskrivelse af tegn på at produktet ikke længere kan anvendes. Det er muligt, at Hexal Chemie GmbH & Co KG har valgt at trykke disse informationer på selve produktets emballage. Da jeg ikke har haft mulighed for at få indlægssedlerne sammen med emballagen til produktet, kan jeg hverken be- eller afkræfte dette. Det kan være en fordel for patienten, hvis producenten har valgt at trykke disse informationer på enten emballagen eller selve produktet, da man i tilfælde af mangel på indlægsseddel stadig vil kunne se sidste anvendelsesdato. På baggrund af, at indlægssedlen følger hvert enkelt produkt, kan det besværliggøre trykningen af indlægssedler, hvis der på hver enkelt skulle stå en ny sidste anvendelsesdato. 8.2 Verständlichkeitsdimensionen Forståelighedsdimensionerne70 går dybere ind i teksten ned på sætningsniveau, hvor formål, afsender og modtager er ydre faktorer, som har betydning for måden, hvorpå afsenderen skal forfatte sin tekst. I det følgende afsnit vil jeg komme ind på de seks forståelighedsdimensioner, som jeg beskrev i afsnit 6.7. 8.2.1 Struktur Som nævnt tidligere undersøges der i dette afsnit på makroniveau, om afsenderen har formået at tilpasse opstillingen af komplekse informationer til modtagerens kendskab til emnet, om der er brugt en disposition, der giver modtageren en fornemmelse for den ”mentale Denotatsmodell”, og om der er brugt advanced organizers i teksten. På mikroniveau kommer jeg ind på om informationerne i teksten kommer i den rækkefølge, som læseren har brug for dem. 69 70 Arzneimittelgesetz §11 stk.6 a,b og c Egen oversættelse 30 Indlægssedlen er opbygget sådan, at læserne efter en kort indledning ser dispositionen, som er vist nedenfor. Denne disposition giver et godt overblik over, hvilke læseren kan forvente at finde i indlægssedlen og hvor de er placeret. Dispositionen giver læserne god mulighed for at danne sig et visuelt billede, ”mentales Denotatsmodell, ”af, hvordan informationerne vil blive præsenteret for dem i den følgende tekst. ”Diese Packungsbeilage beinhaltet: 1. Was ist Carvedilol HEXAL® 12,5 mg und wofür wird es angewendet? 2. Was müssen Sie vor der Einnahme von Carvedilol HEXAL® 12,5 mg beachten? 3. Wie ist Carvedilol HEXAL® 12,5 mg einzunehmen? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Carvedilol HEXAL® 12,5 mg aufzubewahren?“71 Inddelingen af teksten gør det overskueligt for læseren at kunne springe til det afsnit, der omhandler præcis de informationer han mangler. F.eks. kan læseren efter at have læst hele indlægssedlen, se dispositionen igennem igen og vide, at han skal til afsnit 5 for at genlæse afsnittet om, hvordan man opbevarer produktet. Afsenderen har i denne indlægsseddel valgt at hjælpe læseren flere steder i teksten. F.eks. beskrives kriterierne for hyppighedsskalaen for bivirkninger, inden selve bivirkningerne beskrives. Selvom teksten bliver forlænget, med hvad der på nogle punkter kan virke ligegyldigt, kan det lette læsningen af afsnittet om bivirkninger, som er et væsentligt afsnit i indlægssedlen. Desuden er bivirkninger inddelt i to grupper, alt efter hvilke lidelser der ligger til grund for brug af produktet. Dette bidrager til, at læseren nemmere får overblik over, hvilke bivirkninger der er relevante at læse om i hans tilfælde. ”sehr häufig: mehr als 1 von 10 Behandelten häufig: weniger als 1 von 10, aber mehr als 1 von 100 Behandelten gelegentlich: weniger als 1 von 100, aber mehr als 1 von 1000 selten: weniger als 1 von 1000, aber mehr als 1 von 10.000 Behandelten sehr selten: weniger als 1 von 10.000 Behandelten, einschließlich Einzelfälle“ 71 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 31 Det ovenstående eksempel viser, hvordan en forklarende oversigt over de anvendte betegnelser for hyppighed. Denne oversigt giver læseren et godt overblik over de anførte bivirkninger og deres hyppighed, som nævnes umiddelbart efter denne tabel. Informationerne i den rækkefølge, som læseren skal bruge dem. Eksempelvis er det vigtigt at vide for patienten, nøjagtigt hvad det er han indtager, derefter kommer der advarsler for brugen af produktet, hvad man skal være opmærksom på og hvad man ikke må før man får at vide, hvordan man skal indtage produktet. 8.2.2 Prägnanz Ved produktion af en tekst skal den ”mentale Denotatsmodell” tage hensyn til ”die kommunikative Funktion” og ”Textproduktionseckdaten”, men man skal være opmærksom på at man ikke får skabt huller eller giver overflødige detaljer, derudover skal teksten være tegnøkonomisk. I det følgende afsnit vil jeg se på om der i denne tekst er manglende/overflødige detaljer og tautologier (sætninger hvor den samme genstand beskrives med flere forskelligartede udtryk, f.eks. en stærk kraftkarl72). Denne indlægsseddel indeholder 25.474 tegn uden mellemrum, hvilket vil sige at den fylder, hvad der svarer til 11,5 normalsider. Det er mange sider, som læseren skal læse og dermed også mange informationer for læseren at skulle forholde sig til. Indlægssedlen indeholder informationer, som kan betyde liv og død for læseren, derfor er det vigtig at der ikke er for stor andel overflødige detaljer. Overflødige detaljer vil gøre teksten endnu længere, hvilket vil betyde at læseren får en større mængde informationer, som han skal afkode, hvoraf nogle eventuelt kunne have været undladt. Det er klart at afsenderen i dette tilfælde, hvor det drejer sig om livsvigtig medicin, er nødsaget til at beskrive bivirkningerne, og hvordan medikamentet opfører sig i forbindelse med andre medikamenter. Dog må man også forvente, at patienten har fået ordineret dette medikament i forbindelse med dybdegående undersøgelser hos egen læge eller på sygehuset. Derfor er det ikke nødvendigt at beskrive hver enkelt sygdom, som kan opstå som bivirkning, fuldstændig udtømmende. Det er tilstrækkeligt kort at beskrive eller bruge den almenkendte betegnelse for bivirkningne. ”Aufgrund seiner Eigenschaft als gefäßerweiternder Betablocker ist während der Anwendung von Carvedilol HEXAL® 12,5 mg eine Verschlechterung einer peripheren Gefäßerkrankung unwahrscheinlicher als in Zusammenhang mit konventionellen Betablockern. Jedoch liegen bisher nur wenig klinische 72 Eksempel fra denstoredanske.dk 32 Erfahrungen in dieser Patientengruppe vor. Wenn Sie an Gefäßkrämpfen im Bereich der Finger und der Zehen (Raynaud-Krankheit) leiden, ist jedoch eine Verschlechterung der Symptome möglich.”73 I det ovenstående eksempel nævner afsender, at en forværring af perifere karsygdomme er usandsynlig i forhold til andre konventionelle betablokkere. Hvis denne forværring er forholdsvis usandsynlig, er der ikke behov for at forklare dette i et afsnit på 416 anslag, hvis der for læseren ikke består en reel risiko. Man kunne nøjes med at beskrive mulige følger eller mulige symptomforværringer, hvis man lider af Raynaudssyndrom. På den måde kunne man have sparet tegn og dermed forkortet teksten og læsetiden for læseren. ”Stillzeit Carvedilol (der Wirkstoff von Carvedilol HEXAL® 12,5 mg) geht in die Muttermilch über. Daher sollten Mütter während einer Behandlung mit Carvedilol HEXAL® 12,5 mg nicht stillen. Fragen Sie vor einer Einnahme von Carvedilol HEXAL® 12,5 mg in der Stillzeit Ihren Arzt um Rat.”74 I ovenstående eksempel fra teksten har afsenderen brugt 44 ord og 239 tegn på at informere læseren om at mødre ikke må amme, når de anvender Carvedilol HEXAL® 12,5 mg og at de skal kontakte lægen for rådgivning. Jeg mener, at der kunne spares overflødige tegn ved at knytte afsnittet med graviditet og amning sammen til et afsnit. Begge afsnit har betydning for den samme gruppe kvinder, en snævrere gruppe, der enten er gravide eller lige har født. Ved at samle disse afsnit til ét, vil man kunne undlade at nævne f.eks. medikamentets navn så ofte og tekstafsnittet vil blive mere tegnøkonomisk. Kvinderne får den fordel, at de i ved graviditet og amning kun skal forholde sig til ét afsnit. I afsnittet om betjening af maskineri og evnen til at føre køretøjer bruger teksten også flere tegn end nødvendigt. ”Verkehrstüchtigkeit und das Bedienen von Maschinen Carvedilol HEXAL® 12,5 mg kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass z. B. die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol und insbesondere bei Therapiebeginn und Dosiseinstellung.”75 Her anvender afsenderen 52 ord og 343 tegn til at beskrive en simpel advarsel om at medikamentet kan have indvirkning på evnen til at føre køretøjer og anvende maskineri, særligt ved indtag af alkohol. Det 73 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 75 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 74 33 store antal anvendte tegn fører til, at det bliver svært for læseren at gennemskue om han må køre bil eller anvende maskineri. 8.2.3 Motivation Da en indlægsseddel er en brugsanvisning til et medikament, som potentielt kan redde patientens liv, vil læseren allerede have en motivation for at læse indlægssedlen, uden at teksten i sig selv har givet læseren motivation i form af letlæselighed eller spænding. Men teksten i sig selv bør kunne fremføre motivation hos læseren som gør, at de læser teksten færdig. På samme niveau som de øvrige ”Textproduktionseckdaten” skal motivationen ses i forbindelse med ”das mentale Denotatsmodell”. Som allerede berørt i begyndelsen af dette afsnit om motivation, så er det slået fast at læseren af en indlægsseddel førend han påbegynder læsningen besidder en motivation for at finde og forstå informationer om det medikament, han sidder med i hånden. Motivationen fra læserens side er vigtig for indlægssedlen, da den ikke som romaner eller avisartikler har mulighed for, enten på bagsiden af bogens omslag, eller ved hjælp af en fængende overskrift at fange læserens opmærksomhed. Når læseren sidder med indlægssedlen i hånden og ønsker at forstå de følgende informationer, er det vigtigt at teksten i sig selv formår, at få læseren til at forsætte læsning også på trods af at informationerne ikke nødvendigvis er i et sprog han bruger til daglig. En af de måder hvorpå teksten kan motivere læseren til at forsætte læsningen, er ved at inddrage læseren i teksten. Brug af passiv i en tekst kan få læseren til at føle sig fjern fra teksten, da han ikke bliver inddraget. Hvorimod brugen af verber i aktiv sammen med brugen af personlige pronominer, hvor læseren bliver inddraget i teksten, gør at læseren føler at teksten har en tilknytning til ham. I denne indlægsseddel vil man i henhold til tabel 276 og tabel 377 kunne se, hvor ofte der er anvendt personlige pronominer i denne tekst også set i forhold til hvor mange ord, der er i hele teksten. Afsenderen har i denne indlægsseddel valgt at bruge 34 personlige pronominer, i en tekst der i alt består af 3.587 ord. Umiddelbart virker 34 ord ud af 3.587 ikke til at kunne have den store betydning for en tekst. Men ser man på det nedenstående eksempel fra indlægssedlen, hvor det ses, at der i dette tekststykke er 48 ord i en sætning. Tager dette faktum med i betragtning, så opdager man, at der er brugt personlige pronominer i den langt overvejende del af teksten. Det har positiv betydning for læserens forståelse af teksten, at afsenderen har valgt at inddrage læseren på dette plan. 76 77 Se bilag Se bilag 34 ”Wenn Sie Arzneimittel erhalten, die bestimmte Leberenzyme induzieren (z. B. Rifampicin, Barbiturate) oder hemmen (z. B. Cimetidin, Ketoconazol, Fluoxetin, Haloperidol, Verapamil, Erythromycin) müssen Sie während einer gleichzeitigen Behandlung mit Carvedilol engmaschig überwacht werden, da die CarvedilolSerumspiegel durch die erstgenannten Mittel gesenkt und durch die Enzymhemmer erhöht werden können.”78 Der er dog også eksempler på passager i teksten, hvor afsenderen ikke formår at inddrage læseren i teksten, hvorfor læseren kommer på større afstand af teksten. ” Bei gleichzeitiger Anwendung von Ergotaminen (Arzneistoffe gegen Migräne) kann es zu einer verstärkten Engstellung der Gefäße kommen.”79 Læseren bliver ikke inddraget i denne sætning, selvom den omhandler en relevant information for ham, hvis han anvender lægemidler mod migræne. Ved at anvende personligt pronomen i denne sætning og dermed at inddrage læseren, kunne teksten blive nemmere for læseren at forholde sig til. I dette eksempel mener jeg at afsenderen skulle have valgt en anden løsning. Løsningen, som afsender havde valgt til forrige eksempel fra teksten, hvor læseren bliver trukket med ind i teksten, havde været en bedre løsning i dette tilfælde også. ”Wenn Sie gleichzeitig Ergotaminen (Arzneistoffe gegen Migräne) anwenden, kann es zu einer verstärkten Engstellung der Gefäße kommen”80 Ovenstående er et eksempel på forbedring af teksten, her er læseren blevet inddraget i sætning. Dette bevirker, at han lettere kan relatere sig til informationerne. Han bliver mere opmærksom på, om denne sætning har betydning for ham og hans anvendelse af Carvedilol HEXAL® 12,5 mg. 8.2.4 Simplizität ([sprachliche] Einfachheit) ”Simplizität” er en undtagelse fra de andre dimensioner, da denne ikke tager hensyn til ”das mentale Denotatsmodell”, men udelukkende omhandler tekstens kodering.81 I dette afsnit vil jeg undersøge om ordvalget er passende, graden af direkthed og om der undgås tvetydighed. Grundet indlægssedlens udprægede faglige indhold skal formidlingen af disse informationer ske med et passende ordvalg. Indlægssedlens modtagere blev beskrevet i afsnit 8.1.2, hvor jeg kom frem til at afsenderne skal stile deres indlægssedler mod en heterogen målgruppe. Modtagerne kan være på 78 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.2 80 Eget forslag 81 Göpferich, Susanne: (2001) s.131-132 79 35 forskellige uddannelsesniveauer, hvilket også betyder at jeg, i min vurdering af ordvalget, skal tage den heterogene målgruppe i betragtning. Da man må gå ud fra, at det er relativt få inden for målgruppen, der besidder et stort medicinsk ordforråd, vil jeg se på om afsenderen formår at bruge et mere bredt ordvalg, eller om de vælger at bruge medicinske udtryk med eller uden beskrivelse. Et passende ordvalg i indlægssedler er et, som formår at bruge termer, som modtageren forstår og som videreformidler de vigtige informationer, som er hensigten med indlægssedlen. Samtidig skal afsender holde teksten på et niveau, så fagligheden bliver bibeholdt. Jeg mener, at afsenderen ikke har formået konsekvent at bruge et passende ordforråd, eller formået at beskrive upassende ordvalg på et sprog, der sænker niveauet i teksten og som ville have positiv indvirkning på modtagernes forståelse af teksten. Nedenstående er et eksempel fra indlægssedlen. ”Wenn Sie gleichzeitig Sympathomimetika mit alpha- und beta-mimetischen Wirkungen und Carvedilol HEXAL® 12,5 mg einnehmen, kann es zu einem übermäßigen Blutdruckanstieg und einer überschießenden Senkung der Herzfrequenz kommen.”82 Her mener jeg at afsender burde have forklaret termen ”Sympathomimetika mit alpha- und betamimetischen Wirkungen”. Den derpå følgende sætning er skrevet med et passende ordvalg, modtageren vil forstå at der kan forekomme kraftig forhøjelse af blodtrykket og lav hjertefrekvens. Dog vil det være uklart, hvorfor disse bivirkninger kan opstå. Her burde afsender enten have brugt andre ord for denne medicin eller have beskrevet, hvad det drejer sig om i en parentes efter termen. ”Herz-Kreislauf-System Sehr häufig: Beinödeme und eine verlangsamte Herzschlagfolge (Bradykardie), übermäßiger Blutdruckabfall bei Lagewechsel vom Liegen zum Stehen (orthostatische Hypotonie) Selten: Reizüberleitungsstörung am AV-Knoten (totaler AV-Block), Verschlechterung einer Herzleistungsschwäche (Herzinsuffizienz)”83 Ovenstående er et eksempel på, hvor jeg mener at det er lykkedes afsender at vælge et passende ordvalg og samtidig skabe en tekst, der både er faglig og forståelig for modtageren. Det ville dog forbedre forståeligheden yderligere, hvis man havde valgt en anden term i stedet for ”Reizüberleitungsstörung am AV-Knoten” f.eks. ”Herzrhythmusstörung”. 82 83 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.2 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.2 36 Jeg mener, at det er nødvendigt for modtageren i mange tilfælde at få den medicinske term med, også selvom disser termer ikke indgår i et passende ordvalg. Disse medicinske betegnelser kan vise sig nyttige senere eller i forbindelse med yderligere informationssøgning. Læseren af indlægssedlen læser netop denne på baggrund af en sygdom og på baggrund af, at han ønsker vejledning i præcis hvordan han skal anvende og opføre sig i forbindelse med dette medikament. Derfor er graden af direkthed i nedenstående eksempel fra teksten ikke tilfredsstillende. Der er anvendt et svagt formulering i advarslen og den ses sent i sætningen. For at hjælpe læseren til at udvise forsigtighed havde et stærkere verbum, fremrykning af verbet og brug af personligt pronomen givet sætningen et stærkere udtryk. ”Bei der gleichzeitigen Anwendung von Carvedilol HEXAL® 12,5 mg und bestimmten Anästhetika ist Vorsicht geboten (siehe Abschnitt „Wechselwirkungen mit anderen Arzneimitteln”).”84 ”Weisen Sie Aufmerksamkeit auf, wenn Sie Carvedilol HEXAL® 12,5 mg und bestimmten Anästhetika gleichzeitig verwenden”85 Ovenstående skal ses for forslag til forbedring af forrige sætning. Her er anvendt personligt pronomen for at inddrage læseren i teksten. Samtidig er advarslen rykket frem i teksten, så læseren straks forstår, at dette er en vigtig information. Jeg fandt ingen tvetydigheder i teksten. Så dette emne vil jeg ikke komme nærmere ind på. 8.2.5 Korrektheit Göpferich har som den eneste af de tre nævnte teoretikere lavet dimensionen ”Korrektheit”. Det har hun gjort, da hun ikke som psykologerne og Groeben går ud fra at hver tekst, uanset om den skal optimeres eller er blevet optimeret, er uden fejl. Igen skal denne dimension ses i forbindelse med ”das mentale Denotatsmodell” og tekstens kodering. Da der for indlægssedler er fastlagt flere retningslinjer, som dikterer udformningen af indlægssedlen. Da læserne af indlægssedlen har en ”mentales Konventionsmodell” om, hvordan en indlægsseddel er opbygget, er skrivefasen begrænset men samtidig er der mange forventninger fra læsernes side om udformningen. 84 85 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 Eget forslag 37 Udover eventuelle fejl i skrivefasen eller en uegnet ”mentales Denotatsmodell” fra afsenders side kan man også undersøge om, der er sproglige fejl i teksten og om afsender har en korrekt vurdering af modtagerens kendskab til emnet. Modtagerne af denne indlægsseddel er, som tidligere beskrevet en heterogen målgruppe, formet af mennesker med forhøjet blodtryk. Disse mennesker kan have afsluttet folkeskolen eller taget en Ph.d., de kan være i alle aldersgrupper og fra alle sociale lag, derfor er det svært for afsenderen at lave en vurdering af modtagernes kendskab til emnet, i og med at der kan være enkelte modtagere, som er bekendt med det medicinske fagsprog og fagområdet generelt, men også enkelte som ingen kendskab har til det medicinske fagområde. For at efterkomme hver enkelt modtagers kendskab til fagsproget, går afsenderen ind og forklarer medicinske fagord, som ikke er almenkendte. F.eks. ” insbesondere wenn Sie an Herzleistungsschwäche (Herzinsuffizienz) leiden: Carvedilol HEXAL® 12,5 mg sollte grundsätzlich zusätzlich zu Diuretika (Stoffe, die die Harnausscheidung steigern),ACE-Hemmern (Arzneistoffe gegen Bluthochdruck und Herzleistungsschwäche), Digitalis (herzwirksamer Arzneistoff)und/oder Vasodilatatoren (Arzneistoffe,die zu einer Gefäßerweiterung führen)gegeben werden.”86 For at nævne et medicinsk ord, som er kendt for de fleste er ”paracetamol”. Paracetamol er det stof, man finder i flere lette smertestillende præparater, som f.eks. Panodil og Pamol. Dette ord anvendes også på tysk og anvendes i præparater til samme formål. For at lette forståelsen beskrives fagordet i en parentes bagefter. Afsenderen har vurderet, at ikke alle modtagere kender fagsproget og drager konsekvensen af det og forklarer begreber, som i ovennævnte eksempel. Tager man de ovennævnte overvejelser i betragtning mht. egnet ”mentales Denotatsmodell” og ”mentales Konventionsmodell”, er der brugt en passende ”mentales Denotatsmodell” og ”mentales Konventionsmodell”. De følger anbefalingerne fra den tyske Arzeimittelgesetz87, Rådets direktiv 92/27/EØF af 31. marts 199288, de ”juristische und redaktionelle Richtlinien” og indlægssedlens opbygning er lavet over en ”mustertext” fra BfArM.89 Disse fire egenskaber gør at indlægssedlen passer ind i modtagerens forventninger til dens opbygning og indhold. Desuden gør dispositionen i starten af teksten, at læseren får en ”mentales Denotatsmodell”, som er passende, da teksten opfylder de løfterne, de er givet i dispositionen. Det valgte ”Medium”, som i dette tilfælde er både i papirform og på internettet, kan ikke 86 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 Arzneimittelgesetz §11 stk.6 88 Rådets direktiv 92/27/EØF af 31. marts 1992 om etikettering af og indlægssedler til humanmedicinske lægemidler 89 sunset-clause.dimdi.de 87 38 være anderledes, da det er påskrevet, at indlægssedlen skal følge med produktet. Derfor er det en ekstra service til modtagerne, at de kan hente indlægssedlen på nettet, i det tilfælde at de skulle have mistet den medfølgende papirsudgave af indlægssedlen. 8.2.6 Perzipierbarkeit Göpferich har indført denne dimension, for også at kunne vurdere de makro – og mikrotypografiske tekstegenskaber, som er med til at bestemme tekstens lethed. Under makrotypografiske egenskaber vil jeg se på: Sideformat Linjeafstand Inddeling af siden og teksten Placering af billeder og tabeller i teksten Mængeforholdet mellem skrift, billeder og tabeller Skriftstørrelse Fremhævelse af tekst Da jeg som sagt ikke har haft mulighed for at få denne indlægsseddel i papirversion, men derimod i en pdfudgave fra producentens hjemmeside, kan jeg kun tale om indlægssedlens sideformat i det omfang, hvordan en indlægsseddel normalt er i papirsform. En indlægsseddel er printet på et stykke papir, men kan være trykt på begge sider. Papiret som indlægssedlen er trykt på er som regel et aflangt og smalt papir. Der skal forfattes mange informationer om lægemidlet på lidt plads, hvilket har konsekvenser for skriftstørrelsen. Fordi de mange informationer skal skrives på lidt plads, har afsenderen været nødsaget til at bruge en lille skriftstørrelse. Ifølge Teigeler er den optimale skriftstørrelse for voksne størrelse 1090, denne standard kan de fleste indlægssedler ikke leve op til. Ofte vil skriftstørrelsen være mindre og svært læselig. I det anvendte eksemplar af indlægssedlen, som er en pdf-udgave, har læseren muligheden for at forstørre dele af teksten, hvorved skriften bliver større. Muligheden for at gøre teksten større letter ikke direkte forståelsen af teksten, men gør at teksten bliver tydeligere og lettere at læse, hvilket indirekte har en positiv indflydelse på forståeligheden af teksten. Kopierer man et tekststykke fra pdf over i et dokument, ses det at der er brugt skriftstørrelse 8, hvilket ifølge Teigeler som ovenfor nævnt er mindre end den anbefalede skriftstørrelse 10. 90 Teigeler, Peter: (1982) s.125 39 Dog er der ved indlægssedlens format et andet aspekt, som har en negativ effekt på forståeligheden, nemlig det faktum, at teksten er inddelt i to spalter. Spalter ses oftest i avis – og magasinartikler, som i modsætning til indlægssedlen er trykt i et større format, som regel A4 ogA3, hvilket gør spalterne lettere at skelne fra hinanden. I indlægssedlen derimod gør den trange plads at spalterne, trods en skillelinje, bliver svære at skelne fra hinanden. Spalterne forstyrrer læseprocessen. Læseren ville have haft fordel af at teksten var opbygget uden spalter, så læseren ikke læser videre mod højre, når han egentlig skal skifte linje og læse fra venstre på ny. Af den grund mener jeg, at spalterne for læseren har en indirekte negativ indvirkning på forståelsen af teksten. Spalterne er, ligesom dette afsnit omhandler, en ydre egenskab i denne tekst, derfor har den ingen direkte indflydelse på forståelsen, men den forlænger læsetiden, som igen gør at læseren kan miste motivationen for at læse teksten. Fremhævelse af en tekst kan ske på forskellige måder, man kan vælge at bruge kursiv skrift, fed skrift og understregning. I indlægssedlen for Carvedilol HEXAL® 12,5 mg er der brugt fed skrift i overskrifterne, som vist nedenunder. ”2.Was müssen Sie vor der Einnahme von Carvedilol HEXAL® 12,5 mg beachten? Carvedilol HEXAL® 12,5 mg darf nichteingenommen werden bei - Überempfindlichkeit gegenüber Carvedilol oder einem der sonstigen Bestandteile von Carvedilol HEXAL® 12,5 mg”91 Brugen af fed skrift i denne forbindelse hjælper til letlæseligheden af teksten, da læseren nemmere kan orientere sig i teksten ved hjælp af de fremhævede overskrifter. I originalversionen af pdf-udgaven er den fremhævede skrift også skrevet i en større skriftstørrelse, hvilket gør den yderligere fremtrædende. Fremhævelse af overskrifter er gennemgående i hele indlægssedlen, hvor også underafsnit er skrevet med fed og i større skriftstørrelse end den resterende tekst. Flere steder i teksten er der brugt kursiv til at fremhæve; ”Andere Warnhinweise für Carvedilol HEXAL® 12,5 mg und Betablocker im Allgemeinen: Wenn Sie an einer dauerhaften Atemwegserkrankung …”92 Afsenderen har valgt at bruge kursiv skrift til at fremhæve underafsnit, hvilket ifølge Teigeler93 kan gøre det svære at læse teksten. Kursiveret skrift kan have den effekt at gøre læseren opmærksom på afsnit, der kræver større koncentration, dog mener jeg at de i denne indlægsseddel ikke hjælper læseren, men gør 91 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 93 Teigeler, Peter: (1982) s.125 92 40 teksten svære at læse, da skriften bliver sløret og ikke yderligere bliver fremhævet, hvorved læseren kan blive forvirret over meningen med brugen af kursiv. ”Erkrankung der Herzkranzgefäße (chronisch stabile Angina pectoris) Erwachsene: Die empfohlene Dosis zu Beginn der Behandlung beträgt 2-mal täglich 1 Tablette Carvedilol HEXAL® 12,5 mg (entsprechend 2-mal täglich 12,5 mg Carvedilol) für zwei Tage.”94 Medikamentet som denne indlægsseddel tilhører kan anvendes i forbindelse med forskellige lidelser, hvilket gør at afsenderen skal beskrive forskellige for anvendelse af produktet. Kursiv er brugt som i ovennævnte eksempel, hvor de nævnte forskellige lidelser står i kursiv som overskrift for den følgende tekst, som er en uddybelse af anvendelsen, hvilket er skrevet i enkel skrift. Dette produkt er et livsvigtigt medikament for folk, som lider af hypertension(forhøjet blodtryk)95 og stabil angina pectoris (hjertekramper)96, derfor er det af højeste betydning for dem at få de korrekte informationer i forhold til den sygdom, der ligger til grund for deres brug af medikamentet. Derfor mener jeg, at overskrifter i afsnittet ”Wie ist Carvedilol HEXAL® 12,5 mg einzunehmen?” burde være skrevet med fed, så læseren lettere ville kunne skimte de sygdomme igennem, som ikke repræsenterer ham. I indlægssedlen for Carvedilol HEXAL® 12,5 mg er der ikke forskel på skriftstørrelsen i de tilfælde, hvor der er brugt kursiv. Dette bevirker at overskrift og tekst er svær at skelne fra hinanden, hvilket yderligere besværliggør læsningen. I indlægssedlens afsnit 4 ”Welche Nebenwirkungen sind möglich?” er der to steder brugt understregning til at fremhæve tekststykker. ”Berichte über Nebenwirkungen aus klinischen Studien bei Patienten mit Herzleistungsschwäche”97 Understregningerne er brugt i forbindelse med beskrivelser af studier omkring bivirkninger ved mennesker med de før nævnte sygdomme. Afsenderen har i dette tilfælde formentlig valgt at fremhæve disse tekststykker, da det for modtageren er vigtige informationer mht. bivirkninger ved lige nøjagtig deres sygdom. Dog mener jeg, at det havde været mere hensigtsmæssigt i forhold til læseren at bruge fed skrift i stedet for understregning. Det er forvirrende for læseren, hvad afsenderens hensigt med understregningen er. Hvis der havde været konsekvent brug af understregning ved andre vigtige afsnit i teksten, havde det 94 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 Netdoktor.dk 96 Netdoktor.dk 97 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.2 95 41 virket bedre. Men på baggrund af at der tidligere både er brugt fed skrift og kursiv, havde det været bedre at vælge en af de to muligheder. Der er ikke brugt tabeller i teksten, det eneste der går ud over at være normal tekst to tekstbokse og et logo.98 Tekstboksen er brugt til at indramme forklaringen af betegnelserne for hyppighed af bivirkninger. Den første tekstboks99 er det første man ser i indlægssedlen og indrammer vigtige informationer, som skal læses før modtageren læser selve indlægssedlen og ikke hører til i nogle af de følgende afsnit i indlægssedlen. Den anden tekstboks er placeret i højre kolonne øverst på side 2, efter introduktionen af afsnittets indhold, denne tekstboks mener jeg er placeret et hensigtsmæssigt sted, da den her forklarer hyppighedsbetegnelserne før end at bivirkningerne bliver forklaret. På indlægssedlens første side har afsenderen indsat deres logo, direkte under den første tekstboks og til højre for dispositionen. Der er overvejende gjort brug af tekst i denne indlægsseddel, hvilket gør at forholdet mellem tekst og tabeller, billeder og tekstbokse er asymmetrisk. Tabeller og billeder kan gøre en tekst nemmere at forstå, hvis de bliver brugt på en hensigtsmæssig måde. Jeg mener at man ville kunne have draget fordel af at bruge flere tabeller i indlægssedlen. F.eks. i afsnittet ” Wie ist Carvedilol HEXAL® 12,5 mg einzunehmen?” ville læseren bedre kunne forstå forklaringen af op - eller nedtrapningsperioden, når de starter på medikamentet eller genstarter efter en pause. Der er mange informationer for modtageren i dette afsnit, som det ses i det nedenstående eksempel fra teksten. ”Erwachsene: Die empfohlene Dosis zu Behandlungsbeginn beträgt 1-mal täglich 1 Tablette Carvedilol HEXAL® 12,5 mg (entsprechend 12,5 mg Carvedilol) für zwei Tage. Danach wird die Behandlung mit einer Dosis von 1-mal täglich 2 Tabletten Carvedilol HEXAL® 12,5 mg (entsprechend 25 mg Carvedilol) fortgesetzt. Die Dosis kann gegebenenfalls schrittweise in Abständen von zwei Wochen oder in größeren Abständen weiter erhöht werden.”100 I eksemplet ser man, hvordan der med mange ord bliver beskrevet, hvad man kunne have forklaret i en model. Modellen havde haft positiv indvirkning på indlægssedlen forståelighed. Jeg har lavet en tabel, som jeg mener, kunne have været hensigtsmæssig at bruge i dette tilfælde i stedet for at skrive informationer sammen med andre informationer, så læseren nemt bliver forvirret. Udover tabellen, mener jeg at man kunne have tekst, som i den originale tekst, men kun som uddybende informationer til tabellen. 98 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.2 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 100 Indlægsseddel; Carvedilol HEXAL® 12,5 mg s.1 99 42 Carvedilol HEXAL® 12,5 Tag 1 Tag 2 Evt. Tag 3/Woche 2 mg Menge 1 Tablette - einmal am 2 Tabletten - einmal am 2,5 Tabletten 1 Tablette = 12,5 mg Tag Tag Tabel 1.101 I denne indlægsseddel kan man også diskutere valget af linjeafstand. Jeg vil igen gøre opmærksom på, at det kun har været muligt for mig at få denne indlægsseddel som pdf. Dette betyder, at jeg ikke kan komme ind på, hvordan linjeafstanden er i papirsudgaven. Derfor er det, som nævnt tidligere nævnt, muligt i denne anvendte pdf-udgave af indlægssedlen muligt at forstørre teksten, dvs. at man også kan vælge enkelte tekststykker, som man gerne vil se nærmere på. Linjeafstanden i denne indlægsseddel er ikke tilstrækkelig, da linjerne allerede i form af spalterne har let ved at flyde sammen, får den korte linjeafstand teksten til at flyde yderligere sammen. Afsender har valgt ikke at tilføje afstand mellem overskrifter og selve afsnittene men derimod mellem delafsnit i den løbende tekst. Linjeafstanden mellem delafsnittene giver en god effekt, det giver læseren mulighed for kort at stoppe op og reflektere over det nyligt læste. Linjeafstand mellem overskrift og afsnit havde givet en god effekt for læseren på den måde, at det bliver gjort klart, at der nu kommer nye informationer, men at læseren får lov at forberede og indstille sig på de nye informationer, inden de nye informationer starter. En større linjeafstand i den løbende tekst havde lettet læsningen, og dermed også forståelsen af teksten. Som tidligere fastslået har teksten layout også betydning for forståelsen, da disse faktorer indirekte har indflydelse på læseren oplevelse af teksten. 8.3 Delkonklusion Igennem analyse af den første indlægsseddel for Carvedilol HEXAL® 12,5 mg er jeg kommet frem til, at hovedformålet med en indlægsseddel er at formidle de informationer læseren skal bruge for at kunne anvende medikamentet korrekt, dette er af særlig betydning for et medikament som har livsvigtig betydning for patienten. Læseren får i denne indlægsseddel serveret 11,5 normalsiders tætskrevet tekst, dette kan have en intimiderende effekt på læseren, som igen vil have negativ betydning for tekstens motivation. Læseren bliver inddraget i store dele af teksten, men i optimering af teksten ville det være muligt at inddrage læseren endnu mere. Indlægssedlen dumper også i den faktor, som Hexal kun delvis har indflydelse, nemlig i tekstens layout. Afsenderen skal på disse 11,5 sider informere og vejlede læseren i brugen af medikamentet, derfor er det væsentligt om afsenderen formår at forklare de anvendte fagord for læseren. Hexal, som er afsenderen bag denne indlægsseddel lykkes med at forklare overvejende del af de anvendte fagord. En gennemarbejdning og fuldstændig optimering af teksten ville kunne gøre teksten mere 101 Egen tabel 43 tegnøkonomisk og mere tilpasset til læserens forudgående viden og kendskab til det medicinske fagområde. 8.4 Indlægsseddel nr.2 8.4.1 Zweck Carvedilol-ratiopharm® 12,5 mg Filmtabletten har som nævnt ved forrige indlægsseddel til formål at informere og vejlede patienter og deres pårørende om hvilke virkninger medikamentet har, hvis de ikke selv er i stand til at indtage medicinen, eller læse indlægssedlen. Formålet er vigtigt for afsenderen at holde sig for øje, da deres informationer og evne til at få patienten til at gøre som beskrevet er vigtig for korrekt anvendelse af medikamentet, som kan have stor betydning for patientens liv. 8.4.2 Adressanten Modtageren af denne tekst kan beskrives på samme måde som i afsnit 8.1.2 . I Tyskland er ca. hver anden voksen ramt af forhøjet blodtryk. For gruppen af mennesker i Tyskland mellem 18 – 79 år, er ca. 44 % af kvinderne ramt af forhøjet blodtryk og ca. 51 % af mændene 103 . Disse tal bidrager til den opfattelse af at målgruppen for indlægssedlerne for blodtrykssænkende medicin er meget bred. Forhøjet blodtryk er en folkesygdom, og derfor kan mennesker fra alle sociale klasser blive ramt. Taget i betragtning at målgruppen er så bred, er det nødvendigt også at gøre indlægssedlen bred, så den matcher de forskellige modtageres behov for forklaring og forudgående viden. Størstedelen af patienter med forhøjet blodtryk, som har behov medicin, er lægmænd. Hvilket vil sige at de ikke er kendte og fortrolige med det medicinske fagsprog og de har begrænset eller slet ingen viden inden for det medicinske område. ”Da es weder den Einheits- oder Durchschnitts-Patienten gibt, kann es auch nicht die perfekte und einzig richtige Gebrauchsinformation geben. Es gibt immer mehrere Möglichkeiten. Das Ziel muss es sein, das jeweils richtige Maß an Aufklärung für möglichst viele Patienten zu finden, das Ihnen den sinnvollen Gebrauch eines Arzneimittels im Rahmen ihrer Behandlung ermöglicht”104 Her beskrives det klart, at det ikke er muligt at klassificere patienter som gennemsnitspatienter og der beskrives også hvordan en indlægsseddel skal udformes. Som der er skrevet i citatet, er målet for en indlægsseddel at indholdet forklares på en sådan måde at flest mulige patienter forstår at bruge medikamentet på en hensigtsmæssig måde. 102 netdoktor.de netdoktor.de 104 Schuldt, Janna (1992a) s.57 103 44 8.4.3 Sender Den indlysende afsender af indlægssedlen for Carvedilol-ratiopharm® 12,5 mg Filmtabletten er firmaet Ratiopharm. Ratiopharm blev grundlagt i 1881 og er i dag en af de oftest anvendte lægemiddelmærker. Dog gemmer der sig bag firmanavnet nogle mennesker, som i deres egenskab af fagfolk har den viden, der skal til for at kunne beskrive og forklare informationerne om netop dette medikament. Folkene bag indlægssedlen har uddannelser som toksikologer, farmaceuter og læge. Det har ikke været muligt for mig at få bekræftet, at folkene bag indlægssedlerne sidder der i kraft af disse uddannelser. Dog står der på BfArMs hjemmeside, at folkene bag deres skabeloner til indlægssedler har disse uddannelser ”Die Muster werden im BfArM in einem festgelegten Verfahren (interne SOP) unter multidisziplinärer Beteiligung (Mediziner, Toxikologen, Pharmazeuten) erstellt.”105 Når der hos BfArM106 er brugt folk med denne baggrund, er sandsynligheden for at de enkelte lægemiddelproducenter også har ansatte med denne baggrund til at udarbejde deres indlægssedler, forholdsvis stor. De vil gerne have godkendt deres produkter og indlægssedler så hurtigt som muligt, så de kan komme i handlen, derfor vil jeg tro at de ansætter folk med samme baggrund som de ansatte hos BfArM. Som jeg vil komme ind på senere i dette afsnit, er denne indlægsseddel opbygget på en måde, der minder om de skabeloner man kan finde på BfArMs hjemmeside. Der opstår et ulige forhold mellem afsender og modtager i og med at tekstens afsender består af fagfolk, som forstår det medicinske fagsprog og som formår at kommunikere med andre fagfolk på dette præcise og økonomiske sprog og tekstens modtagere er lægfolk, som ikke er bekendt med det medicinske fagsprog og det medicinske fagområde. På baggrund af denne ulighed er afsenderen nødsaget til at udjævne forholdet mellem dem, for at kunne skabe en tekst, der er forståelig for en bred modtagergruppe. I de følgende afsnit vil jeg se på, om afsenderen formår at bygge bro mellem dem og modtagerne, så afsenders intentioner kommer klart og tydeligt frem hos modtageren. 8.4.4 Textproduktionseckdaten Textproduktionseckdaten fastsættes ud fra de oplysninger, jeg har analyseret mig frem til i tekstens ”kommunikative Funktion”. I følgende afsnit vil jeg komme ind på ”das mentale Denotatsmodell”, ”das mentale Konventionsmodell” og ”medium”. 105 106 bfarm.de Das Bundesinstitut für Arzneimittel und Medizinprodukte 45 8.4.5 Das mentale Denotatsmodell ”Das mentale Denotatsmodell” er det visuelle billede som afsenderen har haft af teksten inden han begyndte at producere selve teksten, og det er det billede som modtageren gerne skulle få, når han læser teksten. Da jeg allerede har slået fast at modtageren af denne indlægsseddel hovedsageligt er lægmænd og at man er nødsaget til at tilpasse indlægssedler en bred modtagergruppe, som har ingen eller lidt kendskab til det medicinske fagsprog og fagområde, er det nødvendigt at afsenderen ikke har en for kompliceret ”mentales Denotatsmodell”, da modtageren skal kunne afkode det billede som afsenderen har kodet ind i teksten. Afsenderens ”mentales Denotatsmodell” formår at opfylde ”die kommunikative Funktion”, da den informerer og vejleder læseren om og i brugen af dette Carvedilol-ratiopharm® 12,5 mg Filmtabletten. 8.4.6 Das mentale Konventionsmodell Ligesom en indlægsseddel er underlagt love, der bestemmer en del af dens udformning, så er der også ”Das mentale Konventionsmodell” som er uskrevne regler for udformningen af indlægssedler. Dette er nogle uskrevne regler, som de mennesker, der har læst, set og stiftet et vist bekendtskab med indlægssedler har sat som en målestok for alle indlægssedler. De finder passager, ord og andre kendetegn ved indlægssedlen som genre, som de vil beskrive som typiske for netop denne genre og som de mener, bør være i enhver indlægsseddel. Disse uskrevne regler er afsendere af indlægssedler nødt til at forholde sig til, idet forståeligheden af deres tekst kan forværres ved ikke at følge læserens forventninger til indlægssedlen. Udover modtagerens forventninger har BfArM107 (Bundesinstitut für Arzneimittel und Medizinprodukte) opstillet 242 forskellige skabeloner til indlægssedler, som medicinalfirmaerne frit kan bruge. Disse skabeloner er skabt ud fra de love, der er fastsat i AMG108 og ud fra EU-bestemmelser109110 I dette afsnit vil jeg se på om denne indlægsseddel følger normerne for dens genre og modtagerens forventninger og om medicinalfirmaet i nogen eller ingen udstrækning har valgt at bruge de ovennævnte skabeloner fra BfArM. Dog er der hos BfArM ikke en specifik skabelon, der henvender sig til produkter med det aktive stof ”Carvedilol”, men da der er en generel tendens til at alle skabeloner er opbygget på nogenlunde samme måde, vil Ratiopharm kunne bruge dele af skabeloner, på trods af at de ikke er direkte henvendt til deres produkt. 107 Bfarm.de Arzneimittelgesetz 109 EUROPA-PARLAMENTETS OG RÅDETS DIREKTIV 2001/83/EF af 6. november 2001 om oprettelse af en fællesskabskodeks for humanmedicinske lægemidler 110 Bfarm.de 108 46 Allerede ved første sammenligning ser man, at indlægssedlens første del er nærmest identisk med en af BfArMs skabeloner. ”Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. – Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. – Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker. – Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie. – Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker. Diese Packungsbeilage beinhaltet: 1. Was ist Carvedilol-ratiopharm® 12,5 mg und wofür wird es angewendet? 2. Was müssen Sie vor der Einnahme von Carvedilol-ratiopharm® 12,5 mg beachten? 3. Wie ist Carvedilol-ratiopharm® 12,5 mg einzunehmen? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Carvedilol-ratiopharm® 12,5 mg aufzubewahren? 6. Weitere Informationen”111 I en af skabelon fra BfArM, der er rettet mod medicin med virkestoffet ”Diltiazemhydrochlorid”112, ses det at der er anvendt samme formuleringer og samme disposition i Ratiopharms indlægsseddel, som i skabelonen. Der er få afvigelser som f.eks. denne sætning fra det sidste punkt i tekstboksen hos ratiopharm. ”Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.” Denne information er ikke med i skabelonen, som jeg har valgt at sammenligne Ratiopharms indlægsseddel med. Da der kan være afvigelser i skabelonerne også, kan jeg ikke udelukke at Ratiopharm har benyttet en anden skabelon og at dermed ikke selv har tilføjet sætningen. Desuden er der i punkt 6 i dispositionen brugt et andet substantiv, nemlig ”Informationen” i stedet for ”Angaben”. 111 112 Indlægssedlen for Carvedilol-ratiopharm® 12,5 mg Filmtabletten Skabelon for medicin med virkestoffet ”Diltiazemhydrochlorid” 47 Den tilføjede sætning har ikke negativ indflydelse på forståeligheden af teksten. Teksten bliver længere, men der bliver ikke brugt fagord i sætningen, som derimod er skrevet på et ”dagligdagssprog”. Det er en vigtig meddelelse til læseren om at tage kontakt til lægen, hvis han oplever bivirkninger af enhver slags. Man kan sige at der er tale om en udtalelse, der bliver gentaget flere gange i teksten. Om ikke direkte gengivet, men så henvises, der til læge eller apoteker i flere henseender. En direkte gentagelse kan findes i indlægssedlens afsnit 4. Det ændrede substantiv har ingen betydning for forståelsen af teksten. I forhold til skabelonens opbygning med informationer om virkestoffer og yderligere indholdsstoffer, medikamentets form (piller, injektion), og antal i pakken, hvor disse informationer er placeret før gennemgang af de 6 afsnit, har Ratiopharm valgt at placere disse oplysninger sidst i teksten. Jeg mener at Ratiopharm gør det på den med mest hensigtsmæssige metode, da disse informationer ikke er så relevante i forhold til læserens behov. Størstedelen af læserne vil ikke have et forhold til virkestofferne. De har fået at vide, at de skal tage dette medikament pga. en bestemt lidelse og virkestofferne har derfor mindre betydning for deres brug af produktet. Pakningens indhold er væsentligt for læseren på det punkt at de ved, hvor lang tid de ville have til i pakningen. For at sørge for at læseren når at komme til det, for ham relevante i teksten, mener jeg at Ratiopharm har formået på god vis at få læseren videre fra dispositionen til de relevante informationer. 8.4.7 Medium Det mest anvendte medium for indlægssedler er et foldet, aflangt stykke papir, som er vedlagt medikamentet. Dog har jeg fundet mit eksemplar af indlægssedlen på producentens hjemmeside, som både kan udskrives eller blot læses på computerskærmen. Dette er en mulighed som er mulig for alle med adgang til internettet. Den ligger frit tilgængelig, og kan uden problemer gemmes på computeren til senere brug. Fordi Ratiopharm har gjort det muligt for patienterne at finde deres indlægsseddel på nettet, har de gjort det lettere for patienterne at læse indlægssedlen. De har ikke lettet forståeligheden af indlægssedlen på tekstniveau ved at ændre selve indlægssedlen, men layoutmæssigt har patienten nu muligheden for at se deres indlægsseddel i stort format med en skriftstørrelse, der letter læsningen, da den ikke flyder sammen med de andre linjer pga. de små bogstaver. Dog har Ratiopharm begået den fejl ikke at ændre indlægssedlens opsætning. Man kan, som ovenfor nævnt, selv printe indlægssedlen fra Ratiopharms hjemmeside, dog opstår der problemer med udskrivningen, da den fra Ratiopharms side er opstillet som en indlægsseddel og vil derfor ved udskrivning samle sig som en smal stribe utydelig skrift midt i papiret. Jeg har selv forsøgt på flere forskellige måder at ændre denne opstilling, dette har dog vist sig at være tæt på umuligt, med mindre man klipper i og flytter rundt med de klippede dele af pdf-dokumentet. Dette bør dog ikke være nødvendigt, da det store arbejde for at få lov til at læse indlægssedlen har en negativ effekt på 48 både læserens motivation. Klipper man ikke i teksten vil det have betydning for læsningen af teksten, da den lille og sammenflydende tekst er umulig at læse. 8.4.8 Juristische und redaktionelle Richtlinien Medicinalfirmaerne er i forholdsvis kort snor, når det kommer til, hvad de kan tillade sig i en indlægsseddel. De juridiske retningslinjer i forbindelse med opbygning og hvilke informationer, der er obligatoriske i en indlægsseddel er formuleret klart hos både EU og i AMG. Som nævnt i afsnit 8.1.8 skal indlægssedlen ifølge den tyske Arzneimittelgesetz113 formuleres på ”allgemein verständlich in deutscher Sprache, in gut lesbarer Schrift”. EU-direktivet siger således ”Indlaegssedlen skal vaere let laeselig og vaere affattet i udtryk, der er klare og forstaaelige for patienterne, paa det eller de officielle sprog i den medlemsstat, hvor laegemidlet markedsfoeres”114. Kravene som nævnes i AMG kan alle findes i indlægssedlen for Carvedilol-ratiopharm® 12,5 mg Filmtabletten. Ratiopharm forholder sig helt korrekt til at indlægssedlen skal affattes på det officielle sprog i den medlemsstat, hvor lægemidlet markedsføres, da indlægssedlen er skrevet på tysk. Det er ikke tilstrækkeligt at indlægssedlen er skrevet på tysk, det skal også være i udtryk, der er klare og forståelige for patienterne. Det er individuelt for hver enkelt læser af indlægssedlen, hvilke udtryk de finder klare og forståelige. Men da man må regne med at læserne af denne indlægsseddel er på forskellige uddannelsesniveauer og har forskellig niveauer af viden inden for det medicinske fagområde, er det vigtigt for Ratiopharm at sigte deres indlægsseddel mod den gruppe af deres modtagere, som ingen eller lidt viden har inden for området. På baggrund af dette handler det om for Ratiopharm at undgå overflåd af fagord og at forklare de fagord, som de anvender, hvis disse ikke er almenkendte. Ratiopharm har anvendt på fagord på forskellige måder, som f.eks. i nedenstående eksempel, hvor de har valgt ikke at uddybe ”Angina pectoris”115, selvom dette er den fagsproglige betegnelse for sygdommen. Angina pectoris ses i forskellige former, men på tysk kendes lidelsen også som ”Brustenge” eller ”Brustbeklemmung” og med beskrivelse ”Unter Angina Pectoris versteht man ein plötzlich auftretendes Engegefühl in der Brust. For at lette forståelsen for dem, der ikke kender fagtermen, ville det være hensigtsmæssigt at beskrive eller omskrive termen i parentes. Der kan argumenteres for at mennesker, som lider under angina pectoris kender termen. Derimod kan der også argumenteres for at lægen eventuelt ikke har fortalt patienten, at vedkommendes lidelse kaldes angina pectoris. Eller det er muligt at patienten 113 Arzneimittelgesetz §11 Rådets direktiv 92/27/EØF af 31. marts 1992 om etikettering af og indlægssedler til humanmedicinske lægemidler 115 herzberatung.de 114 49 har glemt betegnelsen for lidelsen, men er klar over, hvilke symptomer der følger med lidelsen. På baggrund af dette, havde modtageren haft fordel af en anden term eller beskrivelse af symptomer ved angina pectoris. Konsekvensen for ikke at beskrive eller forklare angina pectoris er, at afsender i præcis dette tilfælde ikke formår at skrive ”allgemein verständlich” som foreskrevet af AMG. For at sætningen skal være alment forståeligt, havde en omskrivning eller beskrivelse, som tidligere beskrevet været en forudsætning. ”… zur Behandlung der Angina pectoris angewendet.”116 ”wenn Sie an einer schwer eingeschränkten Herzfunktion (kardiogener Schock) oder zu langsamem Herzschlag (Bradykardie) leiden.”117 I ovenstående eksempel ses, hvordan Ratiopharm har valgt en anden løsning end i forrige eksempel. For at efterkomme AMGs krav om et alment forståeligt sprog, har Ratiopharm her valgt at bruge såvel forklarende termer og de medicinske betegnelser. Forskellen fra det forrige eksempler viser sig også på den måde at den primære term, der er brugt i denne eksempel er den forklarende. Afsender har forklaret for læseren, at han ikke må anvende dette præparat, hvis han lider utilfredsstillende pumpeevne i hjertet118 også kaldt kardiogent shock.119 Derefter har de valgt at anføre den medicinske fagterm for denne lidelse. Anvendelsen af begge dele dvs. beskrivelse og fagterm gør, at patienten kan forstå at han i tilfælde at hans hjerte har utilfredsstillende pumpeevne, og samtidig kan han finde flere oplysninger om selve sygdommen, hvis han er i tvivl om, om han lider af netop denne sygdom. Det samme kan man sige om næste fagterm, der er brugt i teksten. Her er igen valgt en beskrivende term, før fagtermen så er skrevet i parentes efter beskrivelse. Brugen af begge dele er en oplagt måde, hvorpå man kan beholde det faglige niveau i teksten, mens lægmænd stadig vil kunne forstå, hvad det drejer sig om. 8.4.9 Verständlichkeitsdimensionen I dette afsnit vil jeg se på de forskellige dimensioners betydning for forståelsen af teksten. Dimensioner vil have en tilknytning til ”die kommunikative Funktion” og ”mentales Denotatsmodell”, som jeg har gennemgået tidligere i afsnit 8.4. 8.4.10 Struktur I Göpferichs model skal man i dimensionen struktur undersøge tekstens indholdsmæssige struktur, hvilket foregår på to niveauer, på makro- og mikroniveau. På makroniveau vil jeg undersøge om der i starten af 116 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 118 Denstoredanske.dk 119 Laegehaandbogen.dk 117 50 teksten er en slags disposition, der giver modtageren en ”grov mentales Denotatsmodell” og om der er brugt advanced organizers? På mikroniveau vil jeg komme ind på om oplysningerne nævnes i den rækkefølge som modtageren har brug for dem og om sætningerne begynder med det af laveste nyhedsværdi og slutter med nye informationer? Konventionerne for indlægssedler er ridset forholdsvis klart op i AMG såvel som i BfArMs skabeloner. Det står medicinalfirmaerne frit for om de vil følge skabelonernes opbygning, hvorimod punkterne i AMG skal følges. Desuden er der læsernes forventning til, hvordan en indlægsseddel ser ud. Ifølge Göpferich120 bør man bruge flere advanced organizers i en tekst, hvor konventionerne ikke er så urokkelige, derfor forventer jeg ikke at se en overvejende brug af advanced organizers i denne indlægsseddel. I denne indlægsseddel fra Ratiopharm er der ligesom vi så det hos Hexal brugt en disposition i starten af teksten som set nedenfor. Dispositionen er god, da den forbereder læseren på, hvad han kan forvente af teksten og hvornår han kan forvente de forskellige informationer. Umiddelbart før denne disposition ses en tekstboks, hvor læseren bliver bedt om at læse indlægssedlen grundigt igennem og hvor der nævnes nogle vigtige retningslinjer, som læseren bør følge. Læseren kan på baggrund af denne introduktion til, hvad han kan forvente af teksten, skabe sig et indre billede eller en ”mentales Denotatsmodell” af teksten. Dispositionen har dobbelt effekt for læseren, da den kan være en grov ”mentales Denotatsmodell” og samtidig kan fungere som ”advanced organizer”. Overskrifterne, der er benyttet i dispositionen introducerer læseren for hvert afsnit i løbet af teksten. ” Diese Packungsbeilage beinhaltet: 1. Was ist Carvedilol-ratiopharm® 12,5 mg und wofür wird es angewendet? 2. Was müssen Sie vor der Einnahme von Carvedilol-ratiopharm® 12,5 mg beachten? 3. Wie ist Carvedilol-ratiopharm® 12,5 mg einzunehmen? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Carvedilol-ratiopharm® 12,5 mg aufzubewahren? 6. Weitere Informationen”121 Udover de overordnede overskrifterne, som ses i ovenstående disposition, har Ratiopharm brugt flere små overskrifter, som introducerer yderligere, end de overordnede overskrifter, til det følgende afsnit. Eksempelvis ses i følgende afsnit ”2. Was müssen Sie vor der Einnahme von Carvedilol-ratiopharm® 12,5 mg beachten?” at der er brugt denne overskrift ”Schwangerschaft und Stillzeit“ til at introducere afsnittet og 120 121 Göpferich, Susanne ()s. Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 51 senere ses overskrifter som ” Schwangerschaft” og ” Stillzeit” til at opdele i mindre, men mere specifikke afsnit. På mikroniveau er det vigtigt for læseren, at han bliver præsenteret for informationerne i den rækkefølge han har brug for dem. I følgende simple eksempel præsenteres læseren ikke for informationerne i den rækkefølge han har behov for. Brugeren af mobiltelefonen har behov for at vide, at han allerførst skal tænde for telefonen, inden han kan foretage sig andet. Ikke: ”Tast pinkoden og tryk ok, efter du har tændt mobiltelefonen på den grønne tast”.122 Derimod: ”Tænd mobiltelefonen på den grønne tast. Tast derefter din pinkode og tryk godkend”123 I en indlægsseddel er det af stor betydning for læseren, at de vigtigste informationer kommer først. Modtageren skal have at vide, hvilket produkt han sidder med, hvad han skal være opmærksom på inden han anvender produktet, hvornår han skal være ekstra forsigtig ved anvendelse af produktet og hvordan produktet reagerer sammen med andre medikamenter, inden han bliver instrueret i selve anvendelsen af produktet. En indlægsseddel er mere kompleks end ovennævnte eksempel, hvilket dog ikke har betydning for at informationerne skal komme i rigtig rækkefølge. De overordnede afsnit bliver i stedet længere og læseren får flere informationer end ”Tænd mobiltelefonen” inden han bliver introduceret for næste vigtig information. På makroniveau kommer informationerne i den rækkefølge, der er relevant for læseren. Startende med disposition, hvad benyttes Carvedilol-ratiopharm® 12,5 mg Filmtabletten for, hvad skal man være opmærksom på, hvordan indtages produktet, bivirkninger, opbevaring og yderligere informationer. På mikroniveau går man som sagt ind og ser på passager på mindre end to sammenhængende sætninger. Nedenstående er et eksempel fra teksten. ”Wenn Sie eine größere Menge von Carvedilol-ratiopharm® 12,5 mg eingenommen haben, als Sie sollten, oder wenn Kinder versehentlich das Arzneimittel eingenommen haben, nehmen Sie bitte mit Ihrem Arzt oder dem Krankenhaus Kontakt auf oder rufen Sie den Notfalldienst an, um sich über das Risiko zu informieren und sich beraten zu lassen, was Sie tun müssen.”124 I dette eksempel ses, hvordan Ratiopharm giver læseren informationerne i den nødvendige rækkefølge. Hvis man har indtaget for meget af Carvedilol-ratiopharm® 12,5 mg Filmtabletten, skal man tage kontakt til ens egen læge eller vagtlægen. Det er relevant, at årsagen til man tager kontakt til læge/vagtlæge bliver 122 Eget eksempel Eget eksempel 124 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.2 123 52 nævnt først, da det muligvis ikke er relevant med kontakt til lægen, hvis ikke første del af sætningen er opfyldt, hvis man ikke har indtaget for meget af Carvedilol-ratiopharm® 12,5 mg Filmtabletten. ”Carvedilol-ratiopharm® 12,5 mg darf nicht eingenommen werden, – wenn Sie überempfindlich (allergisch) gegen Carvedilol oder einen der sonstigen Bestandteile von Carvedilol-ratiopharm® 12,5 mg sind.”125 I eksemplet oven for har Ratiopharm valgt at give læseren informationerne omvendt end i det forrige eksempel. Dog fungerer det i dette tilfælde godt, da der bliver lagt tryk på den første del af sætningen, som fortæller at man ikke må indtage Carvedilol-ratiopharm® 12,5 mg Filmtabletten, hvis man er allergisk over for nogle af stofferne i Carvedilol-ratiopharm® 12,5 mg Filmtabletten. Eksemplet er taget ud af et afsnit, hvor der opremses årsager til, hvorfor man ikke skulle måtte indtage Carvedilol-ratiopharm® 12,5 mg Filmtabletten. Fordi der efter den første fremhævede sætning følger en opremsning i punktopstilling af disse årsager, giver det en god effekt for læseren, fordi han nu ved at alt nævnt efter ”… darf nicht eingenommen werden…”, betyder at han ikke må indtage produktet. 8.4.11 Prägnanz Under Prägnanz skal man analysere to ting126, ”das mentale Denotatsmodell” og tekstens kodering. I dette afsnit vil jeg komme ind på om der i teksten kan findes følgende punkter, manglende eller overflødige detaljer i henhold til ”das mentale Denotatsmodell”, for lange formuleringer i forhold til, hvad der er passende for teksten, tautologier (hvor flere ord beskriver det samme f.eks. kvindelig gudinde) og redundans (gentagelser). Jeg har ikke fundet tautologier i teksten, derfor vil jeg ikke komme nærmere ind på dette emne, da det ikke har relevans for opgaven. Der er i teksten brugt Carvedilol-ratiopharm® og Carvedilol-ratiopharm® 12,5 mg Filmtabletten 12,5 mg 51 gange i teksten, derudover ses der flere steder i teksten, hvor kun Carvedilol nævnes. Gentagelser kan bidrage til at læserens forståelse af teksten, f.eks. i form af meningsmæssige gentagelser og ikke ordrette gentagelser ifølge Groeben.127 Hvis man følger Groebens forslag, så bidrager disse 51 gentagelser af produktets navn ikke positivt på læseren forståelse af teksten. Produktets navn er langt og gør de sætninger, hvor det er repræsenteret unødvendigt lange. Læseren forstyrres af den lange sætning, som 125 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 Göpferich, Susanne (2001) s.110 127 Groeben, Norbert (1999)s. 145ff 126 53 ville give samme mening for læseren, selvom Ratiopharm havde forkortet navnet ned til ”Carvedilol”. Ratiopharm kunne havde skrevet navnet fuldt ud første gang det nævnes. ”Sprechen Sie mit Ihrem Arzt, …”, ”Bitte informieren Sie Ihren Arzt oder Apotheker, …”, ”Denken Sie daran, Ihren Arzt … zu informieren …“128 De ovenstående eksempler er alle taget fra et afsnit på i alt 107 ord. Der er brugt forskellige formuleringer igennem hele teksten for at man skal kontakte sin læge. På den ene eller anden måde, har Ratiopharm brugt termen ”Arzt” 21 gange i løbet af teksten, enten sammen med ”Apotheker” eller adjektivisk ”ärztlicher”. Uanset hvordan termen er anvendt, henviser den til lægekontakt i tilfælde af tvivl, bivirkninger eller handling uden lægens tilladelse. Det er vigtigt for læseren at han kontakter sin læge, hvis han befinder inden for en af disse kategorier, så han ikke foretager sig en handling, som i sidste ende kan have betydning for hans liv. Dog virker det tungt at anvende tre formuleringer med henvisning til lægekontakt inden for 107 ord. De mange formuleringer bevirker, at teksten kommer til at virke tungere end det er tiltænkt. En omskrivning af teksten, med færre henvisninger til lægen, men derimod med en indledende formulering omkring samtale og kontakt til lægen i visse tilfælde, vil gøre teksten mere flydende og lettere for læseren. 8.4.12 Motivation Som tidligere nævnt i afsnit 6 er der to former for motivation. I dette afsnit vil jeg kun komme ind på den sorm for motivation, som teksten i sig selv kan frembringe hos læseren. Jeg vil se på om denne indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten formår at motivere modtageren til at forsætte læsningen længere end til indholdsfortegnelsen. En af de faktorer, der er vigtige for at motivere læseren, er om han bliver inddraget i teksten. Dette er særligt gældende for brugsanvisninger, hvorunder indlægssedler hører. For at motivere læsere af (brugsanvisninger) kan man vælge den pædagogiske tilgang og inddrage dem i teksten ved at bruge du/Sie i stedet for passivkonstruktioner eller upersonlige imperativer. Jeg har lavet en oversigt over, hvor ofte der er brugt du/Sie i denne indlægsseddel.129 Der er gennemgående brugt Sie/Ihnen i denne tekst, hvilket vil sige at afsenderen prøver at få læseren til at føle sig inddraget i teksten og føle, at det er ham der bliver talt direkte til. Eksempler på at læseren bliver tiltalt med Sie/Ihnen: 128 129 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 Se bilag nr. 54 Fra afsnittet ”2. WAS MÜSSEN SIE VOR DER EINNAHME VON Carvedilol-ratiopharm® 12,5 mg BEACHTEN?“ ”Bitte nehmen Sie Carvedilol-ratiopharm® 12,5 mg daher erst nach Rücksprache mit Ihrem Arzt ein, wenn Ihnen bekannt ist, dass Sie unter einer Unverträglichkeit gegenüber bestimmten Zuckern leiden.“ Som noget af det første i teksten: ”Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen.” I begge sætninger kunne de have valgt at bruge upersonlig imperativ, hvis de ikke ønskede at henvende sig direkte til læseren. F.eks.“ Vor Einnahmebeginn dieses Arzneimittels, die gesamte Packungsbeilage sorgfältig durchlesen“130. ”Bei Unverträglichkeit gegenüber bestimmten Zuckern, Carvedilol-ratiopharm® 12,5 mg daher bitte erst nach Rücksprache mit einem Arzt einnehmen”131 Udover at motivere ved at inddrage læseren i teksten, så læseren føler sig tættere på det indlægssedlen handler om, kan man også motivere igennem ”das mentale Denotatsmodell”. Det gør man f.eks. ved hjælp af illustrationer og eksempler.132 Dette har de også benyttet sig af i denne indlægsseddel idet de beskriver enkelte begreber i parenteser efter sætningerne. Eksempel: ” wenn Sie eine schwere allergische Reaktion hatten (z. B. auf einen Insektenstich oder ein Nahrungsmittel)” Her forklares hvad man kan forstå under allergisk reaktion. Jeg mener ikke at det, der for lægfolk ville kunne forekomme svært forståeligt i denne sætning er ”allergische Reaktion”, men derimod hvordan ”schwer” skal defineres. Hvornår har en allergisk reaktion været særlig slem. De fleste mennesker får en lettere reaktion på insektstik, men efter hvilken skala skal man bedømme den allergiske reaktion. Skal man have været indlagt for at være bekymret, eller er det ”nok” med lettere irriterede luftveje? Ved at der i denne tekst er tilføjet enkelte beskrivelser efter nogle begreber, er resultatet en længere tekst, hvor man umiddelbart kunne have sparet tegn, i en tekst som tidligere nævnt skal forfattes så tegnøkonomisk som muligt. Man er nødt til i hvert enkelt tilfælde at vurdere om det gavner forståeligheden af teksten at tilføje ekstra tegn eller om det i sidste ende ikke gavner forståeligheden tilstrækkeligt. I dette 130 Egen omskrivning Egen omskrivning 132 Göpferich, Susanne: ()s. 131 55 tilfælde mener jeg, at det gavner forståeligheden af teksten, da det er holdt på et niveau, hvor det kun er enkelte begreber, der er forklaret kort som i ovenstående eksempel. 8.4.13 Korrektheit Da Göpferich i modsætning til Groeben og Hamburger psykologerne ikke mener, at der findes fejlfrie tekster, valgte hun at lave en dimension, som beskæftiger sig med teksters ”Korrektheit”. Jeg vil her komme ind på om afsenderen har foretaget en passende vurdering af modtagerens kendskab til emnet, om der er brugt egnet ”mentales Denotatsmodell”, ”mentales Konventionsmodell” og medium og om der er sproglige fejl i teksten. Ratiopharm, som er afsender bag denne indlægsseddel, har skullet fastsætte en målgruppe, da de skulle forfatte indlægssedlen. Med målgruppe fastsat vil man også have en bedre forståelse for modtagernes kendskab til emnet og deres eventuelle viden inde for det medicinske fagområde og deres evne til at forstå medicinske tekster. Udover modtagernes kendskab til emnet, skal afsender også tage højde for modtagerens forventninger til indlægssedlen. Størstedelen af de mennesker, som er modtager af indlægssedlen vil have en idé om, hvordan indlægssedlen ser ud, hvilke emner, der vil blive berørt og hvilke informationer de vil blive præsenteret for. Det er svært at skulle skabe en simpel ”mentales Denotatsmodell” for en indlægsseddel, da det er mange informationer, som skal formidles. I Göpferichs eksempel, bruges en simpel ”mentales Denotatsmodell” til at forklare en koblings dele i en punktopstilling, som det ses i figur 5.133 Dette er ikke muligt med en indlægsseddel, da indholdet er mere kompleks end hvad der er muligt at forklare i en enkel punktopstilling. Dog hjælper Ratiopharm læseren med det visuelle billede af teksten, ved at opstille en disposition. Samtidig anvendes der i indlægssedlen en egnet ”mentales Konventionsmodell”, det sker ved at opfylde forventningerne til en indlægsseddel. Der forefindes de informationer, som en patient forventer at kunne finde, som samtidig er opstillet på den gængse måde i indlægssedler, som er inspireret af BfArMs skabeloner. 133 Göpferich, Susanne (2001)s.117ff 56 Figur 5 Det valgte medium for denne tekst består af to forskellige, internettet og en trykt udgave. Den trykte udgave af indlægssedlen er den mest anvendte ved indlægssedler. Den er egnet i den udstrækning, at den kan følge med produktet ved salget. Dog spiller andre faktorer også ind, f.eks. pladsmangel og lille skrift pga. pladsmangel. Jeg har fået min udgave af indlægssedlen fra internettet, hvor den kan findes som pdfdokument på Ratiopharms hjemmeside. Ulemperne ved internetudgave er adgangen til internettet. Selvom mange i disse moderne tider vil have adgang til internettet, kan man ikke som faktum gå ud fra at alle i realiteten har. Derfor vil internettet ikke fungere som eneste medium til formidling af indlægssedler. En kombination af disse to medier er en god løsning, da ulempen ved den trykte version kan lettes ved læsning på internettet, hvor teksten kan forstørres. Ulempen ved mangel på adgang til internettet for nogle, vil afhjælpes ved den trykte version, som følger med produktet. Jeg har ikke fundet sproglige fejl i teksten, derfor vil jeg ikke komme dybere ind på dette emne. 8.4.14 Simplizität ([sprachliche] Einfachheit) ”Simplizität” er anderledes fra de andre dimensioner, da denne udelukkende tager hensyn tekstens kodering. I dette afsnit vil jeg undersøge om ordvalget er passende og graden af direkthed. I denne indlægsseddel tager Ratiopharm hensyn til læseren, idet de oftest bruger beskrivelser eller mere almenkendte ord i formidling af deres informationer. Nedenfor ses et eksempel på, hvor der er valgt en beskrivende forklaring i stedet for brug af fagord. De har valgt at anføre den medicinske betegnelse i parentes efterfølgende, som på den måde bidrager til, at læseren kan finde yderligere informationer om den pågældende lidelse efterfølgende. Der er i to afsnit anvendt punktopstilling, hvor der anvendes flere fagord, det ses i afsnit 2 og afsnit 6. Afsnit 6 indeholder informationer om andre stoffer i produktet, disse behøver ikke forklares, da disse er der for at læseren på et senere tidspunkt kan finde informationer om disse stoffer, hvis han ønsker det. I afsnit 2 ses opstillinger af sygdomme og medicin. Bege dele forklares i 57 parentes efter eventuelt anvendte fagord. Medikamenterne skal skrives med det navn, den findes under i andre henseender, da det er vigtigt for læseren at være i stand til at undersøge, om han anvender et eller flere af disse medikamenter. ”eine eingeschränkte Blut- und Sauerstoffversorgung des Herzens (ischämische Herzkrankheit) und eine Verhärtung der Arterien (Atherosklerose)”134 ”Nehmen Sie Carvedilol-ratiopharm® 12,5 mg immer genau nach Anweisung Ihres Arztes ein. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind. Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie den Eindruck haben, dass die Wirkung von Carvedilol-ratiopharm® 12,5 mg zu stark oder zu schwach ist. Sie sollten die Filmtabletten mit mindestens einem halben Glas Wasser schlucken …”135 Ovenstående er et eksempel på den grad af direkthed, der er anvendt i hele teksten. Ratiopharm skriver direkte til læseren, at han skal indtage medikamentet nøjagtigt efter lægens anvisninger og at det skal indtages sammen med et halvt glas vand. Dette er en god strategi i en brugsanvisning, som en indlægsseddel er. Det giver en mere præcis tekst, som læseren kan forholde sig, så han forstår præcis, hvornår han skal gøre hvad. 8.4.15 Perzipierbarkeit Göpferich har indført denne dimension, for også at kunne vurdere de makro – og mikrotypografiske tekstegenskaber, som er med til at bestemme tekstens lethed. Som makrotypografisk egenskaber vil jeg se på: Sideformat Linjeafstand Inddeling af siden og teksten Placering af billeder og tabeller i teksten Mængeforholdet mellem skrift, billeder og tabeller Skriftstørrelse Fremhævelse af tekst Da jeg som nævnt ikke har haft mulighed for at se den trykte udgave af indlægssedlen, men derimod kun versionen fra internettet, som foreligger i et pdf-dokument, kan jeg i dette afsnit kun udtale mig om 134 135 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 58 faktorer ved internetudgaven. Indlægssedlen er i internetudgaven skrevet på lange sider, sådan som det kendes fra de trykte udgaver. Teksten er ikke delt op i spalter, hvilket giver godt overblik for læseren. Der er kun brugt linjeafstand 1,0 og ikke 1,5 som giver plads mellem linjerne. Oveni den lille afstand mellem linjerne er der brugt en lille skriftstørrelse. Skriftstørrelsen kan dog forstørres i internetudgaven, hvilket er en fordel for læsningen af teksten og dermed indirekte på forståelsen af teksten. Ved at have større afstand mellem linjerne, vil teksten ikke flyde sammen, men derimod ville linjerne kunne skelnes fra hinanden. Hvis læseren ikke skal overanstrenge sig for at læse teksten, vil han have mere overskud og motivation tilovers til forståelse af selve tekstens indhold og de informationer der formidles. Der er ikke anvendt billeder i teksten, udover en tekstboks i starten af teksten og en tabel senere. Tekstboksen er placeret på niveau med teksten, så der ses ingen tekst uden for og på linje med tekstboksen. Det står for sig selv, hvilket giver god effekt for læseren. Tekstboksen gør opmærksom på enkelte, vigtige hovedpunkter fra afsender. Tabellen er sat ind i teksten på samme måde som tekstboksen. Da der ikke er anvendt billeder, bliver der ingen konflikt mellem billeder og tekst. Til at fremhæve tekst har Ratiopharm valgt at bruge fed skrift, punktopstilling, understregning og kursiv. Fed skrift er anvendt til at fremhæve hovedoverskrifterne, som det ses i nedenstående eksempel. ”Schwangerschaft und Stillzeit Fragen Sie vor der Einnahme von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat. Schwangerschaft Für das ungeborene Kind besteht das Risiko einer Schädigung. Carvedilol-ratiopharm® 12,5 mg darf daher während der Schwangerschaft nur eingenommen werden, wenn Ihr Arzt es für zwingend erforderlich hält. Fragen Sie deshalb immer erst Ihren Arzt um Rat, bevor Sie Carvedilol-ratiopharm® 12,5 mg während der Schwangerschaft einnehmen.”136 I dette eksempel ses både en med fed skrift fremhævet overskrift og en med understregning fremhævet overskrift. Overskriften fremhævet med fed er en overordnet overskrift, som forbereder læseren på, at der nu kommer et afsnit med informationer om graviditet og amning. Den understregede overskrift underinddeler afsnittene, så læseren kan vælge eller fravælge at læse de enkelte afsnit. En ny patient kan lige havde født og ønsker nu kun informationerne om amning. De fremhævede overskrifter gør det lettere for læseren at orientere sig igennem hele teksten. Ratiopharm har også valgt at anvende fremhævelse ved hjælp af fed skrift i en anden henseende. 136 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 59 ”Arzneimittel, die Reserpin, Guanetidin, Methyldopa, Guanfacin und Monoaminooxidase-Hemmer (MAOHemmer, Arzneimittel zur Behandlung der Depression) enthalten, da diese eine weitere Verlangsamung des Herzschlags hervorrufen können.”137 I ovenfor anførte eksempel fra teksten anvendes fed skrift til at fremhæve vigtige ord i en sætning. I denne sætning drejer det sig om bestemte medikamenter, som er vigtige at informere lægen om, inden behandling med Carvedilol-ratiopharm® 12,5 mg Filmtabletten påbegyndes. Disse fremhævelser hjælper læseren til at finde de vigtigste passager i sætningerne. Der kan også argumenteres for at de forskellige former for brug af fed skrift kan forvirre læseren. I dette tilfælde fungerer de to anvendelsesmåder fint sammen, da hovedafsnittene, udover fed skrift, er mærket med et tal. Desuden vil fremhævelse, som i sidstnævnte eksempel hjælpe læseren igennem teksten, de vigtigste medicinske betegnelser og advarsler vil stå frem i teksten. Der er også anvendt understregning til at fremhæve mindre afsnit i de store afsnit. Denne understregning er af stor betydning, f.eks. i opstilling af mulige bivirkninger. Da der forekommer forskellige bivirkninger alt efter, hvilken sygdom der ligger til grund for behandling med Carvedilol-ratiopharm® 12,5 mg Filmtabletten. Det er vigtigt, at læseren formår at skelne mellem bivirkningerne til de forskellige sygdomme. Disse understregninger gør læseren opmærksom på, at der nu er ændring i de informationer, der præsenteres. 8.4.16 Delkonklusion I denne indlægsseddel har vi set et eksempel på, hvordan en indlægsseddel kan se ud. Der skal i en indlægsseddel bl.a. tages højde for læserens kendskab til emnet og deres motivation for at læse den. I denne indlægsseddel har afsenderen Ratiopharm forsøgt at tilpasse deres indlægsseddel på den målgruppe, som de forventer, deres indlægsseddel henvender sig til. I teksten ser man, hvordan Ratiopharm forklarer fagtermer, inddrager læseren i teksten og inddeler teksten i afsnit, for at lette læseprocessen. Alt dette sammen gør at læseren får en bedre forståelse af teksten, end hvis Ratiopharm ikke havde tilpasset deres indlægsseddel til en homogen målgruppe, hvis kendskab til området ikke kan fastsættes fuldstændig. 137 Indlægsseddel for Carvedilol-ratiopharm® 12,5 mg Filmtabletten s.1 60 9. Konklusion I dette speciale har jeg undersøgt to indlægssedler, deres indhold og afsendernes måde at tilpasse indlægssedlerne til målgruppen. Jeg har undersøgt om afsenderne formår at skrive et egentligt fagsprogligt produktresumé, som er skrevet til fagfolkene inden for fagområdet, om til en tekst, der er forståelig for en heterogen målgruppe. En målgruppe, hvis uddannelsesniveau og kendskab til det medicinske fagområde kan ligge langt fra hinanden, hvis man satte dem på en skala. Det kræver menneskelig og sproglig forståelse fra medicinalfirmaernes side at kunne sætte sig ind i, hvilke passager i deres oprindelige produktresumé, der skal omskrives, skrives mere til eller om nødvendigt skrives helt om. Det er ikke muligt for mig i dette speciale at klarlægge alle Tysklands indlægssedler og deres forståelighed. Dog mener jeg, at de anvendte indlægssedler i dette speciale giver et godt billede af, hvordan de resterende indlægssedler i Tyskland ser ud. Eftersom begge indlægssedler følger den tyske Arnzeimittelgesetz og EU-direktivets regler for indholdet, og desuden har valgt at bygge deres indlægssedler op på lignende måde, som det ses i BfArMa skabeloner. Indlægssedler kan for størstedelen af os, om de er på dansk eller tysk, forekomme umulige at forstå og mange opgiver helt at læse dem eller læser kun afsnittet om, hvilke mængde af produktet der skal indtages. Indlægssedlerne, som er blevet undersøgt i dette speciale er ingen undtagelse. De er for lange, der er anvendt for stor andel af fagord, om end de bliver forklaret. Det layoutmæssige aspekt kan tildeles en del af skylden for læseren manglende motivation for at læse teksten og dermed en indirekte faktor for læserens forståelse af teksten. På et punkt har Bundesinstitut für Arzneimittel und Medizinprodukte, Arzneimittelgesetz § 11 og EUROPA-PARLAMENTETS OG RÅDETS DIREKTIV 2001/83/EF af 6. november 2001 om oprettelse af en fællesskabskodeks for humanmedicinske lægemidler sørget for en ensartethed ved begge indlægssedler. Der er disposition i begge indlægssedler, som udover at hjælpe læseren til at bevare overblikket også sørger for at informationer kommer i den rigtige rækkefølge. Begge firmaer er gode til at inddrage læseren i deres tekster, ved at gøre brug af personlige pronomener i teksterne, for at læseren på den måde kan relatere sig til indlægssedlens indhold. Dette giver god effekt på forståeligheden, da teksten og dens indhold, da ikke virker så fjern fra læseren selv. Igennem mine undersøgelser har jeg fundet frem til at Ratiopharm GmbH har formået at producere en bedre indlægsseddel. Den er kortere og bruger et sprog, der er mere forståeligt for læseren. Med udgangspunkt i dette speciales resultater, mener jeg, at det sandsynligvis vil vare længe førend indlægssedlerne når et forståelsesniveau, hvor ”almindelige” borgere kan få et optimalt informationsudbytte. Hertil er det nødvendigt, at ændre layoutet og teksten skal stå med større skrift og 61 større linjeafstand. Derudover skal medicinalfirmaerne fokusere på, at ramme et sprogligt niveau, således at det anvendte sprog er forståeligt for alle, uanset uddannelsesniveau og social baggrund. 8.1 Perspektivering Denne afhandlings observationer og resultater kan have betydning for de enkelte medicinalfirmaer og deres ansatte fagfolk, som forfatter disse indlægssedler. Resultaterne viser, at de burde være bedre til at bruge almenkendte ord, hvorved der spares forklaringer af de anvendte fagord. Er man ikke tvunget til at skulle skrive lange beskrivelser, gøres teksten mere tegnøkonomisk. En tegnøkonomisk tekst gør at læseren har en mindre informationsmængde, som skal gemmes i korttidshukommelsen. Medicinalfirmaerne er allerede nu, hovedsagligt på baggrund af BfArMs skabeloner, gode til at bruge afsnit i teksten, hvilket tvinger læseren til at stoppe op og reflektere over det nyligt læste. Dette tiltag anser jeg, i henhold til mine undersøgelser, som en vigtig del af indlægssedlerne. Derfor er det af stor betydning, at medicinalfirmaerne bibeholder de positive tekstegenskaber, som jeg har fundet frem til i dette speciale. Afhandlingens resultater kan også have betydning for BfArM og deres ansatte. BfArM skriver eksempler og laver skabeloner, som det er muligt for medicinalfirmaerne at benytte sig af. Vilkårene for indlægssedlerne ville ydermere kunne forbedres meget, hvis pladsen blev mindre trang. Hvis der blev plads til større skrift og bedre linjeafstand, ville medicinalfirmaerne allerede være kommet et stort skridt i den rigtige retning mod bedre forståelighed og læsevenlighed. 62 10. Litteraturliste Brinker, Klaus (2005): Linguistische Textanalyse: eine Einführung in Grundbegriffe und Methoden. 6. überarb. und erw. Aufl., pp. 107-130. Erich Schmidt. Christmann, Ursula / Groeben, Norbert: Psykologie des Lesens. Hrsg. Franzmann, Bodo et al. (1999) K.G. Sauer Verlag GmbH & Co KG, München. S.145-223 Ditlevsen, Marianne Grove et al. (2003): Sprog på arbejde – kommunikation i faglige tekster. Samfundslitteratur, 1. Udgave Engberg, Jan (2003): Introduktion til fagsprogslingvistikken. Systime 1.udgave 2.oplag Engberg et al. (2007): Sprog på arbejde – kommunikation i faglige tekster. Forlaget Samfundslitteratur. 2. udgave. Groeben, Norbert (1982): Leserpsykologie: Textverständnis – Textverständlichkeit. Hrsg. Aschendorff. Münster Westfalen. 2 Auflage Göpferich, Susanne (2002d): "Ein kommunikationsorientiertes Modell zur Bewertung der Verständlichkeit von Texten." Kommunikationsoptimierung: verständlicher - instruktiver - überzeugender Hrsg. Hans Strohner und Roselore Brose. Tübingen: Stauffenburg, 45-66. Göpferich, S. (2001a): „Von Hamburg nach Karlsruhe. Ein kommunikationsorientierter Bezugsrahmen zur Bewertung der Verständlichkeit von Texten.“ Fachsprache/International Journal of LSP 23.3-4: 117-138. Göpferich, Susanne (2004f): "Technische Kommunikation." Angewandte Linguistik: Ein Lehrbuch. Hrsg. Karlfried Knapp et al. Tübingen, Basel: Francke, 143-165 Göpferich, Susanne (2008c): "Textverstehen und Textverständlichkeit." Textlinguistik: 15 Einführungen. Hrsg. Nina Janich. Tübingen: Narr, 291-312. Göpferich, Susanne (1998g): "Fachtextsorten der Naturwissenschaften und Technik - ein Überblick." Fachsprachen/Languages for Special Purposes: Ein internationales Handbuch zur Fachsprachenforschung und Terminologiewissenschaft/An International Handbook of Special Languages and Terminology Research. Hrsg. Lothar Hoffmann, Hartwig Kalverkämper und Herbert Ernst Wiegand in Verbindung mit Christian Galinski und Werner Hüllen. New York, Berlin: de Gruyter, 545-556. Holm, Andreas Beck (2011): Videnskab i virkeligheden – en grundbog i videnskabsteori 63 Samfundslitteratur 1.udgave, 2 oplag Larsen, Ole Schultz (2010): Psykologiens veje © 2010 Ole Schultz Larsen og Systime A/S Schuldt, Janina (1992a): Den Patienten informieren: Beipackzettel von Medikamenten Gunter Narr Verlag, Tübingen Forum für Fachsprachen-Forschung; Band 15 Internetsider Hexal.de. Produktinfos für Patienten <http://www.hexal.de/praeparate/arzneimittel.php> Lokaliseret d.20/11-11 Ratiopharm.com. Man skal bruge hjemmesidens søgefelt til at finde den anvendte indlægsseddel, derfor har jeg anført både hjemmesidens startside og et direkte link til indlægssedlen. <http://www1.ratiopharm.com/de/de/pub/home.cfm> <http://www1.ratiopharm.com/apps/c25_teratioproduct/de/display_v3/index.cfm?fuseaction=getbeilage &pID=1896&lID=2> Lokaliseret d.19/11-11 Ibsen, Hans. Forhøjet blodtryk (hypertension). <http://www.netdoktor.dk/sygdomme/fakta/hypertension.htm> Lokaliseret d.12/01-12 Nielsen, Morten Svenning. Forløb: Hjertekrampe (Stabil angina pectoris). <http://www.netdoktor.dk/forlob/hjertekrampe.htm> Lokaliseret d.12/01-12 64 Praktische Gestaltung verständlicher Texte bzw. Theorie der Textoptimierung. <http://projekte.linse.uni-due.de/verstaendlichkeit/Praxis2.htm> Lokaliseret d.12/01-12 laegemiddelstyrelsen.dk. Godkendelse af lægemidler. <http://laegemiddelstyrelsen.dk/da/topics/godkendelse-og-kontrol/godkendelse-af-laegemidler> Lokaliseret d.19/01-12 Bfarm.de. Muster. <http://www.bfarm.de/DE/Arzneimittel/2_zulassung/verfahren/mufag/mufag-node.html> Lokaliseret d.20/01-12 Europa-Parlamentet. EUROPA-PARLAMENTETS OG RÅDETS DIREKTIV 2001/83/EF af 6. november 2001 om oprettelse af en fællesskabskodeks for humanmedicinske lægemidler. <http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2001L0083:20070126:da:PDF> Lokaliseret d.20/1-12 Europa-Parlamentet. RICHTLINIE 2001/83/EG DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 6. November 2001 zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel. <http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2001L0083:20070126:de:PDF> Lokaliseret d.20/1-12 Bundesministerium für Arzneimittel und Medizinprodukte. Muster für Fach- und Gebrauchsinformationen Det nederste link er det direkte, det virker dog ikke. Derfor har jeg anført et andet link, hvor man kan finde adgang til skabelonerne. <http://www.bfarm.de/DE/Arzneimittel/2_zulassung/verfahren/mufag/mufagDb/mufagdbinhalt.html;jsessionid=0E750ADDD593C48AAB305D4484979CB9.1_cid094> <https://sunset-clause.dimdi.de/Mustertexte/BStationServlet#report> <http://www.bfarm.de/DE/Arzneimittel/2_zulassung/verfahren/mufag/mufag-node.html> 65 Lokaliseret d.23/1-12 Denstoredanske.dk. Tautologi. <http://www.denstoredanske.dk/Samfund,_jura_og_politik/Filosofi/Logik/Tautologi> Lokaliseret d.27/1-12 Denstoredanske.dk. Kredsløbschok. <http://www.denstoredanske.dk/Krop,_psyke_og_sundhed/Sundhedsvidenskab/An%C3%A6stesiologi_og_ smertebehandling/kredsl%C3%B8bschok> Lokaliseret d.28/1-12 Jessica Schmid. Angina Pectoris. <http://www.herzberatung.de/angina_pectoris.html> Lokaliseret d.28/1-12 Danske Regioner. Kardiogent shock <http://laegehaandbogen.dk/hjerte-kar/tilstande-og-sygdomme/kardiogent-shock-10247.html> Lokaliseret d.28/1-12 Juris – Das Rechtsportal. Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz - AMG) <http://www.gesetze-im-internet.de/amg_1976/BJNR024480976.html> Lokaliseret d.4/1-12 Teachsam.de. Die Verständlichkeit der Nachricht – Verständlichkeitsdimensionen. <http://www.teachsam.de/psy/psy_kom/psy_thun/psy_kom_thun_6_3_2.htm> Lokaliseret d.3/12-11 Wikipedia.org. Lesbarkeit. <http://de.wikipedia.org/wiki/Lesbarkeit> Lokaliseret d.15/112 66 Göpferich, Susanne. Ein kommunikationsorientiertes Modell zur Spezifikation und Evaluation von Gebrauchstexten und ihren Translaten <www.ffos.hr/katedre/njemacki/daten/2.ppt> Lokaliseret d.31/1-12 Produktresume.dk. Carvedilol HEXAL, tabletter 3,125 mg, 6,25 mg, 12,5 mg, 25 mg eller 50 mg.doc <http://www.produktresume.dk/docushare/dsweb/GetRendition/Document-20291/html> Lokaliseret d.13/1-12 Den Europæiske Union. Kennzeichnung und Packungsbeilage von Arzneimitteln. <http://europa.eu/legislation_summaries/other/l32006_de.htm> Lokaliseret d.5/12-11 67 11. Deutsches Resümee Der Zweck dieser Dissertation ist die Textteile klarzulegen, die die Verständlichkeit von Packungsbeilagen beeinträchtigen, und welche Schritte eingeleitet werden können, um die Verständlichkeit zu verbessern. „[…] Allgemein verständlich in deutscher Sprache, in gut lesbarer Schrift […]“ so heißt es im Arzneimittelgesetz §11. Genau so sollten die Medizinalfirmen ihre Packungsbeilage verfassen. Werden diesen Satz und die restlichen Vorschriften des AMG aber erfüllt und gelingt es ihnen die Packungsbeilagen an ihre Zielgruppe anzupassen? Welche Eigenschaften in den Packungsbeilagen helfen dem Leser den Text besser zu verstehen, und welche Eigenschaften sollten die Medizinalfirmen in ihre Packungsbeilagen vermeiden? Diese Fragestellungen werden in dieser Magisterarbeit bearbeitet, indem zwei deutsche Packungsbeilagen, anhand des Analysemodells von Susanne Göpferich, untersucht werden. Die Packungsbeilagen sind von zwei verschiedenen deutschen Medizinalfirmen, Hexal AG und Ratiopharm GmbH, sie stellen beide das gleiche Medikament „Carvedilol“ her. Als Analyseobjekt sind zwei Versionen der Packungsbeilagen aus dem Internet ausgewählt worden, da die Papiersausgaben unzugänglich waren. Die Adressanten dieses Medikaments sind Menschen, die Blutdrucksenkende Mittel nötig haben. Das Analysemodell von Göpferich beschäftigt sich mit sowohl der äußersten als auch der innersten Werten der Packungsbeilagen, sowie Layout, Satzlänge, Anwendung von Fachwörtern und die Einschätzung der Kenntnisse der Empfänger. Göpferich hat in ihrem Analysemodell zusätzlich zu den Fragen zum Sender, Adressaten und Zweck, auch die Textproduktionseckdaten und sechs Verständlichkeitsdimensionen. Die Festlegung der Zielgruppe ist bedeutend für sowohl die Sender als auch für die weitere Analyse der Packungsbeilagen. Die Zielgruppe entscheidet, wie die Sender ihre Packungsbeilagen verfassen sollten. Für die Analyse ist sie bedeutsam in Bezug auf die Beurteilung der Verständlichkeit. Die Adressaten dieser Packungsbeilagen sind Menschen, die blutdrucksenkende Mittel nötig haben. Es ist aber nicht möglich, eine Tabelle mit Alter, Ausbildung usw. aufzustellen, wo alle Empfänger ähnlich sind. Alle können von zu hohem Blutdruck betroffen werden ohne Ausnahme. Deswegen müssen auch die Packungsbeilagen an eine breite Zielgruppe angepasst werden. Die Anwendung von Fachwörtern sollte sorgfältig durchgedacht werden. In der Analyse von den Packungsbeilagen Carvedilol HEXAL® 12,5 mg und Carvedilol-ratiopharm® 12,5 mg Filmtabletten ist es deutlich, dass die Schrittgröße und den Zeilenabstand große Probleme bei den Packungsbeilagen erzeugen. Die Schrittgröße 10 hat gemeinsam mit dem engen Zeilenabstand die Wirkung, dass der Text verschwommen aussieht und die beeinträchtigt die Motivation des Lesers, wo die Motivation vom Text entstehen sollte. Die Leser besitzen bei diesem Genre eine eigene Motivation, die Packungsbeilage zu lesen, da sie Informationen über ihre medizinische Behandlung und Anleitungen 68 suchen. Dennoch müssen die Texte in sich zum weiteren Lesen auffordern. Die Anwendung von Personalpronomen wie Sie und Ihnen einbezieht den Leser in den Text. Die Packungsbeilage entsteht angesichts der Fachinformationen, die unter Fachleute veröffentlich werden. Außer der AMG und den Richtlinien von der Europa-Kommission können die Medizinalfirmen, auch Inspiration aus den Mustertexten von BfArM holen. Aus diesem Grund sind die Texte von hoher Fachsprachlichkeit gekennzeichnet. Diese Fachsprachlichkeit muss mit Hinblick auf die Fachkenntnisse des Lesers angepasst werden. Die Verständlichkeit der analysierten Packungsbeilagen wird durch Erklärungen der Fachwörter oder durch Umschreibung erhöht. Jedoch sind noch Fachwörter in den Packungsbeilagen zu finden, die nicht beschrieben sin oder in allgemein verständlicher Sprache übersetzt werden. Um die Verständlichkeit der Packungsbeilage zu erhöhen, müssten die Platzprobleme gelöst werden. Ohne den Platzmangel könnten die Schriftgröße und der Zeilenabstand verbessert werden, was die Motivation erzeugen wollte, und die Verständlichkeit indirekt beeinflussen würde. Wie es jetzt aussieht, fühlen manche Leser sich von einer Packungsbeilage überfordert. Um dieses Faktum zu ändern und um die Verständlichkeit zu erhöhen, sollte die Packungsbeilage kürzer werden, mit weniger Fachwörtern und in größerer Schrift verfasst werden. Die Ergebnisse in dieser Magisterarbeit sind nicht Eindeutig, denn es scheint nicht möglich, ein komplett objektives Fokus praktisieren zu können. In der Arbeit mit Menschen sind die subjektiven Perspektiven nicht zu vermeiden. Jeder ist von irgendeine Kultur oder Tradition geprägt, was dazu beiträgt, eine bestimmte Anschauung heranzuziehen. Deswegen könnte es bei späteren Untersuchungen zu anderen Ergebnissen kommen als die in dieser Arbeit genannten. Anschläge: 4207 69 12. Bilag Da det ikke har været muligt for mig at få de originale papirsudgaver af indlægssedlerne, har jeg her kopieret teksterne fra pdf-udgaven over i et worddokument. Der er dog ved kopiering gået formatering tabt og indlægssedler fremstår her ikke som i den oprindelige udgave. Der er i litteraturlisten anført direkte links, hvor indlægssedlerne vil være at finde i deres oprindelige formatering. Indlægsseddel nr.1: Gebrauchsinformation Lesen Sie die gesamte Gebrauchsinformation Der arzneilich wirksame Bestandteil ist sorgfältig durch, bevor Sie mit der Einnahme Carvedilol. dieses Arzneimittels beginnen. 1 Tablette enthält 12,5 mg Carvedilol. - Heben Sie die Packungsbeilage auf. Vielleicht Die sonstigen Bestandteile sind: möchten Sie diese später nochmals Lactose-Monohydrat, mikrokristalline Cellulose, lesen. Crospovidon, Povidon K 30, hochdisperses -Wenn Sie weitere Fragen haben, wenden Sie sich Siliciumdioxid, Magnesiumstearat bitte an Ihren Arzt oder Apotheker. (Ph.Eur.), Eisen(III)-oxid (E 172), - Dieses Arzneimittel wurde Ihnen persönlich Eisenoxidhydrat (E 172) verschrieben und darf nicht an Dritte Carvedilol HEXAL® 12,5 mg ist in Blisterpackungen weitergegeben werden. Es kann anderen mit 30 (N1), 50 (N2) und 100 Menschen schaden, auch wenn diese (N3) und in Dumadosen mit 100 Tabletten dasselbe Krankheitsbild haben wie Sie. erhältlich. Diese Packungsbeilage beinhaltet: 1.Was ist Carvedilol HEXAL® 12,5 mg 1. Was ist Carvedilol HEXAL® 12,5 mg und wofür und wofür wird es angewendet? wird es angewendet? Carvedilol HEXAL® 12,5 mg gehört zur 2. Was müssen Sie vor der Einnahme von Stoffgruppe der unselektiven Beta- und Carvedilol HEXAL® 12,5 mg Alpha-1-Rezeptorenblocker. beachten? von: 3. Wie ist Carvedilol HEXAL® 12,5 mg HEXAL AG einzunehmen? Industriestraße 25 4. Welche Nebenwirkungen sind möglich? 83607 Holzkirchen 5. Wie ist Carvedilol HEXAL® 12,5 mg Tel.: (08024) 908-0 aufzubewahren? Fax: (08024) 908-1290 Carvedilol HEXAL® 12,5 m E-Mail: [email protected] Wirkstoff: Carvedilol hergestellt von: 70 Salutas Pharma GmbH, bei der Einnahme von Carvedilol ein Unternehmen der HEXAL AG HEXAL® 12,5 mg ist erforderlich”), Otto-von-Guericke-Allee 1 - klinisch bedeutsamen Leberfunktionsstörungen 39179 Barleben - Bronchialasthma Carvedilol HEXAL® 12,5 mg wird angewendet: - Erregungsleitungsstörungen am Herzen - zur Behandlung des nicht-organbedingten zwischen Vorhof und Herzkammer Bluthochdrucks (essentielle (AV-Block II. oder III. Grades) Hypertonie) - einem Ruhepuls von unter 50 Schlägen - bei Erkrankung der Herzkranzgefäße pro Minute vor Behandlungsbeginn (chronische stabile Angina pectoris) (Bradykardie) - als Zusatzbehandlung bei mäßiger bis - Schock, der durch Herzversagen ausgelöst schwerer stabiler Herzleistungsschwäche wird (kardiogener Schock) (Herzinsuffizienz) - Erkrankungen des Sinusknotens (physiologischer 2.Was müssen Sie vor der Einnahme Schrittmacher des Herzens) von Carvedilol HEXAL® 12,5 mg beachten? (Sinusknotensyndrom, einschließlich Carvedilol HEXAL® 12,5 mg darf nicht sinuatrialer Block) eingenommen werden bei - stark erniedrigtem Blutdruck (schwere - Überempfindlichkeit gegenüber Carvedilol Hypotonie, systolischer Blutdruck kleiner oder einem der sonstigen 85 mmHg) Bestandteile von Carvedilol HEXAL® - Übersäuerung des Blutes (metabolische 12,5 mg Azidose) - Herzmuskelschwäche NYHA-Klasse IV - Prinzmetal-Angina (Einteilung der klinischen Schweregrade - unbehandeltem Tumor des Nebennierenmarks der Herzinsuffizienz nach der (Phäochromozytom) New York Heart Association), die einer - schweren peripheren arteriellen Behandlung mit Herzleistung-fördernden Kreislaufstörungen Arzneimitteln, die über die Vene - gleichzeitiger intravenöser Behandlung angewendet werden, bedarf mit Verapamil oder Diltiazem - dauerhafter Atemwegserkrankung mit (siehe Abschnitt „Wechselwirkungen Verengung der Atemwege durch mit anderen Arzneimitteln”). Krämpfe der Bronchialmuskulatur Besondere Vorsicht bei der Einnahme (chronisch obstruktive Lungenerkrankung) von Carvedilol HEXAL® 12,5 mg ist erforderlich (siehe Abschnitt „Besondere Vorsicht insbesondere wenn Sie an Herzleistungsschwäche 71 (Herzinsuffizienz) leiden: der Nierenfunktion beobachtet. Carvedilol HEXAL® 12,5 mg sollte grundsätzlich Daher sollte bei Patienten mit zusätzlich zu Diuretika (Stoffe, Herzleistungsschwäche und diesen die die Harnausscheidung steigern), Risikofaktoren die Nierenfunktion während ACE-Hemmern (Arzneistoffe gegen Bluthochdruck der Dosiseinstellung von Carvedilol und Herzleistungsschwäche), HEXAL® 12,5 mg überwacht werden. Digitalis (herzwirksamer Arzneistoff) Bei deutlicher Verschlechterung und/oder Vasodilatatoren (Arzneistoffe, der Nierenfunktion muss die Dosis von die zu einer Gefäßerweiterung führen) Carvedilol HEXAL® 12,5 mg reduziert gegeben werden. Die Therapie sollte oder die Therapie abgebrochen werden. nur begonnen werden, wenn Sie seit Bei gleichzeitiger Anwendung von mindestens 4 Wochen auf eine konventionelle Carvedilol HEXAL® 12,5 mg und Digitalis Basistherapie stabil eingestellt muss bedacht werden, dass sowohl sind. Patienten mit schwerer Digitalis als auch Carvedilol HEXAL® Herzleistungsschwäche, 12,5 mg die Erregungsausbreitung im Salz- und Volumenmangel, Herzen vom Vorhof zur Kammer ältere Patienten oder Patienten (atrioventrikuläre mit niedrigem Basis-Blutdruck sollten Überleitung) verlangsamen etwa 2 Stunden nach der ersten Dosis (siehe Abschnitt „Wechselwirkungen mit oder nach einer Dosiserhöhung überwacht anderen Arzneimitteln”). werden, da eine Blutdrucksenkung Andere Warnhinweise für Carvedilol auftreten kann. HEXAL® 12,5 mg und Betablocker im Bei Patienten mit Herzleistungsschwäche Allgemeinen: und gleichzeitig vorliegendem niedrigem Wenn Sie an einer dauerhaften Blutdruck (systolisch < 100 mmHg), Atemwegserkrankung die zusätzlich an Durchblutungsstörungen mit Verengung der des Herzmuskels (ischämische Atemwege durch Krämpfe der Herzkrankheit) und allgemeiner Bronchialmuskulatur Arterienverkalkung (chronisch obstruktive und/oder an eingeschränkter Lungenerkrankung) leiden und keine Nierenfunktion leiden, wurde Medikamente gegen diese Erkrankung unter der Therapie mit Carvedilol einnehmen oder inhalieren, sollten Sie HEXAL® 12,5 mg eine reversible Verschlechterung Carvedilol HEXAL® 12,5 mg nicht einnehmen, 72 es sei denn, der Nutzen überwiegt Verringerung der Herzschlagfolge (Bradykardie) die potenziellen Risiken einer Anwendung. verursachen. Wenn die Pulsfrequenz Bei Einnahme von Carvedilol unter 55 Schläge pro Minute HEXAL® 12,5 mg müssen Sie zu Beginn abfällt und mit Bradykardie assoziierte der Therapie und während der Dosiseinstellung Symptome auftreten, sollte die Dosis sorgfältig überwacht werden. von Carvedilol HEXAL® 12,5 mg reduziert Die Dosis von Carvedilol HEXAL® werden. 12,5 mg muss reduziert werden, wenn Kontaktlinsenträger sollten auf die bei Ihnen während der Behandlung Möglichkeit eines verminderten Tränenflusses Zeichen einer Verengung der Atemwege hingewiesen werden. auftreten. Wenn bei Ihnen schwere Carvedilol HEXAL® 12,5 mg kann die Überempfindlichkeitsreaktionen Symptome und Zeichen einer Unterzuckerung in der Vorgeschichte verschleiern oder abmildern. aufgetreten sind, oder Sie an einer Wenn Sie gleichzeitig an Diabetes Desensibilisierungstherapie mellitus und Herzleistungsschwäche leiden, teilnehmen, ist kann die Einnahme von Carvedilol Vorsicht geboten, da Carvedilol HEXAL® HEXAL® 12,5 mg gelegentlich mit 12,5 mg die Empfindlichkeit gegenüber einer Verschlechterung der Blutzucker- allergieauslösenden Stoffen und Einstellung verbunden sein. Deshalb die Schwere von Überempfindlichkeitsreaktionen müssen Sie, wenn Sie Carvedilol HEXAL® vom Soforttyp (anaphylaktische 12,5 mg erhalten, mittels regelmäßiger Reaktionen) erhöhen kann. Blutzucker-Kontrollen und gegebenenfalls Wenn Sie an Schuppenflechte Einstellung der Antidiabetika- (Psoriasis) leiden, sollte die Anwendung Medikation engmaschig überwacht von Carvedilol HEXAL® 12,5 mg mit Vorsicht werden (siehe Abschnitt „Wechselwirkungen erfolgen, da die Hautreaktionen mit anderen Arzneimitteln”). verschlimmert werden können. Carvedilol HEXAL® 12,5 mg kann die Aufgrund seiner Eigenschaft als Symptome und Zeichen einer gefäßerweiternder Schilddrüsenüberfunktion Betablocker ist während verschleiern oder der Anwendung von Carvedilol HEXAL® abmildern. 12,5 mg eine Verschlechterung einer Carvedilol HEXAL® 12,5 mg kann eine peripheren Gefäßerkrankung unwahrscheinlicher 73 als in Zusammenhang mit Bei der gleichzeitigen Anwendung von konventionellen Betablockern. Jedoch Carvedilol HEXAL® 12,5 mg und bestimmten liegen bisher nur wenig klinische Erfahrungen Anästhetika ist Vorsicht geboten in dieser Patientengruppe vor. (siehe Abschnitt „Wechselwirkungen Wenn Sie an Gefäßkrämpfen im Bereich mit anderen Arzneimitteln”). der Finger und der Zehen (Raynaud- Kinder und Jugendliche Krankheit) leiden, ist jedoch eine Bisher liegen keine ausreichenden Verschlechterung der Symptome möglich. Erfahrungen für eine allgemeine Empfehlung Wenn von Ihnen bekannt ist, dass Sie in dieser Altersgruppe vor. Debrisoquin (einen Arzneistoff gegen Carvedilol HEXAL® 12,5 mg darf nur Bluthochdruck) schlecht verstoffwechseln nach Rücksprache mit dem Arzt bei können (schlechte Metabolisierer), Kindern und Jugendlichen angewendet sollte der Behandlungsbeginn sorgfältig werden. überwacht werden. Ältere Menschen Da nur begrenzte klinische Erfahrungen Ältere Patienten können empfindlicher vorliegen, sollte Carvedilol HEXAL® auf Carvedilol HEXAL® 12,5 mg reagieren 12,5 mg nicht angewendet werden bei und sollten sorgfältiger überwacht labilem oder organbedingtem (sekundärem) werden. Bluthochdruck, Neigung zu Blutdruckabfall Schwangerschaft bei Lagewechsel (Orthostase), Die Anwendung von Carvedilol HEXAL® akuter entzündlicher Herzerkrankung, 12,5 mg während der Schwangerschaft hämodynamisch relevanter Veränderung wird nicht empfohlen, es sei der Herzklappen oder des denn der potenzielle Nutzen für die Ausflusstraktes, im Endstadium einer Mutter überwiegt gegenüber dem peripheren Arterienerkrankung, unter potenziellen Risiko für den Feten/das gleichzeitiger Behandlung mit Alpha-1- Neugeborene. Rezeptor-Antagonisten oder Alpha-2- In diesem Fall sollte die Behandlung 2- Rezeptor-Agonisten. 3 Tage vor dem erwarteten Geburtstermin Wenn Sie an einem Herzblock 1. Grades beendet werden. Ist dies nicht leiden, sollten Sie Carvedilol HEXAL® möglich, muss das Neugeborene für 12,5 mg wegen seines negativen Effektes die ersten 2-3 Lebenstage überwacht auf die Reizleitungsfähigkeit des werden. Herzens nur mit Vorsicht anwenden. Fragen Sie vor einer Einnahme von 74 Carvedilol HEXAL® 12,5 mg in der leiden. Schwangerschaft Ihren Arzt um Rat. Auswirkungen bei Fehlgebrauch zu Stillzeit Dopingzwecken Carvedilol (der Wirkstoff von Carvedilol Die Anwendung von Carvedilol HEXAL® HEXAL® 12,5 mg) geht in die Muttermilch 12,5 mg kann bei Dopingkontrollen zu über. Daher sollten Mütter während positiven Ergebnissen führen. Eine einer Behandlung mit Carvedilol missbräuchliche HEXAL® 12,5 mg nicht stillen. Anwendung des Arzneimittels Fragen Sie vor einer Einnahme von Carvedilol HEXAL® 12,5 mg zu Carvedilol HEXAL® 12,5 mg in der Stillzeit Dopingzwecken kann zu einer Gefährdung Ihren Arzt um Rat. Ihrer Gesundheit führen. Verkehrstüchtigkeit und das Bedienen Wechselwirkungen mit anderen von Maschinen Arzneimitteln Carvedilol HEXAL® 12,5 mg kann auch Bitte informieren Sie Ihren Arzt oder bei bestimmungsgemäßem Gebrauch Apotheker, wenn Sie andere Arzneimittel das Reaktionsvermögen so weit verändern, einnehmen/anwenden bzw. vor dass z. B. die Fähigkeit zur aktiven kurzem eingenommen/angewendet Teilnahme am Straßenverkehr oder zum haben, auch wenn es sich um nicht Bedienen von Maschinen beeinträchtigt verschreibungspflichtige Arzneimittel wird. Dies gilt in verstärktem Maße handelt. im Zusammenwirken mit Alkohol und Die Wirkung nachfolgend genannter insbesondere bei Therapiebeginn und Arzneistoffe oder Präparategruppen Dosiseinstellung. kann bei gleichzeitiger Behandlung mit Wichtiger Warnhinweis über bestimmte Carvedilol HEXAL® 12,5 mg beeinflusst Bestandteile von Carvedilol werden: HEXAL® 12,5 mg Wenn Sie gleichzeitig Carvedilol HEXAL® Dieses Arzneimittel ist wegen seines 12,5 mg und orale Calciumantagonisten Gehaltes an Lactose ungeeignet für - insbesondere vom Verapamiloder Patienten, die an der selten vorkommenden Diltiazemtyp- oder andere Arzneimittel ererbten Galactose-Unverträglichkeit gegen Herzrhythmusstörungen (Galactoseintoleranz), (Antiarrhythmika, z. B. Amiodaron) einnehmen, einem genetischen Lactasemangel besteht das Risiko einer oder einer Glucose-Galactose-Malabsorption Erregungsleitungsstörung oder eines 75 Herzstillstandes (sich gegenseitig verstärkender nach Absetzen und bei einer Effekt). Deshalb ist unter diesen Dosisanpassung von Carvedilol HEXAL® Bedingungen eine sorgfältige 12,5 mg empfohlen. Überwachung von Blutdruck, Herzfrequenz Carvedilol HEXAL® 12,5 mg kann die und -rhythmus (EKG) angezeigt. Wirkung anderer gleichzeitig angewendeter Eine gleichzeitige intravenöse Anwendung Arzneimittel gegen Bluthochdruck sollte vermieden werden. (z. B. Alpha-1-Rezeptor-Antagonisten) Eine gleichzeitige Behandlung mit und von Arzneimitteln mit blutdrucksenkenden Arzneistoffen wie Reserpin, Guanethidin, Nebenwirkungen, wie z. B. Barbiturate, Methyldopa, Guanfacin (Arzneistoffe, Phenothiazine, trizyklische die blutdrucksenkend wirken) Antidepressiva, Vasodilatatoren und Alkohol, und Monoaminoxidasehemmern (Ausnahme verstärken. MAO-B-Hemmer) kann zu Bei gleichzeitiger Gabe von Carvedilol einem zusätzlichen Abfall der Herzfrequenz HEXAL® 12,5 mg und Ciclosporin (ein führen. Arzneistoff zur Unterdrückung der Wenn Sie Carvedilol HEXAL® 12,5 mg Immunabwehr) zusammen mit Dihydropyridinen erhöht sich der Plasmaspiegel anwenden, sollten Sie engmaschig von Ciclosporin. Es wird empfohlen, überwacht werden, da über die Ciclosporin-Konzentrationen Herzleistungsschwäche sorgfältig zu überwachen. (Herzinsuffizienz) und Der blutzuckersenkende Effekt von schweren Blutdruckabfall berichtet Insulin und oralen Antidiabetika kann wurde. durch Carvedilol HEXAL® 12,5 mg verstärkt Bei gleichzeitiger Anwendung von werden. Carvedilol HEXAL® 12,5 mg und Nitraten Wenn Sie eine Therapie mit Carvedilol kann es zu einem verstärkten Blutdruckabfall HEXAL® 12,5 mg und dem blutdrucksenkenden kommen. Arzneistoff Clonidin absetzen, Wenn Sie gleichzeitig Carvedilol HEXAL® sollte Carvedilol HEXAL® 12,5 mg einige 12,5 mg und Digoxin-haltige Arzneimittel Tage vor der allmählichen Dosisverminderung einnehmen, kann es zu einer Erhöhung von Clonidin abgesetzt werden. des Digoxin-Serumspiegels NSAIDs (nichtsteroidale Antirheumatika), kommen. Eine Überwachung der Digoxinspiegel Östrogene und Kortikosteroide können wird daher vor Beginn, die blutdrucksenkende Wirkung von 76 Carvedilol durch Wasser- und Natriumretention 2. Was müssen Sie vor der Einnahme von abschwächen. Carvedilol HEXAL® 12,5 mg Wenn Sie Arzneimittel erhalten, die bestimmte beachten? Leberenzyme induzieren (z. B. 3. Wie ist Carvedilol HEXAL® 12,5 mg Rifampicin, Barbiturate) oder hemmen einzunehmen? (z. B. Cimetidin, Ketoconazol, Fluoxetin, 4. Welche Nebenwirkungen sind möglich? Haloperidol, Verapamil, Erythromycin) 5. Wie ist Carvedilol HEXAL® 12,5 mg müssen Sie während einer gleichzeitigen aufzubewahren? Behandlung mit Carvedilol engmaschig Carvedilol HEXAL® 12,5 mg überwacht werden, da die Tabletten Carvedilol-Serumspiegel durch die erstgenannten Wirkstoff: Carvedilol Mittel gesenkt und durch auf die Herzfunktion und den Blutdruck die Enzymhemmer erhöht werden können. verstärkt werden. Teilen Sie daher die Wenn Sie eine Narkose (Inhalations- Einnahme von Carvedilol HEXAL® Anästhetika) erhalten sollen, kann die 12,5 mg Ihrem Narkosearzt mit. Wirkung von Carvedilol HEXAL® 12,5 mg Wenn Sie gleichzeitig Sympathomimetika Gebrauchsinformation mit alpha- und beta-mimetischen Lesen Sie die gesamte Gebrauchsinformation Wirkungen und Carvedilol HEXAL® sorgfältig durch, bevor Sie mit der Einnahme 12,5 mg einnehmen, kann es zu einem dieses Arzneimittels beginnen. übermäßigen Blutdruckanstieg und - Heben Sie die Packungsbeilage auf. Vielleicht einer überschießenden Senkung der möchten Sie diese später nochmals Herzfrequenz kommen. lesen. Bei gleichzeitiger Anwendung von -Wenn Sie weitere Fragen haben, wenden Sie sich Ergotaminen (Arzneistoffe gegen Migräne) bitte an Ihren Arzt oder Apotheker. kann es zu einer verstärkten - Dieses Arzneimittel wurde Ihnen persönlich Engstellung der Gefäße kommen. verschrieben und darf nicht an Dritte Wenn Sie Carvedilol HEXAL® 12,5 mg weitergegeben werden. Es kann anderen zusammen mit Muskelrelaxanzien anwenden, Menschen schaden, auch wenn diese kann es zu einer Verstärkung dasselbe Krankheitsbild haben wie Sie. und Verlängerung der muskelerschlaffenden Diese Packungsbeilage beinhaltet: Wirkung kommen. 1. Was ist Carvedilol HEXAL® 12,5 mg und wofür 3.Wie ist Carvedilol HEXAL® wird es angewendet? 12,5 mg einzunehmen? 77 Nehmen Sie Carvedilol HEXAL® 12,5 mg 1 Tablette Carvedilol HEXAL® immer genau nach der Anweisung des 12,5 mg (entsprechend 12,5 mg Carvedilol) Arztes ein. Bitte fragen Sie bei Ihrem Arzt für zwei Tage. Danach wird die oder Apotheker nach, wenn Sie sich Behandlung mit einer Dosis von 1-mal nicht ganz sicher sind. täglich 2 Tabletten Carvedilol HEXAL® Art der Einnahme 12,5 mg (entsprechend 25 mg Carvedilol) Die Einnahme der Tabletten kann unabhängig fortgesetzt. Die Dosis kann von einer Mahlzeit erfolgen. gegebenenfalls schrittweise in Abständen Es wird jedoch Patienten mit von zwei Wochen oder in größeren Herzleistungsschwäche Abständen weiter erhöht werden. empfohlen, die Tabletten Ältere Patienten: Die empfohlene Dosis mit Nahrung zu sich zu nehmen, zu Beginn der Behandlung beträgt 1- damit der Wirkstoff Carvedilol langsamer mal täglich 1 Tablette Carvedilol HEXAL® resorbiert und das Risiko von 12,5 mg (entsprechend 12,5 mg Carvedilol). Kreislaufregulationsstörungen bei Lagewechsel Diese Dosis kann auch für die (orthostatische Effekte) vermindert Weiterbehandlung ausreichend sein. wird. Bei ungenügender Wirkung kann die Falls vom Arzt nicht anders verordnet, ist Dosis jedoch schrittweise in Abständen die übliche Dosis: von zwei Wochen oder in größeren Bluthochdruck (Essentielle Hypertonie) Abständen erhöht werden. Carvedilol HEXAL® 12,5 mg kann zur Erkrankung der Herzkranzgefäße (chronisch Behandlung des Bluthochdrucks allein stabile Angina pectoris) oder in Kombination mit anderen Erwachsene: Die empfohlene Dosis zu blutdrucksenkenden Arzneimitteln, insbesondere Beginn der Behandlung beträgt 2-mal harntreibenden Mitteln täglich 1 Tablette Carvedilol HEXAL® (Thiazid-Diuretika), verwendet werden. 12,5 mg (entsprechend 2-mal täglich Eine 1-mal tägliche Dosierung wird 12,5 mg Carvedilol) für zwei Tage. empfohlen, die empfohlene maximale Danach wird die Behandlung mit einer Einzeldosis beträgt jedoch 25 mg und Dosis von 2-mal täglich 2 Tabletten die empfohlene maximale Tagesdosis Carvedilol HEXAL® 12,5 mg (entsprechend 50 mg. 2-mal täglich 25 mg Carvedilol) Erwachsene: Die empfohlene Dosis zu fortgesetzt. Die Dosis kann gegebenenfalls Behandlungsbeginn beträgt 1-mal täglich schrittweise in Abständen von zwei 78 Wochen oder in größeren Abständen wird empfohlen, die höchste vom weiter erhöht werden. Die empfohlene Patienten tolerierte Dosis anzustreben. Tageshöchstdosis beträgt 100 mg, verteilt Die empfohlene Maximaldosis beträgt auf zwei Dosen. 2-mal täglich 2 Tabletten Carvedilol Ältere Patienten: Die empfohlene HEXAL® 12,5 mg (entsprechend 2-mal Initialdosis beträgt 2-mal täglich 1 Tablette täglich 25 mg Carvedilol) bei Patienten Carvedilol HEXAL® 12,5 mg (entsprechend mit einem Körpergewicht unter 85 kg 2-mal täglich 12,5 mg und 2-mal täglich 50 mg* bei Patienten Carvedilol) für 2 Tage. Danach wird die mit einem Körpergewicht über 85 kg, Behandlung mit einer Dosis von 2-mal vorausgesetzt, dass keine schwere täglich 2 Tabletten Carvedilol HEXAL® Herzleistungsschwäche vorliegt. Eine 12,5 mg (entsprechend 2-mal täglich Dosiserhöhung auf 2-mal täglich 50 mg 25 mg Carvedilol) fortgesetzt, welche sollte unter engmaschiger ärztlicher auch die empfohlene Tageshöchstdosis Kontrolle erfolgen. ist. Zu Therapiebeginn oder bei Dosiserhöhung Zusatzbehandlung bei mäßiger bis kann eine vorübergehende schwerer Herzleistungsschwäche Verschlechterung der Symptome der (Herzinsuffizienz): Herzleistungsschwäche auftreten, insbesondere Die Dosis zu Behandlungsbeginn beträgt bei Patienten mit schwerer 2-mal täglich 3,125 mg* für zwei Wochen. Herzleistungsschwäche und/oder hochdosierter Wenn diese Dosis gut vertragen Diuretikatherapie. Dies erfordert wird, kann die Carvedilol-Dosis in Intervallen üblicherweise keinen Abbruch der von zwei Wochen oder in größeren Behandlung, die Dosis sollte jedoch Abständen zuerst auf 2-mal täglich nicht erhöht werden. Nach Behandlungsbeginn 1/2 Tablette Carvedilol HEXAL® 12,5 mg oder Dosiserhöhung sollte (entsprechend 2-mal täglich 6,25 mg der Patient von einem Internisten/ Carvedilol), dann auf 2-mal täglich Kardiologen überwacht werden. 1 Tablette Carvedilol HEXAL® 12,5 mg Vor jeder Erhöhung der Dosis sollte eine (entsprechend 2-mal täglich 12,5 mg Untersuchung im Hinblick auf mögliche Carvedilol) und danach auf 2-mal täglich Symptome einer Verschlechterung der 2 Tabletten Carvedilol HEXAL® Herzleistungsschwäche oder Symptome 12,5 mg (entsprechend 2-mal täglich einer übermäßigen Gefäßerweiterung 25 mg Carvedilol) erhöht werden. Es (z. B. Nierenfunktion, Körpergewicht, 79 Blutdruck, Herzfrequenz und Herzleistungsschwäche, kardiogenem -rhythmus) stattfinden. Schock und Herzstillstand kommen. Falls die Carvedilol-Therapie länger als Zusätzlich können Atembeschwerden, zwei Wochen unterbrochen wurde, Verkrampfung der Atemmuskulatur, sollte sie mit 2-mal täglich 3,125 mg* Erbrechen, Bewusstseinsstörungen und wieder aufgenommen werden und Krampfanfälle auftreten. erneut eine schrittweise Erhöhung - Bei Verdacht auf eine Überdosierung gemäß obiger Empfehlungen - erfolgen. mit Carvedilol HEXAL® 12,5 mg benachrichtigen Nierenfunktionseinschränkung Sie bitte sofort Ihren Arzt. Die Dosierung muss für jeden Patienten Dieser entscheidet über gegebenenfalls individuell festgelegt werden, es gibt erforderliche Maßnahmen, unter jedoch aufgrund der pharmakokinetischen Umständen unter intensivmedizinischer Parameter keine Hinweise darauf, Überwachung. Carvedilol HEXAL® dass eine Dosisanpassung von 12,5 mg kann nicht mittels Dialyse eliminiert Carvedilol HEXAL® 12,5 mg bei Patienten werden. mit Herzleistungsschwäche erforderlich Wenn Sie die Einnahme von ist. Carvedilol HEXAL® 12,5 mg vergessen Mäßige Leberfunktionsstörung haben Eine Anpassung der Dosis kann erforderlich Nehmen Sie nicht die doppelte Dosis, sein. wenn Sie die vorherige Einnahme vergessen * Für diese Dosierungen wird Carvedilol haben, sondern fahren Sie wie HEXAL® in 5 Stärken angeboten: gewohnt mit der Einnahme fort. 3,125 mg, 6,25 mg, 12,5 mg, 25 mg Auswirkungen, wenn die Behandlung und 50 mg. mit Carvedilol HEXAL® 12,5 mg beendet Bitte sprechen Sie mit Ihrem Arzt, wenn oder abgebrochen wird Sie den Eindruck haben, dass die Eine Unterbrechung der Therapie sollte Wirkung von Carvedilol HEXAL® 12,5 mg ohne die Anweisung des Arztes nicht zu stark oder zu schwach ist. erfolgen. Wenn Sie eine größere Menge Wie andere Betablocker sollte Carvedilol HEXAL® 12,5 mg eingenommen Carvedilol HEXAL® 12,5 mg nicht abrupt haben, als Sie sollten abgesetzt werden. Dies gilt insbesondere, kann es zu schwerem Blutdruckabfall, wenn Sie an Durchblutungsstörungen Verlangsamung der Herzschlagfolge, des Herzmuskels leiden. Die 80 Therapie mit Carvedilol HEXAL® 12,5 mg einschließlich Einzelfälle muss innerhalb von zwei Wochen Nebenwirkungen schrittweise abgesetzt werden, z. B. Nebenwirkungen treten hauptsächlich durch Reduktion der Tagesdosis alle zu Beginn der Behandlung auf. drei Tage auf die Hälfte. Gleichzeitig Berichte über Nebenwirkungen aus klinischen sollte gegebenenfalls eine Ersatztherapie Studien bei Patienten mit eingeleitet werden, um eine Verschlechterung Herzleistungsschwäche einer Angina pectoris Nebenwirkungen, die bei Patienten mit (anfallsweise auftretender Brustschmerz Herzleistungsschwäche in klinischen infolge Verengung der Herzkranzgefäße) Studien auftraten und bei Patienten zu verhindern. unter der Einnahme eines Scheinmedikaments Ihre Ärztin/Ihr Arzt, Ihre Apotheke und HEXAL (Placebo) nicht so häufig wünschen gute Besserung! gesehen wurden, sind im Folgenden 4.Welche Nebenwirkungen sind aufgeführt. möglich? Blut- und Lymphsystem Wie alle Arzneimittel kann Carvedilol Häufig: leichter Abfall der Blutplättchen HEXAL® 12,5 mg Nebenwirkungen (Thrombozyten) haben. Stoffwechsel Bei der Bewertung von Nebenwirkungen Sehr häufig: erhöhte Blutzuckerspiegel werden folgende Häufigkeitsangaben (siehe Abschnitt „Besondere Vorsicht bei zugrunde gelegt: der Einnahme von Carvedilol HEXAL® sehr häufig: mehr als 1 von 10 Behandelten 12,5 mg ist erforderlich”), häufig: weniger als 1 von 10, Flüssigkeitsansammlungen aber mehr als 1 von in den Extremitäten, 100 Behandelten Flüssigkeitsretention, Hypervolämie (erhöhtes gelegentlich: weniger als 1 von zirkulierendes Blutvolumen). 100, aber mehr als 1 Zentrales und peripheres Nervensystem von 1000 Häufig: Schwindel selten: weniger als 1 von Selten: Vorübergehende Bewusstlosigkeit 1000, aber mehr als Augen 1 von 10.000 Behandelten Sehr häufig: Sehstörungen sehr selten: weniger als 1 von Herz-Kreislauf-System 10.000 Behandelten, Sehr häufig: Beinödeme und eine verlangsamte 81 Herzschlagfolge (Bradykardie), (anfallsweise auftretender Brustschmerz übermäßiger Blutdruckabfall infolge Verengung der Herzkranzgefäße) bei Lagewechsel vom Liegen zum Das Nebenwirkungsprofil bei Patienten Stehen (orthostatische Hypotonie) mit Bluthochdruck und Angina pectoris Selten: Reizüberleitungsstörung am AVKnoten ähnelt dem der Patienten mit (totaler AV-Block), Verschlechterung Herzleistungsschwäche. einer Herzleistungsschwäche Jedoch treten die (Herzinsuffizienz) Nebenwirkungen bei Patienten mit Nieren und ableitende Harnwege Bluthochdruck und Angina pectoris seltener Selten: Verschlechterung der Nierenfunktion auf. Magen-Darm-Trakt Blut- und Lymphsystem Sehr häufig: Übelkeit, Durchfall und Erbrechen Selten: leicht erniedrigte Zahl der Gelegentlich: Verstopfung Blutplättchen (Thrombozytopenie), Fortpflanzungsorgane leichter Abfall der weißen Blutkörperchen Sehr häufig: Ödeme an den Genitalien (Leukopenie) Allgemein Stoffwechsel Sehr häufig: Ödeme Häufig: Erhöhung des Cholesterinspiegels Bei Patienten mit allgemeiner Gefäßverkalkung im Blut und/oder eingeschränkter Selten: Flüssigkeitsansammlungen in Nierenfunktion sind akutes Nierenversagen den Extremitäten und Nierenfunktionsstörungen Psyche seltene Nebenwirkungen. Mit Ausnahme Selten: Schlafstörungen, Depressionen von Schwindel, Sehstörungen, verlangsamter Zentrales und peripheres Nervensystem Herzschlagfolge (Bradykardie) Sehr häufig: Schwindel, Kopfschmerzen, und Verschlechterung einer insbesondere zu Beginn der Behandlung Herzleistungsschwäche ist die Häufigkeit Selten: Missempfindungen wie Kribbeln der Nebenwirkungen nicht dosisabhängig. und Kältegefühl an den Gliedmaßen, Die Pumpfähigkeit des Herzens kann vorübergehende Bewusstlosigkeit, insbesondere bei der Dosiseinstellung vermindert zu Beginn der Behandlung sein, dies ist jedoch selten. Augen Berichte aus klinischen Studien über Sehr häufig: verminderter Tränenfluss Nebenwirkungen bei Patienten mit Sehr selten: Sehstörungen, Augenreizungen Bluthochdruck und Angina pectoris Herz-Kreislauf-System 82 Sehr häufig: erniedrigte Herzschlagfolge oder Zehen) sind: anfallsweiser Brustschmerz (Bradykardie), insbesondere zu infolge Verengung der Herzkranzgefäße Beginn der Behandlung, übermäßiger (Angina pectoris), Erregungsleitungsstörungen Blutdruckabfall bei Lagewechsel vom von den Vorhöfen Liegen zum Stehen (orthostatische auf die Kammern (AV-Block) und Hypotension), insbesondere zu Beginn Verschlechterung der Symptome. der Behandlung Atemwege Selten: peripheres Kreislaufversagen Bei vorbelasteten Patienten wurde häufig Atemwege eine Asthma-ähnliche Atemnot Selten: verstopfte Nase beobachtet. Magen-Darm-Trakt Haut und Unterhautzellgewebe Häufig: Übelkeit, Bauchschmerzen, Unterschiedliche Hautreaktionen sind Durchfall selten berichtet worden (z. B. allergisches Selten: Verstopfung, Erbrechen Exanthem, Nesselsucht, Hautjucken Sehr selten: Mundtrockenheit und Lichen-planus-ähnliche Bewegungsapparat Reaktion). Schuppenflechte-ähnliche Sehr häufig: Gliederschmerzen (psoriatische) Hautläsionen können auftreten Nieren- und ableitende Harnwege oder bestehende Läsionen können Selten: Verschlechterung der Nierenfunktion sich verschlechtern. Sehr selten: Störungen beim Wasserlassen Insbesondere nicht-selektive Betablocker Fortpflanzungsorgane können zur Manifestation einer Sehr selten: Impotenz zwar vorhandenen aber noch nicht Allgemein ausgebrochenen Blutzuckerkrankheit Sehr häufig: Müdigkeit, insbesondere (Diabetes mellitus) führen, bereits bestehender zu Beginn der Behandlung Diabetes kann sich verschlechtern, Laborergebnisse und die Kontrolle des Selten: Erhöhte Leberwerte Blutzuckerspiegels kann beeinträchtigt (Serumtransaminasen) sein. Ebenso sind leichte Störungen des Sehr seltene Nebenwirkungen bei Glucosehaushalts während einer Behandlung Patienten mit arterieller Verschlusskrankheit mit Carvedilol HEXAL® der Beine („Schaufensterkrankheit”) 12,5 mg möglich, jedoch nicht häufig. oder Raynaud-Krankheit Gegenmaßnahmen (Gefäßkrämpfe im Bereich der Finger Sollten Sie die oben genannten Nebenwirkungen 83 bei sich beobachten, benachrichtigen Sie Ihren Arzt. Er wird über den Schweregrad und gegebenenfalls über erforderliche weitere Maßnahmen entscheiden. Informieren Sie Ihren Arzt oder Apotheker, wenn Sie Nebenwirkungen bemerken, die nicht in dieser Packungsbeilage aufgeführt sind. 5.Wie ist Carvedilol HEXAL® 12,5 mg aufzubewahren? Arzneimittel für Kinder unzugänglich aufbewahren. Sie dürfen das Arzneimittel nach dem auf dem Umkarton und der Blisterpackung angegebenen Verfallsdatum nicht mehr verwenden. Aufbewahrungsbedingungen: In der Originalverpackung aufbewahren! Stand der Information Februar 2010 697077 84 85 Indlægsseddel nr.2: Carvedilol-ratiopharm® 12,5 mg Filmtabletten GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Carvedilol-ratiopharm® 12,5 mg Filmtabletten Wirkstoff: Carvedilol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. – Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. – Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker. – Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie. – Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker. Diese Packungsbeilage beinhaltet: 1. Was ist Carvedilol-ratiopharm® 12,5 mg und wofür wird es angewendet? 2. Was müssen Sie vor der Einnahme von Carvedilol-ratiopharm® 12,5 mg beachten? 3. Wie ist Carvedilol-ratiopharm® 12,5 mg einzunehmen? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Carvedilol-ratiopharm® 12,5 mg aufzubewahren? 6. Weitere Informationen 1. WAS IST Carvedilol-ratiopharm® 12,5 mg UND WOFÜR WIRD ES ANGEWENDET? Carvedilol-ratiopharm® 12,5 mg gehört zu der Arzneimittelgruppe der Alpha- und Beta-Blocker. Carvedilolratiopharm ® 12,5 mg wird zur Behandlung des Bluthochdrucks und zur Behandlung der Angina pectoris angewendet. Außerdem wird Carvedilol-ratiopharm® 12,5 mg als ergänzende Behandlung bei einer Herzleistungsschwäche (Herzinsuffizienz) angewendet. 2. WAS MÜSSEN SIE VOR DER EINNAHME VON Carvedilol-ratiopharm® 12,5 mg BEACHTEN? Carvedilol-ratiopharm® 12,5 mg darf nicht eingenommen werden, 86 – wenn Sie überempfindlich (allergisch) gegen Carvedilol oder einen der sonstigen Bestandteile von Carvedilol-ratiopharm® 12,5 mg sind. – wenn Sie eine schwere Herzinsuffizienz haben, die mit bestimmten intravenösen (über eine Vene verabreichten) Arzneimitteln behandelt wird. – wenn Sie Asthma haben. – wenn Sie eine nicht ausgeglichene (dekompensierte) Herzinsuffizienz haben oder bestimmte Arten von Störungen im Reizleitungssystem des Herzens (so genannter AV-Block II. und III. Grades oder Sinusknotensyndrom). – wenn Sie an einer schwer eingeschränkten Herzfunktion (kardiogener Schock) oder zu langsamem Herzschlag (Bradykardie) leiden. – wenn Sie einen sehr niedrigen Puls oder einen sehr niedrigen Blutdruck haben. – wenn Sie an einer schweren Störung des Säurebasenhaushalts (Übersäuerung) des Körpers (metabolische Azidose, Azidämie) leiden. – wenn Sie an einer ungewöhnlichen Form der Angina pectoris, einer so genannten Prinzmetal-Angina, die durch Verkrampfung der Herzkranzgefäße ausgelöst wird, leiden. – wenn Sie eine Überfunktion der Nebennieren (Phäochromozytom) haben, die nicht mit Medikamenten behandelt wird. – wenn Sie schwere Durchblutungsstörungen in Händen und Füßen oder eine Claudicatio intermittens (so genannte Schaufensterkrankheit) haben. – wenn Sie an einer schweren Lebererkrankung leiden. – wenn Sie zurzeit intravenös mit Arzneimitteln behandelt werden, die zur Behandlung von unregelmäßigem Herzschlag angewendet werden (Verapamil oder Diltiazem). Besondere Vorsicht bei der Einnahme von Carvedilol-ratiopharm® 12,5 mg ist erforderlich Fragen Sie Ihren Arzt vor der Einnahme von Carvedilol-ratiopharm® 12,5 mg, – wenn Sie eine Herzinsuffizienz haben und gleichzeitig • niedrigen Blutdruck, • eine eingeschränkte Blut- und Sauerstoffversorgung des Herzens (ischämische Herzkrankheit) und eine Verhärtung der Arterien (Atherosklerose) und/oder • Nierenprobleme. In diesen Fällen muss Ihre Nierenfunktion überwacht werden. Möglicherweise muss Ihre Dosis verringert werden. 87 – wenn Sie eine Zuckerkrankheit (Diabetes) haben. Die Behandlung mit Carvedilol-ratiopharm® 12,5 mg kann die Anzeichen eines niedrigen Blutzuckers verschleiern. Deshalb muss Ihr Blutzucker regelmäßig kontrolliert werden. – wenn Sie schwere unbehandelte Atemprobleme haben. Carvedilol-ratiopharm® 12,5 mg kann diese Atembeschwerden verschlimmern. – wenn Sie Kontaktlinsen tragen. Carvedilol-ratiopharm® 12,5 mg kann die Tränenproduktion verringern. – wenn Sie an dem Raynaud-Phänomen (die Finger oder Zehen verfärben sich zunächst bläulich, dann weißlich und schließlich rötlich und schmerzen) leiden. Carvedilol-ratiopharm® 12,5 mg kann die Beschwerden verschlimmern. – wenn sie eine Überfunktion der Schilddrüse mit vermehrter Bildung des Schilddrüsenhormons haben. Carvedilol-ratiopharm® 12,5 mg kann die Beschwerden verschleiern. – wenn Sie Carvedilol-ratiopharm® 12,5 mg einnehmen und sich einer Operation unter Anwendung eines Narkosemittels unterziehen müssen. Darüber sollten Sie schon möglichst lange im Voraus mit dem für die Operation verantwortlichen Arzt sprechen. – wenn Sie einen sehr niedrigen Puls (weniger als 55 Schläge pro Minute) haben. – wenn Sie eine schwere allergische Reaktion hatten (z. B. auf einen Insektenstich oder ein Nahrungsmittel) oder wenn Sie gerade eine Desensibilisierungsbehandlung durchführen lassen oder vorhaben. Carvedilolratiopharm® 12,5 mg kann die Wirksamkeit von Arzneimitteln zur Behandlung solcher allergischer Reaktionen abschwächen. – wenn Sie Psoriasis (Schuppenflechte) haben. Auswirkungen bei Fehlgebrauch zu Dopingzwecken Sprechen Sie mit Ihrem Arzt, wenn Sie Sportler sind und sich Doping-Tests unterziehen müssen. Die Einnahme von Carvedilol-ratiopharm® 12,5 mg kann bei Dopingkontrollen zu positiven Ergebnissen führen. Bei Einnahme von Carvedilol-ratiopharm® 12,5 mg mit anderen Arzneimitteln Andere gleichzeitig verabreichte Arzneimittel können Carvedilol-ratiopharm® 12,5 mg beeinflussen oder durch Carvedilol-ratiopharm® 12,5 mg beeinflusst werden. Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Denken Sie daran, Ihren Arzt über die Behandlung mit Carvedilol-ratiopharm® 12,5 mg zu informieren, wenn Ihnen während der Behandlung ein anderes Arzneimittel verschrieben wird. Es ist besonders wichtig, dass Ihr Arzt weiß, ob Sie bereits mit folgenden Arzneimitteln behandelt werden: – Digoxin (zur Behandlung der Herzinsuffizienz) – Rifampicin (Antibiotikum zur Behandlung der Tuberkulose) 88 – Cimetidin (Arzneimittel zur Behandlung von Magengeschwüren, Sodbrennen und Rückfluss von Magensäure) – Ketoconazol (Arzneimittel zur Behandlung von Pilzerkrankungen) – Fluoxetin (Arzneimittel zur Behandlung der Depression) – Haloperidol (Arzneimittel zur Behandlung bestimmter seelischer Erkrankungen) – Erythromycin (Antibiotikum) – Ciclosporin (Arzneimittel zur Unterdrückung des Immunsystems zur Verhütung von Abstoßungsreaktionen nach einer Organtransplantation; wird auch bei bestimmten rheumatischen oder Hauterkrankungen angewendet) – Clonidin (Arzneimittel zur Senkung des Blutdrucks oder zur Behandlung der Migräne) – Verapamil, Diltiazem, Amiodaron (Arzneimittel zur Behandlung von unregelmäßigem Herzschlag) – Chinidin, Disopyramid, Mexiletin, Propafenon, Flecainid (Arzneimittel zur Behandlung von unregelmäßigem Herzschlag) – Andere blutdrucksenkende Arzneimittel. Carvedilol kann die Wirkungen anderer, gleichzeitig verabreichter blutdrucksenkender Arzneimittel (z. B. Alpha-1-Rezeptor-Antagonisten) und von Arzneimitteln verstärken, bei denen die Blutdrucksenkung als eine Nebenwirkung auftritt, wie beispielsweise Barbiturate (zur Behandlung der Epilepsie), Phenothiazine (zur Behandlung von Psychosen), trizyklische Antidepressiva (zur Behandlung der Depression), gefäßerweiternde Arzneimittel und Alkohol – Insulin oder orale Antidiabetika (blutzuckersenkende Arzneimittel), da ihre blutzuckersenkende Wirkung verstärkt und die Anzeichen eines niedrigen Blutzuckers verschleiert werden können – Inhalationsnarkotika (Arzneimittel, die bei der Narkose verwendet werden) – Sympathomimetika (Arzneimittel, die die Funktion des sympathischen Nervensystems steigern) – Dihydropyridine (Arzneimittel zur Behandlung von Bluthochdruck und Herzerkrankungen) – Nitrate (Arzneimittel zur Behandlung von Herzerkrankungen), da sie die blutdrucksenkenden Wirkungen von Carvedilol plötzlich verstärken können – Muskelrelaxanzien (Arzneimittel, die die Muskeln entspannen) – Ergotamin (Migränemittel) – Bestimmte Schmerztabletten (NSARs = nicht-steroidale Antirheumatika), Estrogene (Hormone) und Kortikosteroide (Nebennierenhormone), da diese in einigen Fällen die blutdrucksenkende Wirkung von Carvedilol abschwächen können 89 – Arzneimittel, die Reserpin, Guanetidin, Methyldopa, Guanfacin und Monoaminooxidase-Hemmer (MAOHemmer, Arzneimittel zur Behandlung der Depression) enthalten, da diese eine weitere Verlangsamung des Herzschlags hervorrufen können. Bei Einnahme von Carvedilol-ratiopharm® 12,5 mg zusammen mit Nahrungsmitteln und Getränken Carvedilol-ratiopharm® 12,5 mg kann die Wirkung von Alkohol verstärken. Schwangerschaft und Stillzeit Fragen Sie vor der Einnahme von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat. Schwangerschaft Für das ungeborene Kind besteht das Risiko einer Schädigung. Carvedilol-ratiopharm® 12,5 mg darf daher während der Schwangerschaft nur eingenommen werden, wenn Ihr Arzt es für zwingend erforderlich hält. Fragen Sie deshalb immer erst Ihren Arzt um Rat, bevor Sie Carvedilol-ratiopharm® 12,5 mg während der Schwangerschaft einnehmen. Stillzeit Aus Ergebnissen von Studien mit säugenden Tieren geht hervor, dass Carvedilol in die Muttermilch übergeht. Carvedilol-ratiopharm® 12,5 mg sollte daher nicht während der Stillzeit eingenommen werden. Verkehrstüchtigkeit und das Bedienen von Maschinen Dieses Arzneimittel hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Bei Behandlungsbeginn oder bei Änderungen der Behandlung können Schwindel und Müdigkeit auftreten. Wenn Sie sich nach der Einnahme der Filmtabletten schwindlig oder schwach fühlen, sollten Sie vermeiden, Auto zu fahren oder Arbeiten durchzuführen, die hohe Aufmerksamkeit erfordern. Wichtige Informationen über bestimmte sonstige Bestandteile von Carvedilol-ratiopharm® 12,5 mg Dieses Arzneimittel enthält Lactose. Bitte nehmen Sie Carvedilol-ratiopharm® 12,5 mg daher erst nach Rücksprache mit Ihrem Arzt ein, wenn Ihnen bekannt ist, dass Sie unter einer Unverträglichkeit gegenüber bestimmten Zuckern leiden. 3. WIE IST Carvedilol-ratiopharm® 12,5 mg EINZUNEHMEN? Nehmen Sie Carvedilol-ratiopharm® 12,5 mg immer genau nach Anweisung Ihres Arztes ein. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind. Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie den Eindruck haben, dass die Wirkung von Carvedilol-ratiopharm® 12,5 mg zu stark oder zu schwach ist. Sie sollten die Filmtabletten mit mindestens einem halben Glas Wasser schlucken. Sie können die Filmtabletten unabhängig von den Mahlzeiten einnehmen. Patienten mit einer Herzinsuffizienz sollten die Filmtabletten jedoch mit einer Mahlzeit einnehmen, um die Gefahr des Auftretens von Schwindel bei plötzlichem Aufstehen zu verringern. Carvedilol-ratiopharm® Filmtabletten sind in den folgenden Wirkstärken erhältlich: 90 6,25 mg, 12,5 mg und 25 mg. Bluthochdruck Erwachsene Die übliche Dosis ist einmal täglich 1 Filmtablette Carvedilol-ratiopharm® 12,5 mg (entsprechend 12,5 mg Carvedilol) für die ersten zwei Tage und danach einmal täglich 2 Filmtabletten Carvedilol-ratiopharm® 12,5 mg (entsprechend 25 mg Carvedilol). Falls erforderlich, kann die Dosis schrittweise weiter erhöht werden. Die empfohlene Tageshöchstdosis beträgt 50 mg Carvedilol. Ältere Patienten Die empfohlene Dosis ist einmal täglich 1 Filmtablette Carvedilol-ratiopharm® 12,5 mg (entsprechend 12,5 mg Carvedilol). Falls erforderlich, kann die Dosis schrittweise in Abständen von zwei Wochen auf die Tageshöchstdosis von 50 mg Carvedilol pro Tag erhöht werden. Angina pectoris Erwachsene Die übliche Dosis ist zweimal täglich 1 Filmtablette Carvedilol-ratiopharm® 12,5 mg (entsprechend zweimal täglich 12,5 mg Carvedilol) für die ersten zwei Tage und danach zweimal täglich 2 Filmtabletten Carvedilolratiopharm ® 12,5 mg (entsprechend zweimal täglich 25 mg Carvedilol). Falls erforderlich, kann die Dosis schrittweise weiter erhöht werden. Die empfohlene Tageshöchstdosis beträgt 100 mg Carvedilol pro Tag. Ältere Patienten Die übliche Dosis ist zweimal täglich 1 Filmtablette Carvedilol-ratiopharm® 12,5 mg (entsprechend zweimal täglich 12,5 mg Carvedilol) für die ersten zwei Tage und danach zweimal täglich 2 Filmtabletten Carvedilolratiopharm ® 12,5 mg (entsprechend zweimal täglich 25 mg Carvedilol). Die empfohlene Tageshöchstdosis beträgt 50 mg Carvedilol pro Tag. Herzinsuffizienz Die übliche Anfangsdosis ist zweimal täglich 3,125 mg Carvedilol für zwei Wochen. Für diese Dosierung stehen andere Dosisstärken zur Verfügung. Die Dosis kann schrittweise, im Allgemeinen in zweiwöchentlichen Abständen, gesteigert werden. Die Dosis muss jedoch möglicherweise erhöht oder verringert werden. Ihr Arzt wird Sie entsprechend beraten. Die empfohlene Tageshöchstdosis beträgt 25 mg zweimal täglich für Patienten mit einem Körpergewicht unter 85 kg und 50 mg zweimal täglich für Patienten mit einem Körpergewicht über 85 kg, vorausgesetzt, es handelt sich nicht um eine schwere Herzinsuffizienz. Eine Dosiserhöhung auf 50 mg zweimal täglich sollte vorsichtig unter engmaschiger ärztlicher Überwachung erfolgen. Wenn Sie eine größere Menge von Carvedilol-ratiopharm® 12,5 mg eingenommen haben, als Sie sollten 91 Wenn Sie eine größere Menge von Carvedilol-ratiopharm® 12,5 mg eingenommen haben, als Sie sollten, oder wenn Kinder versehentlich das Arzneimittel eingenommen haben, nehmen Sie bitte mit Ihrem Arzt oder dem Krankenhaus Kontakt auf oder rufen Sie den Notfalldienst an, um sich über das Risiko zu informieren und sich beraten zu lassen, was Sie tun müssen. Zu den Anzeichen einer Überdosierung können wegen des extrem niedrigen Blutdrucks das Gefühl des Ohnmächtig werdens sowie langsamer Herzschlag und in schweren Fällen gelegentlich ausbleibende Herzschläge zählen. Atembeschwerden, verengte Atemwege, Unwohlsein, Bewusstseinstrübung und Krampfanfälle können ebenfalls auftreten. Wenn Sie die Einnahme von Carvedilol-ratiopharm® 12,5 mg vergessen haben Wenn Sie die Einnahme einer Dosis (oder mehrerer Dosen) vergessen haben, nehmen Sie die nächste Dosis wieder zu Ihrem üblichen Zeitpunkt der Einnahme ein. Nehmen Sie nicht die doppelte (oder eine größere) Dosis ein, wenn Sie die vorherige(n) Einnahme(n) vergessen haben. Wenn Sie die Einnahme von Carvedilol-ratiopharm® 12,5 mg abbrechen Brechen Sie Ihre Behandlung nicht plötzlich ab und verändern Sie nicht die Dosis, wenn Ihr Arzt dies nicht angewiesen hat. Ihre Behandlung muss schrittweise über einen Zeitraum von zwei Wochen ausgeschlichen werden. Ein plötzlicher Abbruch der Behandlung kann Ihre Beschwerden verschlimmern. Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker. 4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? Wie alle Arzneimittel kann Carvedilol-ratiopharm® 12,5 mg Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt: Sehr häufig: mehr als 1 Behandelter von 10 Häufig: 1 bis 10 Behandelte von 100 Gelegentlich: 1 bis 10 Behandelte von 1.000 Selten: 1 bis 10 Behandelte von 10.000 Sehr selten: weniger als 1 Behandelter von 10.000 Nicht bekannt Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar Die Mehrzahl der Nebenwirkungen ist dosisabhängig und geht zurück, wenn die Dosis verringert oder die Behandlung beendet wird. Einige Nebenwirkungen können bei Behandlungsbeginn auftreten und während des Verlaufs der Behandlung wieder spontan verschwinden. Nebenwirkungen bei Patienten mit Herzinsuffizienz Sehr häufig: 92 – Schwindel – Kopfschmerzen – Müdigkeit Häufig: – Gewichtszunahme – Erhöhte Cholesterinspiegel – Mangelnde Blutzuckerkontrolle bei Diabetikern – Langsamer Herzschlag – Niedriger Blutdruck. Zu den Anzeichen gehört Schwindel (z. B. bei schnellem Aufstehen) – Ödeme (einschließlich Schwellungen des Körpers oder von Körperteilen wie Händen und Füßen, Genitalödem), Flüssigkeitsüberlastung, erhöhtes Blutvolumen – Sehstörungen – Durchfall – Unwohlsein, Erbrechen Gelegentlich: – Ohnmacht – Störungen im Reizleitungssystem des Herzens – Verschlimmerung der Herzinsuffizienz bei Behandlungsbeginn Selten: – Verringerte Anzahl von Blutplättchen (Thrombozytopenie) – Akute Niereninsuffizienz und Nierenfunktionsstörungen bei Patienten mit Arterienverhärtung (Atherosklerose) und/oder eingeschränkter Nierenfunktion Sehr selten: – Geringe Anzahl weißer Blutkörperchen (Leukopenie) Nebenwirkungen bei Patienten mit Bluthochdruck oder Schmerzen im Brustraum (Angina pectoris) Häufig: – Langsamer Herzschlag vor allem bei Behandlungsbeginn (Bradykardie) 93 – Schwindel (z. B. bei schnellem Aufstehen) – Kopfschmerzen – Müdigkeit – Verminderte Tränensekretion, Augenreizung – Asthma und Atembeschwerden – Unwohlsein, Magenschmerzen – Durchfall – Schmerzen in Armen und Beinen Gelegentlich: – Empfindungsstörungen – Ohnmacht – Durchblutungsstörungen (Anzeichen sind kalte Hände und Füße), Verschlechterung der Beschwerden bei Patienten mit Raynaud-Krankheit (die Finger oder Zehen verfärben sich zunächst bläulich, dann weißlich und schließlich rötlich und schmerzen) oder mit Claudicatio intermittens (Schmerzen in den Beinen, die beim Gehen schlimmer werden) – Störungen im Reizleitungssystem des Herzens, Angina pectoris (einschließlich Brustschmerz), Anzeichen einer Herzinsuffizienz und Ödeme (Schwellungen von mehr als einem Körperteil) – Sehstörungen – Verstopfung – Erbrechen – Bestimmte Hautreaktionen (z. B. allergische Hautentzündung, Quaddeln, Juckreiz und entzündliche Hauterscheinungen, vermehrtes Schwitzen). Schuppenflechtenartige Hautveränderungen können ebenfalls auftreten oder eine bestehende Schuppenflechte kann sich verschlimmern. – Schlafstörungen – Depression – Halluzinationen – Verwirrtheit – Impotenz Selten: 94 – Mundtrockenheit – Verstopfte Nase – Schwierigkeiten beim Wasserlassen Sehr selten: – Psychose – Verändertes Blutbild (Thrombozytopenie, Leukopenie) Vereinzelte Fälle von allergischen Reaktionen. Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind. 5. WIE IST Carvedilol-ratiopharm® 12,5 mg AUFZUBEWAHREN? Arzneimittel für Kinder unzugänglich aufbewahren. Sie dürfen das Arzneimittel nach dem auf dem Umkarton, dem Etikett und/oder den Blisterpackungen angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats. Nicht über 30 °C lagern. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Das Arzneimittel darf nicht im Abwasser oder Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen. 6. WEITERE INFORMATIONEN Was Carvedilol-ratiopharm® 12,5 mg enthält – Der Wirkstoff ist: Carvedilol Jede Filmtablette enthält 12,5 mg Carvedilol. – Die sonstigen Bestandteile sind: – Mikrokristalline Cellulose – Lactose-Monohydrat – Crospovidon (Typ A) (Ph.Eur.) – Povidon K30 95 – Hochdisperses Siliciumdioxid – Magnesiumstearat (Ph.Eur.) – Hypromellose – Titandioxid (E 171) – Triethylcitrat – Macrogol 8000 – Polydextrose (E 1200) Wie Carvedilol-ratiopharm® 12,5 mg aussieht und Inhalt der Packung Weiß, oval, mit einer Bruchkerbe auf beiden Seiten und der Prägung „12“ auf einer Seite. Die Filmtablette kann in gleiche Hälften geteilt werden. Carvedilol-ratiopharm® 12,5 mg ist in Packungen mit 30, 50 und 100 Filmtabletten erhältlich. Pharmazeutischer Unternehmer und Hersteller Pharmazeutischer Unternehmer ratiopharm GmbH Graf-Arco-Str. 3 89079 Ulm Hersteller Merckle GmbH Ludwig-Merckle-Str. 3 89143 Blaubeuren Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen: Bulgarien Carvedilol-ratiopharm 12,5 mg film-coated tablets Deutschland Carvedilol-ratiopharm® 12,5 mg Filmtabletten Dänemark, Finnland, Schweden, Norwegen Carveratio Niederlande Carvedilol ratiopharm 12,5 mg Österreich Carvedilol-ratiopharm 12,5 mg Filmtabletten 96 Polen Carvedilol-ratiopharm Ungarn Carvedilol-ratiopharm 12,5 mg filmtabletta Diese Gebrauchsinformation wurde zuletzt genehmigt im Februar 2010 Versionscode: Z02 M148212.02-Z02 97 Produktresumé for Carvedilol ”HEXAL” tabletter Side 2 fra produktresumeet Voksne: Anbefalet startdosis er 12,5 mg én gang dagligt i 2 dage. Derefter fortsættes behandling med 25 mg én gang dagligt. Om nødvendig kan dosis gradvist øges yderligere med intervaller på 2 uger eller sjældnere. Ældre: Anbefalet startdosis ved hypertension er 12,5 mg én gang dagligt, som også kan være tilstrækkelig for fortsat behandling. Hvis terapeutisk respons viser sig at være utilstrækkelig ved denne dosering, kan dosis gradvist øges yderligere med intervaller på 2 uger eller sjældnere. Kronisk, stabil angina pectoris. Voksne: Anbefalet startdosis er 12,5 mg to gange dagligt i to dage. Derefter fortsættes behandling med en dosering på 25 mg to gange dagligt. Om nødvendigt kan dosis gradvist øges yderligere med intervaller på 2 uger eller sjældnere. Den anbefalede daglige maksimumdosis er 100 mg fordelt på doser (to gange dagligt). Ældre: Anbefalet startdosis er 12,5 mg to gange dagligt i to dage. Derefter fortsættes behandling med en dosering på 25 mg to gange dagligt, som er den anbefalede maksimale daglige dosis. Hjerteinsufficiens. Behandling af moderat til svær hjerteinsufficiens udover konventionel grundbehandling med diuretika, ACE-hæmmere, digitalis og/eller vasodilatorer. Patienten skal være klinisk stabil (ingen ændring i NYHA-klasse, ingen indlæggelse på grund af hjerteinsufficiens), og grundbehandlingen skal være stabiliseret i minimum 4 uger inden behandlingen. Desuden skal patienten have en reduceret uddrivningsfraktion for venstre ventrikel, en hjertefrekvens på > 50 slag/min. og et systolisk blodtryk på > 85 mm Hg (se 4.3 "Kontraindikationer"). Startdosis er 3,125 mg to gange dagligt i to uger. Hvis initialdosis tolereres godt, kan carvediloldosis øges med intervaller på 2 uger eller sjældnere, først til 6,25 mg to gange dagligt, så til 12,5 mg to gange dagligt 98 og dernæst til 25 mg to gange dagligt. Det anbefales, at dosis øges til det højeste niveau, som patienten kan tåle. Den anbefalede maksimumdosis er 25 mg administreret to gange dagligt til patienter, som vejer under 85 kg og 50 mg to gange dagligt til patienter, som vejer over 85 kg, forudsat at patientens hjerteinsufficiens ikke er svær. En dosisforøgelse til 50 mg to gange dagligt skal foretages omhyggeligt og under tæt lægeovervågning af patienten. En forbigående forværring af symptomerne på hjerteinsufficiens kan forekomme i begyndelsen af behandlingsforløbet eller som følge af en dosisforøgelse, især hos patienter med svær hjerteinsufficiens og/eller under behandling med diuretika i høje doser. Det er normalt ikke nødvendigt at afbryde behandlingen, men dosis bør ikke øges. Patienten skal overvåges af en læge/kardiolog efter behandlingens start eller ved forøgelse af dosis. Inden en dosisforøgelse foretages skal patienten altid undersøges for potentielle symptomer på forværring af hjerteinsufficiens eller symptomer på udtalt vasodilation (f.eks. nyrefunktion, legemsvægt, blodtryk, hjertefrekvens og -rytme). Forværring af hjerteinsufficiens eller væskeretention behandles med øgning af diuretikadosis, og carvediloldosis bør ikke øges før patienten er stabil. I tilfælde af bradykardi eller forlængelse af AV-ledning skal digoxinniveauet først overvåges. Af og til kan det være nødvendigt at reducere carvediloldosis eller midlertidigt afbryde behandlingen helt. Selv i de tilfælde kan titrering af carvediloldosis ofte fortsættes med succes. 99 Arzneimittelgesetz § 11 Packungsbeilage (1) 1Fertigarzneimittel, die Arzneimittel im Sinne des § 2 Abs. 1 oder Abs. 2 Nr. 1 sind und die nicht zur klinischen Prüfung oder Rückstandsprüfung bestimmt oder nach § 21 Abs. 2 Nr. 1a, 1b oder 6 von der Zulassungspflicht freigestellt sind, dürfen im Geltungsbereich dieses Gesetzes nur mit einer Packungsbeilage in den Verkehr gebracht werden, die die Überschrift „Gebrauchsinformation" trägt sowie folgende Angaben in der nachstehenden Reihenfolge allgemein verständlich in deutscher Sprache, in gut lesbarer Schrift und in Übereinstimmung mit den Angaben nach § 11a enthalten muss: 1. zur Identifizierung des Arzneimittels: a) die Bezeichnung des Arzneimittels, § 10 Abs. 1 Satz 1 Nr. 2 und Abs. 1a finden entsprechende Anwendung, b) die Stoff- oder Indikationsgruppe oder die Wirkungsweise; 2. die Anwendungsgebiete; 3. eine Aufzählung von Informationen, die vor der Einnahme des Arzneimittels bekannt sein müssen: a) Gegenanzeigen, b) entsprechende Vorsichtsmaßnahmen für die Anwendung, c) Wechselwirkungen mit anderen Arzneimitteln oder anderen Mitteln, soweit sie die Wirkung des Arzneimittels beeinflussen können, d) Warnhinweise, insbesondere soweit dies durch Auflage der zuständigen Bundesoberbehörde nach § 28 Abs. 2 Nr. 2 angeordnet oder durch Rechtsverordnung nach § 12 Abs. 1 Nr. 3 vorgeschrieben ist; 100 4. die für eine ordnungsgemäße Anwendung erforderlichen Anleitungen über a) Dosierung, b) Art der Anwendung, c) Häufigkeit der Verabreichung, erforderlichenfalls mit Angabe des genauen Zeitpunkts, zu dem das Arzneimittel verabreicht werden kann oder muss, sowie, soweit erforderlich und je nach Art des Arzneimittels, d) Dauer der Behandlung, falls diese festgelegt werden soll, e) Hinweise für den Fall der Überdosierung, der unterlassenen Einnahme oder Hinweise auf die Gefahr von unerwünschten Folgen des Absetzens, f) die ausdrückliche Empfehlung, bei Fragen zur Klärung der Anwendung den Arzt oder Apotheker zu befragen; 5. die Nebenwirkungen; zu ergreifende Gegenmaßnahmen sind, soweit dies nach dem jeweiligen Stand der wissenschaftlichen Erkenntnisse erforderlich ist, anzugeben; den Hinweis, dass der Patient aufgefordert werden soll, dem Arzt oder Apotheker jede Nebenwirkung mitzuteilen, die in der Packungsbeilage nicht aufgeführt ist; 6. einen Hinweis auf das auf der Verpackung angegebene Verfalldatum sowie a) Warnung davor, das Arzneimittel nach Ablauf dieses Datums anzuwenden, b) soweit erforderlich besondere Vorsichtsmaßnahmen für die Aufbewahrung und die Angabe der Haltbarkeit nach Öffnung des Behältnisses oder nach Herstellung der gebrauchsfertigen Zubereitung durch den Anwender, 101 c) soweit erforderlich Warnung vor bestimmten sichtbaren Anzeichen dafür, dass das Arzneimittel nicht mehr zu verwenden ist, d) vollständige qualitative Zusammensetzung nach Wirkstoffen und sonstigen Bestandteilen sowie quantitative Zusammensetzung nach Wirkstoffen unter Verwendung gebräuchlicher Bezeichnungen für jede Darreichungsform des Arzneimittels, § 10 Abs. 6 findet Anwendung, e) Darreichungsform und Inhalt nach Gewicht, Rauminhalt oder Stückzahl für jede Darreichungsform des Arzneimittels, f) Name und Anschrift des pharmazeutischen Unternehmers und, soweit vorhanden, seines örtlichen Vertreters, g) Name und Anschrift des Herstellers oder des Einführers, der das Fertigarzneimittel für das Inverkehrbringen freigegeben hat; 7. bei einem Arzneimittel, das unter anderen Bezeichnungen in anderen Mitgliedstaaten der Europäischen Union nach den Artikeln 28 bis 39 der Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel vom 6. November 2001 (ABl. EG Nr. L 311 S. 67), geändert durch die Richtlinien 2004/27/EG (ABl. EU Nr. L 136 S. 34) und 2004/24/EG vom 31. März 2004 (ABl. EU Nr. L 136 S. 85), für das Inverkehrbringen genehmigt ist, ein Verzeichnis der in den einzelnen Mitgliedstaaten genehmigten Bezeichnungen; 8. das Datum der letzten Überarbeitung der Packungsbeilage. 2Erläuternde Angaben zu den in Satz 1 genannten Begriffen sind zulässig. 3Sofern die Angaben nach Satz 1 in der Packungsbeilage zusätzlich in einer anderen Sprache wiedergegeben werden, müssen in dieser Sprache die gleichen Angaben gemacht werden. 4Satz 1 gilt nicht für Arzneimittel, die nach § 21 Abs. 2 Nr. 1 einer Zulassung nicht bedürfen. 5Weitere Angaben, die nicht durch eine Verordnung der Europäischen Gemeinschaft vorgeschrieben oder bereits nach einer solchen Verordnung zulässig sind, sind zulässig, soweit sie mit der Anwendung des 102 Arzneimittels im Zusammenhang stehen, für die gesundheitliche Aufklärung der Patienten wichtig sind und den Angaben nach § 11a nicht widersprechen. 6Bei den Angaben nach Satz 1 Nr. 3 Buchstabe a bis d ist, soweit dies nach dem jeweiligen Stand der wissenschaftlichen Erkenntnisse erforderlich ist, auf die besondere Situation bestimmter Personengruppen, wie Kinder, Schwangere oder stillende Frauen, ältere Menschen oder Personen mit spezifischen Erkrankungen einzugehen; ferner sind, soweit erforderlich, mögliche Auswirkungen der Anwendung auf die Fahrtüchtigkeit oder die Fähigkeit zur Bedienung bestimmter Maschinen anzugeben. (1a) Ein Muster der Packungsbeilage und geänderter Fassungen ist der zuständigen Bundesoberbehörde unverzüglich zu übersenden, soweit nicht das Arzneimittel von der Zulassung oder Registrierung freigestellt ist. (2) Es sind ferner in der Packungsbeilage Hinweise auf Bestandteile, deren Kenntnis für eine wirksame und unbedenkliche Anwendung des Arzneimittels erforderlich ist, und für die Verbraucher bestimmte Aufbewahrungshinweise anzugeben, soweit dies nach dem jeweiligen Stand der wissenschaftlichen Erkenntnisse erforderlich oder durch Auflage der zuständigen Bundesoberbehörde nach § 28 Abs. 2 Nr. 2 angeordnet oder durch Rechtsverordnung vorgeschrieben ist. (2a) Bei radioaktiven Arzneimitteln gilt Absatz 1 entsprechend mit der Maßgabe, dass die Vorsichtsmaßnahmen aufzuführen sind, die der Verwender und der Patient während der Zubereitung und Verabreichung des Arzneimittels zu ergreifen haben, sowie besondere Vorsichtsmaßnahmen für die Entsorgung des Transportbehälters und nicht verwendeter Arzneimittel. (3) 1Bei Arzneimitteln, die in das Register für homöopathische Arzneimittel eingetragen sind, gilt Absatz 1 entsprechend mit der Maßgabe, dass die in § 10 Abs. 4 vorgeschriebenen Angaben, ausgenommen die Angabe der Chargenbezeichnung, des Verfalldatums und des bei Mustern vorgeschriebenen Hinweises, zu machen sind sowie der Name und die Anschrift des Herstellers anzugeben sind, der das Fertigarzneimittel für das Inverkehrbringen freigegeben hat, soweit es sich dabei nicht um den pharmazeutischen Unternehmer handelt. 2Satz 1 gilt entsprechend für Arzneimittel, die nach § 38 Abs. 1 Satz 3 von der Registrierung freigestellt sind. 103 (3a) Bei Sera gilt Absatz 1 entsprechend mit der Maßgabe, dass auch die Art des Lebewesens, aus dem sie gewonnen sind, bei Virusimpfstoffen das Wirtssystem, das zur Virusvermehrung gedient hat, und bei Arzneimitteln aus humanem Blutplasma zur Fraktionierung das Herkunftsland des Blutplasmas anzugeben ist. (3b) 1Bei traditionellen pflanzlichen Arzneimitteln nach § 39a gilt Absatz 1 entsprechend mit der Maßgabe, dass bei den Angaben nach Absatz 1 Satz 1 Nr. 2 anzugeben ist, dass das Arzneimittel ein traditionelles Arzneimittel ist, das ausschließlich auf Grund langjähriger Anwendung für das Anwendungsgebiet registriert ist. 2Zusätzlich ist in die Packungsbeilage der Hinweis nach § 10 Abs. 4a Satz 1 Nr. 2 aufzunehmen. (3c) Der Inhaber der Zulassung hat dafür zu sorgen, dass die Packungsbeilage auf Ersuchen von Patientenorganisationen bei Arzneimitteln, die zur Anwendung bei Menschen bestimmt sind, in Formaten verfügbar ist, die für blinde und sehbehinderte Personen geeignet sind. (3d) 1Bei Heilwässern können unbeschadet der Verpflichtungen nach Absatz 2 die Angaben nach Absatz 1 Satz 1 Nr. 3 Buchstabe b, Nr. 4 Buchstabe e und f, Nr. 5, soweit der dort angegebene Hinweis vorgeschrieben ist, und Nr. 6 Buchstabe c entfallen. 2Ferner kann bei Heilwässern von der in Absatz 1 vorgeschriebenen Reihenfolge abgewichen werden. (4) 1Bei Arzneimitteln, die zur Anwendung bei Tieren bestimmt sind, gilt Absatz 1 mit der Maßgabe, dass anstelle der Angaben nach Absatz 1 Satz 1 die folgenden Angaben nach Maßgabe von Absatz 1 Satz 2 und 3 in der nachstehenden Reihenfolge allgemein verständlich in deutscher Sprache, in gut lesbarer Schrift und in Übereinstimmung mit den Angaben nach § 11a gemacht werden müssen: 1. Name und Anschrift des pharmazeutischen Unternehmers, soweit vorhanden seines örtlichen Vertreters, und des Herstellers, der das Fertigarzneimittel für das Inverkehrbringen freigegeben hat; 2. Bezeichnung des Arzneimittels, gefolgt von der Angabe der Stärke und Darreichungsform; die gebräuchliche Bezeichnung des Wirkstoffes wird aufgeführt, wenn das Arzneimittel nur einen einzigen Wirkstoff enthält und sein Name ein Phantasiename ist; bei einem Arzneimittel, das unter 104 anderen Bezeichnungen in anderen Mitgliedstaaten der Europäischen Union nach den Artikeln 31 bis 43 der Richtlinie 2001/82/EG des Europäischen Parlaments und des Rates zur Schaffung eines Gemeinschaftskodexes für Tierarzneimittel vom 6. November 2001 (ABl. EG Nr. L 311 S. 1), geändert durch die Richtlinie 2004/28/EG (ABl. EU Nr. L 136 S. 58), für das Inverkehrbringen genehmigt ist, ein Verzeichnis der in den einzelnen Mitgliedstaaten genehmigten Bezeichnungen; 3. Anwendungsgebiete; 4. Gegenanzeigen und Nebenwirkungen, soweit diese Angaben für die Anwendung notwendig sind; können hierzu keine Angaben gemacht werden, so ist der Hinweis „keine bekannt" zu verwenden; der Hinweis, dass der Anwender oder Tierhalter aufgefordert werden soll, dem Tierarzt oder Apotheker jede Nebenwirkung mitzuteilen, die in der Packungsbeilage nicht aufgeführt ist; 5. Tierarten, für die das Arzneimittel bestimmt ist, Dosierungsanleitung für jede Tierart, Art und Weise der Anwendung, soweit erforderlich Hinweise für die bestimmungsgemäße Anwendung; 6. Wartezeit, soweit es sich um Arzneimittel handelt, die zur Anwendung bei Tieren bestimmt sind, die der Gewinnung von Lebensmitteln dienen; ist die Einhaltung einer Wartezeit nicht erforderlich, so ist dies anzugeben; 7. besondere Vorsichtsmaßnahmen für die Aufbewahrung; 8. besondere Warnhinweise, insbesondere soweit dies durch Auflage der zuständigen Bundesoberbehörde angeordnet oder durch Rechtsverordnung vorgeschrieben ist; 9. soweit dies nach dem jeweiligen Stand der wissenschaftlichen Erkenntnisse erforderlich ist, besondere Vorsichtsmaßnahmen für die Beseitigung von nicht verwendeten Arzneimitteln oder sonstige besondere Vorsichtsmaßnahmen, um Gefahren für die Umwelt zu vermeiden. 2Das Datum der letzten Überarbeitung der Packungsbeilage ist anzugeben. 3Bei ArzneimittelVormischungen sind Hinweise für die sachgerechte Herstellung der Fütterungsarzneimittel und Angaben über die Dauer der Haltbarkeit der Fütterungsarzneimittel aufzunehmen. 4Weitere 105 Angaben sind zulässig, soweit sie mit der Anwendung des Arzneimittels im Zusammenhang stehen, für den Anwender oder Tierhalter wichtig sind und den Angaben nach § 11a nicht widersprechen. 5Bei Arzneimitteln zur Anwendung bei Tieren, die in das Register für homöopathische Arzneimittel eingetragen sind, oder die nach § 38 Absatz 1 Satz 3 oder nach § 60 Absatz 1 von der Registrierung freigestellt sind, gelten die Sätze 1, 2 und 4 entsprechend mit der Maßgabe, dass die in § 10 Absatz 4 vorgeschriebenen Angaben mit Ausnahme der Angabe der Chargenbezeichnung, des Verfalldatums und des bei Mustern vorgeschriebenen Hinweises zu machen sind. 6Bei traditionellen pflanzlichen Arzneimitteln zur Anwendung bei Tieren ist zusätzlich zu den Hinweisen nach Absatz 3b Satz 1 ein der Anwendung bei Tieren entsprechender Hinweis nach § 10 Absatz 4a Satz 1 Nummer 2 anzugeben. (5) 1Können die nach Absatz 1 Satz 1 Nr. 3 Buchstabe a und c sowie Nr. 5 vorgeschriebenen Angaben nicht gemacht werden, so ist der Hinweis „keine bekannt" zu verwenden. 2Werden auf der Packungsbeilage weitere Angaben gemacht, so müssen sie von den Angaben nach den Absätzen 1 bis 4 deutlich abgesetzt und abgegrenzt sein. (6) 1Die Packungsbeilage kann entfallen, wenn die nach den Absätzen 1 bis 4 vorgeschriebenen Angaben auf dem Behältnis oder auf der äußeren Umhüllung stehen. 2Absatz 5 findet entsprechende Anwendung. (7) 1Aus Fertigarzneimitteln entnommene Teilmengen, die zur Anwendung bei Menschen bestimmt sind, dürfen nur zusammen mit einer Ausfertigung der für das Fertigarzneimittel vorgeschriebenen Packungsbeilage abgegeben werden. 2Absatz 6 Satz 1 gilt entsprechend. 3Abweichend von Satz 1 müssen bei der im Rahmen einer Dauermedikation erfolgenden regelmäßigen Abgabe von aus Fertigarzneimitteln entnommenen Teilmengen in neuen, patientenindividuell zusammengestellten Blistern Ausfertigungen der für die jeweiligen Fertigarzneimittel vorgeschriebenen Packungsbeilagen erst dann erneut beigefügt werden, wenn sich diese gegenüber den zuletzt beigefügten geändert haben. 106 Skabelon fra BfArM for produkter med virkestoffet ”Diltiazemhydrochlorid” 8000127 M0 M1 M2 Stand: 30.03.2004 Nr.: diltiazem_oral_pal_2004-03-30_009a Diltiazemhydrochlorid Tabletten / Filmtabletten Retardtabletten / Retardkapseln Stoff Darreichungsform 60 mg 90 mg / 240 mg / 300 mg / 360 mg Stärke PA Anlage PB Wortlaut der für die Packungsbeilage vorgesehenen Angaben PCX Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage / Gebrauchsinformation sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker. Dieses Arzneimittel wurde Ihnen persönlich verschrieben und darf nicht an Dritte weiter gegeben werden. Es kann anderen Menschen schaden, auch wenn diese das selbe Krankheitsbild haben wie Sie. Diese Packungsbeilage beinhaltet: 1. Was ist /.../ und wofür wird es angewendet? 2. Was müssen Sie vor der Einnahme von /.../ beachten? 3. Wie ist /.../ einzunehmen? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist /.../ aufzubewahren? [Ggf.] 6. Weitere Angaben PE /.../ [Bezeichnung des Arzneimittels, Stärke Darreichungsform] 107 PF Wirkstoff: Diltiazemhydrochlorid PG Der arzneilich wirksame Bestandteil ist Diltiazemhydrochlorid. /Für Tabletten/Filmtabletten 60 mg: 1 Tablette/Filmtablette enthält 60 mg Diltiazemhydrochlorid./ /Für Retardtabletten/Retardkapseln 90 mg / 240 mg / 300 mg / 360 mg: 1 Retardtablette/Retardkapsel enthält 90 mg / 240 mg / 300 mg / 360 mg Diltiazemhydrochlorid./ PH Die sonstigen Bestandteile sind: [Angaben entsprechend der Zusammensetzung] P4 [Darreichungsform und Inhalt / für den Patienten erhältliche Packungsgrößen] /.../ ist in Packungen mit ... Tabletten / Filmtabletten / Retardtabletten / Retardkapseln erhältlich. PC1 1. WAS IST /.../ UND WOFÜR WIRD ES ANGEWENDET? PI 1.1 /.../ ist ein Mittel zur Behandlung von Herzerkrankungen, die mit einer unzureichenden Sauerstoffversorgung des Herzmuskels einhergehen, sowie zur Behandlung von Bluthochdruck. PD 1.2 von: [Name, Anschrift des pharmazeutischen Unternehmers, optional Telefon- und Telefaxnummer, E-Mail-Adresse und Internet-Adresse] P5 hergestellt von: [Name, Anschrift des Herstellers, optional Telefon- und Telefaxnummer, E-Mail-Adresse und Internet-Adresse; kann entfallen, wenn mit pharmazeutischem Unternehmer identisch] PK 1.3 /.../ wird angewendet bei Beschwerden (z.B. Schmerzen oder Engegefühl im Brustbereich) bei Zuständen mit unzureichender Sauerstoffversorgung des Herzmuskels (Angina pectoris): bei Belastung: chronisch stabile Angina pectoris (Belastungsangina) 108 in Ruhe: instabile Angina pectoris (Crescendoangina, Ruheangina) durch Gefäßverkrampfung: vasospastische Angina pectoris (Prinzmetal-Angina, Variant Angina). Bluthochdruck /Zusätzlich für Retardtabletten/Retardkapseln 240 mg / 300 mg / 360 mg: /.../ darf nur bei Patienten, die mit niedrigeren Einzel- und Tagesdosen nicht ausreichend behandelbar sind, nach sorgfältiger Nutzen-Risiko-Abwägung durch den Arzt angewendet werden./ PC2 2. WAS MÜSSEN SIE VOR DER EINNAHME VON /.../ BEACHTEN? PL /.../ darf nicht eingenommen werden 2.1 - wenn Sie überempfindlich (allergisch) gegenüber dem Wirkstoff Diltiazemhydrochlorid oder einem der sonstigen Bestandteile von /.../ sind wenn bei Ihnen höhergradige Erregungsleitungsstörungen im Herzen zwischen Sinusknoten und Herzvorhof (SA-Block II. oder III. Grades) auftreten wenn bei Ihnen höhergradige Erregungsleitungsstörungen im Herzen zwischen Herzvorhof und Herzkammern (AV-Block II. oder III. Grades) auftreten wenn Sie unter einem Sinusknotensyndrom (Herzrhythmusstörungen infolge gestörter Funktion des Sinusknotens) leiden, z.B. verlangsamter Herzschlag auf weniger als 60 Schläge pro Minute oder im Wechsel auftretender verlangsamter oder beschleunigter Herzschlag oder Erregungsleitungsstörungen im Herzen zwischen Sinusknoten und Herzvorhof oder Ausfall der Reizbildung im Sinusknoten (Sinusbradykardie, Bradykardie-Tachykardie-Syndrom, SA-Blockierungen oder Sinusarrest) wenn Sie einen Schock erlitten haben wenn Sie einen akuten Herzinfarkt mit Komplikationen, z.B. verlangsamter Herzschlag (Bradykardie), ausgeprägter Blutdruckabfall (Hypotonie) oder eine Herzmuskelschwäche des linken Herzens (Linksherzinsuffizienz), erlitten haben wenn Sie unter einer Herzmuskelschwäche (manifeste Herzinsuffizienz) leiden wenn Sie unter Vorhofflimmern/-flattern (Herzrhythmusstörungen infolge einer krankhaft 109 erhöhten Vorhoferregung) und gleichzeitigem Vorliegen eines WPW-Syndroms (anfallsweise auftretender beschleunigter Herzschlag durch beschleunigte Erregungsleitung zwischen Herzvorhof und Herzkammer über ein zusätzlich vorhandenes Erregungsleitungssystem) leiden: es besteht dann ein erhöhtes Risiko für die Auslösung eines beschleunigten Herzschlags in den Herzkammer (Kammertachykardie) wenn Sie einen Ruhepuls unter 50 Schlägen pro Minute (Bradykardie) haben wenn Sie schwanger sind oder stillen (siehe Abschnitt 2.2). Hinweis: Die gleichzeitige intravenöse Gabe von Betarezeptorenblockern sollte während der Behandlung mit /.../ unterbleiben (siehe Abschnitt 2.3). PV 2.2 Besondere Vorsicht bei der Einnahme von /.../ ist erforderlich Im folgenden wird beschrieben, wann Sie /.../ nur unter bestimmten Bedingungen und nur mit besonderer Vorsicht anwenden dürfen. Befragen Sie hierzu bitte Ihren Arzt. Dies gilt auch, wenn diese Angaben bei Ihnen früher einmal zutrafen. wenn bei Ihnen leichtere Erregungsleitungsstörungen im Herzen zwischen Sinusknoten und Herzvorhof (SABlock I. Grades), zwischen Herzvorhof und Herzkammern (AV-Block I. Grades) oder innerhalb der Herzkammern (intraventrikulären Leitungsstörungen, z.B. Linksoder Rechtsschenkelblock) auftreten wenn Sie niedrigen Blutdruck (systolisch unter 90 mmHg) haben wenn Sie älter als 60 Jahre sind (die Ausscheidung von /.../ ist dann verzögert) wenn Sie vorgeschädigte Nieren haben (siehe Abschnitt 3.2) wenn Sie unter Leberfunktionsstörungen leiden (siehe Abschnitt 3.2) wenn Sie gleichzeitig mit Betarezeptorenblockern in Tablettenform behandelt werden (siehe Abschnitt 2.3). Hinweis: Bei gleichzeitiger Behandlung mit /.../ und Carbamazepin, 110 Midazolam, Triazolam, Alfentanil, Theophyllin, Ciclosporin A, Digoxin oder Digitoxin sollte vorsorglich auf Symptome einer Überdosierung dieser Arzneimittel geachtet werden (siehe Abschnitt 2.3). Die Behandlung des Bluthochdruckes mit diesem Arzneimittel bedarf der regelmäßigen ärztlichen Kontrolle. PV2 b) Ältere Menschen Bei älteren Menschen (über 60 Jahre) muss /.../ vorsichtig dosiert werden (siehe Abschnitt 3.2). Männer Aufgrund von Laborexperimenten können bei längerfristiger Verabreichung von Diltiazemhydrochlorid vorrübergehende Störungen der männlichen Befruchtungsfähigkeit nicht ausgeschlossen werden. PV3 c) Schwangerschaft Es liegen nur unzureichende Erfahrungen über eine Anwendung von Diltiazemhydrochlorid an Schwangeren vor. In zwei Fällen wurde nach der Anwendung von Diltiazemhydrochlorid im 1. Schwangerschaftsdrittel über Fehlbildungen am Herzen bei Neugeborenen berichtet. Tierstudien mit Diltiazemhydrochlorid haben eine fruchtschädigende Wirkung bei den Nachkommen gezeigt. Daher dürfen Sie Diltiazemhydrochlorid in der Schwangerschaft nicht einnehmen (siehe Abschnitt 2.1). Wenn Sie im gebärfähigen Alter sind, ist vor einer Diltiazemhydrochlorid-Behandlung eine mögliche Schwangerschaft durch Ihren Arzt auszuschließen. Während der Behandlung mit Diltiazemhydrochlorid sollen Sie geeignete Maßnahmen zur Schwangerschaftsverhütung treffen. PV4 d) Stillzeit Da Diltiazemhydrochlorid in die Muttermilch übergeht, dürfen Sie Diltiazemhydrochlorid in der Stillzeit nicht einnehmen. Hält Ihr Arzt eine Anwendung von Diltiazemhydrochlorid in der Stillzeit für unumgänglich, müssen Sie abstillen (siehe Abschnitt 2.1). PV5 e) Verkehrstüchtigkeit und das Bedienen von Maschinen: Dieses Arzneimittel kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen soweit verändern, dass 111 die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol. PN 2.3 Wechselwirkungen mit anderen Arzneimitteln Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen bzw. vor kurzem eingenommen haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Die Wirkung nachfolgend genannter Arzneistoffe bzw. Präparategruppen kann bei gleichzeitiger Behandlung mit /.../ beeinflusst werden. Verstärkung der Wirkung bis hin zu erhöhtem Nebenwirkungsrisiko von: anderen gleichzeitig verabreichten blutdrucksenkenden Arzneimitteln Arzneimitteln, die die Herzkraft ungünstig beeinflussen, den Herzschlag verlangsamen und/oder die Erregungsleitung im Herzen (AV-Überleitung) hemmen, wie z.B. Betarezeptorenblocker, Arzneimittel gegen Herzrhythmusstörungen (Antiarrhythmika) oder Arzneimittel zur Erhöhung der Herzkraft (Herzglykoside: z.B. Digoxin, Digitoxin): Verstärkung der Wirkung ist möglich, z.B. höhergradige Erregungsleitungsstörungen im Herzen (AVBlockierung), Verlangsamung des Herzschlags, verstärkte Blutdrucksenkung sowie evtl. das Auftreten einer Herzmuskelschwäche (Herzinsuffizienz). Deshalb ist bei gleichzeitiger Anwendung von Diltiazemhydrochlorid und diesen Arzneimitteln eine sorgfältige Überwachung des Patienten angezeigt. Betarezeptorenblocker sollten während der Behandlung mit Diltiazemhydrochlorid nicht intravenös verabreicht werden (siehe Abschnitt 2.1). Die Blutkonzentrationen von Arzneimitteln zur Senkung des Cholesterinspiegels (HMG-CoA-Reduktase-Hemmer, sog. Statine, wie Simvastatin, Lovastatin oder Atorvastatin) können durch Diltiazemhydrochlorid erhöht werden. Dadurch können die Wirkungen bzw. Nebenwirkungen dieser Arzneimittel (Statine) verstärkt werden. Carbamazepin (Arzneimittel gegen Krampfanfälle des Gehirns), Midazolam und Triazolam (Schlafmittel), 112 Alfentanil (Narkosemittel), Theophyllin (Arzneimittel gegen Atemwegsverengung), Ciclosporin A (Arzneimittel zur Verringerung von Transplantatabstoßungen, das auch in der Rheumabehandlung eingesetzt wird), Digoxin und Digitoxin (Arzneimittel zur Stärkung der Herzkraft): die Konzentration dieser Arzneimittel im Blut kann ansteigen. Deshalb sollte vorsorglich auf die Symptome einer Überdosierung dieser Arzneimittel geachtet werden, ggf. die Konzentration dieser Arzneimittel im Blut bestimmt und falls notwendig, eine Verringerung der Dosis des jeweiligen Wirkstoffs vorgenommen werden. Inhalationsnarkosemittel (Inhalationsanästhetika): in seltenen Fällen kann es zu einem Abfall des Blutdrucks (Hypotonie) oder einer Verlangsamung des Herzschlags (Bradykardie) kommen. Nifedipin: Diltiazemhydrochlorid vermindert die Ausscheidungsrate (Clearance) von Nifedipin. Bei gleichzeitiger Behandlung ist eine sorgfältige Überwachung der Patienten, evtl. eine Dosisreduktion von Nifedin angezeigt. Bei gleichzeitiger Gabe von /.../ und Cimetidin oder Ranitidin (Arzneimittel gegen Magen- oder Zwölffingerdarmgeschwüre) kann es zu einer Verstärkung der Wirkung von /.../ kommen. Abschwächung der Wirkung: Bei gleichzeitiger Behandlung mit Diazepam (Beruhigungsmittel) ist eine Abnahme der Konzentration von /.../ im Blut möglich. /.../ sollte daher nicht zusammen mit einem der o.g. Stoffe angewendet werden, ohne dass der Arzt ausdrücklich die Anweisung gegeben hat. Hinweis: Nach Transplantation besonders zu beachten: Der Plasmaspiegel von Ciclosporin A kann unter gleichzeitiger Behandlung mit /.../ ansteigen. Unter einer Dauertherapie mit Ciclosporin A und Diltiazemhydrochlorid (oral) ist für die Konstanthaltung des Ciclosporin-A-Spiegels eine Reduktion der Ciclosporin-A-Dosierung erforderlich. Die Dosisreduktion hat individuell unter Kontrolle des Ciclosporin-ASpiegels mit einer spezifischen Methode(z.B. mittels monoklonaler Antikörper) zu erfolgen. PC3 3. WIE IST /../ EINZUNEHMEN? 113 PMX Nehmen Sie /.../ immer genau nach der Anweisung des Arztes ein. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind. 3.1 Art der Anwendung Zum Einnehmen 3.2 Falls vom Arzt nicht anders verordnet, ist die übliche Dosis: /Für Tabletten/Filmtabletten 60 mg: Koronare Herzkrankheit 3-mal täglich 1 Tablette/Filmtablette /.../ (entsprechend 180 mg Diltiazemhydrochlorid). Bei unzureichender Wirkung kann die Dosis vom Arzt schrittweise auf maximal 6 Tabletten/Filmtabletten /.../ (entsprechend 360 mg Diltiazemhydrochlorid) pro Tag erhöht werden. Bei Langzeitbehandlung und andauernder Beschwerdefreiheit wird empfohlen, dass der Arzt in Abständen von 2-3 Monaten überprüft, ob die Tagesdosis reduziert werden kann. Bluthochdruck 3-mal täglich 1 Tablette/Filmtablette /.../ (entsprechend 180 mg Diltiazemhydrochlorid). Bei unzureichender Blutdrucksenkung kann die Dosis vom Arzt schrittweise auf maximal 6 Tabletten/Filmtabletten /.../ (entsprechend 360 mg Diltiazemhydrochlorid) pro Tag erhöht werden. Nach Erreichen einer langfristigen ausreichenden blutdrucksenkenden Wirkung wird empfohlen, dass der Arzt die Möglichkeit einer Dosisverringerung überprüft./ /Für Retardtabletten/Retardkapsel 90 mg: Koronare Herzkrankheit 2-mal täglich 1 Retardtablette/Retardkapsel /.../ (entsprechend 180 mg Diltiazemhydrochlorid). Bei unzureichender Wirkung kann die Dosis vom Arzt schrittweise auf maximal 4 Retardtabletten/Retardkapseln 114 /.../ (entsprechend 360 mg Diltiazemhydrochlorid) pro Tag erhöht werden. Bei Langzeitbehandlung und andauernder Beschwerdefreiheit wird empfohlen, dass der Arzt in Abständen von 2-3 Monaten überprüft, ob die Tagesdosis reduziert werden kann. Bluthochdruck 2-mal täglich 1 Retardtablette/Retardkapsel /.../ (entsprechend 180 mg Diltiazemhydrochlorid). Bei unzureichender Blutdrucksenkung kann die Dosis vom Arzt schrittweise auf maximal 4 Retardtabletten/Retardkapseln /.../ (entsprechend 360 mg Diltiazemhydrochlorid) pro Tag erhöht werden. Nach Erreichen einer langfristigen ausreichenden blutdrucksenkenden Wirkung wird empfohlen, dass der Arzt die Möglichkeit einer Dosisverringerung überprüft./ /Für Retardtabletten/Retardkapseln 240 mg: Die Behandlung soll mit niedrigen Dosen zur Ermittlung der individuellen Tagesdosis begonnen werden. Hierfür stehen niedrigere retardierte Dosisstärken zur Verfügung. /.../ darf nur bei Patienten, die mit niedrigeren Einzel- und Tagesdosen nicht ausreichend behandelbar sind, nach sorgfältiger Nutzen-Risiko-Abwägung durch den Arzt angewendet werden. Koronare Herzkrankheit 1-mal täglich 1 Retardtablette/Retardkapsel /.../ (entsprechend 240 mg Diltiazemhydrochlorid). Bei unzureichender Wirkung kann die Dosis vom Arzt schrittweise auf maximal 360 mg Diltiazemhydrochlorid pro Tag erhöht werden. Dafür stehen andere Dosisstärken zur Verfügung. Bei Langzeitbehandlung und andauernder Beschwerdefreiheit wird empfohlen, dass der Arzt in Abständen von 2-3 Monaten überprüft, ob die Tagesdosis reduziert werden kann. Bluthochdruck 1-mal täglich 1 Retardtablette/Retardkapsel /.../ (entsprechend 240 mg Diltiazemhydrochlorid). 115 Bei unzureichender Blutdrucksenkung kann die Dosis vom Arzt schrittweise auf maximal 360 mg Diltiazemhydrochlorid pro Tag erhöht werden. Dafür stehen andere Dosisstärken zur Verfügung. Nach Erreichen einer langfristigen ausreichenden blutdrucksenkenden Wirkung wird empfohlen, dass der Arzt die Möglichkeit einer Dosisverringerung überprüft./ /Für Retardtabletten/Retardkapseln 300 mg: Die Behandlung soll mit niedrigen Dosen zur Ermittlung der individuellen Tagesdosis begonnen werden. Hierfür stehen niedrigere retardierte Dosisstärken zur Verfügung. /.../ darf nur bei Patienten, die mit niedrigeren Einzel- und Tagesdosen nicht ausreichend behandelbar sind, nach sorgfältiger Nutzen-Risiko-Abwägung durch den Arzt angewendet werden. Koronare Herzkrankheit 1-mal täglich 1 Retardtablette/Retardkapsel /.../ (entsprechend 300 mg Diltiazemhydrochlorid). Bei unzureichender Wirkung kann die Dosis vom Arzt auf maximal 360 mg Diltiazemhydrochlorid pro Tag erhöht werden. Dafür stehen andere Dosisstärken zur Verfügung. Bei Langzeitbehandlung und andauernder Beschwerdefreiheit wird empfohlen, dass der Arzt in Abständen von 2-3 Monaten überprüft, ob die Tagesdosis reduziert werden kann. Bluthochdruck 1-mal täglich 1 Retardtablette/Retardkapsel /.../ (entsprechend 300 mg Diltiazemhydrochlorid). Bei unzureichender Blutdrucksenkung kann die Dosis vom Arzt auf maximal 360 mg Diltiazemhydrochlorid pro Tag erhöht werden. Dafür stehen andere Dosisstärken zur Verfügung. Nach Erreichen einer langfristigen ausreichenden blutdrucksenkenden Wirkung wird empfohlen, dass der Arzt die Möglichkeit einer Dosisverringerung überprüft./ /Für Retardtabletten/Retardkapseln 360 mg: 116 Die Behandlung soll mit niedrigen Dosen zur Ermittlung der individuellen Tagesdosis begonnen werden. Hierfür stehen niedrigere retardierte Dosisstärken zur Verfügung. /.../ darf nur bei Patienten, die mit niedrigeren Einzel- und Tagesdosen nicht ausreichend behandelbar sind, nach sorgfältiger Nutzen-Risiko-Abwägung durch den Arzt angewendet werden. Koronare Herzkrankheit 1-mal täglich 1 Retardtablette/Retardkapsel /.../ (entsprechend 360 mg Diltiazemhydrochlorid). 1-mal täglich 1 Retardtablette/Retardkapsel /.../ stellt gleichzeitig die Tageshöchstdosis für Diltiazemhydrochlorid dar. Bei Langzeitbehandlung und andauernder Beschwerdefreiheit wird empfohlen, dass der Arzt in Abständen von 2-3 Monaten überprüft, ob die Tagesdosis reduziert werden kann. Bluthochdruck 1-mal täglich 1 Retardtablette/Retardkapsel /.../ (entsprechend 360 mg Diltiazemhydrochlorid). 1-mal täglich 1 Retardtablette/Retardkapsel /.../ stellt gleichzeitig die Tageshöchstdosis für Diltiazemhydrochlorid dar. Nach Erreichen einer langfristigen ausreichenden blutdrucksenkenden Wirkung wird empfohlen, dass der Arzt die Möglichkeit einer Dosisverringerung überprüft./ Hinweis: Bei Patienten mit Leber und/oder Nierenfunktionsstörungen sowie bei älteren Patienten muss /.../ vorsichtig dosiert werden. Nehmen Sie die Tabletten/Filmtabletten/Retardtabletten/ Retardkapseln bitte unzerkaut am besten nach den Mahlzeiten mit ausreichend Flüssigkeit (z.B. 1 Glas Wasser) ein. Eine Dosiserhöhung darf nur auf Anweisung des Arztes erfolgen. Eine Unterbrechung oder Änderung der Dosierung darf nur auf ärztliche Anweisung erfolgen. 117 Die Behandlung mit /.../ ist in der Regel eine Langzeittherapie. Ein Absetzen der Therapie mit /.../ sollte besonders bei Patienten mit Angina pectoris nicht abrupt, sondern ausschleichend erfolgen. Bitte sprechen Sie mit Ihrem Arzt, wenn Sie den Eindruck haben, dass die Wirkung von /.../ zu stark oder zu schwach ist. PW 3.3 Wenn Sie eine größere Menge /.../ eingenommen haben, als Sie sollten: Eine Überdosierung von Diltiazemhydrochlorid kann zu starkem Blutdruckabfall (Hypotonie), Verlangsamung des Herzschlages (Bradykardie), Herzmuskelschwäche (Herzinsuffizienz) und Erregungsleitungsstörungen im Herzen (AV-Block) bis zum Herz-Kreislauf-Stillstand führen. Bei Verdacht auf eine Überdosierung mit /.../ benachrichtigen Sie bitte sofort einen Arzt/Notarzt. Dieser kann entsprechend der Schwere der Überdosierung/Vergiftung über die gegebenenfalls erforderlichen Maßnahmen entscheiden. 3.4 Wenn Sie die Einnahme von /.../ vergessen haben: Nehmen Sie beim nächsten Mal nicht die doppelte Dosis von /.../ ein, wenn Sie die vorherige Einnahme vergessen haben, sondern führen Sie die Einnahme, wie in der Dosierungsanleitung beschrieben bzw. vom Arzt verordnet, fort. 3.5 Auswirkungen, wenn die Behandlung mit /.../ abgebrochen wird: Bitte unterbrechen oder beenden Sie die Behandlung mit /.../ nicht, ohne dies vorher mit Ihrem Arzt abgesprochen zu haben. Eine Beendigung der Behandlung mit /.../ sollte besonders bei Patienten mit Angina pectoris nicht abrupt, sondern ausschleichend erfolgen. PC4 4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? PM Wie alle Arzneimittel kann /.../ Nebenwirkungen haben. 118 Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrundegelegt: Sehr häufig: mehr als 1 von 10 Behandelten häufig: weniger als 1 von 10, aber mehr als 1 von 100 Behandelten Selten: weniger als 1 von 1.000, aber mehr als 1 von 10.000 Behandelten Gelegentlich: weniger als 1 von 1oo, aber mehr als 1 von 1.000 Behandelten Sehr selten: weniger als 1 von 10.000 Behandelten, einschließlich Einzelfälle 4.1 Nebenwirkungen Störungen des Nervensysteme: Häufig: Kopfschmerzen, Müdigkeit, Schwindel und Schwächegefühl. Gelegentlich: Schlaflosigkeit, Sinnestäuschungen (Halluzinationen) und depressive Verstimmungszustände. Störungen der Haut, Schleimhaut und des Bindegewebes: Häufig: Allergische Hautreaktionen wie Hautrötungen, Juckreiz und Hautausschläge (Exantheme). Sehr selten: Schwere allergische Hautreaktionen (wie Erythema exsudativum multiforme, StevensJohnson-Syndrom, Lupus-erythematodesähnliche Hautveränderungen). Sehr selten können unter längerer Behandlung Zahnfleischveränderungen (Gingivahyperplasien) auftreten (Mundhygiene beachten), die sich nach Absetzen von /.../ völlig zurückbilden. Störungen des Magen-Darm-Bereiches: Gelegentlich: Magen-Darm-Beschwerden (Übelkeit, Erbrechen, Sodbrennen, Durchfall, Verstopfung). Störungen der Leber: Gelegentlich: Wieder zurückgehender (reversibler) Anstieg der Leberenzyme (SGOT, SGPT, gamma-GT, LDH und alkalischen Phosphatase) als Zeichen einer akuten Leberschädigung. Es empfiehlt sich daher, die Leberparameter in regelmäßigen Abständen zu überwachen. Störungen des Herz-Kreislauf-Systems: 119 Häufig: Sehr selten: Wasseransammlungen in den Knöcheln bzw. Beinen (Knöchel- bzw. Beinödeme). Besonders im höheren Dosisbereich und/oder bei entsprechender Vorschädigung des Herzens: Verlangsamung des Herzschlages (Bradykardie), Erregungsleitungsstörungen des Herzen (SA- und AV-Blockierungen), stärkerer Blutdruckabfall (Hypotonie), Herzklopfen, Ohnmachtsanfälle (Synkopen), Abnahme der vom Herzen pro Minute gepumpten Blutmenge (Herzminutenvolumenabnahme) oder Herzmuskelschwäche (Herzinsuffizienz). Störungen des Blut- und Lymphsystems: Sehr selten: Schwere allergische Reaktionen wie Vermehrung der Anzahl bestimmter weißer Blutkörperchen im Blut (Eosinophilie)und Lymphknotenschwellung (Lymphadenopathie). Störungen der Fortpflanzungsorgane: Sehr selten: Potenzstörungen. Stoffwechselstörungen: Sehr selten: Erhöhung des Blutzuckers (Hyperglykämie). Dies sollte vor allem bei Patienten mit Diabetes mellitus beachtet werden. 4.2 Gegenmaßnahmen Sollten Sie die oben genannten Nebenwirkungen bei sich beobachten, soll /.../ nicht nochmals eingenommen werden. Benachrichtigen Sie Ihren Arzt, damit er über den Schweregrad und die gegebenenfalls erforderlichen Maßnahmen entscheiden kann. 4.3 PC5 5. Informieren Sie Ihren Arzt oder Apotheker, wenn Sie Nebenwirkungen bemerken, die nicht in dieser Packungsbeilage aufgeführt sind. WIE IST /.../ AUFZUBEWAHREN? Arzneimittel für Kinder unzugänglich aufbewahren. PZ Sie dürfen das Arzneimittel nach dem auf dem [Packmittel] angegebenen Verfallsdatum nicht mehr verwenden. P1 <Hinweis auf Haltbarkeit nach Anbruch oder Zubereitung> P2 < Aufbewahrungsbedingungen :> 120 P9 <Sie dürfen /.../ nicht verwenden, wenn Sie folgendes bemerken: {Beschreibung der sichtbaren Anzeichen von Nichtverwendbarkeit}> P6 Stand der Information: PC6 6. Weitere Angaben Oversigt over brugen af personlige pronominer Indlægsseddel Sie/Ihnen Carvedilol Hexal 12,5 mg Carvedilol Ratiopharm 12,5 mg 34 85 Tabel 2 Antal ord/tegn Datakategori Carvedilol Hexal 12,5 mg Carvedilol-ratiopharm® 12,5 mg Filmtabletten Tegn uden mellemrum Ord Tegn/ord Tabel 3 25.474 3.587 7,10 18.072 2.529 7,15 121