Bennenung von Salzen und Komplexen
Werbung
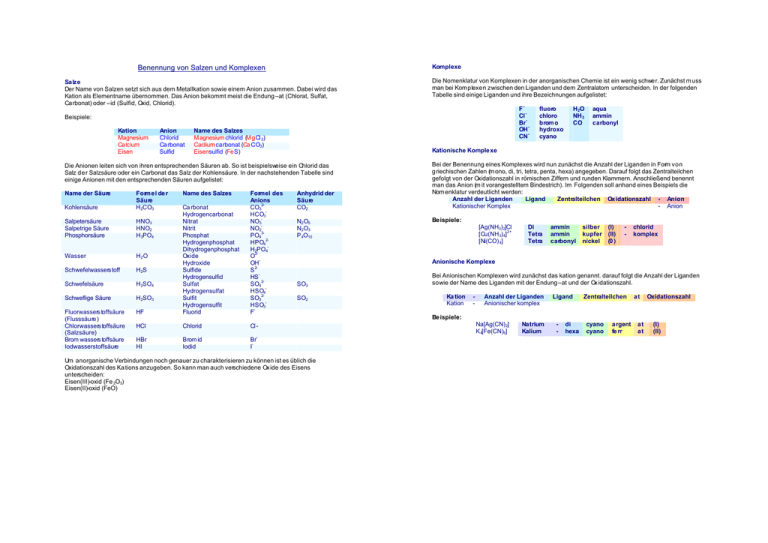
Komplexe Benennung von Salzen und Komplexen Salze Der Name von Salzen setzt sich aus dem Metallkation sowie einem Anion zusammen. Dabei wird das Kation als Elementname übernommen. Das Anion bekommt meist die Endung –at (Chlorat, Sulfat, Carbonat) oder –id (Sulfid, Oxid, Chlorid). Die Nomenklatur von Komplexen in der anorganischen Chemie ist ein wenig schwer. Zunächst m uss man bei Komplexen zwischen den Liganden und dem Zentralatom unterscheiden. In der folgenden Tabelle sind einige Liganden und ihre Bezeichnungen aufgelistet: - F Cl Br OH CN Beispiele: Kation Magnesium Calcium Eisen Anion Chlorid Carbonat Sulfid Name des Salzes M agnesium chlorid (M gCl 2) Cacliumcarbonat (Ca CO3) Eisensulfid (FeS) Kohlensäure Formel de r Säure H 2CO3 Salpetersäure Salpetrige Säure Phosphorsäure HNO3 HNO2 H 3PO4 Wasser H2O Schwefelwassers toff H 2S Schwefelsäure H 2SO4 Schweflige Säure H 2SO3 Fluorwassers toffsäure (Flusssäure) Chlorwassers toffsäure (Salzsäure) Brom wassers toffsäure Iodwasserstoffsäure HF Ca rbonat Hydrogencarbonat Nitrat Nitrit Phosphat Hydrogenphosphat Dihydrogenphosphat Oxide Hydroxide Sulfide Hydrogensulfid Sulfat Hydrogensulfat Sulfit Hydrogensulfit Fluorid Formel des Anions 2CO3 HCO3 NO3 NO23PO4 2HPO4 H2PO4 2O OH 2S HS 2SO4 HSO4 2SO3 HSO3 F HCl Chlorid Cl - Brom id Iodid - HBr HI Name des Salzes H 2O NH 3 CO aqua ammin carbonyl Kationische Komple xe Die Anionen leiten sich von ihren entsprechenden Säuren ab. So ist beispielsweise ein Chlorid das Salz der Salzsäure oder ein Carbonat das Salz der Kohlensäure. In der nachstehenden Tabelle sind einige Anionen mit den entsprechenden Säuren aufgelistet: Name der Säure fluoro chloro brom o hydroxo cyano Anhydrid der Säure CO2 N2 O5 N2 O3 P 4O10 Bei der Benennung eines Komplexes wird nun zunächst die Anzahl der Liganden in Form von griechischen Zahlen (m ono, di, tri, tetra, penta, hexa) angegeben. Darauf folgt das Zentralteilchen gefolgt von der Oxidationszahl in römischen Ziffern und runden Klammern. Anschließend benennt man das Anion (m it vorangestelltem Bindestrich). Im Folgenden soll anhand eines Beispiels die Nom enklatur verdeutlicht werden: Anzahl der Liganden Ligand Zentralteilchen Ox idationszahl - Anion Kationischer Komplex - Anion Beispiele: [Ag(NH3)2]Cl 2+ [Cu(NH3)4] [Ni(CO) 4] Di Tetra Tetra ammin ammin carbonyl silber (I) kupfer (II) nickel (0 ) - chlorid komplex Anionische Komplexe SO3 SO2 Br I- Um anorganische Verbindungen noch genauer zu charakterisieren zu können ist es üblich die Oxidationszahl des Ka tions anzugeben. So kann man auch verschiedene Ox ide des Eisens unterscheiden: Eisen(III)-oxid (Fe 2O3) Eisen(II)-oxid (FeO) Bei Anionischen Komplexen wird zunächst das kation genannt. darauf folgt die Anzahl der Liganden sowie der Name des Liganden mit der Endung –at und der Ox idationszahl. Ka tion Kation - Anzahl der Liganden Anionischer komplex Ligand Zentralteilchen at Oxidationszahl Beispiele: Na[Ag(CN) 2] K 4[Fe(CN)6] Natrium Kalium - di hexa cyano cyano argent fe rr at at (I) (II)