Pathologie - des FSR Medizin Greifswald
Werbung
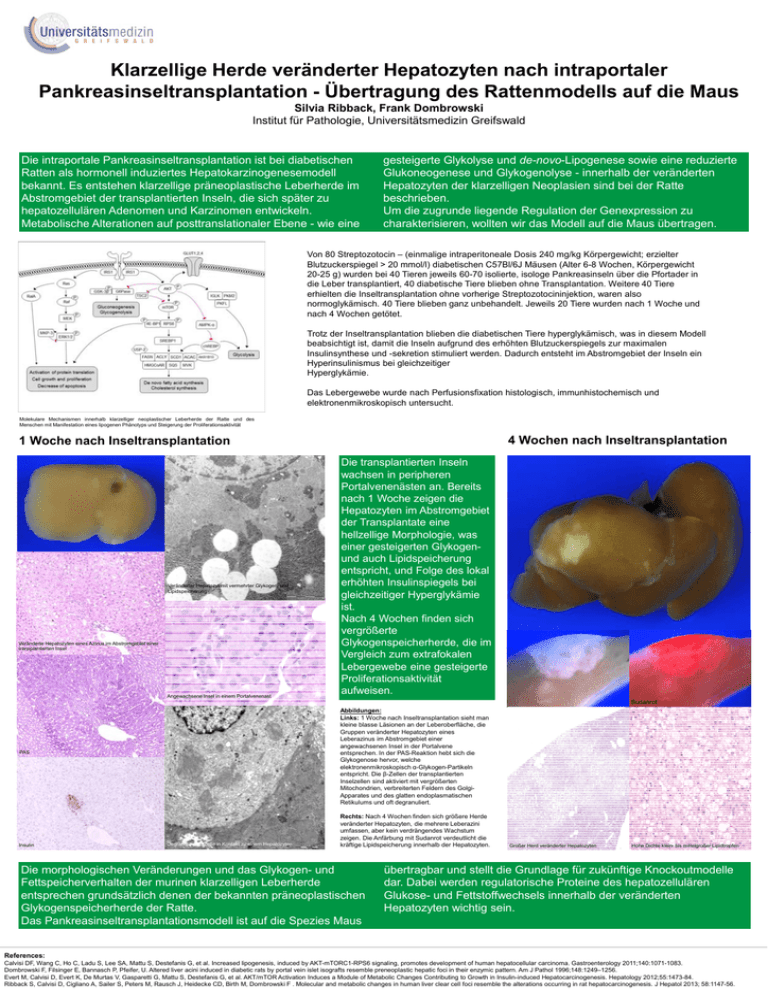
Klarzellige Herde veränderter Hepatozyten nach intraportaler Pankreasinseltransplantation - Übertragung des Rattenmodells auf die Maus Silvia Ribback, Frank Dombrowski Institut für Pathologie, Universitätsmedizin Greifswald Die intraportale Pankreasinseltransplantation ist bei diabetischen Ratten als hormonell induziertes Hepatokarzinogenesemodell bekannt. Es entstehen klarzellige präneoplastische Leberherde im Abstromgebiet der transplantierten Inseln, die sich später zu hepatozellulären Adenomen und Karzinomen entwickeln. Metabolische Alterationen auf posttranslationaler Ebene - wie eine gesteigerte Glykolyse und de-novo-Lipogenese sowie eine reduzierte Glukoneogenese und Glykogenolyse - innerhalb der veränderten Hepatozyten der klarzelligen Neoplasien sind bei der Ratte beschrieben. Um die zugrunde liegende Regulation der Genexpression zu charakterisieren, wollten wir das Modell auf die Maus übertragen. Von 80 Streptozotocin – (einmalige intraperitoneale Dosis 240 mg/kg Körpergewicht; erzielter Blutzuckerspiegel > 20 mmol/l) diabetischen C57Bl/6J Mäusen (Alter 6-8 Wochen, Körpergewicht 20-25 g) wurden bei 40 Tieren jeweils 60-70 isolierte, isologe Pankreasinseln über die Pfortader in die Leber transplantiert, 40 diabetische Tiere blieben ohne Transplantation. Weitere 40 Tiere erhielten die Inseltransplantation ohne vorherige Streptozotocininjektion, waren also normoglykämisch. 40 Tiere blieben ganz unbehandelt. Jeweils 20 Tiere wurden nach 1 Woche und nach 4 Wochen getötet. Trotz der Inseltransplantation blieben die diabetischen Tiere hyperglykämisch, was in diesem Modell beabsichtigt ist, damit die Inseln aufgrund des erhöhten Blutzuckerspiegels zur maximalen Insulinsynthese und -sekretion stimuliert werden. Dadurch entsteht im Abstromgebiet der Inseln ein Hyperinsulinismus bei gleichzeitiger Hyperglykämie. Das Lebergewebe wurde nach Perfusionsfixation histologisch, immunhistochemisch und elektronenmikroskopisch untersucht. Molekulare Mechanismen innerhalb klarzelliger neoplastischer Leberherde der Ratte und des Menschen mit Manifestation eines lipogenen Phänotyps und Steigerung der Proliferationsaktivität 4 Wochen nach Inseltransplantation 1 Woche nach Inseltransplantation Veränderter Hepatozyt mit vermehrter Glykogen- und Lipidspeicherung Glykogenspeichernde Hepatozyten Veränderte Hepatozyten eines Azinus im Abstromgebiet einer transplantierten Insel Angewachsene Insel in einem Portalvenenast Sudanrot Abbildungen: Links: 1 Woche nach Inseltransplantation sieht man kleine blasse Läsionen an der Leberoberfläche, die Gruppen veränderter Hepatozyten eines Leberazinus im Abstromgebiet einer angewachsenen Insel in der Portalvene entsprechen. In der PAS-Reaktion hebt sich die Glykogenose hervor, welche elektronenmikroskopisch α-Glykogen-Partikeln entspricht. Die β-Zellen der transplantierten Inselzellen sind aktiviert mit vergrößerten Mitochondrien, verbreiterten Feldern des GolgiApparates und des glatten endoplasmatischen Retikulums und oft degranuliert. PAS Insulin Die transplantierten Inseln wachsen in peripheren Portalvenenästen an. Bereits nach 1 Woche zeigen die Hepatozyten im Abstromgebiet der Transplantate eine hellzellige Morphologie, was einer gesteigerten Glykogenund auch Lipidspeicherung entspricht, und Folge des lokal erhöhten Insulinspiegels bei gleichzeitiger Hyperglykämie ist. Nach 4 Wochen finden sich vergrößerte Glykogenspeicherherde, die im Vergleich zum extrafokalen Lebergewebe eine gesteigerte Proliferationsaktivität aufweisen. Degranulierte β-Zelle in Kontakt zu einem Hepatozyten Rechts: Nach 4 Wochen finden sich größere Herde veränderter Hepatozyten, die mehrere Leberazini umfassen, aber kein verdrängendes Wachstum zeigen. Die Anfärbung mit Sudanrot verdeutlicht die kräftige Lipidspeicherung innerhalb der Hepatozyten. Die morphologischen Veränderungen und das Glykogen- und Fettspeicherverhalten der murinen klarzelligen Leberherde entsprechen grundsätzlich denen der bekannten präneoplastischen Glykogenspeicherherde der Ratte. Das Pankreasinseltransplantationsmodell ist auf die Spezies Maus Großer Herd veränderter Hepatozyten Hohe Dichte klein- bis mittelgroßer Lipidtropfen übertragbar und stellt die Grundlage für zukünftige Knockoutmodelle dar. Dabei werden regulatorische Proteine des hepatozellulären Glukose- und Fettstoffwechsels innerhalb der veränderten Hepatozyten wichtig sein. References: Calvisi DF, Wang C, Ho C, Ladu S, Lee SA, Mattu S, Destefanis G, et al. Increased lipogenesis, induced by AKT-mTORC1-RPS6 signaling, promotes development of human hepatocellular carcinoma. Gastroenterology 2011;140:1071-1083. Dombrowski F, Filsinger E, Bannasch P, Pfeifer, U. Altered liver acini induced in diabetic rats by portal vein islet isografts resemble preneoplastic hepatic foci in their enzymic pattern. Am J Pathol 1996;148:1249–1256. Evert M, Calvisi D, Evert K, De Murtas V, Gasparetti G, Mattu S, Destefanis G, et al. AKT/mTOR Activation Induces a Module of Metabolic Changes Contributing to Growth in Insulin-induced Hepatocarcinogenesis. Hepatology 2012;55:1473-84. Ribback S, Calvisi D, Cigliano A, Sailer S, Peters M, Rausch J, Heidecke CD, Birth M, Dombrowski F . Molecular and metabolic changes in human liver clear cell foci resemble the alterations occurring in rat hepatocarcinogenesis. J Hepatol 2013; 58:1147-56.











