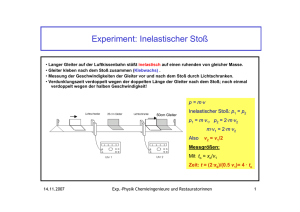
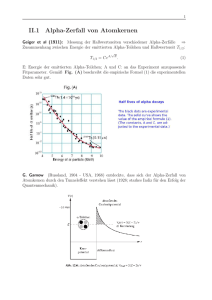
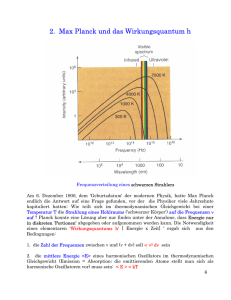
13. Vorlesung - Physik
Werbung
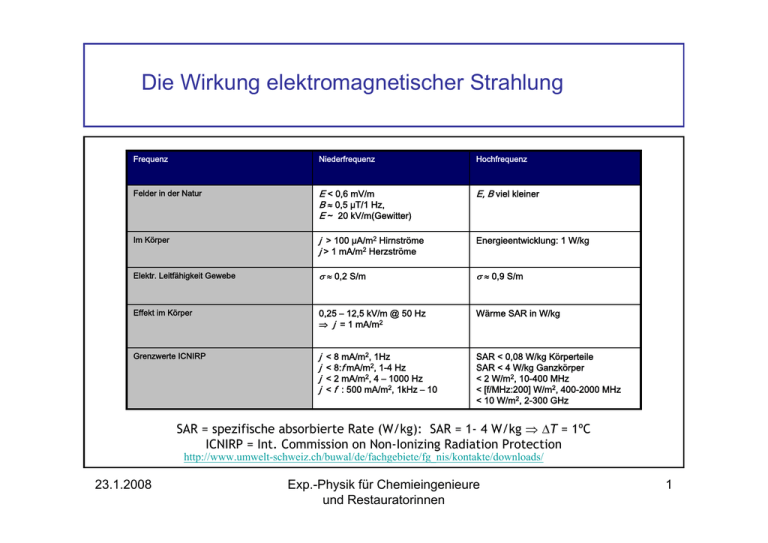
Die Wirkung elektromagnetischer Strahlung Frequenz Niederfrequenz Hochfrequenz Felder in der Natur E < 0,6 mV/m B ≈ 0,5 µT/1 Hz, E ~ 20 kV/m(Gewitter) E, B viel kleiner Im Körper j > 100 µA/m2 Hirnströme j > 1 mA/m2 Herzströme Energieentwicklung: 1 W/kg Elektr. Leitfähigkeit Gewebe σ ≈ 0,2 S/m σ ≈ 0,9 S/m Effekt im Körper 0,25 – 12,5 kV/m @ 50 Hz ⇒ j = 1 mA/m2 Wärme SAR in W/kg Grenzwerte ICNIRP j j j j SAR < 0,08 W/kg Körperteile SAR < 4 W/kg Ganzkörper < 2 W/m2, 10-400 MHz < [f/MHz:200] W/m2, 400-2000 MHz < 10 W/m2, 2-300 GHz < 8 mA/m2, 1Hz < 8:f mA/m2, 1-4 Hz < 2 mA/m2, 4 – 1000 Hz < f : 500 mA/m2, 1kHz – 10 SAR = spezifische absorbierte Rate (W/kg): SAR = 1- 4 W/kg ⇒ ΔT = 1ºC ICNIRP = Int. Commission on Non-Ionizing Radiation Protection http://www.umwelt-schweiz.ch/buwal/de/fachgebiete/fg_nis/kontakte/downloads/ 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 1 Niedrige Frequenzen (< kHz) Induktionsgesetz Uind = -d(A·B)/dt j = π·R ·f ·σ ·B Polarisation der Materie, E erniedrigt (um Faktor 106), j = σ ·E 23.1.2008 Amplitude des elektrischen und magnetischen Feldes 1 m über der Erde unter einer Hochspannungsleitung 380 kV, 50 Hz. Exp.-Physik für Chemieingenieure und Restauratorinnen 2 Grenzwerte Hz kHz MHz GHz Hz 104 104 102 10 kHz MHz GHz http://www.emf-portal.de/_index.php 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 3 Hochfrequente Felder Belastung Hochhaus 7. Stock Ballungsgebiet: M = Mobilfunk, LMK = Lang-, Mittel-, Kurzwellensender 23.1.2008 Belastung Handy (H), „Babyphon“ (B) Mikrowelle (MW) Exp.-Physik für Chemieingenieure und Restauratorinnen 4 Hochfrequente Felder (Forts.) Handies f = 900/1800/ MHz, Eindringtiefe im cm-Bereich SAR-Grenzwert Strahlenschutzkommission: 2 W/kg, gemittelt über 10 g!! SAR = Spezifische absorbierte Rate http://www.bfs.de/de/elektro/oekolabel.html 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 5 Gefahren durch das Handy: Berichterstattung SZ, 31.1.2007 Stellungnahme Internet International J. of Cancer 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 6 Teilchenbeschleuniger • Zweck: Beschleunigung von geladenen Teilchen (p, e, Ionen) auf hohe Energien • Anwendung: Forschung in Kern-, Teilchen-, Festkörperphysik (z.B. µSR), Tumorbehandlung • Prinzip: Kraft F = q∗E auf Teilchen zur Beschleunigung • Ausführungsarten: Linearbeschleuniger (Tandem), Kreisbeschleuniger (Betatron, Zyklotron, Isochronenzyklotron, Synchrozyklotron, Synchrotron): Lorentz-Kraft F = q⋅v⋅B zwingt Teilchen auf Kreisbahn G B Zyklotron 23.1.2008 Beispiele • Tandembeschleuniger (Garching): p, ~20 MeV • SL-Isochronenzyklotron (PSI , Villigen, CH; München): p, 250 MeV, 180´000 km/s, v = 0,60·c • Isochronenzyklotron (PSI): p, 590 MeV • SPS-Synchrotron (CERN, Genf, CH/F): p, 400 GeV, v = 0,99999·c, m = 220·m0!! • LHC (large hadron collider,CERN, Genf, CH/F): p, 7+7 TeV 1 MeV = 106 eV, 1 GeV = 109 eV, 1 TeV = 1012 eV Exp.-Physik für Chemieingenieure und Restauratorinnen 7 Teilchenbeschleuniger • ACCEL Isochronenzyklotron – PSI/MUC (Rinecker) • 250 MeV Protonen • Energieverlust in Materie durch Stoß mit e• H2O → H2O+ + e-; H2O+ → H+ + OH Schädigung DNS • Maximaler Energieverlust am Ende der Bahn (Bragg-Peak) • Reichweite p(250 MeV): 38 cm im Körper 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 8 Schneller, größer .... 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 9 LHC = Large Hadron Collider • Installiert in einem Tunnel mit ∅ = 3.8 m, 50-175 m unter der Erde. Umfang 27 km. • Zwei Protonenstrahlen aus dem SPS, in gegenläufiger Richtung injiziert. • Injektion bei 450 GeV, Extraktion bei 7 TeV. • 2808 Bunches mit je 1.15·1011 Protonen = 362 MJ pro Strahl. • 1232 Dipolmagnete mit supraleitenden Spulen in einem Bad von superfluidem He bei 1.9 K. Feld ca. 8.4 Tesla am Strahl. I = 11700 A. Supraleiter NbTi. • Gespeicherte Energie 11 GJ. Kühlleistung 140 kW @ 4.5 K! • Vakuum ca. 10-10 mbar für eine Speicherzeit von 10 –20 h. 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 10 LHC (Forts.) 8.6 km 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 11 Experiment am LHC 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 12 Transport von Komponenten Probleme ?? 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 13 Das Standardmodell der Teilchenphysik • Es gibt vier Arten von Wechselwirkungen (WW): - Starke WW (hält Atomkerne zusammen), - Elektromagnetische WW (hält Atome zusammen), - Schwache WW (bewirkt Zerfall der radioaktiven Kerne), n → p + e− + ν ⎛u⎞ ⎛u⎞ ⎜ ⎟ ⎜ ⎟ − d → u + e +ν ⎜ ⎟ ⎜ ⎟ ⎜d ⎟ ⎜d ⎟ ⎝ ⎠ ⎝ ⎠ - Gravitation. • Es gibt 3 Arten von leichten Teilchen (Leptonen): • Elektron (e), Myon (µ), Tauon (τ), • Neutrinos νe, νµ , ντ neutral. • Es gibt sechs Arten von Quarks: up (u), down(d), charmed (c), strange (s), top (t), bottom (b). Nicht beobachtbar! • Zu jedem Quark gibt es ein Antiquark. • Ladung von u, c, t +2/3 Elementarladungen, Ladung von d, s, b -1/3 Elementarladungen. 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 14 Wechselwirkungen Art des ausgetauschten Teilchens bestimmt WW Reichweite der Wechselwirkung: Austauschteilchen ist virtuelles Teilchen→ Energiesatz wird verletzt ΔE ⋅ Δt = = mit ΔE = mTeilchen und vmax = c ⇒ in Zeit t zurückgelegte Distanz: Δr = =c mTeilchen = 200 fm mTeilchen [ MeV ] Große Masse (Energie) Kleine Reichweite 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 15 Wechselwirkungen (Forts.) 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 16 Die Bausteine 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 17 Die Geschichte des Universums • Expansion des Universums (Rotverschiebung: Hubble, NP) ⇒ Urknall (Big Bang) • Kosmische Untergrundstrahlung (2.73 K) (Penzias, Wilson NP) ⇒ Universum homogen Größe Universum Rotverschiebung 0 4 Entfernteste Galaxie Entferntester Quasar 0 8 5 10 [Ga] 10 20 30 [Ga] Alter des Weltalls Alter des Weltalls 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 18 Dunkle Materie, dunkle Energie Dunkle Materie: Beeinflussung der Sternenbahnen Gravitationslinsen 23.1.2008 Dunkle Energie: Rotshift von Galaxien des Typs Ia Exp.-Physik für Chemieingenieure und Restauratorinnen 19 Temperatur und Wärme Thermogramm eines Hauses, aufgenommen mit einer Infrarotkamera. Bereiche mit hohem Wärmeverlust sind rot und gelb, solche mit geringem Wärmeverlust in blau und schwarz gezeigt. Das Verständnis des Wärmeflusses erlaubt energiesparendes Design. 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 20 Versuch: Geysir Geysa = wirbeln (isländisch) • Druck im Wasserreservoir = Atmosphärendruck p0 + Schweredruck H2O im Rohr: p(h) = p0 + ρ⋅g⋅h, • Siedetemperatur im Wasserreservoir TSiede(H2O) > 100°C, • Durch erste Dampfblasen, die an die Oberfläche dringen. Höhe h der Wassersäule wird kleiner, • Druck niedriger ⇒ TSiede(H2O) sinkt, • Sieden heftiger, mehr Wasser ausgestoßen, • Prozess schaukelt sich explosionsartig auf. 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 21 Wärme und Temperatur Wärme ist Energie • kinetische Energie der Atome bzw. Moleküle, • Schwingungen oder Rotation von Molekülen • Schwingungen der Ionen/Atome in Festkörpern. Es gibt verschiedene Methoden, einem Körper Wärme zuzuführen: Feuer 23.1.2008 Elektrische Heizung Reibung, mech. Arbeit Exp.-Physik für Chemieingenieure und Restauratorinnen 22 Wärme und Temperatur Maßeinheit für Wärmemenge (wie für alle Energien): Joule (J). Wenn einem Körper Wärme zugeführt wird, dann erhöht sich normalerweise seine Temperatur (Ausnahme: Änderung des Aggregatzustands). Die Temperatur ist also ein Maß für die Stärke der Wärmebewegungen oder der Menge an Wärmeenergie, die ein Körper enthält. Die Maßeinheit für die Temperatur ist das Kelvin (K), eine Basiseinheit des SI. Der Nullpunkt der Kelvinskala ist der so genannte ABSOLUTE Nullpunkt, bei dem die Atome eines Körpers keine Wärmebewegung mehr ausführen (unerreichbar). 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 23 Vergleich von Temperaturskalen Fahrenheit wählte als Nullpunkt den Gefrierpunkt einer Salz-Schnee-Mischung und ordnete der(leicht erhöhten) Körpertemperatur den Wert 100 F zu ! 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 24 Spezifische Wärmekapazität Die Wärmemenge ΔQ, die benötigt wird, um die Temperatur eines Körpers der Masse m um ΔT zu ändern, ist Temperaturerhöhung ΔT Masse m ΔQ = C ⋅ m ⋅ ΔT Wärmezufuhr ΔQ C = Spezifische Wärmekapazität [C] = J/(kg·K) 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 25 Temperaturmessung: Gasthermometer Durch einen Fixpunkt und dem Gasdruck eines Gasthermometers ist die Temperaturskala festgelegt. Der Gefrierpunkt des Wassers liegt: in der Celsius-Skala bei 0 oC, in der Kelvin-Skala bei 273,15 K. p Wenn wir p ~ T wählen, dann gilt eine lineare Abhängigkeit: T = [Konstante] x [p] = 273,15 K x [pmess/peich] 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 26 Versuch: Änderung des Gasdrucks mit der Temperatur Ein mit Fuchsinlösung gefülltes URohr-Manometer wird optisch abgebildet und mit einem Schlauch mit einer geschlossenen Glaskugel (ca. 2 Liter Inhalt) verbunden. Erwärmt man die Glaskugel mit der Hand, dann steigt der Druck im Manometer. 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 27 Temperaturmessung: Thermometer Elektrischer Widerstand Oft ist der elektrische Widerstand in Metallen proportional zur Temperatur. RT = Ro ( 1 + γ⋅T ) 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 28 Versuch: Widerstandsthermometer RT = Ro ( 1 + γ⋅T ) Eine Cu-Spule wird an ein stabilisiertes Netzgerät angeschlossen. Die Spannung und der Strom durch die Spule werden durch Projektionsmessgeräte (Mavo) dargestellt. Taucht man die Spule in flüssigen Stickstoff, so steigt der Strom bei gleich bleibender Spannung. RT = 23.1.2008 U U 1 →I= ⋅ I R0 1 + γ ⋅ T Exp.-Physik für Chemieingenieure und Restauratorinnen 29 Ideales Gas Ein ideales Gas können wir uns als ein Gas aus nicht miteinander wechselwirkenden Teilchen vorstellen. Es soll also keine Kräfte langer Reichweite geben. Das Eigenvolumen der Teilchen wird als vernachlässigbar betrachtet. Es soll allerdings Stöße zwischen den Teilchen geben, bei denen diese Impuls und Energie austauschen. 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 30 Brownsche Molekularbewegung Eine Rauchkammer wird unter dem Mikroskop mit Zigarettenrauch (aus der Rauchmaschine) gefüllt und mit einem Laserstrahl (He-Ne) beleuchtet. Die Fernsehkamera wird auf das Mikroskop gesetzt und überträgt das Bild der vibrierenden Rauchteilchen auf die Bildprojektion. 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 31 Zustandsgleichung des idealen Gases p ⋅V = n ⋅ R ⋅T F p = Druck auf die Wände (Kraft pro Fläche) p = A V = Volumen n = Anzahl der Mole im Gasraum R = universelle Gaskonstante (= 8,31 J/mol K) T = Temperatur in K p = 105 Pa, T = 273 K, n = 1 Mol ⇒ V = 22,4 dm³ Spezialfälle: Gesetze von Gay-Lussac (V/T= const. @ p = const.) Boyle-Mariotte (p⋅V= const. @ T = const.) 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 32 Erster Hauptsatz der Wärmelehre ΔQ = ΔU + ΔWV Zugeführte Wärme Änderung der inneren Energie Verdrängungsarbeit durch System Innere Energie = die in einem Medium gebundene Energie (kinetische Energie der Atome, Bindungsenergie, etc.) 23.1.2008 Exp.-Physik für Chemieingenieure und Restauratorinnen 33