22. Wärmestrahlung rmestrahlung rmestrahlung, Quantenmechanik
Werbung
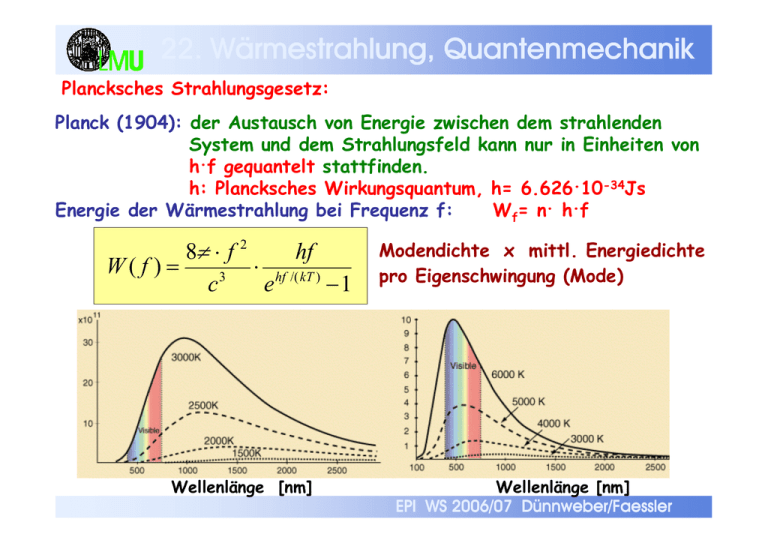
22. Wärmestrahlung, rmestrahlung, Quantenmechanik Plancksches Strahlungsgesetz: Planck (1904): der Austausch von Energie zwischen dem strahlenden System und dem Strahlungsfeld kann nur in Einheiten von h.f gequantelt stattfinden. h: Plancksches Wirkungsquantum, h= 6.626.10-34Js Energie der Wärmestrahlung bei Frequenz f: Wf= n. h.f 8π ⋅ f 2 hf W( f ) = ⋅ c3 e hf /( kT ) − 1 Wellenlänge [nm] Modendichte x mittl. Energiedichte pro Eigenschwingung (Mode) Wellenlänge [nm] EPI WS 2006/07 Dünnweber/Faessler 22. Wärmestrahlung, rmestrahlung, Quantenmechanik Wiensches Verschiebungsgesetz: Die Wellenlänge des Strahlungsmaximums verschiebt sich mit der Temperatur gemäß dem Wienschen Verschiebungsgesetz: λmax.T=2.9.10-3 m.K Sonnentemperatur: ~ 5700 K -> Wellenlänge λmax ~ 480 nm ≈ 0,5 µm * Glühlampe (2000K): λmax = 1 µm (infrarot) Mensch: 10 µm *Energie h · f ≈ 3eV für die gesamte abgestrahlte Leistung gilt: dW/dT ~ T4 : Stefan-Boltzmann-Gesetz Wellenlänge [nm] EPI WS 2006/07 Dünnweber/Faessler „Lichtquanten“ verhalten sich wie Wellen (-> Interferenzen), aber auch wie Teilchen: Beispiele für Teilchencharakter: Photoeffekt (Einstein) Comptoneffekt: elastische Streuung von γ an e- Wie Stoß zweier Kugeln! (Energien Emax bzw. E‘ unabhängig von der Lichtintensität) EPI WS 2006/07 Dünnweber/Faessler 22. Wärmestrahlung, rmestrahlung, Quantenmechanik Was ist Licht: Teilchen oder Welle ? Photoeffekt: Ein Metall wird mit Licht einer Wellenlänge (Farbe) bestrahlt und die Energie der emittierten ‘Photoelektronen’ wird gemessen (Gegenfeldmethode: wenn gerade keine Elektronen die Anode mehr erreichen ist eU=mv2/2) Beobachtung: die Energie der Photonen wird nur durch die Farbe des Lichts (λ λ) bestimmt, nicht durch die Intensität. (mehr Licht -> mehr Elektronen) Erklärung: (Einstein 1905) Auch das Licht wechselwirkt in gequantelten Beträgen h.f -> weitere Methode, die Naturkonstante h zu bestimmen: h=e.∆U/∆ ∆f ∆U ∆f EPI WS 2006/07 Dünnweber/Faessler 22. Wärmestrahlung, rmestrahlung, Quantenmechanik Wellen- und Photonencharakter des Lichts Licht (elektromagnetische Wellen) verhält sich bei der Ausbreitung wie eine Welle -> Interferenz, Beugung … Licht wechselwirkt auf atomarem Niveau (Absorption beim Photoeffekt) wie ein Teilchen (Photon) mit Energie hf Wellenpaket: Lokalisierung durch Überlagerung verschiedener Frequenzen (s. Schwebung). ∆x groß ↔ schmale Frequenzverteilung (schmale Impulsverteilung) ∆x klein ↔ breite Impulsverteilung Allgemein gilt die Heisenbergsche Unschärferelation: ∆p ⋅ ∆x ≥ h = h ebenso 2π ∆E ⋅ ∆t ≥ h Benimmt sich Materie anders als Licht? NEIN EPI WS 2006/07 Dünnweber/Faessler 22. Wärmestrahlung, rmestrahlung, Quantenmechanik Wellencharakter massiver Teilchen: Wenn Licht Teilchencharakter besitzt, kann man dann auch bei (Elementar-)Teilchen einen Wellencharakter finden ? Test: Interferenzexperimente mit Elektronenstrahlen geht sogar mit einzelnen Elektronen -> Wellenpaket f de Broglie (1924): wie bei Licht h 2π h = , k = 2π λ diese Wellenlänge ist sehr klein (energieabhängig): 1 keV Elektron-> 39 pm EPI WS 2006/07 Dünnweber/Faessler 23. Atomphysik, Atomphysik, Röntgenstrahlung Ebenso werden nur Lichtquanten mit der Differenzenergie ∆E absorbiert, wenn ein Medium bestrahlt wird (Absorptionsschattenlinien) EPI WS 2006/07 Dünnweber/Faessler 23. Atomphysik, Atomphysik, Röntgenstrahlung Aufbau des Atoms: Rutherford (1900): Streuung von α Teilchen aus radioaktivem Präparat an einer Goldfolie (Ekin ca. 5 MeV) -> fast gesamte Masse des Atoms ist in winzigem Kern konzentriert, der von einer ausgedehnten Elektronenhülle umgeben ist. Die meisten α Teilchen fliegen gerade durch die Folie durch. EPI WS 2006/07 Dünnweber/Faessler 23. Atomphysik, Atomphysik, Röntgenstrahlung Bohrsches Atommodell (1913): Wasserstoffatom -Elektronen (-) umkreisen auf geschlossenen Bahnen den Kern (+:Proton) -Gleichgewicht aus Coulombanziehung und Zentrifugalkraft Problem: solche Bahn ist für jeden Radius möglich (keine diskreten Energien !) und Energie wird abgestrahlt (> Spiralbahn) Ausweg: Wellenfunktion des Elektrons stabile Bahnen nur bei bestimmten Energien und Drehimpulsen. Für Coulombpotential: E = −R n2 mit n = 1,2,3,4,… „Rydbergenergie“ R = 13,6 eV. Für n → ∞ ist E = 0, d.h. ungebundenes Elektron. h L = n ⋅ Außerdem Drehimpuls mit n = 0,1,2,…. 2π EPI WS 2006/07 Dünnweber/Faessler 23. Atomphysik, Atomphysik, Röntgenstrahlung Energieübergänge im Wasserstoffatom 1 1 Em = R 2 − 2 n m allgemein für Atom mit einem Außenelektron und Ladungszustand Z: 1 En = − R ⋅ Z ⋅ 2 n 2 14243 Röntgenstrahlung für Z ≥ 10 sichtbar n=1: Grundzustand, stabil (13.6.Z2 eV nötig, um e- zu entfernen) n>1: angeregte Zustände, Abregung durch Aussendung von Photonen - Atom kann nur diskrete Energien aufnehmen -> durch Ug beschleunigtes Elektron stößt nur elastisch in einem Gas, solange Ekin=e.Ug kleiner als Anregungsenergie des Atoms ist. -> sobald Ekin>E*: Anregung durch inelast. Stoß EPI WS 2006/07 Dünnweber/Faessler Kohärente Abregung vieler Atome (Moleküle): LASER Niveauschema für Atom mit metastabilem Zustand a) externe Anregung („Pumpen“) b) spontaner Übergang c) stimulierte Emission (phasengleich mit Photon c‘ von Nachbaratomen) Laserlicht: - kohärent (d.h. alle Wellenzüge in Phase) - sehr geringe Divergenz - fast monochromatisch (d.h. frequenzscharf) EPI WS 2006/07 Dünnweber/Faessler 23. Atomphysik, Atomphysik, Röntgenstrahlung Franck-Hertz-Versuch: Röhre mit Hg-Gas, das von Elektronen aus einer Glühkathode beschossen wird EPI WS 2006/07 Dünnweber/Faessler 23. Atomphysik, Atomphysik, Röntgenstrahlung Moderne Vorstellung des Atomaufbaus Orbitale der Elektronen werden quantenmechanisch nicht durch Bahnen beschrieben, sondern durch ‘stehende Wellen’, die durch Quantenzahlen (n,l,m) beschrieben werden. Wellenfuktion: Quantenzahlen: Haupt-QZ: n= 1,2,… Drehimpuls-QZ: l= 0,1,..(n-1) Magnet. QZ: m= -l,… ,+l Spin: +/- 1/2 Das Quadrat der Wellenfunktion beschreibt die Wahrscheinlichkeit, das Elektron zu einer Zeit t an einem Ort x anzutreffen. Das Maximum der Wahrscheinlichkeit liegt beim s-Orbital bei der Bohrschen Bahn. EPI WS 2006/07 Dünnweber/Faessler 23. Atomphysik, Atomphysik, Röntgenstrahlung Periodensystem der Elemente Bor Stickstoff EPI WS 2006/07 Dünnweber/Faessler