BIOCHEMIE des Stoffwechsels (772.113)
Werbung

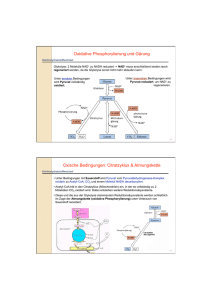
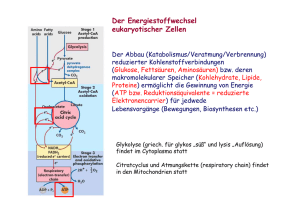
Inhaltsverzeichnis Glycolyse BIOCHEMIE des Stoffwechsels (772.113) 1. Glucosetransport 2. Abfolge der chemischen Umwandlungen der Glucose in Pyruvat (10 Reaktionen) 3. Mechanismen der einzelnen Reaktionen 4. Thermodynamik und Regulation 6. Einheit Schicksale des Pyruvats 5. Einschleusen von Galactose, Mannose, Fructose und Glycerin in die Glykolyse 6. Schicksale des Pyruvats GLUCOSE 2 NAD+ 2 ADP + 2 Pi Neben der aeroben Option (Citratzyklus und Atmungskette) gibt es mehrere anaerobe Optionen, z.B.: Fructose-1,6-bisphosphat 2 ATP 2 NADH 2 Pyruvat Anaerobe homolactische Fermentation Aerobe Oxidation (Mitochondrien) Das in der Glycolyse gebildete Pyruvat muss weiter umgesetzt werden, damit die Glycolyse weiterlaufen kann. Wichtig ist, dass das bei der Oxidation des Glycerinaldehyd-3-phosphats reduzierte NAD+ regeneriert wird. Anaerobe alkoholische Gärung Hefen und einige andere Organismen bilden bei anaerobem Zuckerabbau Ethanol und CO2 anstelle von Lactat (alkoholische Fermentation). Im Gegensatz zu fakultativen Anaerobiern wie E. coli, die für eine unbegrenzte Zeit anaerob wachsen können, können Hefen nur einige Generationen lang in völliger Abwesenheit von Sauerstoff existieren, da sie molekularen Sauerstoff für die Synthese von Membrankomponenten benötigen. Heterolactische Bakterien produzieren neben Lactat auch Ethanol. Andere Bakterien (Propionsäure-Bakterien) wiederum wandeln Pyruvat reduktiv in Propionat um (Herstellung des Schweizer Käse). Andere fermentative Produkte sind beispielsweise Butyrat (ranzige Butter), Aceton oder Isopropanol. In allen Fällen wird NADH durch Transfer von Elektronen auf einen organischen Akzeptor reoxidiert (= Definition der Fermentation). Reduktion von Pyruvat zu Lactat durch Lactat-Dehydrogenase. Viele Organismen haben sich dafür entschieden. Selbst der humane Skelettmuskel bedient sich dieser Strategie, wenn die Sauerstoffversorgung nicht mehr ausreicht. Ökonomisch ist die homolactische Fermentation sehr bedeutend, (z.B. Rolle von Bakterien in der Käse- und Joghurtherstellung mittels Fermentation von Lactose der Milch). 1. Homolactische Fermentation 2. Alkoholische Fermentation 3. Aerobe Oxidation Homolactische Fermentation Ein häufiger Mechanismus der anaeroben Reoxidation von NADH mittels Pyruvat ist die Reduktion der Carbonyl-Gruppe des Pyruvats. Die Lactatbildung aus Pyruvat ist thermodynamisch begünstigt, sodass (selbst unter aeroben Bedingungen) Lactat akkumuliert. HPO42- Glycolyse 11. Reaktion: Lactat-Dehydrogenase O COPO32- CHO H C H OH C 1,3BPG OH CH2OPO32- CH2OPO32- Pyruvat + NADH + H+ L-Lactat + NAD+ Enzym: Oxidoreductase Lactat-Dehydrogenase (EC 1.1.1.28) Glycerinaldehyd3-phosphat Tetramer: 4 35 kDa (Kaninchenmuskel) NAD+ NADH + H+ Cofaktor: NADH L-Lactat Pyruvat O Lactat O OH H3C C COO H3C - LactatDehydrogenase H C COO- OH Pyruvat 2C 3 CH3 5 O 4 Übertragung des pro-R-Wasserstoffs (A-Seite) am C(4)-des NADH auf die re-Seite des C(2) des Pyruvats unter Bildung von L(oder S-)Lactat. C 3 NH2 H+ 6 1 2 N Pyruvat Vergleich mit Glycerinaldehyd-3-P-Dehydrogenase, GAP-DH, zeigt, dass bei GAP-DH die Hydridübertragung auf die andere Seite (BSeite) des Nicotinamid-Ringes erfolgt! NADH R O O H C 2 3 CH3 L-Lactat O C 1C OH H C Lactat-Dehydrogenase, LDH, arbeitet absolut stereospezifisch: HS HR O 1C 2 3 CH3 O O O 1C NH2 H N R Überlagerung von Proteingebundenem NAD+ in LDH und GAP-DH zeigt Verdrehung des jeweiligen Nicotinamid-Ringes um 180° NAD+ in GAPDH NAD+ in LDH NAD+ Monomer Rossmann – Falte: Typisches Faltungsmotiv in NAD+ –bindenden Dehydrogenasen. Besteht aus zwei strukturell ähnlichen Domänen: (a) Nicotinamid-bindende Domäne (gelb) und (b) Adeninbindende Domäne (rot) Ausrichtung des Pyruvats durch Arg171 und His195 LactatDehydrogenase R N H H2 N C H C O CH2 CH 3 O H N Lactat-Dehydrogenase His195 (Monomer) NH C O O H 2N NAD+ NH 2 C Hydridübertragung vom C(4) des NADH auf C(2) des Pyruvats NH 2 Arg171 H+ NAD + O O Gleichzeitige Übertragung eines Protons von der Imidazolium-Einheit des His-195 Pyruvat C H C OH CH 3 Pyruvat + NADH + H+ L-Lactat + NAD+ G‘ = -25,2 kJ/mol; Keq(25°C) = 2,63 104 G‘ = -14,8 kJ/mol Säugetiere: 2 Arten von Untereinheiten: M und H (Aminosäuresequenzen stimmen zu 75% überein; Nachweis in SDS-PAGE) Fünf tetramere Isoenzyme (Hybridformen): M4, M3H, M2H2, MH3, H4 (M und H werden durch unterschiedliche Gene codiert, die durch Genduplikation entstanden sind). Aerobes Gewebe (Herzmuskel): Überwiegend Expression der H-Form (H4, MH3); Hemmung dieser Isoformen durch Pyruvat um Verschwendung dieser potentiell sehr energiereichen Kohlenstoffquelle zu verhindern. Im aeroben Gewebe soll Pyruvat in den Citrat-Zyklus eingeschleust werden! Diese Isoformen haben zudem einen geringen KM-Wert für Lactat. Vorhandenes Lactat wird bevorzugt zu Pyruvat oxidiert. Anaerobes Gewebe (Skelettmuskel, Leber): Das aktive Muskelgewebe ist anaerob und ist auf die Glycolyse als ATPProduzent angewiesen! Es bildet eine erhebliche Menge an Pyruvat (und Alanin, siehe unten). Hier darf die Lactat-Dehydrogenase durch Pyruvat nicht gehemmt werden, da sich sonst der Vorrat an NAD+ vermindern würde und der glycolytische Reaktionsweg wäre unterbrochen! Tatsächlich hat das aktive Muskelgewebe erhöhte Pyruvat-Spiegel und wandelt Pyruvat bereitwillig in Lactat um. Im anaeroben Gewebe überwiegt die M-Form (M4, M3H); diese Isoformen arbeiten optimal unter anaeroben Bedingungen und werden durch Pyruvat nicht gehemmt. Der KM-Wert für Lactat ist hoch. Pyruvat wird bevorzugt zu Lactat reduziert, das freigesetzt wird. 2 Typen von Skelettmuskeln: A. TYP 1 (LANGSAME FASERN): Aerobes Gewebe. Langsam, stetig sich kontrahierende Muskeln (Beispiel: Herzmuskel); enthält viele Mitochondrien („rote Mukselfasern“ siehe Aufbau der Elektronentransportkette und Vorkommen von Cytochromen) und viel Myoglobin (Sauerstoffspeicher). Aerobes Gewebe produziert ATP über oxidative Phosphorylierung. Die Stärke dieser Muskelfasern sind oftmalige Kontraktionen mit jeweils geringer Kraftentwicklung und mit möglichst vollständiger aerober Energiebereitstellung und somit geringer Ermüdung. B. TYP 2 (SCHNELLE FASERN): Anaerobes Gewebe. Beispiel: Skelettmuskeln für kurzzeitige schnelle Leistung (kräftige, schnelle Kontraktion). wenige Mitochondrien („weiße Muskelfasern“) und Myoglobin. ATP wird hauptsächlich über die Glycolyse mit anschließender Lactatbildung erzeugt. Anaerobe Glykolyse: ATP-Produktion 100mal schneller als bei oxidativer Phosphorylierung. Muskelkater (Muskelermüdung, Muskelschmerz) ist KEINE Lactatanhäufung, sondern Akkumulation der durch Glycolyse erzeugten Säure: Glucose + 2 ADP + 2 Pi 2 Lactat + 2 ATP + 2 H+ Muskeln können ihre Arbeitsleistung auch bei hoher Lactatkonzentration aufrechterhalten, wenn der pH-Wert konstant gehalten wird ( das Fleisch eines gehetzten Tieres schmeckt durch LactatAkkumulierung in den Muskeln sauer). Bilanz der Reaktionsfolge Glucose Lactat: Glucose + 2 ADP + 2 Pi 2 Lactat + 2 ATP + 2 H+ vgl. Oxidative Phosphorylierung: 38 ATP/Glucose (bei Annahme 3 ATP pro NADH) Pasteur: „Hefe benötigt bei anaerobem Wachstum wesentlich mehr Zucker als bei aerobem Wachstum“ (Pasteureffekt). Blut Leber Glucose Muskel Glycogen Glucose ATP + GDP+ Pi ADP + Pi GLYCOGENOLYSE GLYCOLYSE GLUCONEOGENESE ATP, GTP ATP Lactat Lactat CORI-ZYKLUS Die Lactatbildung ist im Stoffwechsel ein totes Gleis. Das Lactat muss in Pyruvat zurückverwandelt werden, bevor es metabolisiert werden kann. Es ist zu beachten, dass die Umwandlung von Glucose in Lactat keine Netto-Oxidations-Reduktions-Reaktion darstellt. Die Lactat-Bildung bringt Zeitgewinn und verlagert einen Teil des Stoffwechsels von der Muskulatur zur Leber. Wie? Die Plasmamembran der meisten Zellen ist für Lactat und Pyruvat hochpermeabel. Beide Substanzen diffundieren aus dem aktiven Skelettmuskel in das Blut und werden zur Leber transportiert. Im Muskel wird aufgrund des hohen NADH/NAD+-Verhältnisses aus Pyruvat Lactat gebildet, das ins Blut abgegeben wird. In der Leber jedoch ist das NADH/NAD+-Verhältnis im Cytosol niedrig und somit die Lactat-Oxidation zu Pyruvat begünstigt. Das gebildete Pyruvat wird in der Leber in der sog. Gluconeogenese zu Glucose umgewandelt, die über das Blut wieder zur Skelettmuskulatur gelangen kann (Cori-Zyklus). Bei der Muskelkontraktion und in Erythrocyten entstehen aus Pyruvat neben Lactat auch Alanin durch Transaminierung. Wiederum läuft in der Leber die umgekehrte Reaktion ab. Neben Lactat ist Alanin das wichtigste Rohmaterial für die Gluconeogenese. Alanin-Aminotransferase, die in Säugetiergeweben reichlich vorkommt, katalysiert die Übertragung der Aminogruppe des Alanins auf -Ketoglutarat: Alanin + -Ketoglutarat Pyruvat + Glutamat In der Leber, wo in Säugetieren hauptsächlich der AminosäureAbbau stattfindet, wird Alanin in Pyruvat umgewandelt, das dann in der Gluconeogenese verwendet werden kann. HPO42- 1. Homolactische Fermentation O CHO H 2. Alkoholische Fermentation C H OH COPO32C OH 1,3-BPG CH2OPO32- CH2OPO32- Glycerinaldehyd3-phosphat Alkoholische Gärung In Hefe wird NAD+ unter anaeroben Bedingungen durch die Umwandlung von Pyruvat in Ethanol und CO2 regeneriert ( Herstellung alkoholischer Getränke bzw. Aufgehen des Hefeteigs). Ethanol und CO2 werden in Hefezellen durch zwei Reaktionen erzeugt. NAD+ NADH + H+ H3C O Pyruvat C COO- O PyruvatDecarboxylase C H CO2 Ethanol H3C OH C H H AlkoholDehydrogenase H3C Acetaldehyd Hefe Pyruvat-Decarboxylase Pyruvat Acetaldehyd + CO2 Enzym: CO2 O H3 C Lyase O O C C H3 C O- C H Pyruvat-Decarboxylase (EC 4.1.1.1.) Hefe Cofaktor: Decarboxylierung von Pyruvat unter Bildung von Acetaldehyd und CO2. Thiaminpyrophosphat Pyruvat Acetaldehyd Enzym: Pyruvat-Decarboxylase (kommt bei Tieren und Menschen nicht vor!). Coenzym: Thiaminpyrophosphat (TPP). Häufigstes Coenzym bei -KetocarbonsäureDecarboxylierungen Thiaminpyrophosphat H3C PyrimidinDerivat NH2 H2 4 5 3 C N 2 1S C N H3C H2 C C O H2 Thiaminpyrophosphat O O O- P saures Proton O- O- 1 5 2 saures Proton H N O P Der Thiazoliumring bildet die katalytisch aktive funktionelle Gruppe der Pyruvat-Decarboxylase. Im Menschen findet man dieses Coenzym u.a. in der Pyruvat-Dehydrogenase oder in der -Ketoglutarat-Dehydrogenase. 3 Dipolares Carbanion (YLID): 4 aktive Form des Coenzyms (Funktion als Elektronensenke) Stabilisierung durch pos. geladenes quarternäres Stickstoffatom O O - O C H3C O R' H3C R' O C C R O R N + H S R C C S C O R Bei der Decarboxylierung einer -Ketocarbonsäure würde im Übergangszustand eine negative Ladung am verbleibenden Carbonylkohlenstoff entstehen, was aber einem sehr instabilen Zustand entsprechen würde. Der Übergangszustand kann aber durch Delokalisierung der negativen Ladung innerhalb einer Elektronensenke (=TPP) stabilisiert werden. N O H3 C C C O- H3C C C O- OH O Nucleophiler Angriff der Ylidform des TPP am Carbonylkohlenstoff des Pyruvats und in der Folge Austritt des CO2 unter Bildung eines resonanzstabilisierten Carbanions. H3C R' N R H3C CO2 S N R C S C C O H3C - OH C H 3C Protonierung des Carbanions C OH Resonanzstabilisiertes Carbanion R' N H 3C Resonanzstabilisiertes Carbanion S C R H3C S C Hydroxyethyl-TPP R N R H+ R' OH OH H3C S C H3C C H3C R' N R C O H3C H3C R' R' N H 3C OH C H OH Pyruvat-Decarboxylase aus Hefe C + H+ H S C C O H 3C Hefe, Mensch Eliminierung des TPP-Ylids und Produktfreisetzung H3C R R' N S TPP (Ylid) C Alkohol-Dehydrogenase Acetaldehyd + NADH + H+ Ethanol + NAD+ TPP Enzym: Oxidoreductase Alkohol-Dehydrogenase (EC 1.1.1.1.) Hefe (Tetramer), Mensch: Leber (Dimer) Cofaktoren: NADH , Zn2+ Acetaldehyd Ethanol TPP O H3C NADH NAD+ H3C C H Alkohol- Dehydrogenase Humaner Stoffwechsel: Primäre Alkohole, insbesondere Ethanol, werden in zwei Schritten in der Leber metabolisiert: OH C H Alkohol-Dehydrogenase (ADH): H Ethanol + NAD+ Acetaldehyd + NADH + H+ Aldehyd-Dehydrogenase (ALDH): Hefe: ADH ( “yeast“-ADH, YADH): Tetramer Acetaldehyd + NAD+ Acetat + NADH + H+ Mensch: Leber-ADH. Thiokinase: Alkohol-Quelle: a) zugeführt („Nahrung“) b) von Darmflora (anaerob) produziert Acetat + CoA + ATP Acetyl-CoA + AMP + PPi Dimer: Hohe Homologie zwischen YADH und humaner ADH, Zn2+-abhängige Reaktion Alkohol und Aldehyd, jedoch nicht das Acetat sind giftig. Letzteres kann z.B. als Acetyl-CoA im Citrat-Cyclus verwertet werden. Die Alkohol-Dehydrogenase ist ein Zink-Protein, während die Aldehyd-Dehydrogenase ein Molybdän-Eisen-Flavoprotein ist. Katalytisches Zink von außen nicht sichtbar Das katalytische Zink-Ion sitzt in einer etwa 20 Å tiefen Tasche in der Verbindungsstelle von zwei Domänen. In dieser Tasche befinden sich auch Substrat und CoenzymBindungsstellen. grün: NAD+ CH3 H S C H O Zn S N Das elektropositive Zink-Ion, Zn2+, fördert die Deprotonierung des Substrats unter Bildung von koordiniertem RO-, Ethanolat. Funktion des Zink-Ions als Lewis-Säure (= Elektronenmangelverbindung) Zink ist für die Bindung des Alkohols nötig, nicht jedoch für die Bindung des Coenzyms NAD+, das an der anderen Domäne bindet. Die redoxaktive Position des Nicotinamid-Rings des Cofaktors NAD+ ist mit einem Pfeil gekennzeichnet. His Cys Zn2+ Cys CH3 H C H S O Zn S N Schematische Darstellung des NAD+-bindenden Bereichs in der ADH der Leber. Die Bindung des Coenzyms NAD+ an ADH ist mit einer Konformationsänderung des Proteins von einer offenen zu einer geschlossenen Form verbunden (induced fit: Drehung der beiden Domänen um etwa 10°). Das Coenzym wird dadurch für die HydridIonen-Übertragung vom -Kohlenstoffatom des Alkohols auf den Nicotinamidring richtig positioniert. Nach der Elektronenübertragung dissoziieren Produkt und NADH rasch ab. Humane ADHs oxidieren verschiedenartige kurzkettige primäre und auch sekundäre aliphatische Alkohole (mit sehr unterschiedlichen Reaktionsgeschwindigkeiten). Es gibt verschiedene ADH-Isoformen unterschiedlicher Reaktivität. Hydrid-Übertragung vom zinkgebunden Ethanolat-Ion auf NAD+ unter Bildung von Acetaldehyd und NADH Methanol wird auch (relativ langsam) umgesetzt und damit zu toxischem(!) Formaldehyd oxidiert. Bei Methanol-Vergiftungen versucht man diese Reaktion durch Ethanolgaben zu unterdrücken! Andere Alkohole wie n-Propanol oder n-Butanol werden zwar rasch zum entsprechenden Aldehyd oxidiert, jedoch nur langsam weiteroxidiert ( unangehme physiologische Nebenreaktionen). Bei der Ethanol-Oxidation entstehender Acetaldehyd ruft “Kater”ähnliche Syndrome hervor. Das für die Oxidation verantwortliche Enzym Aldehyd-Dehydrogenase kann - genetisch bedingt – ineffizient arbeiten (häufig bei Ostasiaten) Ansteigen des Acetaldehyd-Spiegels. Alkoholtherapie: Durch Verabreichung des Schwermetallkomplexierenden Tetraethylthiuramdisulfids (Disulfiram, “Antabus”) wird das Metalloenzym Aldehyd-Oxidase inaktiviert. Hohe AldehydKonzentrationen werden dabei also bewußt zur Erzeugung von unangenehmen Nebenwirkungen eingesetzt. Unterschiedliche ADH-Verfügbarkeit wird dafür verantwortlich gemacht, dass Ethanol an Missbildungen und Krebsentstehung beteiligt sein kann. Frauen verfügen z.B. im Gastro-Intestinalbereich über weniger ADH, sodass bei gleichem Alkoholkonsum mehr in die Blutbahn und in das zentrale Nervensystem gelangen kann. Warum schädigt Alkohol die Leber? Sowohl ADH als auch ALDH produzieren in der Leber NADH, das akkumuliert und die Oxidation von Lactat zu Pyruvat (und somit die Gluconeogenese) hemmt. Folge Hypoglykämie und Lactatacidose! Der Überschuss an NADH hemmt auch die Fettsäureoxidation. Folge: Fettleber. 1. Homolactische Fermentation 2. Alkoholische Fermentation 3. Aerobe Oxidation Aerobe Oxidation Im Zuge der aeroben Oxidation werden Reduktionsäquivalente (NADH, FADH2) letztendlich in der Atmungskette der Mitochondrien oxidiert. Neben dem in der Glycolyse anfallenden NADH, entstehen weitere Reduktionsäquivalente im CitronensäureCyclus. Die Pyruvat-Dehydrogenase verbindet die Stoffwechselwege der Glycolyse und des Citronensäure-Cyclus. Acetylgruppen treten als Acetyl-CoA, das gemeinsame Produkt des Kohlenhydrat-, Fettsäure- und Aminosäureabbaus, in den Citronensäure-Cyclus ein. Im Kohlenhydrat-Stoffwechsel katalysiert die PyruvatDehydrogenase die Umwandlung von Pyruvat in Acetyl-CoA. Glucose Glycolyse Aerobe Option: Oxidation von NADH in der Atmungskette der Mitochondrien. In diesem Fall unterliegt das Pyruvat der enzymatischen Decarboxylierung unter Bildung von Acetyl-CoA, das in den sog. Citronensäure-Cyclus (TricarbonsäureCyclus; TCA-Cyclus; Krebs-Cyclus) eingeschleust wird. Dort wird Acetyl-CoA oxidativ formal zu CO2 abgebaut. Pyruvat Acetyl-CoA Pyruvat - DH TCACyclus Acetyl-CoA Elektronentransport Oxidative Phosphorylierung Der TCA-Zyklus ist verantwortlich für den größten Teil der Kohlenhydrat-, Fettsäureund Aminosäureoxidation. Neben seiner herausragenden Rolle im katabolen Stoffwechsel, stellt der Citronensäurezyklus aber auch zahlreiche Zwischenstufen für Biosynthesen zur Verfügung (amphibolische Natur des Citronensäure-Cyclus). Äußere Membran Cristae TCACyclus Matrix Im Citronensäure-Cyclus werden die (u.a. durch PyruvatDehydrogenase) gebildeten Acetyl-CoA-Einheiten formal zu CO2 oxidiert. Nettoreaktion: 3 NAD+ + FAD + GDP + Acetyl-CoA + Pi + 2 H2O 3 NADH + FADH2 + GTP + CoA + 2 CO2 + 2 H+ Die gebildeten Reduktionsäquivalente werden anschließend in der Atmungskette mittels molekularem Sauerstoff reoxidiert.. Innere Membran Matrix Intermembranraum Mitochondriale Matrix: enthält (u.a.) Enzyme des CitronensäureCyclus sowie den Multienzymkomplex Pyruvat-Dehydrogenase (Rinderherz: 8400 kDa), der aus Pyruvat Acetyl-CoA synthetisiert. Wie gelangt das Endprodukt der Glycolyse, Pyruvat, in die mitochondriale Matrix? • Es gibt mehrere mitochondriale Transportsysteme für Ionen und geladene Metaboliten: Der Pyruvat-Carrier befördert entweder im Austausch gegen OH- (Pyruvat/OH--Antiport) oder zusammen mit H+ (Pyruvat/H+-Symport) Pyruvat vom Cytosol in die Mitochondrien. • Der Eintritt von ADP in die Mitochondrien ist mit dem Austritt von ATP über eine sog. ATP-ADP-Translocase gekoppelt • Der Phosphat-Carrier arbeit in Abstimmung mit der ATPADP-Translocase und vermittelt den elektroneutralen Austausch von Pi und OH-. • Der Dicarboxylat-Carrier befördert Malat, Fumarat und Succinat im Austausch gegen Pi aus dem Mitochondrium. Innere Membran • Der Tricarboxylat-Carrier befördert Citrat und ein Proton im Austausch gegen Malat. Cytosol Diesen mitochondrialen Carriern liegt ein gemeinsames Strukturmotiv zugrunde. Sie bestehen aus drei ähnlichen, jeweils etwa hundert Reste umfassenden Einheiten mit jeweils 2 Transmembran-Helices: Matrix 1 2 3 4 5 6 COO- NH3+ Pyruvat-Dehydrogenase Pyruvat + CoA + NAD+ Acetyl-CoA + CO2 + NADH Enzym: E.C 1.2.4.1 (Oxidoreductase) Cofaktoren: TPP, CoA, FAD, NAD+ und Liponamid Pyruvat-Dehydrogenase Multienzymkomplex (Rinderherz: 8400 kDa): Pyruvat-Dehydrogenase (E1): 30 E1-22-Tetramere Dihydrolipoyl-Transacetylase (E2): 60 E2-Monomere (Kern des Komplexes) Dihydrolipoyl-Dehydrogenase (E3): 6 E3-Dimere Multienzymkomplexe: hohe katalytische Effizienz durch geringere Distanzen für Edukte und Intermediate, weniger Nebenreaktionen und besser koordinierte Kontrolle. Modell der PyruvatDehydrogenase: DihydrolipoylTransacetylase (E2)Kern PyruvatDehydrogenase (E1, gelb) DihydrolipoylDehydrogenase (E3) A B Elektronenmikroskopische Aufnahme des Pyruvat-DH-Komplexes aus E. coli (A) und des Dihydrolipoyl-Transacetylase (E2)-“Kerns“ (B). Pyruvat-Dehydrogenase ist eines der kompliziertesten Enzyme, da es zahlreiche Cofaktoren benötigt, die aus vitaminischen Vorstufen synthetisiert werden. Die Vitamine werden aus der Nahrung aufgenommen. Vitamine B sind wasserlöslich! Vitamine in rot sind für die Funktionalität der Pyruvat-DH essentiell: Coenzyme und prosthetische Gruppen der Pyruvat-Dehydrogenase Cofaktor Einordnung Funktion Thiaminpyrophosphat, TPP An E1 gebunden Pyruvatdecarboxylierung Liponsäure kovalent an E2 gebunden Übernimmt HydroxyethylCarbanion von TPP Substrat für E2 Übernimmt die Acetylgruppe vom Liponamid Coenzym A (CoA) Flavinadenindinucleotid An E3 gebunden NAD+ Substrat für E3 Wird durch Liponamid reduziert Durch FADH2 reduziert Thiaminpyrophosphat saures Proton 1 5 2 3 Dipolares Carbanion (YLID): 4 aktive Form des Coenzyms (Funktion als Elektronensenke) Stabilisierung durch pos. geladenes quarternäres Stickstoffatom Wie wird Thiamin in Thiaminpyrophosphat im menschlichen Körper umgewandelt? Vitamin Cofaktor Thiamin (Vitamin B1) Thiaminpyrophosphat Riboflavin (Vitamin B2) FAD Niacin (Vitamin B3) NAD+ Pantothenat (Vitamin B5) Coenzym A Pyridoxin (Vitamin B6) Pyridoxalphosphat (siehe Glykogen- und Aminosäurestoffwechsel) Vitamin B12 Cobalamin (Fettsäurestoffwechsel) Thiaminpyrophosphat ist an vielen Decarboxylierungsreaktionen als Cofaktor beteiligt. Es leitet sich vom Thiamin ab, das als Vitamin B1, das vom Menschen weder synthetisiert noch in ausreichender Menge gespeichert werden kann, mit der Nahrung aufgenommen werden muss. Ein Mangel führt beim Menschen zu einer lebensgefährlichen Erkrankung, der Beriberi, bei der es zu neurologischen Ausfällen kommt (das Nervensystem verlässt sich im Wesentlichen auf Glucose als Brennstoff!; d.h. sein Energiestoffwechsel kommt zum Erliegen): Schmerzen, Lähmungen, Atrophie (Muskelschwund) der Extremitäten, Ödeme (Flüssigkeitsansammlungen in Geweben und Körperhöhlen). Beriberi tritt typischerweise in Ländern des Orients auf, in denen Reis Hauptnahrungsmittel ist. Der Reis wird poliert, wobei seine groben, aber thiaminhaltigen Schichten entfernt werden. H H O C C O S CH2 CH2 NH C CH2 CH2 NH H Thiamin wird in der Leber in die Pyrophosphatform übergeführt und in der Niere dephosphoryliert (Ausscheidung). Im Mitochondrium der Leber erfolgt die Umwandlung von Thiamin zu Thiaminpyrophosphat (TPP) durch die Thiamin-Kinase: Thiamin + ATP TPP +AMP Neben seiner Funktion als Cofaktor in Decarboxylierungsreaktionen (Pyruvat-Dehydrogenase, -Ketoglutarat-Dehydrogenase), fungiert TPP als Überträger von C2-Einheiten in Transketolasen (siehe Pentosephosphat-Cyclus). Acetyl-CoA Acetyl-CoA + H2O CoA + Acetat G’ = -31,5 kJ/mol Die Bildung der Thioesterbindung konserviert die Freie Enthalpie des Pyruvats in der Pyruvat-DH-Reaktion. O OH CH3 C CH C CH2 O CH3 ADP Acetylgruppe Pantothensäure kann vom Menschen nicht synthetisiert werden. Cysteamin Adenosin-3’phosphat Wie wird Pantothenat in Coenzym A im menschlichen Körper umgewandelt? C C C H2 H CH3 HO Pantothenat ist das wasserlösliche Vitamin B5! Mangelerkrankungen sind sehr selten. Pantothensäure-Rest Pantothenat CH3 OH O C ATP Pantothenat-Kinase ADP CH3 OH O O O P C C C H2 H CH3 O O C 4’-Phosphopantothenat O O P O CH3 OH O O C C C H2 H CH3 O C ATP + Cystein P Phosphopantothenoylcystein -Synthase O ADP + Pi O P O O P C C C H2 H CH3 C O N H C CH2 C H2 NH CH CH2 Adenosin P O O P O O C C C H2 H CH3 C N H C CH2 C H2 NH P C C C H2 H CH3 C CH2 SH H O N H C CH2 C H2 O CH P CH3 OH O O C C C H2 H CH3 O C NH CH CH2 SH O N H C CH2 C H2 H2C CH2 CH2 S SH O CH H2C C C CH2 C H2 H2 ATP DephosphoCoA-Kinase CH CO2 O O H O NH PPi SH S CH3 OH O C CH2 C H2 Dephospho-CoAPyrophosphorylase O O COO- O N H ATP COO- Adenosin O C CH3 OH O O O CH3 OH O C C C H2 H CH3 Phosphopantothenoylcystein-Decarboxylase O O CH3 OH O O O C CH2 COOH2 N H C CH2 COOH2 N H Acetyl-Coenzym A (Acetyl-CoA) O C CH2 COOH2 N H NH NH (CH2)4 CH C O Liponamid 2 H+ + 2 e- ADP HS H2C HS CH CH2 H2C O C C CH2 C H2 H2 NH NH Phosphorylierung Dihydroliponamid (CH2)4 CH C O H NH CH CH2 SH Liponsäure kovalent über Amidbindung an Lysin im aktiven Zentrum des Enzyms gebunden Liponsäure (6,8-Dithiooctansäure) ist kein Vitamin, kann vom Menschen endogen synthetisiert werden Flavinadenindinukleotid (FAD) NH2 N O D-Ribitol CH2 O P H C OH O H C OH H C OH O O P N O CH2 O H H OH N Adenosin -diphosphat N O H H OH Der Mensch kann die Isoalloxazin-Komponente der Flavine nicht synthetisieren. Muss in Form des Vitamins B2 (Riboflavin) aufgenommen werden. CH2 H3C H3C N N 5 12 4 3N N D-Ribitol CH2OH O H C OH H C OH H C OH (stammt vom Alkohol des Zuckers DRibose) Riboflavin (Der Ausdruck CH2 Isoalloxazinring H H3C N H3C N N “Flavin” ist synonym mit dem Isoalloxazinring) O O Isoalloxazin N H O O Wie entstehen die Cofaktoren FMN und FAD aus dem Vitamin Riboflavin? O CH2 OH H C CH2 O OH H C OH H C OH H C OH H C OH H C OH ATP CH2 H3C N N N H3C ADP O N H O N H3C C OH O H C OH H C OH O H3C O ATP PPi N N O H3C N H Flavinmononucleotid, FMN CH2 O P OH O C H C OH H C OH O N P Riboflavinmononucleotid, FMN H3C N H3C N O CH2 O H H CH2 O Riboflavin O H H N N O O O N NH2 FAD-Pyrophosphorylase N N O P H CH2 CH2 H3C Flavokinase P CH2 O O N OH N N O H H OH Flavinadenindinucleotid, FAD N H O Struktur von Nicotinamidadenindinucleotid (NAD+) H O C NH2 Nicotinamid (ein Pyridinderivat) Nicotinamid (synonym Niacinamid) oder das Carbonsäure-Analogon Nicotinsäure (Niacin) sind Vitaminvorstufen (Vitamin B3) für das Coenzym NAD+ oder NADP+. N O O O H H OH H OH P O N O N N N O O P O O H H H OH H OH C NH2 D-Ribose NH2 O O C H N Adenosindiphosphat NAD Nicotinamid (Niacinamid) OH N Nicotinsäure (Niacin) Der Mensch kann Nicotinamid auch aus dem TryptophanAbbauprodukt Chinolinat synthetisieren. Bei Mangelernährung ist dieser Weg aber nicht aktiv, weil Tryptophan in der Proteinbiosynthese benötigt wird. Wie entstehen die Cofaktoren NAD+ und NADP+ aus den Vitaminen Niacin bzw. Niacinamid? O O C Nicotinat (Niacin) O- C Nicotinamid (Niacinamid) N N H NicotinatPRPP Phosphoribosyltransferase PP H PRPP ist 5-Phosporibosyl1-pyrophosphat O i C O P O P N O H OH H OH NH2 Nicotinamidmononucleotid O O- H O C - O H PPi O N O O- NicotinamidPhosphoribosyltransferase PRPP NH O-2 O - NH2 H Nicotinatmononucleotid H H OH H OH O O C NH2 C ATP NH2 PPi PRPP ist die aktivierte Form von Ribosephosphat. Neben der Biosynthese von NAD(P)+ aus dem Vitamin B3, ist 5-Phosphoribosyl-1-pyrophosphat auch eine Schlüsselsubstanz bei der Biosynthese von Purin und Pyrimidinnucleotiden und bei der Synthese von Histidin. Nicotinat-adenindinucleotid O C O - O P N N O O OH H H OH H OH NAD+Pyrophosphorylase Ribose O O C O - OO C Adenin O P PPi O OH H H OH H OH NAD+Pyrophosphorylase Nicotinatmononucleotid Ribose Pi Nicotinatadenindinucleotid NH2 N H H OH OH P O N P N O O H H OH O O P 2 1 N O H NAD+ Pi Pi Pi Adenin NAD+-Kinase: Ribose Adenin NAD+ + ATP NADP+ + ADP H O Modell der PyruvatDehydrogenase: DihydrolipoylTransacetylase (E2)Kern N O O Struktur von Nicotinamidadenindinucleotidphosphat (NADP+) 4 NH2 O (Ligase) Ribose Adenin O H NH2 Pi Ribose C H C O H O Ribose Ribose N N O NAD+-Synthase Pi O- OO O - O N N Ribose ATP O- AMP ADP++PPi + Glutamat NAD+ Pi Pi Nicotinamidmononucleotid ATP + Glutamin + H20 Die reaktive Gruppierung (= C4-Position des Nicotinamid) ist bei NAD+ und NADP+ ident. PyruvatDehydrogenase (E1, gelb) DihydrolipoylDehydrogenase (E3) O Pyruvat + CoA + NAD+ Acetyl-CoA + CO2 + NADH Coenzyme und prosthetische Gruppen der Pyruvat-Dehydrogenase Cofaktor Einordnung Funktion Thiaminpyrophosphat, TPP An E1 gebunden Pyruvatdecarboxylierung Liponsäure Übernimmt HydroxyethylCarbanion von TPP kovalent an E2 gebunden Coenzym A (CoA) Substrat für E2 Flavinadenindinucleotid NAD+ R An E3 gebunden Substrat für E3 H3C R' N Übernimmt die Acetylgruppe vom Liponamid Wird durch Liponamid reduziert Durch FADH2 reduziert H3C CO2 S - O H3C R' TPP-E1 N R H3C H S R C O O C C O O N S C - R' + CH3 C C O OH CH3 Bindung der Ketocarbonsäure an die Ylid-Form des TPP Pyruvat Struktur des Transacetylasekerns (E2) R' N R C Die Funktion des Cofaktors Thiaminpyrophosphat in E1 von Pyruvat-DH ist analog jener in Pyruvat-Decarboxylase von Hefe: S C C C O OH CH3 HO C Jede Untereinheit besteht aus drei Domänen: CH3 einer LiponamidBindungsdomäne, Hydroxyethyl-TPP-E1 Pyruvat-Dehydrogenase (E1): Decarboxylierung von Pyruvat unter Bildung von Hydroxyethyl-TPP einer kleinen Domäne zur Wechselwirkung mit E3 und Anschließend wird die C2-Einheit an E2 weitergegeben. Hydroxyethyl-TPP wird durch Liponamid-E2 oxidiert: einer großen katalytischen Transacetylasedomäne Jede rote Kugel stellt ein Trimer aus drei E2-Untereinheiten dar H3C R H3C R' N S R N C H3C R' H+ R S N C Eliminierung des TPP S C C HO HO H3C R' CH3 HO C C R' N R S C CH3 CH3 O C CH3 S S S S HS Liponamid-E2 E2 HS E2 S E2 Angriff des Hydroxyethyl-Carbanions am Liponamiddisulfid HS E2 Bildung von Acetyl-dihydrolipoylamid-E2 Acetyl-CoA CoA CoA O C Der Lipoyllysyl-Arm von E2 “vermittelt” im Multienzym-Komplex PyruvatDehydrogenase zwischen E1 und E3. Auch innerhalb der Lipoyl-Gruppen von E2 werden Austauschreaktionen beobachtet: O SH S C CH3 CH3 14 Å HS S HS HS E2 E2 Dihydrolipoylamid-E2 Acetyl-dihydrolipoylamid-E2 Dihydrolipoyl-Transacetylase (E2) überträgt schließlich die Acetylgruppe auf CoA unter Bildung von Acetyl-CoA und Dihydroliponamid-E2. Lipoyllysyl-Arm (voll ausgestreckt) Der Reaktionszyklus von Pyruvat-Dehydrogenase wird schließlich vollendet, wenn durch die Dihydrolipoyl-Dehydrogenase (E3) Liponamid regeneriert wird: Oxidiertes Enzym enthält reaktive Disulfidgruppe und FAD: Reoxidation von Dihydrolipoylamid durch Disulfidaustauschreaktion. Oxidation des Lipoylamids bei gleichzeitiger Reduktion des reaktiven Disulfids von E3. 1. Reoxidation der Sulfhydrylgruppen durch FAD FAD FAD 2. Reoxidation des FADH2 durch NAD+ SH S SH E3 (reduziert) S E3 (oxidiert) Reduziertes E3 wird durch NAD+ reoxidiert: NAD+ S HS S E2 FAD S SH HS NADH + H+ FADH2 FAD SH E3 (reduziert) S S S E3 (oxidiert) E2 Überblick: Pyruvat-Dehydrogenase Multienzymkomplex DihydrolipoylDehydrogenase (E3) PyruvatDehydrogenase (E1) DihydrolipoylTransacetylase (E2) Pyruvat + CoA + NAD+ Acetyl-CoA + CO2 + NADH Regulation der Pyruvat-Dehydrogenase Glucose Der Multienzymkomplex Pyruvat-Dehydrogenase reguliert den Eintritt von aus Kohlenhydraten stammenden Acetyleinheiten in den Citronensäure-Cyclus. Die Decarboxylierung von Pyruvat durch E1 ist irreversibel (= exergonischer Schritt im Gesamtzyklus: G‘ etwa –30 kJ/mol) und stellt daher wieder einen Regulationspunkt dar. Glycolyse Gluconeogenese Pyruvat Glucose kann auch aus Pyruvat entstehen (siehe Gluconeogenese, siehe Einheit 9). In tierischen Zellen ist jedoch die Bildung von Acetyl-CoA aus Pyruvat ein irreversibler Schritt des Stoffwechsels und daher können tierische Zellen Acetyl-CoA nicht in Glucose umwandeln. Die oxidative Phosphorylierung von Pyruvat zu Acetyl-CoA bedeutet für die Kohlenstoffe der Glucose zwei mögliche Schicksale: a) Oxidation zu CO2 im Citrat-Cyclus b) Einbau in Lipide Acetyl-CoA Citrat-Cyclus CO2 Drei regulatorische Systeme: 1. 1. Produkthemmung durch NADH und Acetyl-CoA Fettsäureoxidation bzw. -synthese Lipide Produkthemmung durch NADH und Acetyl-CoA Konkurrenz von NADH und Acetyl-CoA mit NAD+ und CoA um Bindungsstellen am Enzym Hohe Konzentrationen an Reaktionsprodukten (NADH, Acetyl-CoA) hemmen die Pyruvat-Dehydrogenase. Große Verhältnisse [NADH]/[NAD+] und [Acetyl-CoA]/[CoA] bewirken, dass E2 in der acetylierten Form bleibt. E1 kann die Hydroxyethylgruppe nicht abgeben. TPP bleibt in der Hydroxyethyl-Form. 2. Kovalente Modifikation durch Phosphorylierung/ Dephosphorylierung der Untereinheit E1 Bei Eukaryoten ist kovalente Modifikation das wichtigste Mittel der Regulation. Die Phosphorylierung der PyruvatDehydrogenase durch eine spezifische Kinase schaltet die Aktivität des Komplexes ab. Die Inaktivierung wird durch eine spezifische Phosphatase wieder aufgehoben. NADH und Acetyl-CoA treiben somit die Transacetylase (E2) und die DihydrolipoylDehydrogenase (E3) rückwärts. 3. Das Hormon Insulin induziert die Synthese von PyruvatDehydrogenase (auch von Glucokinase, Phosphofructokinase und Pyruvatkinase; siehe Einheit 9) 2. NAD+ Kovalente Modifikation durch Phosphorylierung/ Dephosphorylierung der Untereinheit E1 Nur in eukaryotischen Enzymkomplexen. CO2 Pyruvat NADH E3 HydroxyethylTPP Liponamid E1 E2 TPP Acetyldihydroliponamid Dihydroliponamid Acetyl-CoA CoA Produkthemmung: NADH und/oder Acetyl-CoA konkurrieren in den Reaktionen 3 und 5 mit NAD+ und CoA. Die von E2 und E3 katalysierten reversiblen Reaktionen werden durch Produkthemmung rückwärts getrieben. Phosphorylierung durch Pyruvat-Dehydrogenase-Kinase und Dephosphorylierung durch Pyruvat-DehydrogenasePhosphatase (am Dihydrolipoyl-Transacetylase-Kern gebunden) Kinase: Inaktivierung von E1 durch Phosphorylierung eines Serin-Restes (Phosphorylierung nicht von cAMP abhängig). Kinase selbst durch NADH und Acetyl-CoA aktiviert Phosphatase: Hydrolyse des Phosphoserin-Restes aktiviert Komplex Quecksilber- und Arsenverbindungen sind giftig! Warum? Aktivatoren Mg2+ Pi Ca2+ E1-OH (aktiv) ATP Pyruvat-DHPhosphatase PyruvatDH-Kinase E1-OPO32(inaktiv) H2 O ADP Aktivatoren Acetyl-CoA NADH Inhibitoren Pyruvat, ADP, Ca2+, Mg2+ Beide Metalle haben eine hohe Affinität zu (benachbarten) Sulfhydrylgruppen, so auch zu den reduzierten Dihydrolipoylgruppen der Pyruvat-Dehydrogenase. Die Bindung von Quecksilber oder Arsenit (AsO33-) hemmt das Enzym und führt zu Erkrankungen des Zentralnervensystems! Für das Nervensystem und Gehirn ist Glucose die wichtigste Energiequelle. Wird daher ein Schlüsselenzym wie die PyruvatDehydrogenase inhibiert, kommt der Energiestoffwechsel des Nervensystems praktisch zum Erliegen. „Hutmacherkrankheit“: Früher wurde Quecksilbernitrat als Weichmacher tierischer Felle verwendet! Kovalente Modifikation Ähnliche Probleme hatten frühe Fotografen, die dampfförmiges Quecksilber bei der Daguerrotypie verwendeten. Arsenit (AsO33-), bildet kovalente Verbindungen mit Sulfhydrylgruppen, z.B. mit Dihydrolipoylamid (= zweizähniger Ligand) Entgiftung mit Sulfhydrylreagenzien Gilt auch für methylierte Arsenverbindungen: R O HS R S As As R' HS R' R H2O S R


![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)