Stabilität von Nitroxylradikalen
Werbung

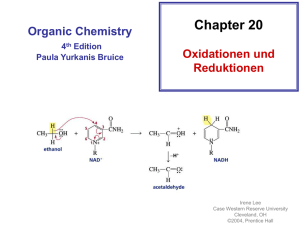
Oxidationen mit TEMPO Christopher Rose/ Stefan Weiß Gliederung: 1.) Stabilität/ Labilität von Nitroxylradikalen 2.) TEMPO- ein stabiles Radikal 3.) Vorteile von TEMPO gegenüber anderen (gewöhnlichen) Oxidationsmitteln 4.) Redox- Chemie von TEMPO 5.) Möglichkeiten der Reaktionsführung 6.) Mechanismus der Alkoholoxidation 7.) Produktdifferenzierung durch Wahl der Reaktionsbedingungen 8.) Zusammenfassung 1.) Stabilität/ Labilität von Nitroxylradikalen Einflussfaktoren auf Stabilität/ Labilität: Sterische Hinderung Stabilität gegenüber (radikal.) Disproportionierung Delokalisation des ungepaarten Elektrons 2.) TEMPO- Ein stabiles Radikal Keine - Wasserstoffatome! Me Me N Me Me Delokalisation des ungepaarten Elektrons nur über N-O- Bindung! O Sterische Abschirmung durch die Methylgruppen TEMPO= 2,2,6,6-tetramethylpiperidin- N- oxyl 3.) Wichtige Vorteile von TEMPO gegenüber anderen konventionellen Oxidationsmitteln Bei entsprechenden Reaktionsbedingungen: Selektive Oxidation von primären Alkoholen in Gegenwart sekundärer Alkohole Lediglich katalytische Mengen an TEMPO nötig „Saubere“ und leicht zugängliche Co-Oxidantien wie z.B. NaOCl 4.) Redox- Chemie von TEMPO R N ox. R red. OH R N R ox. R red. O + N R O Reaktive Spezies bei der Oxidation von Alkoholen! pH- Abhängigkeit: + R 2 N O R H R + H + N O R + R N R OH 5.) Möglichkeiten der Reaktionsführung 5.1 Separate Darstellung des Oxoammoniumsalzes Vorteil: Kein Co- Oxidans in der Reaktionsmischung vorhanden Nachteil: Stöchiometrische Mengen an TEMPO nötig Wird im Vergleich zur katalytischen Reaktionsführung eher selten angewandt! 5.2 Einbau in einen Katalysezyklus 5.2.1 pH < 2 2 Me Me N Me Me Me Me + N Me + Me Oxidation des Alkohols +Co- Oxidans Me 2 Me Me N OH Me Me N OH O O Me Me Me 5.2.2 pH > 3 2 Me Me Me N Me +Co- Oxidans 2 Me Me + N O O Me Me + N O Me Me Oxidation des Alkohols Me + Me Me Me Me N OH Me Gesamtübersicht Ox = Co- Oxidans 6.) Mechanismus der Alkoholoxidation „pH- abhängige“ Übergangszustände: pH < 2 Me Me Me Me N HO + O R2 Me Me Me N Me O + + R2 R1 OH B H R1 pH > 3 O Me Me N Me Me -O + O R1 H R2 Me Me Me N OH Me + R2 R1 BH+ 7.) Produktdifferenzierung durch Wahl der Reaktionsbedingungen 7.1. Reines organisches Lösungsmittel 7.2. Zweiphasiges- Lösungsmittelgemisch (wässrig/ organisch) 7.3. Homogen- wässriges Millieu 7.1. Reines organisches Lösungsmittel Oxidation nur bis zur Carbonylverbindung Reaktionsbeispiele: 7.2. Zweiphasiges- Lösungsmittelgemisch (wässrig/ organisch) Oxidation zum Carboxylat nur bei Verwendung von ausreichend hydrophilen Substraten in Verbindung mit Phasentransferkatalysatoren und, wenn gleichzeitig 2 eq CoOxidans eingesetzt werden. Reaktionsbeispiele: 7.3. Homogen- wässriges Millieu Ausschließliche Oxidation zum Carboxylat (Voraussetzung: mindestens 2 eq Co- Oxidans) Methode der Wahl zur Oxidation von (teilweise geschützten) Kohlehydraten Reaktionsbeispiel: Zusammenfassung: Die Oxidation von Alkoholen mit TEMPO bietet folgende Vorteile: Selektive Oxidation von primären Alkoholen in Gegenwart sekundärer Alkohole Es fallen keine toxischen Abfälle an Katalytischer Einsatz von TEMPO genügt (bei entsprechender Reaktionsführung); NaOCl als Co- Oxidans kostengünstig und einfach zugänglich Wahl der Reaktionsbedingungen (Lösungsmittel; Stoffmengenverhältnis Substrat/ Co-Oxidans) lässt eine Produktdifferenzierung Carbonylverbindung/ Carbonsäure zu Oxidationen mit TEMPO können meist unter relativ milden Bedingungen durchgeführt werden: Leicht alkalische Lösung/ Raumtemperatur bzw. geringfügig darüber oder darunter Kurze Reaktionszeiten: i. d. R. im Bereich 15min bis 5h Funktionelle Gruppen wie Doppel-/ Dreifachbindungen, Ester Ether, Acetale, Epoxide, Amide, Halogenide und Azide sowie die Schutzgruppen benzyl, acetyl, Cbz, Boc, MOM, THP, TBDMS werden nicht beeinträchtigt Quellen: Arjan E.J. de Nooy, Arie C. Besemer, Herman van Bekkum, Synthesis, 1996, 1153- 1174 Waldemar Adam, Chantu R. Saha-Möller, Pralhad A. Ganeshpure, Chem. Rev., 2001, 101, 3499- 3548