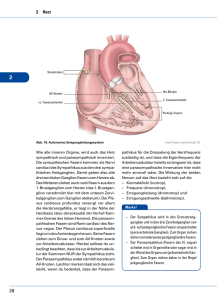
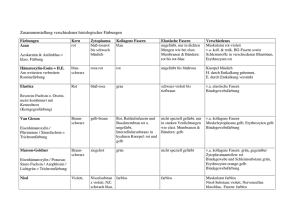
ZIP - FreiDok - Albert-Ludwigs
Werbung

Aus dem Anatomischen Institut I der Albert-Ludwigs-Universität Freiburg im Breisgau Direktor: Prof. Dr. med. M. Frotscher Die Körnerzellposition beeinflusst die Faserschichtung der Fascia dentata der Maus: Eine Studie an Reeler, Apolipoprotein E Receptor 2 defizienten und Very Low Density Lipoprotein Receptor defizienten Mäusen Inauguraldissertation zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs Universität Freiburg im Breisgau vorgelegt 2003 von Carl Alexej Werner Gebhardt geboren in Ulm/Donau 2 Dekan: Prof. Dr. med. Josef Zentner 1.Gutachter: Prof. Dr. med. Thomas Deller 2.Gutachter: Prof. Dr. med. Stefan Pollak Jahr der Promotion: 2003 3 Für meine Eltern 4 I Einleitung .................................................................................................................6 I-1 Einführung ..........................................................................................................6 I-2 Die Fascia dentata ..............................................................................................9 Abbildung 1: Schematische Darstellung des Hippokampus............................11 Abbildung 2: Die Schichten der Fascia dentata ..............................................11 I-3 Reelin und die reeler Maus ...............................................................................13 Abbildung 3: Schematisierte Darstellung der Reelin-Signaltransduktion über Lipoproteinrezeptoren .....................................................................................15 I-4 Einführung in die verwendeten Techniken ........................................................16 I-4-1 Anterograde Markierung von Nervenfasern mit Hilfe der Markierungssubstanz Phaseolus vulgaris-Leukoagglutinin ................................16 I-4-2 Immunhistochemie .....................................................................................17 Abbildung 4: Schematische Darstellung der Immunhistochemie mittels der Avidin-Biotin-Peroxidase Methode ..................................................................18 I-5 Mausmutanten ..................................................................................................18 II Material und Methoden.........................................................................................20 II-1 Verwendete Tiere ............................................................................................20 Abbildung 5: Genotypisierung von vldlr -/-, apoER2 -/- und rl -/- Mäusen mittels Polymerasekettenreaktion (PCR). .......................................................21 II-2 Tracer Injektionen ............................................................................................21 II-3 Gewebegewinnung und Gewebefixierung .......................................................22 II-4 Immunhistochemie...........................................................................................22 II-4-1 Neuronal Nuclei Immunfärbung ................................................................22 II-4-2 Calbindin Immunfärbung ...........................................................................23 II-4-3 Calretinin Immunfärbung...........................................................................23 II-4-4 Phaseolus vulgaris-Leukoagglutinin Immunfärbung..................................24 II-4-5 Entwicklung ...............................................................................................24 II-4-6 Immunfluoreszenzdoppelfärbung ..............................................................24 II-5 Polymerasekettenreaktion ...............................................................................25 II-6 Digitale Bildverarbeitung ..................................................................................25 III Ergebnisse ...........................................................................................................26 III-1 Verteilung von Nervenzellen in der Fascia dentata.........................................26 III-1-1 NeuN Immunhistochemie.........................................................................26 Abbildung 6: Verteilung von Neuronen in der Fascia dentata von vldlr -/-, apoER2 -/- und rl -/- Mäusen (NeuN Immunhistochemie). ..............................27 III-1-2 Calbindin Immunhistochemie ...................................................................27 Abbildung 7: Calbindin-positive Körnerzellen in der Fascia dentata von vldlr -/-, apoER2 -/- und rl -/- Mäusen..............................................................29 III-2 Die Termination entorhinaler Fasern erfolgt schichtenspezifisch....................30 Abbildung 8: Afferenzen aus der entorhinalen Rinde terminieren schichtenspezifisch in der Fascia dentata von vldlr -/-, apoER2 -/- und rl -/Mäusen ...........................................................................................................31 III-3 Die kommissurale Projektion ..........................................................................32 Abbildung 9: Die geschichtete Termination kommissuraler Fasern ist in vldlr -/, apoER2 -/- und rl -/- Mäusen gestört...................................................34 III-4 Calretinin-Immunhistochemie zeigt eine veränderte Termination kommissural/assoziativer Mooszellaxone in vldlr -/-, apoER2 -/- und rl -/Mäusen ..................................................................................................................35 Abbildung 10: Calretinin-Immunhistochemie zeigt Mooszellen und CajalRetzius Zellen in vldlr -/-, apoER2 -/- und rl -/- Mäusen ..................................36 5 III-5 Calretinin- / Calbindin-Doppelimmunfluoreszenzfärbungen bestätigen die räumliche Assoziation Calbindin-positiver Körnerzellen und Calretinin-positiver kommissural/assoziativer Fasern...........................................................................38 Abbildung 11: Immunfluoreszenzdoppelfärbung für Calretinin (kommisural/assoziative Fasern) und Calbindin (Körnerzellen) ......................39 III-6 Calretinin-positive Cajal-Retzius Zellen in vldlr -/-, apoER2 -/- und rl -/Mäusen ..................................................................................................................40 IV Diskussion ...........................................................................................................42 IV-1 Kritische Betrachtung der verwendeten Methoden .........................................42 IV-2 Die Termination entorhinaler Fasern ist unabhängig von Reelin und dem Reelin-Rezeptor Komplex ......................................................................................44 IV-3 Die geschichtete Termination kommissuraler Fasern hängt von der Anordnung der Körnerzellen ab .............................................................................46 Abbildung 12: Die Zyto- und Faserarchitektur der Fascia dentata von Kontrolltieren (+/+), VLDLR- (vldlr -/-), ApoER2 defizienten Mäusen (apoER2 -/-) und reeler Mäusen (rl -/-)............................................................48 IV-4 Die Reelin-Signaltransduktion und die Entwicklung des Hippokampus ..........49 V Zusammenfassung ..............................................................................................51 VI Zitierte Literatur...................................................................................................52 Danksagung .............................................................................................................62 Lebenslauf................................................................................................................63 Schriftenverzeichnis ...............................................................................................64 Im Rahmen dieser Arbeit ist folgende Publikation entstanden: Gebhardt C, Del Turco D, Drakew A, Tielsch A, Herz J, Frotscher M, and Deller T (2002) Abnormal positioning of granule cells alters afferent fiber distribution in the mouse fascia dentata: morphologic evidence from reeler, apolipoprotein E receptor 2-, and very low density lipoprotein receptor knockout mice. J Comp Neurol, 445: 278-292. 6 I Einleitung I-1 Einführung Das zentrale Nervensystem (ZNS) eines gesunden erwachsenen Organismus zeichnet sich durch eine große Zahl von Nervenzellen aus, die über Nervenfasern miteinander in geordneter Verbindung stehen. Diese Faserverbindungen entstehen während der Entwicklungsperiode und bilden die Grundlage für den sinnvollen Ablauf funktioneller Prozesse im ZNS. Es ist bis heute allerdings unklar, wie spezifische Verbindungen zwischen Nervenzellen entstehen können und wie solche Verbindungen über Jahre hinweg im erwachsenen Organismus aufrecht erhalten und bei Bedarf modifiziert werden können (Frotscher, 1992; Frotscher, 1991). Die Aufklärung der molekularen und zellulären Grundlagen dieser Entwicklungsprozesse ist ein fundamentales Ziel der Entwicklungsneurobiologie. Ein erfolgreicher experimenteller Ansatz, um zu einem besseren Verständnis entwicklungsneurobiologischer Prozesse im Gehirn zu kommen, ist die genetische und morphologische Untersuchung von Mausmutanten. Insbesondere die Erforschung von solchen Mutanten, bei denen eine abnormale Zytoarchitektur des Gehirns zu beobachten ist, hat dazu geführt, dass wir in den vergangenen Jahren viel über diejenigen Gene und Moleküle gelernt haben, die eine geordnete Zellmigration und Schichtung der kortikalen Neurone während der Gehirnentwicklung steuern (Rice and Curran, 1999). Beispielhaft hierfür ist die neurobiologische Untersuchung der ataktischen Mausmutante reeler, bei der ausgeprägte Störungen der Zytoarchitektur des ZNS zu bobachten sind (Caviness and Rakic, 1978; zur Übersicht: Lambert and Goffinet, 1998). Bei diesen Mäusen kommt es zu Störungen der Nervenzellmigration während der Entwicklung: Die Nervenzellen werden zunächst im Bereich der Ventrikulärzone gebildet und wandern daraufhin radiär entlang von Gliazellfortsätzen nach außen. Später gebildete Neurone passieren dabei die früher gebildeten, so dass die oberflächlichen Schichten des Kortex jünger sind als die tiefen. Die Schichten entwickeln sich also, wenn man die zeitliche Abfolge betrachtet, von innen nach außen. Im Gegensatz hierzu gelingt es den später gebildeten Neuronen in reeler Mutanten jedoch nicht, an den früher gebildeten vorbeizuwandern, so dass der Kortex der reeler Maus invers aufgebaut ist (Bar et al., 7 2000b; Rice and Curran, 1999; Ogawa et al., 1995; Caviness, Jr., 1982). Mit Hilfe molekulargenetischer Techniken konnte vor wenigen Jahren das mutierte Gen der reeler Mäuse identifiziert werden (D'Arcangelo et al., 1996; D'Arcangelo et al., 1995; Ogawa et al., 1995). Es konnte gezeigt werden, dass den reeler Mutanten das Extrazellulärmatrixprotein Reelin fehlt, das für eine geordnete Migration von Neuronen entlang der radialen Gliazellen während der Entwicklung verantwortlich ist (Caviness, Jr., 1982). Es stellte sich jetzt die Frage, wie Reelin die Migration von Nervenzellen im sich entwickelnden ZNS reguliert. Es gelang die Rezeptoren von Reelin zu identifizieren und den Signaltransduktionsweg von Reelin in Nervenzellen aufzuklären. Es zeigte sich, dass ein Rezeptorkomplex aus Lipoproteinrezeptoren mit Reelin interagiert und über eine intrazelluläre Signalkaskade die Adhäsion migrierender Nervenzellen reguliert. Von entscheidender Bedeutung waren in diesem Zusammenhang Untersuchungen weiterer Mausmutanten, die den reeler Mäusen ähnliche Phänotypen zeigen. So kommt es bei Mäusen mit Mutationen im disabled-1 (Dab-1) Gen (Sheldon et al., 1997; Howell et al., 1997; Ware et al., 1997) ebenso wie bei Mäusen mit Mutationen in den Genen der Lipoproteinrezeptoren ApoER2 (Apolipoprotein E Rezeptor 2) und VLDLR (very-low-density Lipoproteinrezeptor) (Trommsdorff et al., 1999) zu reeler ähnlichen Veränderungen. Es konnte gezeigt werden, dass ApoER2 und VLDLR als Rezeptorkomplex für das Protein Reelin fungieren (Hiesberger et al., 1999; D'Arcangelo et al., 1999). Die Bindung von Reelin an diese Rezeptoren führt zur Phosphorylierung des intrazellulären Proteins Dab-1 (Keshvara et al., 2001; Howell et al., 1999; Hiesberger et al., 1999). Somit kann man die Ähnlichkeit der neuropathologischen Veränderungen dieser Mausmutanten gut erklären. Da diese Veränderungen allerdings auf unterschiedlichen Störungen im Reelin-Signaltransduktionsweg beruhen, kann man durch die genaue Analyse der Morphologie dieser Mausmutanten zum einen Hypothesen überprüfen, die aufgrund von Untersuchungen an reeler Mäusen aufgestellt wurden. Zum anderen kann man möglicherweise Rückschlüsse auf die Funktion der einzelnen Entwicklungsprozess ziehen. Elemente des Signaltransduktionsweges im 8 In den letzten Jahren wurde die Fascia dentata der reeler Maus intensiv untersucht, da sie im Vergleich mit dem Neokortex eine einfache Zell- und Faserschichtung besitzt. So findet sich in der normalen Fascia dentata eine einzige Zellschicht, die Körnerzellschicht. An den Dendriten der dicht gepackten Körnerzellen enden zwei mächtige Faserschichten: Fasern aus dem entorhinalen Kortex (EC) enden an distalen Teilen des Dendritenbaumes in der äußeren Molekularschicht (OML), während kommissurale Afferenzen (COM) aus dem kontralateralen Hippokampus an proximalen Teilen der Körnerzelldendriten in der inneren Molekularschicht (IML) enden (Frotscher et al., 1991; Blackstad, 1958; Blackstad, 1956;). Aufgrund dieser Zell- und Faserarchitektur wurde vorgeschlagen, dass Signale auf definierten Abschnitten der Körnerzelldendriten die Terminationszone der Afferenzen bestimmen. Somit würden Signale auf den distalen Körnerzelldendriten entorhinale Fasern in ihre Zielschicht lenken, während Signale auf den proximalen Körnerzelldendriten kommissurale Fasern in ihre Zielschicht führen würden. Eine Trennung der entorhinalen und kommissuralen Faserschichten ließe sich mit der kompakten Anordnung der Körnerzellen, spezifischen molekularen Signalen auf distalen bzw. proximalen Abschnitten der Körnerzelldendriten und der parallelen Anordnung der Körnerzelldendriten, erklären. Mit der reeler Maus, in der die Körnerzellen abnormal verteilt sind (Stanfield and Cowan, 1979b; Stirling and Bliss, 1978; Caviness and Rakic, 1978; Caviness and Sidman, 1973; Falconer, 1951), bot sich erstmals die Gelegenheit zur Überprüfung dieser klassischen Hypothese. Falls die Hypothese richtig wäre, dürfte sich in der Fascia dentata der reeler Maus keine normale Faserschichtung mehr entwickeln. Überraschenderweise zeigten Untersuchungen zur Faserschichtung der reeler Maus jedoch, schichtenspezifische dass eine Termination gestörte kommissuraler Körnerzellverteilung Afferenzen nur die beeinflusst, die schichtenspezifische Termination entorhinaler Afferenzen hingegen erhalten bleibt (Deller et al., 1999a; Stanfield et al., 1979). Für die Wegfindung der entorhinalen Fasern scheinen demnach andere Mechanismen entscheidend zu sein. CajalRetzius Zellen, die vorübergehend während der Hirnentwicklung vorhanden sind, bilden transiente Synapsen mit den einwachsenden entorhinalen Fasern aus und dienen ihnen vermutlich als Leitschiene in die äußere Molekularschicht der Fascia dentata (Ceranik et al., 2000; Ceranik et al., 1999; Del Rio et al., 1997). Dieses 9 Führungssystem ist auch in reeler Mäusen vorhanden (Deller et al., 1999a). Für die kommissuralen Afferenzen scheint allerdings in der Tat die Position ihrer postsynaptischen Zielzellen und damit auch die Position der vermuteten Führungssignale entscheidend zu sein, da wie oben bereits erwähnt, in reeler Mäusen das Terminationsmuster der kommissuralen Afferenzen mit der Verteilung der Körnerzellen korreliert (Deller et al., 1999a). In den vergangenen Jahren wurde jedoch vorgeschlagen, dass auch im Fall der kommissuralen Faserprojektion GABAerge Pionierneurone und nicht die Körnerzellen für das Einwachsen kommissuraler Fasern entscheidend sind (Borrell et al., 1999). Es wurde vermutet, dass diese Pionierneurone eine ähnliche Funktion wie Cajal-Retzius Zellen haben und einwachsenden kommissuralen Fasern als Leitschiene dienen könnten. Die Verfügbarkeit von vldlr -/- und apoER2 -/- Mäusen ermöglichte es uns jetzt, die umstrittene Rolle der Körnerzellen für die kommissurale Schichtung genauer zu untersuchen. Da die Störung der Körnerzellverteilung in diesen Mutanten weniger stark ausgeprägt ist, als in den reeler Mäusen, sollte es in diesen Mausmutanten zu einer weniger ausgeprägten Störung der kommissuralen Fasertermination kommen. Wir untersuchten daher die Zyto- und Faserarchitektur dieser Mausmutanten und korrelierten den Grad der Störung der Körnerzellverteilung mit dem Grad der Störung der Faserschichtung entorhinaler und kommissuraler Afferenzen. I-2 Die Fascia dentata Der Hippokampus entwicklungsneurobiologischen ist zur experimentellen Fragestellungen Untersuchung ein häufig von verwendetes Modellsystem. Aufgrund seiner geordneten Zyto- und Faserarchitektur gilt er als ein vergleichsweise einfach gebauter Teil des Kortex. Seine Entwicklung (Bayer and Altman, 1987; Stanfield and Cowan, 1979a), sein zellulärer Aufbau (Amaral and Witter, 1995; Frotscher et al., 1988), sowie seine intrinsischen und extrinsischen Verschaltungen sind in der Vergangenheit intensiv untersucht und zum Teil aufgeklärt worden Experimentator, die (Amaral and molekularen Witter, und 1995). Dies zellulären erleichtert es dem Zusammenhänge von 10 Entwicklungsprozessen zu untersuchen und aufzuklären (Frotscher et al., 1995; Frotscher et al., 1988). Darüber hinaus lässt sich der junge Hippokampus explantieren und über Wochen in vitro kultivieren. Mit Hilfe dieser organotypischen Schnittkulturen des Hippokampus lassen sich entwicklungsbiologische Fragestellungen elegant untersuchen und experimentell beeinflussen (Gähwiler et al., 1997; Heimrich and Frotscher, 1993). Auf diese Weise konnten einige der Zellen und Moleküle identifiziert werden, die an der Entwicklung spezifischer Verbindungen im Hippokampus beteiligt sind (Skutella and Nitsch, 2001; Del Rio et al., 1997). Die Fascia dentata ist Teil der Hippokampusformation, die sich aus Fascia dentata, Hippokampus (auch Ammonshorn genannt, welches nochmals in CA1, CA2 und CA3 unterteilt wird), Subiculum, Präsubiculum, Parasubiculum und entorhinalem Kortex zusammensetzt. Während frühere Untersucher den Hilus noch als Teil des Ammonshorn ansahen und ihn als CA4 bezeichneten (de No, 1934), so wird er heute als Teil der Fascia dentata gesehen und synonym als polymorphe Schicht der Fascia dentata bezeichnet (Amaral and Witter, 1995). Die dreidimensionale Ausdehnung macht es nötig, bestimmte Teile näher zu bezeichnen: so spricht man von einem suprapyramidalen und einem infrapyramidalen Blatt der Fascia dentata, wobei das suprapyramidale Blatt benachbart zu CA1 liegt und an der Spitze des Gyrus dentatus in das infrapyramidale Blatt übergeht (Abbildung 1). Außerdem spricht man von einem septalen, eher rostral gelegen Teil und einem temporalen, eher dorsolateral gelegenen Teil. Die Fascia dentata wird aufgrund ihres relativ einfachen Aufbaus häufig als Modellsystem zur Untersuchung von neurobiologischen Fragestellungen verwendet. Sie besteht aus einer einzigen Zellschicht, der Körnerzellschicht. Oberhalb der Körnerzellschicht findet sich eine Faserschicht, die Molekularschicht, die ihrerseits in zwei Bereiche unterteilt wird, in die innere und die äußere Molekularschicht (Abbildung 1 und 2). Diese Unterteilung der Molekularschicht erfolgt aufgrund der Schichtung zweier mächtiger afferenter Fasersysteme, die in diesen Bereichen der Molekularschicht enden. Im Bereich der inneren Molekularschicht enden hippokampale Assoziationsfasern und Kommissurenfasern, während im Bereich der äußeren Molekularschicht Fasern aus dem ipsilateralen entorhinalen Kortex enden. 11 Abbildung 1: Schematische Darstellung des Hippokampus Zu sehen ist die Pyramidenzellschicht (schwarz), mit den Regionen CA1 und CA3. Die Fascia dentata ist ebenfalls zu sehen mit Ihrer Körnerzellschicht (KZS blau), der inneren Molekularschicht (IMS, grün), der äußeren Molekularschicht (ÄMS, rot) und dem Hilus (H). Innere und äußere Molekularschicht lassen sich nur aufgrund der Termination der verschiedenen Afferenzen unterscheiden. In der Inneren Molekularschicht enden die kommissural/assoziativen Fasern, in der äußeren Molekularschicht die Fasern aus dem entorhinalen Kortex. Die Körnerzellschicht wird zudem noch in ein suprapyramidales Blatt (SPB) unterteilt, dass an der Spitze der Fascia dentata in das infrapyramidale Blatt (IPB) übergeht. Abbildung 2: Die Schichten der Fascia dentata Schematisierte Darstellung der Schichten der Fascia dentata. Zu sehen sind der Hilus (H), die Körnerzellschicht (KZS), die innere Molekularschicht (IMS) und die äußere Molekularschicht (ÄMS). Exemplarisch ist eine Körnerzelle in der Körnerzellschicht abgebildet, deren apikaler Dendritenbaum in die Molekularschicht ragt. Die Molekularschicht wird in zwei Faserschichten unterteilt. In der inneren Molekularschicht enden die kommissural/assoziativen (C/A) Fasern, in der äußeren Molekularschicht die Fasern aus der entorhinalen Rinde (EC). 12 Die entorhinalen Afferenzen ziehen als Fasertrakt gebündelt (Tractus perforans) zum ipsilateralen Hippokampus. Sie entstammen überwiegend sternförmigen Neuronen der Schicht II (Steward and Scoville, 1976) und sind glutamaterg. Des weiteren kommen Fasern GABAerger Neurone aus Schicht I und III hinzu (Germroth et al., 1991; Germroth et al., 1989), sowie eine kleine Population von Fasern deren Ursprungszellen in Schicht IV-VI liegen (Deller et al., 1997; VonHaebler et al., 1993; Köhler, 1985). Mit retrograden Tracingmethoden wurde die Topographie der Projektion entorhinaler Zellen zur Fascia dentata aufgeklärt (Ruth et al., 1988; Ruth et al., 1982; Steward and Scoville, 1976). Es konnte gezeigt werden, dass Zellen aus dem dorsalen Teil des entorhinalen Kortex in septale Regionen der Fascia dentata projizieren, während weiter ventral liegende Zellen in temporale Regionen projizieren. Die Ursprungszellen der kommissuralen Projektion sind ebenfalls heterogen. Der Großteil der Fasern entstammt glutamatergen, im Hilus gelegenen, Calretininpositiven Mooszellen (Scharfman, 1995; Soriano and Frotscher, 1994; Frotscher et al., 1991; Amaral, 1978). Ein kleinerer Teil entstammt GABAergen Interneuronen. Diese sind in sich heterogen. Außerdem noch (1) Somatostatin- (Leranth and Frotscher, 1987) und Neuropeptid Y- (Deller and Leranth, 1990) haltigen Zellen, die Subpopulationen GABAerger (Kosaka et al., 1988) Neurone sind (2) GABAerge, Parvalbuminhaltige (Goodman and Sloviter, 1992) Neurone und (3) verschiedene GABAerge Neurone, die keinen anderen der obengenannten Marker enthalten (Leranth and Frotscher, 1987; Sloviter and Nilaver, 1987). Die allermeisten Zellen die zum kontralateralen Hippokampus projizieren entsenden ebenfalls Fasern zum ipsilateralen Hippokampus, weshalb man auch von kommissural/assoziativen (C/A) Fasern spricht (Zappone and Sloviter, 2001). Die Termination der kommissural/assoziativen (C/A) Fasern und der Axone aus der entorhinalen Rinde (EC) erfolgt im Wildtyp in einer schichtenspezifischen Art und Weise. Der Großteil der entorhinalen Fasern terminiert in der äußeren Molekularschicht an distalen Abschnitten von Körnerzelldendriten. Einige wenige Fasern enden in der inneren Molekularschicht, der Körnerzellschicht und im Hilus (Deller et al., 1997). Die kommissuralen Fasern enden an proximalen Abschnitten der Körnerzelldendriten im Bereich der inneren Molekularschicht (Abbildung 2). Ein 13 kleiner Teil der C/A Fasern endet in der äußeren Molekularschicht und im Hilus (Deller et al., 1995). Die wichtigste Efferenz der Fascia dentata sind die Moosfaseraxone der Körnerzellen. Bereits Ramón y Cajal beschrieb diese charakteristischen unmyelinierten Axone und gab Ihnen Ihren Namen (Cajal, 1911). Sie enden an den Pyramidenzellen in der Region CA3, bilden davor jedoch mehrere Kontakte mit Mooszellen im Hilus und mit mehreren anderen Interneuronen (Amaral and Witter, 1995). Die Moosfasern sind also intrahippokampale assoziative Fasern, was die Fascia dentata als Haupteingangstür zum Ammons Horn erscheinen lässt. I-3 Reelin und die reeler Maus Die reeler Maus ist eine spontan aufgetretene ataktische Mausmutante, die erstmals von Falconer Anfang der Fünfziger Jahre beschrieben wurde (Falconer, 1951). Ihren Namen erhielt sie aufgrund ihres auffälligen schwankend-ataktischen Gangbilds (Engl.: "reeling gait"). Der Gendefekt der reeler Maus blieb für mehr als 40 Jahre unbekannt und Untersuchungen zur reeler Maus konzentrierten sich zunächst ausschließlich auf die detaillierte Beschreibung ihrer pathomorphologischen Veränderungen (zur Übersicht: Lambert and Goffinet, 1998). So wurden die Störungen der Zytoarchitektur im Kortex untersucht und es wurde gezeigt, dass es den Neuronen in der reeler Maus nicht gelingt, sich in Schichten anzuordnen. Die kortikalen Zellen sind bunt "durchmischt" und eine klare Ordnung ist nicht mehr erkennbar (Stanfield and Cowan, 1979b; Caviness and Sidman, 1973). Morphologische Veränderungen sind in reeler Mäusen allerdings auch in subkortikalen Bereichen des ZNS vorhanden, wie dem Thalamus, dem Mittelhirn, dem Hirnstamm und dem Rückenmark (Frost et al., 1986; Goffinet et al., 1984). Die charakteristische Störung der kortikalen Zytoarchitektur, insbesondere die umgekehrte Schichtung der Nervenzellen im Kortex, machte die reeler Maus zu einem interessanten Untersuchungsobjekt für entwicklungsneurobiologische Fragestellungen. Insbesondere konnte erstmals der Frage nachgegangen werden, 14 inwiefern die korrekte Positionierung von Neuronen innerhalb des ZNS und ihre Anordnung in Zellschichten eine Voraussetzung für die Entstehung spezifischer neuronaler Verbindungen ist. Es zeigte sich, dass Nervenzellen in reeler Mäusen durchaus dazu in der Lage sind, sinnvolle synaptische Kontakte aufzubauen, obwohl ihre Zielzellen fehlpositioniert sind. Diese Befunde legten nahe, dass es sich beim Gendefekt der reeler Maus um ein Gen handelt, das für die Migration von Nervenzellen während der Entwicklung entscheidend ist, auf die molekularen Mechanismen, die zur Bildung spezifischer Verbindungen im ZNS führen, aber keinen entscheidenden Einfluss haben kann (Rakic and Caviness, 1995). Erst mehr als 40 Jahre nach der Erstbeschreibung der reeler Maus wurde das zugehörige Gen (D'Arcangelo et al., 1995) und das von ihm kodierte Protein (Ogawa et al., 1995) entdeckt. Reelin besteht aus 3461 Aminosäuren und hat ein relatives Molekulargewicht vom 388 kDa (D'Arcangelo et al., 1995). Es ist ein hochgradig konserviertes Molekül: die Aminosäuresequenzen von humanem Reelin und mäuse Reelin stimmen zu 94,2% überein, während die Nukleotidsequenzen noch zu 87,2% Übereinstimmung zeigen (DeSilva et al., 1997). Dies spricht dafür, dass Reelin ein phylogenetisch altes Protein und dementsprechend wichtig für die kortikale Entwicklung ist (Bar et al., 2000a). Die Untersuchung von weiteren Mausmutanten, die einen der reeler Maus ähnlichen neurologischen und neuropathologischen Phänotyp zeigten, führte zu weiteren Erkenntnissen. So führten sowohl Mutationen im disabled-1 (Dab-1) Gen (Sheldon et al., 1997; Howell et al., 1997; Ware et al., 1997) als auch Mutationen in den Genen der Lipoproteinrezeptoren ApoER2 und VLDLR (Trommsdorff et al., 1999) zu reeler ähnlichen Veränderungen. Es zeigte sich, dass Dab-1, VLDLR und ApoER2 Bestandteile der Reelin-Signaltransduktionskaskade sind, deren Grundzüge heute aufgeklärt sind (Abbildung 3): als Rezeptoren für Reelin fungieren der Apolipoprotein E Receptor 2 (ApoER2) und der very low density lipoprotein receptor (VLDLR) (Trommsdorff et al., 1999). An diese bindet Reelin (Hiesberger et al., 1999; D'Arcangelo et al., 1999), was zur Phosphorylierung des intrazellulären Proteins Dab-1 führt (Keshvara et al., 2001; Howell et al., 1999; Hiesberger et al., 1999). In einem alternativen Signalweg bindet Reelin an α3β1 Integrin, wodurch die Ablösung 15 der migrierenden Nervenzellen von den radialen Gliazellen reguliert werden könnte (Dulabon et al., 2000). CR-Zelle reeler Maus Reelin vldlr -/Maus apoEr2 -/Maus ApoER2 b1 Da Src P P Da D b1 VLDLR Cdk5 Abbildung 3: Schematisierte Lipoproteinrezeptoren Darstellung der Reelin-Signaltransduktion über Das Protein Reelin (lila) wird von Cajal-Retzius Zellen (gelb) sezerniert. Es bindet an den Reelin-Rezeptor Komplex, bestehend aus ApoER2 und VLDLR, was zur intrazellulären Phosphorylierung von Dab-1 führt. Dies führt vermutlich zu einer Aktivierung der Cyclin abhängigen Kinase 5 (Cdk5, hellgrün). 16 I-4 Einführung in die verwendeten Techniken I-4-1 Anterograde Markierung von Nervenfasern Markierungssubstanz Phaseolus vulgaris-Leukoagglutinin mit Hilfe der Schon zur Zeit von Cajal und Golgi war die Markierung neuraler Verbindungen eine große Herausforderung. Ohne dafür gut geeignete Methoden, ist die Erforschung neuraler Funktion sowie neuraler Plastizität kaum vorstellbar. Zu Beginn der Erforschung neuraler Konnektivität standen nur die Methoden der antero- und retrograden Degeneration zur Verfügung. Der nächste Schritt war die von Golgi entwickelte Silberimprägnation einzelner Neurone (Golgi, 1879). Erst viel später war es mittels neuer Degenerationsmethoden möglich, anterograd die Projektion eines Kerngebietes zu studieren (zum Beispiel: Fink and Heimer, 1967). Diese Techniken waren insbesondere für lange Verbindungen geeignet, die nicht mittels der Golgimethode sichtbar gemacht werden konnten. Mit der Entdeckung des anteround retrograden Axontransports wurden neue Methoden entwickelt. Die Nutzung von Meerrettich-Peroxidase als retrogradem Tracer (Kristensson and Olsson, 1971; zur Übersicht: Vercelli et al., 2000 und Cowan and Cuénod, 1975) stellte eine deutliche Verbesserung dar. Diese Technik machte es möglich, axonale Verbindungen in vivo sowohl retrograd als auch anterograd zu markieren. Etwa zur gleichen Zeit entwickelten Cowan und Kollegen (Cowan et al., 1972) die Technik der Autoradiographie, um axonale Verbindungen mittels radioaktiv markierter Aminosäuren zu untersuchen. Mit der Entdeckung von Phaseolus vulgarisLeukoagglutinin (PHAL) als Tracersubstanz (Gerfen and Sawchenko, 1984) wurde eine bis dahin nicht mögliche Auflösung erreicht. Einzelne Axone und Axonterminale konnten mit PHAL sichtbar gemacht werden. Dies war davor nur mit immunhistochemischen Methoden für die entsprechenden Subpopulationen von Neuronen möglich, lässt aber im Gegensatz zum Tracingexperiment keine Aussagen über ganze Projektionsbahnen zu, die ja häufig biochemisch heterogen aufgebaut sind (siehe I-2 Die Fascia dentata). PHAL gehört zu einer biochemisch heterogenen Gruppe pflanzlicher Lektine. Es wird aus der Bohne (Phaseolus vulgaris) gewonnen. Phaseolus vulgarisAgglutinin (PHA) ist bekannt dafür, das Wachstum und die Teilung von Lymphozyten zu stimulieren, sowie Blutzellen zu agglutinieren (Weber et al., 1972). Sein 17 Molekulargewicht beträgt 126000, es besteht aus vier Untereinheiten wobei diese sich in zwei weitere Untereinheiten auftrennen lassen. Diese werden als E und L Formen bezeichnet, entsprechend Ihrer Fähigkeit hauptsächlich Erythrozyten bzw. Leukozyten zu agglutinieren (Leavitt et al., 1977), wobei nur PHAL als Tracer in den Neurowissenschaften von Bedeutung ist. PHAL bindet an N-acetyl-glucosamin, wird von Nervenzellen schnell aufgenommen und mit dem anterograden axonalen Transport mit einer Geschwindigkeit von 4-6 mm pro Tag transportiert (Gerfen and Sawchenko, 1984; zur Übersicht: Vercelli et al., 2000). Die Applikation erfolgt iontophoretisch mit 5-6 µA Stromstärke. Die Visualisierung erfolgt mittels Immunhistochemie, wobei die Färbungen in histologischen Präparaten über mehrere Jahre stabil bleiben (Wouterlood et al., 1990). Die Überlebenszeit nach Injektion sollte 10-20 Tage betragen, je nach Länge des darzustellenden Fasertrakts. Zu lange Überlebenszeiten führen zu einer Verschlechterung des Färbeergebnisses (Wouterlood et al., 1990). Mit PHAL lassen sich auch elektronenmikroskopische Studien durchführen (Pare et al., 1995) und man kann es in Kombination mit anderen Tracern und für doppelimmunhistochemische Färbungen verwenden (Deller et al., 2000; Dolleman-Van der Weel MJ et al., 1994). Alle diese Eigenschaften machen PHAL zu einem leicht und sicher applizierbaren, zuverlässigen, hochauflösenden und vielseitigen Tracer im neurowissenschaftlichen Bereich. I-4-2 Immunhistochemie Mit Hilfe von Antikörpern, die gegen bestimmte Merkmale von Nervenzellen oder Gliazellen gerichtet sind, lassen sich selektiv bestimmte Zelltypen oder Subpopulationen von Nervenzellen (z.B. Mooszellen oder Calbindin-positive Zellen) markieren. Dadurch ist es möglich, die biochemische Heterogenität morphologisch ähnlicher Nervenzellen darzustellen. Die Herstellung und Entwicklung immer neuer Antikörper führte in den Neurowissenschaften zu einem enormen Wissenszuwachs. Doppelimmunhistochemische Färbungen ermöglichen sogar die Darstellung zweier verschiedener Antigene. Die Immunhistochemie beruht auf der spezifischen Bindung von Antikörpern an das entsprechende Antigen. Zur Darstellung des Antigen-Antikörper Komplexes 18 stehen verschiedene Verfahren zur Verfügung. Zur Vereinfachung wird hier nur das von uns verwendete beschrieben. Peroxidase Abbildung 4: Schematische Darstellung der Immunhistochemie mittels der Avidin-Biotin-Peroxidase Methode Avidin Biotin Das Fab-Fragment (gelb) des verwendeten Antikörpers (AK) bindet das entsprechende Antigen Erstantikörper (blau). Das Fc-Fragment (rot) des AK ist biotiniliert. Das Coenzym Biotin (orange) reagiert mit dem aus Eiklar gewonnenen Avidin (grün). Das Avidin ist mit Peroxidase (hellgrün) gekoppelt, welche nach Antigen Zugabe des Indikators die Farbreaktion katalysiert. Da Avidin vier Bindungsstellen für Biotin hat, kommt es zu einer Verstärkung der Färbung. Ist der Erstantikörper noch nicht mit Biotin gekoppelt, wird ein biotinilierter Zweitantikörper verwendet, der gegen das Fc-Fragment des Erstantikörpers gerichtet ist. Ist bereits der direkt gegen das nachzuweisende Antigen gerichtete Antikörper (Erstantikörper) mit einem Biotin Molekül gekoppelt, kann man direkt die AvidinBiotin-Methode (Hsu et al., 1981) anwenden. Das Coenzym Biotin reagiert mit dem an Peroxidase gekoppelten Avidin und bildet einen stabilen Komplex (siehe Abbildung 4). Die Peroxidase reduziert nach Zugabe von Wasserstoffperoxid den Indikator 3,3’-Diaminobenzidin, der in seiner reduzierten Form intensiv braun gefärbt ist. Zur Verstärkung der Färbung wurde in unserem Fall noch Ammonium-NickelSulfat und Cobalt-Chlorid hinzugegeben, was in einer dunkelblau bis schwarzen Färbung resultiert. I-5 Mausmutanten Die Untersuchung von Mausmutanten mit neurologischen Veränderungen ist eine sinnvolle Strategie, um die Entwicklung des ZNS besser zu verstehen. In den vergangenen vier Dekaden wurden große Fortschritte gemacht, die Gene zu identifizieren, die für die korrekte Zellpositionierung während der Hirnentwicklung von Mäusen und Menschen nötig sind (Walsh, 1999; D'Arcangelo and Curran, 1998). Viele Jahre diente die bereits oben erwähnte Mausmutante reeler als Prototyp zur 19 Untersuchung von Mutationen, die die neurale Migration und die Organisation des ZNS betreffen. Nach der Identifikation des reeler Gens (D'Arcangelo et al., 1995) wurden in kurzer Zeit weitere Gene entdeckt, die ebenfalls für neuronale Migration entscheidend sind. Dazu gehören das disabled-1 Gen (Howell et al., 1997; Sheldon et al., 1997; Ware et al., 1997), das Gen für die Cyclin abhängige Kinase 5 (Cdk5) oder den spezifischen neuronalen Aktivator für Cdk5, p35 (Chae et al., 1997; Ohshima et al., 1996). Vor kurzem wurde berichtet, das Mäuse denen entweder ApoER2 oder VLDLR fehlen einen reeler ähnlichen Phänotyp und ähnliche neuropathologische Veränderungen zeigen und das die Bindung von Reelin an diese Rezeptoren zur intrazellulären Phosphorylierung von Dab-1 führt (D'Arcangelo et al., 1999; Hiesberger et al., 1999; Trommsdorff et al., 1999). Vom reeler Phänotyp gibt es verschiedene Mutationen. Die heutzutage meist nur als reeler (rl) bezeichnete Mutation trat erstmals spontan 1948 in Edinburgh, Schottland auf und wurde 1951 beschrieben (Falconer, 1951). Nach Ihrer Herkunft wird diese Mutation manchmal noch als rled bezeichnet. Für diese Studie wurden reeler Mäuse mit diesem Allel verwendet. Ein anderes natürlich vorkommendes Allel ist rlorl, das 1961 in einem BALB/c Stamm in Orleans, Frankreich auftrat (Guenet, 1961). In den letzen Jahren wurden drei weitere Allele durch Mutagenese erzeugt. rltg wurde im Roche Institut für Molekularbiologie in Nutley, NJ während der Generierung eines transgenen Stammes erzeugt (Miao et al., 1994). rlAlb1 und rlAlb2 wurden in Albany, NY während einer Studie über Chlorambucil induzierte Mutationen erzeugt (Flaherty et al., 1992). Der Phänotyp aller bekannten reeler Allele ist sehr ähnlich und die Unterschiede lassen sich auf den unterschiedlichen genetischen Hintergrund zurückführen (zur Übersicht: D'Arcangelo and Curran, 1998). Die anderen in dieser Studie verwendeten Mausmutanten, die ApoER2- und VLDLR-defizienten Mäuse sind mittel gene (Trommsdorff et al., 1999; Frykman et al., 1995;). targeting hergestellt worden 20 II Material und Methoden II-1 Verwendete Tiere Es wurden insgesamt 68 männliche und weibliche Mäuse verwendet (Alter: zwischen 2 und 3 Monate). Die Tiere wurden unter Standardbedingungen (12 stündiger Tag und Nacht Zyklus; Mäusefutter und Wasser zur freien Verfügung) gehalten und in vier experimentelle Gruppen aufgeteilt: • Gruppe 1: Kontrolltiere (n=26; C57/BL6 n=14; B6/C3H n=12). Als Kontrollen wurden Mäuse verwendet, die auf dem gleichen genetischen Hintergrund gezüchtet wurden, wie die jeweiligen Mutanten. Der genetische Hintergrund der apoER2 -/- und vldlr -/- Mausmutanten ist C57/BL6, der genetische Hintergrund der rl -/- Mutanten ist B6/C3H. Jeweils eine Hälfte der Tiere erhielt PHAL-Injektionen in den EC zur Markierung des Tractus perforans, die zweite Hälfte der Tiere erhielt PHAL-Injektionen in den Hilus der Fascia dentata zur Darstellung der kommissuralen Faserprojektion. • Gruppe 2: VLDLR-defiziente Mäuse (n=14). Die Hälfte der Tiere erhielt PHALInjektionen in den EC zur Markierung des Tractus perforans, die zweite Hälfte der Tiere erhielt PHAL-Injektionen in den Hilus der Fascia dentata zur Darstellung der kommissuralen Faserprojektion. • Gruppe 3: ApoER2-defiziente Mäuse (n=14). Die Hälfte der Tiere erhielt PHAL-Injektionen in den EC zur Markierung des Tractus perforans, die zweite Hälfte der Tiere erhielt PHAL-Injektionen in den Hilus der Fascia dentata zur Darstellung der kommissuralen Faserprojektion. • Gruppe 4: Reeler Mäuse (n=14). Die Hälfte der Tiere erhielt PHAL-Injektionen in den EC zur Markierung des Tractus perforans, die zweite Hälfte der Tiere erhielt PHAL-Injektionen in den Hilus der Fascia dentata zur Darstellung der kommissuralen Faserprojektion. 21 Der Genotyp sämtlicher Tiere wurde mittels genomischer PCR bestimmt (siehe Abbildung 5). Abbildung 5: Genotypisierung von vldlr -/-, apoER2 -/- und rl -/- Mäusen mittels Polymerasekettenreaktion (PCR). Der Genotyp jeder Maus wurde mittels PCR bestimmt. Ethidiumbromid gefärbte Agarosegele von vldlr -/- (a), apoER2 -/- (b) und reeler (c) Mäusen sind abgebildet. Bei vldlr -/- Mäusen wird die obere Bande (400 Basenpaare) vom Gen des VLDL-Rezeptors amplifiziert, die untere Bande (200 Basenpaare) von einer künstlich eingesetzten Neokassette, die in das Exon 5 des VLDLR Gens eingesetzt wurde, was zu einer Leserastermutation geführt hat (Frykman et al., 1995). Ebenso verhält es sich bei apoER2 -/- Mäusen: die obere Bande (520 Basenpaare) wird vom Gen des ApoER2-Rezeptors amplifiziert, die untere (420 Basenpaare) von einer Neokassette. II-2 Tracer Injektionen Alle Tiere erhielten vor den operativen Eingriffen eine tiefe Anästhesie: 1. Thalamonal (Fentanyl, 0,5 mg/kg Körpergewicht; Droperidol, 16,5 mg/kg Körpergewicht; intraperitoneal). 2. Dormicum (Midazolam, 0,1 mg/kg Körpergewicht; intraperitoneal) Nach Überprüfung der Anästhesietiefe wurden die Mäuse in einen stereotaktischen Apparat (Stoelting Instruments, Illinois, USA) eingespannt, die Schädelkalotte wurde freipräpariert und der Schädel wurde trepaniert. Die stereotaktischen Koordinaten wurden dem Atlas von Franklin und Paxinos (Franklin and Paxinos, 1997) entnommen. Alle Angaben beziehen sich auf den relativen Abstand von Bregma. • Koordinaten für Injektionen in den EC: 1 (L–3,5; V–4; AP–4,7), 2 (L–3; V–4; AP–4,7), 3 (L–3; V–4,6; AP–4,5). • Koordinaten für Injektionen in den Hilus: 1 (L–2,25; V-2,5; AP–3,1), 2 (L–2,6; V–3,1; AP–3,5), 3 (L–2,5; V–2,8; AP–3,4), 4 (L–2,3; V–2,6; AP– 3,3). 22 Zur Injektion wurde PHAL (2,5% in 0,1 M PBS, pH 8,0; Vector Laboratories, USA) in Glaspipetten mit 8-20 µm Öffnungsdurchmesser und 1,5 mm Außendurchmesser aufgezogen. Die Injektion erfolgte iontophoretisch mit Hilfe einer geeigneten Iontophoreseeinheit (Midgard iontophoresis pump; Stoelting Instruments). Es wurde ein 5 µA Strom appliziert, die Elektrode war über einen Silberdraht an die Anode der Iontophoreseeinheit angeschlossen. Der Strom wurde für 7 Sekunden appliziert, gefolgt von einer Pause von 7 Sekunden. Die iontophoretische Applikation von PHAL erfolgte über einen Zeitraum von 12-15 Minuten. II-3 Gewebegewinnung und Gewebefixierung Die Tiere wurden vierzehn Tage nach Tracerinjektion mit Nembutal tief anästhesiert (Pentobarbital, 300 mg/kg Körpergewicht; intraperitoneal), transkardial mit 0,9% NaCl Lösung zum Ausspülen des Blutes und anschließend mit 4% Paraformaldehyd (PFA) Lösung in 0,1 M Phosphatpuffer (pH 7,4; PB) zur Fixation für 12-15 Minuten perfundiert. Daraufhin wurden die Gehirne entnommen und für weitere 12-18 Stunden in 4% PFA Lösung nachfixiert. Nach der Fixierung wurden die Gehirne in 4% Agar eingebettet, aufgeblockt und schließlich 50 µm dicke Frontalschnitte mit einem Vibratom hergestellt. Die Hirnschnitte wurden mehrmals in PB gewaschen, um ungebundene Reste des Fixativs zu entfernen. II-4 Immunhistochemie Für alle Färbungen wurden die Schnitte zunächst mit 0,3 % Wasserstoffperoxid (H2O2, in 0,1 M PB) für 10 min inkubiert um die endogen Peroxidase zu blockieren. Um unspezifische Bindungen zu blockieren inkubierten wir die Schnitte mit 5% normalem Pferdeserum (NHS, in 0,1 M PB). II-4-1 Neuronal Nuclei Immunfärbung Um die Verteilung von Nervenzellen in der Fascia dentata darzustellen, verwendeten wir einen Antikörper, der spezifisch gegen ein neuronales Kernprotein (Neuronal Nuclei, NeuN) gerichtet ist (Mullen et al., 1992). Mit dieser Färbung konnten wir die Zellverteilungsstörungen von Neuronen in den verschiedenen Mutanten erfassen. 23 Das Gewebe wurde für 24 Stunden bei 4°C mit Maus anti-NeuN (1:1000; monoclonal, Chemicon, USA), 1% NHS, 0,1% NaN3 in 0,1 M PB inkubiert. Nach mehrmaligem Waschen in PB wurden die Schnitte für 2 Stunden mit dem Zweitantikörper (biotiniliertes anti-Maus IgG, 1:200; Linaris), ebenfalls mit 1% NHS in 0,1 M PB, inkubiert. II-4-2 Calbindin Immunfärbung Das kalziumbindende Protein Calbindin kann in der Fascia dentata zur Identifikation von Körnerzellen verwendet werden (Andressen et al., 1993; Sloviter, 1989a). Nur eine verschwindend geringe Zahl an Interneuronen ist in der Fascia dentata ebenfalls Calbindin immunreaktiv. Im Rahmen unserer Untersuchungen spielten diese Neurone keine Rolle, weshalb Calbindin als Marker für Körnerzellen eingesetzt wurde. Zur Durchführung der Calbindin-Immunfärbung wurden die Schnitte für 24 Stunden bei 4°C mit Maus anti-Calbindin (1:500; monoclonal, Swant, CH), 1% NHS, 0,3% Triton X-100, 0,1% NaN3 in 0,1 M PB inkubiert. Nach mehreren Waschschritten mit 0,1 M PB wurde das Gewebe für 2 Stunden mit dem Zweitantikörper (biotiniliertes anti-Maus IgG, 1:200; Linaris), ebenfalls mit 1% NHS in 0,1 M PB inkubiert. II-4-3 Calretinin Immunfärbung Das kalziumbindende Protein Calretinin ist ein Markermolekül für Mooszellen. Diese Zellen bilden den größten Teil der assoziativen und kommissuralen Axone zur inneren Molekularschicht der Fascia dentata (Blasco-Ibanez and Freund, 1997). Die Calretinin-Immunfärbung wurde daher - zusätzlich zur anterograden Markierung mit PHAL - zur Darstellung der kommissuralen und assoziativen Faserbahn verwendet. (Fujise et al., 1998) Das Gewebe wurde 48 Stunden lang bei 4°C mit Kaninchen anti-Calretinin (1:10000; polyclonal, Swant, CH), 1% NHS, 0,3% Triton X-100, 0,1% NaN3 in 0,1 M PB inkubiert. Nach mehrmaligem Waschen mit 0,1 M PB wurden die Schnitte mit dem Zweitantikörper (biotiniliertes anti-Kaninchen IgG, 1:200; Linaris) inkubiert. 24 II-4-4 Phaseolus vulgaris-Leukoagglutinin Immunfärbung PHAL wurde zur anterograden Markierung der entorhinalen und kommissuralen Faserbahnen zur Fascia dentata eingesetzt (siehe oben). Die Markierungssubstanz wurde mit einem immunzytochemischen Verfahren im Gewebe nachgewiesen. Hierzu wurden die Schnitte für 48 h bei 4°C mit biotiniliertem Ziegen anti-PHAL (1:800; polyclonal, Linaris), 1% NHS, 0,5% Triton X-100, 0,1% NaN3 in 0,1 M PB inkubiert. Ein Zweitantikörper wurde nicht verwendet, da bereits der gegen PHAL gerichtete Antikörper biotiniliert ist. II-4-5 Entwicklung Nach der Inkubation mit dem Erst- bzw. Zweitantikörper wurden die Schnitte mehrmals mit 0,1 M PB gewaschen und für 2 h mit dem Avidin-Biotin-Peroxidase Komplex (1:100; ABC-Elite, Vector Laboratories, USA; in 0,1 M PB) inkubiert. Nach mehreren Waschschritten mit 0,1 M PB erfolgte die Entwicklung mit Nickel/DAB Lösung (5-10 min; 0.05% 3,3’-Diaminobenzidin, 0.005% Ammonium-Nickel-Sulfat, 0.006% Cobalt-Chlorid, 0.001% H2O2 in 0,1 M PB), was zu einer tiefblauen Färbung führte. II-4-6 Immunfluoreszenzdoppelfärbung Zur Darstellung des topographischen Verhältnisses von kommissuralen und assoziativen Fasern innerhalb eines Schnittes wurde eine Immunfluoreszenzdoppelfärbung für Calretinin (Markierung kommissuraler und assoziativer Fasern) und Calbindin (Markierung der Körnerzellen) durchgeführt. Hierzu wurden Schnitte für 24h mit einem Antikörpercocktail aus Kaninchen anti-Calretinin (1:5000) und Mäuse anti-Calbindin (1:500; beide Antikörper von Swant, Bellinzona, CH) mit 1% NHS, 0.1% Triton X-100 in 0.1 M PB inkubiert. Nach mehrmaligem Waschen in 0,1 M PB wurde das Gewebe in Cy2-konjugiertem antiMäuse IgG (1:1000, 2 h, bei Raumtemperatur, in 0.1 M PB; Molecular Probes, Eugene, OR, U.S.A.) inkubiert, erneut gewaschen und in Cy3- konjugiertem antiKaninchen IgG (1:500, 2 h, bei Raumtemperatur, in 0.1 M PB; Molecular Probes). 25 Nach mehrmaligem Waschen in 0,1 M PB wurden die Schnitte in Moviol (Aventis, Frankfurt/M.) eingebettet. II-5 Polymerasekettenreaktion Die Polymerasekettenreaktion (PCR) wurde zur Genotypisierung der Mausmutanten verwendet. Bei der Auswahl der Primer und bei der Durchführung der PCR wurde auf die Empfehlungen der Jackson Laboratories zurückgegriffen (The Jackson Laboratory, Bar Harbor, ME und Frykman et al., 1995). Zur Identifizierung der ApoER2 Mäuse wurden die Primer und das Protokoll entsprechend den von Trommsdorff und Kollegen beschriebenen Empfehlungen verwendet (Trommsdorff et al., 1999). Die reeler Mäuse wurden nach dem Protokoll von D’Arcangelo und Kollegen genotypisiert (Deller et al., 1999b; D'Arcangelo et al., 1996). II-6 Digitale Bildverarbeitung Alle Abbildung wurden mit Adobe Photoshop 6.0 ® zusammengestellt. Die Fluoreszenzbilder wurden mit einer digitalen Kamera (Spot, Visitron, Deutschland) aufgenommen. Fluoreszenzeinzelbilder des gleichen Schnittes wurden digital übereinandergelegt. Bis auf die Korrektur von Kontrast und Helligkeit wurden keine Änderungen an den Bildern vorgenommen. 26 III Ergebnisse III-1 Verteilung von Nervenzellen in der Fascia dentata III-1-1 NeuN Immunhistochemie Die NeuN-Färbung dient zur Darstellung der Nervenzellverteilung (Mullen et al., 1992). Die Kontrolltiere zeigten die erwartete reguläre Verteilung von Nervenzellen in der Fascia dentata (Stanfield and Cowan, 1979b) mit einer dichtgepackten Körnerzellschicht und mehreren größeren Neuronen im Hilus (Abbildung 6 a). Bei der Mehrzahl der Zellen im Hilus handelt es sich um Mooszellen, die den Ursprung der C/A Fasern bilden. Nur sehr wenige Zellen sind in der Molekularschicht zu finden, von denen die meisten GABAerge Interneurone sind. Die vldlr -/- Tiere zeigen nur eine leicht veränderte Zytoarchitektur (Abbildung 6 b). Die dichte Körnerzellschicht ist wie in Kontrollen vorhanden. Es sind allerdings einige ektope Körnerzellen unmittelbar unterhalb der Körnerzellschicht zu finden und eine weitere Gruppe ektoper Neurone findet sich in der inneren Molekularschicht (Pfeile in 6 b). Bei den meisten dieser Zellen dürfte es sich ebenfalls, der Größe Ihres Zellkerns nach, um Körnerzellen handeln. Die zytoarchitektonischen Veränderungen der apoER2 -/- Tiere sind deutlicher zu sehen. Es finden sich viele ektope Neurone im Hilus und die Körnerzellschicht ist weniger deutlich abgrenzbar (Abbildung 6 c). Viele der ektopen Neurone sind Körnerzellen. Verglichen mit vldlr -/- Mäusen scheinen sich weniger ektope Zellen in der Molekularschicht zu finden. Die reeler Mäuse zeigen die stärksten Veränderungen der Zytoarchitektur. Eine Körnerzellschicht ist nicht mehr erkennbar und das Zentrum der Fascia dentata ist mit Neuronen bedeckt (Abbildung 6 d). Außerdem finden sich zahlreiche Nervenzellen in der Molekularschicht. Bei diesen ektopen Zellen handelt es sich, der Größe und Form ihres Zellkerns nach, um Körnerzellen. 27 Abbildung 6: Verteilung von Neuronen in der Fascia dentata von vldlr -/-, apoER2 -/- und rl -/Mäusen (NeuN Immunhistochemie). a: Die Zytoarchitektur der Fascia dentata in einem Kontrolltier. Die normale Zellverteilung ist zu sehen: die Körnerzellen sind in der Körnerzellschicht (KZS) dichtgepackt. Nur wenige Neurone sind in der Molekularschicht (MS) oder dem Hilus (H) zu sehen. b: In vldlr -/- Mäusen ist die normale Zytoarchitektur weitgehend erhalten. Falsch positionierte Neurone finden sich in der Molekularschicht (Pfeile) und dem Hilus. Eine dichtgepackte Körnerzellschicht ist vorhanden. c: Die Zytoarchitektur von apoER2 -/- Mäusen ist im Vergleich zur Zytoarchitektur von vldlr -/- Mäusen stärker beeinträchtigt. Der Hilus ist gefüllt mit falsch positioniert Neuronen (Stern) und die Körnerzellschicht ist weniger dicht gepackt. d: Die Fascia dentata einer rl -/- Maus. Neurone sind über das gesamte Zentrum der Fascia dentata verteilt (Stern). Zusätzlich finden sich mehr Neurone in der Molekularschicht. Eine kompakte Körnerzellschicht ist nicht mehr erkennbar. Eichstriche: a-d: 150 µm. III-1-2 Calbindin Immunhistochemie Während NeuN in allen Neuronen zu finden ist, findet sich das kalziumbindende Protein Calbindin überwiegend in Körnerzellen der Fascia dentata (Sloviter, 1989a; Baimbridge et al., 1982; zur Übersicht: Freund and Buzsàki, 1996). Um die Verteilung der Körnerzellen genauer zu charakterisieren, wurde in einem zweiten Schritt die Verteilung Calbindin-positiver Neurone in der Fascia dentata der Kontrolltiere und Mutanten untersucht. 28 In Kontrolltieren sieht man die normale Verteilung Calbindin-positiver Zellen: viele gefärbte Zellen finden sich in der Körnerzellschicht, während im Hilus nur wenige Calbindin-haltige Zellen zu finden sind (Abbildung 7 a). CalbindinImmunreaktivität ist im Hilus mit den Axonen der Körnerzellen assoziiert, den Moosfasern (Projektion der Körnerzellen zu den Pyramidenzellen in CA3; zur Übersicht: Amaral and Witter, 1995). Calbindin-positive Dendriten der Körnerzellen sind in der Molekularschicht nachweisbar. In vldlr -/- sieht man, wie in der NeuN-Färbung, nur eine geringgradige Störung der Zytoarchitektur. Die stark Calbindin-haltige Körnerzellschicht ist deutlich erkennbar (Abbildung 7 b). Einige Calbindin-positive Zellen sind im Hilus direkt unter der Körnerzellschicht zu finden. Diese falsch positionierten Körnerzellen scheinen jedoch Ihre Polarität beizubehalten und ihre Dendritenbäume in die Körnerzellschicht zu richten. Außerdem gibt es mehrere Calbindin-immunreaktive Zellen in der Molekularschicht. Die Zahl der Calbindin-haltigen Körnerzellen im Hilus ist bei apoER2 -/Mäusen verglichen mit Kontrolltieren und vldlr -/- Mäusen deutlich größer (Abbildung 7 c). Außerdem haben diese Körnerzellen Ihre Polarität verloren. Ihre Dendriten verzweigen sich im Hilus und scheinen ungerichtet zu sein. Wie schon die NeuN Färbung vermuten ließ, ist die Körnerzellektopie bei reeler Mäusen am stärksten ausgeprägt (Abbildung 7 d). Das gesamte Zentrum der Fascia dentata ist mit Calbindin-positiven Körnerzellen ausgefüllt, deren Dendriten ein dichtes Netz in der desorganisierten Körnerzellzone bilden. Da bei reeler Mäusen eine Körnerzellschicht nicht mehr identifiziert werden kann, wird im Folgenden der Begriff Körnerzellzone verwendet. Damit ist der zentrale Bereich der Fascia dentata gemeint, der bei reeler Mäusen von Körnerzellen bedeckt ist. 29 Abbildung 7: Calbindin-positive Körnerzellen in der Fascia dentata von vldlr -/-, apoER2 -/- und rl -/- Mäusen. a: Ausschnitt der Fascia dentata eines Kontrolltieres. Die Zellkörper von Körnerzellen in der Körnerzellschicht (KZS) sind stark angefärbt. Der Hilus (H) enthält nur sehr wenige Calbindin-positive Zellen. Calbindin-Immunreaktivität ist im Hilus mit Calbindin-positiven Moosfasern assoziiert. b: Verglichen mit Kontrollen zeigt die Fascia dentata von vldlr -/- Tieren nur leichte Veränderungen. Falsch positionierte Körnerzellen finden sich unterhalb der KZS (Pfeile) und oberhalb (offene Pfeile, vergleiche mit Abbildung 4 b). c: In der Fascia dentata von apoER2 -/- Mäusen finden sich viele Calbindin-positive Körnerzellen im Hilus (Pfeile). Die Calbindin-positiven Dendriten dieser Körnerzellen (Pfeilspitzen) sind ohne erkennbare Ordnung im ganzen Hilus zu finden. d: In rl -/- Mäusen ist der ganze Hilus mit Calbindin-positiven Körnerzellen übersäht (Pfeile). Deren Dendriten bilden ein dichtes Netz in der gesamten Körnerzellzone (Pfeilspitzen). Eichstriche: a-d: 15 µm. 30 III-2 Die Termination entorhinaler Fasern erfolgt schichtenspezifisch Zur Aufklärung der Termination entorhinaler Fasern wurden die Fasern des Tractus perforans, also die Projektionsbahn von EC zur Fascia dentata mit dem anterograden Tracer PHAL markiert. In Kotrolltieren beobachteten wir ein normales Terminationsmuster: entorhinale Fasern enden in der äußeren Molekularschicht an den distalen Abschnitten der Körnerzelldendriten (Deller et al., 1999a; Stanfield et al., 1979) (Abbildungen 8 a-c). Die Fasern bilden eine scharfe Grenze zur inneren Molekularschicht. Im Hilus finden sich nur sehr wenige Fasern (Deller, 1998). Dieses Muster bleibt in vldlr -/- (Abbildungen 4 d-f) und apoER2 -/(Abbildungen 8 g-i) Mäusen erhalten. Entorhinale Fasern enden in den äußeren zwei Dritteln der Molekularschicht und bilden einen dichten Faserplexus mit einer scharfen Grenze zur inneren Molekularschicht. Im Hilus finden sich nur wenige Fasern. Auch in reeler Mäusen bleibt das geschichtete Terminationsmuster entorhinaler Fasern erhalten. Wiederum lässt sich ein dichter entorhinaler Faserplexus in der äußeren Molekularschicht nachweisen. Diese Fasern bilden eine scharfe Grenze zur benachbarten Körnerzellzone (Abbildungen 8 j-l). Leichte Veränderungen der Termination entorhinaler Fasern sind jedoch in früheren Studien bereits beschrieben worden und konnten von uns bestätigt werden (Borrell et al., 1999; Deller et al., 1999a; Stanfield et al., 1979). Zum einen scheint der entorhinale Faserplexus in reeler Mäusen weniger dicht zu sein und die Grenze zur inneren Molekularschicht erscheint etwas weniger scharf als in Kontrollen. Zum anderen finden sich auf einigen Schnitten band- oder zungenartige Fortsätze des entorhinalen Faserplexus, die in den Hilus der Fascia dentata hineinreichen. Diese Erweiterungen des entorhinalen Faserplexus sind gegenüber den benachbarten Gebieten scharf abgegrenzt (Stanfield et al., 1979). Zum gegenwärtigen Zeitpunkt gibt es für diese Veränderungen der entorhinalen Terminationszone in reeler Mäusen noch keine zufriedenstellende Erklärung. 31 Abbildung 8 32 Abbildung 8: Afferenzen aus der entorhinalen Rinde terminieren schichtenspezifisch in der Fascia dentata von vldlr -/-, apoER2 -/- und rl -/- Mäusen. a-c: Anterogrades Tracing mit Phaseolus vulgaris-Leukoagglutinin zeigt das schichtenspezifische Terminationsmuster in einem Kontrolltier. Zu sehen sind die Fascia dentata (a), die Molekularschicht (b) und der Hilus (c). Markierte Fasern sieht man in den äußeren zwei Dritteln der Molekularschicht (äußere Molekularschicht; ÄMS). Die entorhinalen Fasern bilden einen dichten Plexus mit scharfer Grenze (Pfeil in b) zur inneren Molekularschicht (IMS). Nur wenige Fasern sind im Hilus (H; Pfeilspitze in c) zu finden. d-f: Entorhinale Fasern in der Fascia dentata (d), der Molekularschicht (e) und dem Hilus (f) von vldlr -/- Tieren. Verglichen mit Kontrolltieren ist das Terminationsmuster sehr ähnlich. Die scharfe Grenze zwischen markierten entorhinalen Fasern und der inneren Molekularschicht (Pfeil in e) ist erhalten und es finden sich nur wenige Fasern im Hilus (Pfeilspitze in f). g-i: Entorhinale Fasern in der Fascia dentata (g), der Molekularschicht (h) und dem Hilus (i) von apoER2 -/- Tieren. Die schichtenspezifische Termination bleibt erhalten ebenso wie die scharfe Grenze zur inneren Molekularschicht (Pfeil in h). Nur wenige Fasern finden sich im Hilus (Pfeilspitze in i). j-l: Entorhinale Fasern in der Fascia dentata (j), der Molekularschicht (k) und dem Hilus (l) von reeler (rl -/-) Mäusen. Trotz vieler falsch positionierter Körnerzellen bleibt das grundsätzliche Terminationsmuster entorhinaler Fasern erhalten (j). Beachte die nach wie vor erhaltene scharfe Grenze zwischen dem entorhinalen Faserplexus und der Körnerzellzone (Pfeil in k). Im Hilus hingegen finden sich verglichen zu Kontrollen viele Fasern (Pfeilspitze in l). Eichstriche: a, d, g und j: 150 µm; b, e, h und k: 30 µm; c, f, i und l: 50 µm. III-3 Die kommissurale Projektion Zur Darstellung der kommissuralen Projektion wurde PHAL in den kontralateralen Hilus injiziert. Dort wurde der Tracer von den Ursprungszellen der kommissuralen Fasern aufgenommen und über die hippokampale Kommissur in den kontralateralen Hippokampus transportiert. In Kontrolltieren (Abbildungen 9 a-c) enden die kommissuralen Fasern überwiegend geschichtet im inneren Drittel der Molekularschicht (Deller et al., 1999a; Stanfield et al., 1979; Blackstad, 1956; zur Übersicht: Deller, 1998 und Amaral and Witter, 1995). Diese Fasern bilden einen dichten Plexus, der gegenüber der äußeren Molekularschicht scharf abgegrenzt ist. Eine geringere Zahl kommissuraler Fasern verhält sich jedoch anders und endet auch in Kontrolltieren in der äußeren Molekularschicht. Diese Fasern durchqueren den kommissuralen Faserplexus in der inneren Molekularschicht und verzweigen in der äußeren Molekularschicht. Es wird vermutet, dass es sich bei diesen kommissuralen Fasern zur äußeren Molekularschicht um die Axone kommissural projizierender GABAerger Neurone im Hilus handelt (Zappone and Sloviter, 2001; Deller et al., 1999a; Deller et al., 1995). Im Hilus finden sich vereinzelte kommissurale Fasern, die den Hilus mehr oder weniger gradlinig durchqueren, um bis in die Molekularschicht der Fascia dentata zu ziehen. Diese kommissuralen 33 Fasern verzweigen nur selten und bilden nur vereinzelte en passant Boutons (Deller et al., 1995). Das Terminationsmuster kommissuraler Fasern bleibt in vldlr -/- Mäusen erhalten (Abbildungen 9 d-f). Der Großteil der kommissuralen Fasern bildet einen dichten Plexus in der inneren Molekularschicht und man findet einzelne kommissurale Fasern in der äußeren Molekularschicht. Im Gegensatz zu Kontrolltieren beobachtet man in vldlr -/- Mäusen jedoch eine vermehrte Zahl an kommissuralen Fasern im Hilus, insbesondere unmittelbar unterhalb der Körnerzellschicht. Die Betrachtung einzelner kommissuraler Axone zeigte, dass es sich bei diesen Fasern mit großer Wahrscheinlichkeit um Axonkollateralen kommissuraler Axone handelt, die bis zur inneren Molekularschicht ziehen. Diese Axonkollateralen verzweigen sich direkt unterhalb der Körnerzellschicht, in topographischer Beziehung zu den dort vorhandenen ektopen Körnerzellen. Das Terminationsmuster in apoER2 -/- Mäusen ist gegenüber Kontrollen noch deutlicher verändert (Abbildungen 9 g-i). In der inneren Molekularschicht findet sich zwar noch ein Faserplexus, jedoch erscheint die Abgrenzung dieses Faserplexus zur Körnerzellschicht unscharf. Die Grenze zur äußeren Molekularschicht ist nach wie vor scharf ausgebildet. Im Hilus und in der aufgelockerten Körnerzellschicht findet man zahlreiche kommissurale Fasern, wobei die Fasern im Hilus viele Verzweigungen und Boutons ausbilden. Die kommissurale Projektion von reeler Mäusen wurde bereits detailliert beschrieben (Borrell et al., 1999; Deller et al., 1999a; Stanfield et al., 1979) und diese früheren Ergebnisse konnten in der vorliegenden Untersuchung bestätigt werden (Abbildungen 9 j-l). So fanden wir keinen abgrenzbaren kommissuralen Faserplexus mehr, lediglich eine gewisse Präferenz kommissuraler Fasern für die Zone direkt oberhalb der Körnerzellen konnte beobachtet werden. Die meisten kommissuralen Fasern enden in der Körnerzellzone, wo sie ein dichtes Netzwerk bilden. Ebenso wie bei allen anderen untersuchten Mausstämmen findet man bei reeler Mäusen kommissurale Fasern in der äußeren Molekularschicht. 34 Abbildung 9 35 Abbildung 9: Die geschichtete Termination kommissuraler Fasern ist in vldlr -/-, apoER2 -/- und rl -/- Mäusen gestört. a-c: Anterogrades Tracing mit Phaseolus vulgaris-Leukoagglutinin zeigt die geschichtete Termination kommissuraler Fasern in Kontrolltieren (+/+). Fascia dentata (a), der Molekularschicht (b) und dem Hilus (c). Kommissurale Fasern bilden einen dichten Faserplexus (Pfeil in b) in der inneren Molekularschicht (IMS). Einige Fasern finden sich in der äußeren Molekularschicht (ÄMS; Pfeilspitze in b). Der Hilus (H) wird von Fasern gekreuzt (Pfeilspitze in c), die auf dem Weg zur Molekularschicht sind. KZS, Körnerzellschicht. d-f: Das Terminationsmuster kommissuraler Fasern ist leicht verändert in der Fascia dentata (d), der Molekularschicht (e) und dem Hilus (f) von vldlr -/- Mäusen. Der dichte Faserplexus in der inneren Molekularschicht ist erhalten (Pfeil in e). Mehrere kommissurale Fasern sind in der äußeren Molekularschicht (Pfeilspitze in e) zu finden. Im Gegensatz zu Kontrollen finden sich mehrere kommissurale Fasern direkt unterhalb der Körnerzellschicht (Pfeilspitzen in d), wo sie sich verzweigen und Kollateralen bilden. g-i: Die Termination kommissuraler Fasern ist in der Fascia dentata (g), der Molekularschicht (h) und dem Hilus (i) von apoER2 -/- Tieren verändert. Der Faserplexus in der inneren Molekularschicht (Pfeil in h) ist weniger gut abgrenzbar. Mehrere kommissurale Fasern finden sich in der äußeren Molekularschicht (Pfeilspitze in h). Im Hilus finden sich viele Fasern (Pfeilspitzen in i) die sich dort verzweigen und Terminalen bilden. j-l: In rl -/- Mäusen ist die Termination kommissuraler Fasern in der Fascia dentata (j), der Molekularschicht (k) und dem Hilus (l) stark verändert. Obwohl die Fasern immer noch die Zone direkt über der Körnerzellzone bevorzugen (Pfeil in k), wird keine kompakte Faserschicht gebildet. Kommissurale Fasern finden sich in der äußeren Molekularschicht (Pfeilspitze in k). Der Hilus ist voll mit kommissuralen Fasern (Pfeilspitze in l), die Faszikel und einen lockeren Plexus bilden. Eichstriche: a, d, g und h: 100 µm; b, e, h und k: 50 µm; c, f, i und l: 30 µm. III-4 Calretinin-Immunhistochemie zeigt eine veränderte Termination kommissural/assoziativer Mooszellaxone in vldlr -/-, apoER2 -/- und rl -/- Mäusen Mooszellaxone bilden den größten Teil der kommissuralen und assoziativen Fasern zur inneren Molekularschicht (zur Übersicht: Deller, 1998 und Amaral and Witter, 1995). Diese Zellen enthalten in der Maus das kalziumbindende Protein Calretinin, wodurch man Mooszellen und Mooszellaxone in der Maus immunzytochemisch gut detektieren kann (Fujise et al., 1998; Blasco-Ibanez and Freund, 1997; Liu et al., 1996). Während die PHAL-Markierung alle kommissuralen Fasern darstellt, lässt sich mittels Calretinin-Immunhistochemie eine neurochemisch definierte Untergruppe des kommissuralen/assoziativen Fasersystems markieren und in den Mutanten untersuchen. 36 Abbildung 10 37 Abbildung 10: Calretinin-Immunhistochemie zeigt Mooszellen und Cajal-Retzius Zellen in vldlr -/-, apoER2 -/- und rl -/- Mäusen. a-d: Calretinin Färbung in der Fascia dentata (a), der Molekularschicht (b, c) und dem Hilus (d) eines Kontrolltieres. Mehrere Calretinin-positive Mooszellen sind im Hilus (H) vorhanden. Die Axone dieser Zellen bilden den kommissural/assoziativen Faserplexus in der inneren Molekularschicht (IMS). In der äußeren Molekularschicht (ÄMS) finden sich einige Cajal-Retzius Zellen nahe der hippokampalen Fissur (c). Nur wenige Calretinin-positive puncta sind im Hilus zu finden (d). KZS, Körnerzellschicht. e-h: Calretinin in der Fascia dentata (e), der Molekularschicht (f, g) und dem Hilus (h) einer vldlr -/- Maus. Mooszellen und Cajal-Retzius Zellen finden sich im Hilus (e, h), beziehungsweise in der Nähe der hippokampalen Fissur (g). Ein dichter Calretinin-positiver Plexus findet sich in der inneren Molekularschicht (Pfeil in f). Verglichen mit Kontrollen sieht man viele Calretininpositive puncta direkt unterhalb der Körnerzellschicht. i-l: Calretinin in der Fascia dentata (i), der Molekularschicht (j, k) und dem Hilus (l) von apoER2 -/- Mäusen. Mooszellen finden sich zwischen falsch positionierten Körnerzellen (i). Mehrere Cajal-Retzius Zellen sieht man an Ihrer normalen Lokalisation in der Nähe der hippokampalen Fissur (k). Zusätzlich zu dem dichten Calretinin-positiven Plexus in der inneren Molekularschicht (Pfeil in j) gibt es viele Calretinin-positive puncta im Hilus (l). m-p: Calretinin in der Fascia dentata (m), der Molekularschicht (n, o) und dem Hilus (p) von reeler (rl -/-) Mäusen. Mooszellen sieht man in der Körnerzellzone (m) und mehrere CajalRetzius Zellen finden sich nahe der hippokampalen Fissur (o). Der Hilus enthält zahlreiche Calretinin-positiven puncta (p). Obwohl kein gut erkennbarer Calretinin-positiver Plexus vorhanden ist, bilden Calretinin-positive Fasern eine Grenze zur äußeren Molekularschicht (Pfeil in n). Eichstriche: a, e, i, m: 100 µm; b, f, j, n: 50 µm; c, g, k, o: 5 µm; d, h, l, p: 30 µm. In Kontrolltieren (Abbildungen 10 a-d) lassen sich zahlreiche Calretininpositive Mooszellen im Hilus nachweisen. Ebenso ist die innere Molekularschicht Calretinin-immunreaktiv; dort enden die kommissural/assoziativen Mooszellaxone. Im Hilus finden sich nur wenige Calretinin-positive puncta, was dafür spricht, dass nur wenige kommissurale/assoziative Mooszellaxone im Hilus von Kontrollmäusen zu finden sind. In vldlr -/- Mäusen (Abbildungen 10 e-h) findet sich ebenfalls ein dichter Calretinin-positiver Plexus in der inneren Molekularschicht; Calretinin-positive Mooszellen sind im Hilus nachweisbar. Verglichen mit Kontrolltieren finden sich jedoch mehr Calretinin-positive puncta im Hilus, direkt unterhalb der Körnerzellschicht, also dort, wo man auch mit Hilfe des anterograden Tracings einen dünnen Faserplexus nachweisen kann. Die Veränderungen bei apoER2 -/- Mäusen sind ausgeprägter (Abbildungen 10 i-l). Calretinin-positive Mooszellen finden sich inmitten ektoper Körnerzellen und der Hilus ist mit Calretinin-positiven puncta bedeckt. 38 Reeler Mäuse zeigen die offensichtlichsten Veränderungen in der Verteilung der Calretinin Immunreaktivität (Abbildungen 10 m-p). Mooszellen sind über die ganze Körnerzellzone verteilt und der Calretinin-positive Faserplexus oberhalb der Körnerzellen ist nicht sicher abgrenzbar. Nur unmittelbar oberhalb der Körnerzellen findet sich eine erhöhte Dichte Calretinin-positiver Fasern. Die meisten Calretininpositiven Fasern enden jedoch in der Körnerzellzone und dort finden sich auch sehr viele Calretinin-positiven puncta. III-5 Calretinin- / CalbindinDoppelimmunfluoreszenzfärbungen bestätigen die räumliche Assoziation Calbindin-positiver Körnerzellen und Calretinin-positiver kommissural/assoziativer Fasern In Kontrolltieren bestätigt die Doppelimmunfluoreszenz die Assoziation von Körnerzellen der Fascia dentata und kommissural/assoziativen Fasern (Abbildung 11 a). Die Körnerzellschicht besteht aus stark Calbindin-positiven, dicht gepackten Körnerzellen, deren Dendriten in die Molekularschicht ragen (Abbildung 11 e). Der Großteil Calretinin-positiver Boutons befindet sich an Körnerzelldendriten in der inneren Molekularschicht (Abbildung 11 e). Auch in vldlr -/- Mäusen besteht die Körnerzellschicht aus Calbindin-positiven, dicht aneinander liegenden Körnerzellen (Abbildung 11 b). Direkt unterhalb der Körnerzellschicht findet sich eine leichte Zuname der Calretinin-Immunreaktivität (Abbildung 11 f), also dort wo man in der PHAL Färbung einen feinen Faserplexus findet. In der inneren Molekularschicht sieht man mehrere Calretinin-positive Boutons an Calbindin-positiven Körnerzellsomata oder –dendriten (Abbildungen 11 b, 11 f). Die Veränderungen in apoER2 -/- Mäusen sind stärker. Der Hilus enthält viele Calbindin-positive Körnerzellen, deren Dendriten teilweise Ihre Polarität verloren haben (Abbildungen 11 c, 11 g). Auch die Calretinin-Immunreaktivität ist im Hilus stärker ausgeprägt und dort um die falsch positionierten Körnerzellen konzentriert (Abbildungen 11 c, 11 g). 39 Abbildung 11: Immunfluoreszenzdoppelfärbung für Calretinin (kommisural/assoziative Fasern; rot) und Calbindin (Körnerzellen; grün) a: Immunfluoreszenzdoppelfärbung für Calretinin und Calbindin in einem Kontrolltiere (+/+). Calretinin positive Fasern finden sich vor allem in der inneren Molekularschicht (IMS). Im Hilus (H) gibt es wenige Calretinin-immunreaktive Zellen. Höhere Vergrößerung eines Ausschnittes in e. Körnerzellschicht, KZS; äußere Molekularschicht, ÄMS. b: Immunfluoreszenzdoppelfärbung für Calretinin und Calbindin in einem vldlr -/- Tier. Calretinin positive Fasern finden sich in der IMS und unterhalb der KZS. Höhere Vergrößerung eines Ausschnittes in f. c: Immunfluoreszenzdoppelfärbung für Calretinin und Calbindin in einer apoER2 -/- Maus. Calretinin positive Fasern finden sich im Hilus, der KZS und der Molekularschicht. Höhere Vergrößerung eines Ausschnittes in g. 40 d: Immunfluoreszenzdoppelfärbung für Calretinin und Calbindin in einer reeler (rl -/-) Maus. Calretinin-positive Fasern finden sich in der gesamten Körnerzellzone. Höhere Vergrößerung eines Ausschnittes in h. e: Höhere Vergrößerung von a. Man sieht Calretinin-positive Boutons direkt neben Calbindin-positiven Körnerzelldendriten in der IMS. f: Höhere Vergrößerung von b. Man sieht Calretinin-positive Boutons direkt neben Calbindin-positiven Körnerzelldendriten oder falsch positionierten Körnerzellen in der IMS (Pfeil). Einige Boutons finden sich unterhalb der KZS (Pfeilspitze). g: Höhere Vergrößerung von c. Falsch positionierte Calbindin-positive Körnerzellen (Pfeil) oder ihre Dendriten sind von Calretinin-positiven puncta umgeben. h: Höhere Vergrößerung von d. Calretinin-positive puncta umgeben falsch positionierte Calbindin-positive Körnerzellen. Eichstriche: a-d: 100 µm; e-h: 20 µm. Am ausgeprägtesten sind die Veränderungen in reeler Mäusen. Die Körnerzellen sind nicht mehr in einer Schicht organisiert und Ihre Dendriten zeigen in alle Richtungen (Abbildungen 11 d, 11 h). Die Calretinin-Immunreaktivität zeigt eine leichte Präferenz für den Bereich oberhalb der Körnerzellzone, ist jedoch auch im Hilus stark ausgeprägt (Abbildung 11 d). Die direkte Assoziation von Calretininpositiven Boutons direkt an falsch positionierten Calbindin-positiven Körnerzellen oder deren Dendriten ist gut erkennbar (Abbildung 11 h). III-6 Calretinin-positive Cajal-Retzius Zellen in vldlr -/-, apoER2 -/- und rl -/- Mäusen Calretinin ist auch ein Molekül für Cajal-Retzius Zellen in der Fascia dentata der Maus (Alcantara et al., 1998; Liu et al., 1996; Del Rio et al., 1995). In Kontrolltieren (Abbildung 10 c), vldlr -/- (Abbildung 10 g), apoER2 -/- (Abbildung 10 k) und rl -/- Mäusen (Abbildung 10 o) findet man Cajal-Retzius Zellen an Ihrer normalen Position nahe der hippokampalen Fissur. Diese Zellen sind klein, horizontal orientiert und von ovaler Gestalt. Sie geben einen Dendriten ab, der parallel zur hippokampalen Fissur verläuft (Drakew et al., 1998; Liu et al., 1996; Del Rio et al., 1995; Soriano et al., 1994; VonHaebler et al., 1993). In erwachsenen Kontrolltieren findet man nur wenige dieser Zellen, da die Mehrheit dieser Neurone nur vorübergehend vorhanden ist und in den ersten Wochen nach Geburt verschwindet (Marin-Padilla, 1998; Del Rio et al., 1997; Soriano et al., 1994). In erwachsenen reeler Mäusen schien die Anzahl vorhandener Cajal-Retzius Zellen jedoch größer zu sein (Deller et al., 1999a), was kürzlich mit Hilfe stereologischer Zählverfahren 41 bewiesen wurde (Coulin et al., 2001). In vldlr -/- und apoER2-/- Mäusen konnten wir keine offensichtlich erhöhte Anzahl von Cajal-Retzius Zellen beobachten. Eine genaue Aussage ließe sich jedoch nur mit Hilfe einer stereologischen Zellzählung machen. 42 IV Diskussion In dieser Studie wurde die Frage gestellt, inwiefern die Schichtung afferenter Fasersysteme im Hippokampus von einer normalen Zytoarchitektur abhängt. Hierzu wurden Mausmutanten (vldlr -/-, apoER2 -/- und rl -/- Mäuse) untersucht, bei denen Gendefekte im Reelin-Signaltransduktionsweg zu charakteristischen Störungen der Körnerzellmigration geführt haben. Die Störungen in der Körnerzellverteilung wurden mit der Termination zweier geschichteter Fasersysteme, den entorhinalen und den kommissural/assoziativen Afferenzen, korreliert. Es zeigte sich, dass die geschichtete Termination der entorhinalen Fasern nicht von der Körnerzellverteilung abhängt, da diese Fasern auch in den Mutanten in ihrer normalen Schicht enden. Im Gegensatz hierzu ist die geschichtete Termination der kommissuralen Fasern von der Körnerzellverteilung abhängig, da die geschichtete Termination kommissuraler Fasern in den Mutanten aufgehoben ist. Diese Daten stützen die Hypothese, dass bislang noch unbekannte molekulare Signale auf den Körnerzellen der Fascia dentata die schichtenspezifische Termination der kommissuralen und assoziativen Fasern regulieren. IV-1 Kritische Betrachtung der verwendeten Methoden Um die Verteilung der zwei Hauptafferenzen zum Hippokampus mit der Verteilung der Körnerzellen zu vergleichen, müssen sowohl die afferenten Faserbahnen als auch die Körnerzellen sicher identifizieren werden. Die Markierung der Fasertrakte erfolgte im Rahmen unserer Experimente mit Hilfe der hochauflösenden und sehr sensitiven anterograden Markierungssubstanz PHAL, die seit längerem mit guten Ergebnissen im neurowissenschaftlichen Bereich eingesetzt wird (Deller et al., 2000; Deller et al., 1999b; Deller, 1998; Frotscher et al., 1997; Pinault, 1996; Deller et al., 1995; Gerfen and Sawchenko, 1984). Von einer sicheren Identifizierung der Faserbahnen mit Hilfe dieser Substanz kann daher ausgegangen werden. Zur Identifikation von Körnerzellen verwendeten wir das kalziumbindende Protein Calbindin. Dieses Molekül ist in der Fascia dentata der Maus sowohl in 43 Körnerzellen als auch in Interneuronen nachweisbar (Baimbridge et al., 1992; Sloviter, 1989b; Baimbridge and Miller, 1982; zur Übersicht: Freund and Buzsàki, 1996). Es stellt sich somit die Frage, ob Calbindin im Rahmen unserer Untersuchungen als ein hinreichend spezifischer Körnerzellmarker angesehen werden kann. Zwei Gründe legen dies nahe: (1) In der Fascia dentata ist die Zahl der Calbindin-positiven Interneurone sehr gering (Baimbridge and Miller, 1982). Da die Zahl der Calbindin-positiven Körnerzellen die Zahl der Calbindin-positiven Interneurone um ein Vielfaches übersteigt, kann die geringe Zahl Calbindin-positiver Interneurone im Rahmen der hier durchgeführten Untersuchung vernachlässigt werden. (2) Die Körnerzellen besitzen eine sehr charakteristische Größe und Form. Dadurch können sie aufgrund ihrer morphologischen Eigenschaften leicht identifiziert (z.B. großer runder Zellkern, Durchmesser des Somas gering, weniger als 10 µm) und von Calbindin-positiven Interneuronen (unregelmäßig geformter Zellkern, Somadurchmesser. meist deutlich größer als 10µm) unterschieden werden (Frotscher, 1988). Wir sind daher davon überzeugt, dass Calbindin als Körnerzellmarker in der Fascia dentata sinnvoll eingesetzt werden kann. Ein zweiter methodischer Aspekt betrifft die qualitative Natur der hier durchgeführten Untersuchungen. Zur Beantwortung unserer Fragestellung haben wir zwar das Verteilungsmuster der markierten Fasersysteme mit der Verteilung der Körnerzellen verglichen, quantitative Aussagen über die untersuchten Projektionssysteme in den verschiedenen Mutanten aber weitestgehend vermieden. Dies hängt damit zusammen, dass zwischen einzelnen Tieren große interindividuellen Schwankungen in der Injektionsgröße beobachtet werden. Kleine Injektionen markieren wenige Fasern, während es nach großen Injektionen zu einer Markierung von vielen Fasern kommt. Es lassen sich daher mit Hilfe anterograder Markierungsverfahren bestenfalls semi-quantitative Aussagen zur Mächtigkeit einer Faserprojektion machen. In den Abbildungen der vorliegenden Arbeit wurden ausschließlich Hirnschnitte von Tieren abgebildet, deren Injektionsgröße und Injektionsqualität miteinander vergleichbar gewesen sind. Es sind seit der Erstbeschreibung des reeler-Phänotyps mehrere Mutationen im reeler Genlocus beschrieben worden. Die verschiedenen reeler Mutanten wurden als Inzucht-Stämme gezüchtet, was zur Entstehung von verschiedenen reeler 44 Mauslinien geführt hat. Um nur auf eine dieser Linien einzugehen, sei an dieser Stelle die Orleans reeler Maus (rlorl) genannt, die noch reelin mRNA (Hirotsune et al., 1995) und eine mutierte Version des Proteins synthetisieren (205 C-terminale Aminosäuren fehlen), aber nicht sekretieren kann. Die von uns in dieser Studie verwendeten reeler Mäuse sind aus den Jackson Laboratories und haben keine Restaktivität, d.h. reelin mRNA wird nicht mehr synthetisiert (zur Übersicht: Curran and D´Arcangelo, 1998). Wie bereits in der Einleitung erwähnt sind die Unterschiede zwischen den verschiedenen reeler Stämmen minimal und vermutlich auf den unterschiedlichen genetischen Hintergrund zurückzuführen, da jedoch über Unterschiede zwischen den reeler Stämmen berichtet wurde (Goffinet, 1990), die eventuell auf einer Restaktivität des mutierten Proteins beruhen könnten, soll an dieser Stelle betont werden, dass die von uns verwendete Jackson Reeler Maus keinerlei Reelin Restaktivität besitzt. IV-2 Die Termination entorhinaler Fasern ist unabhängig von Reelin und dem Reelin-Rezeptor Komplex Die Termination entorhinaler Afferenzen zum Hippokampus erfolgt in allen untersuchten Tieren geschichtet. Auch wenn es kleinere Veränderungen gibt, so bleibt doch generell das Terminationsgebiet auf die äußere Molekularschicht oder ein entsprechendes Pendant beschränkt. Auch in Tierstämmen mit vielen ektopen Körnerzellen, wie zum Beispiel den apoER2 -/- und rl -/- Mäusen, endeten die entorhinalen Fasern in einem schichtenspezifischen Muster in der äußeren Molekularschicht der Fascia dentata. Diese Ergebnisse stehen in gutem Einklang mit früheren Untersuchungen in denen gezeigt wurde, dass entorhinale Fasern unabhängig von der Position der Körnerzellen dazu in der Lage sind, ihre normale Terminationsschicht zu finden (Deller et al., 1999a; Del Rio et al., 1997; Stanfield et al., 1979; Bliss and Chung, 1974). Auch Läsionen der Körnerzellen verschiedenster Art konnten in normalen Mäusen das Terminationsmuster entorhinaler Fasern nicht ändern (Legendre et al., 1994; Goldschmidt and Steward, 1992; Tonder et al., 1989; Zimmer et al., 1986; Laurberg and Hjorth-Simonsen, 1977). Wie in neuen Untersuchungen gezeigt wurde, sind entorhinale Fasern dazu in der Lage, die äußere Molekularschicht auch dann noch zu finden, wenn während der Entwicklung die gesamte Körnerzellschicht fehlt (Schwab et al., 2000). Entorhinale Fasern enden somit unabhängig von Körnerzellen. 45 Welche Signale determinieren das schichtenspezifische Einwachsen entorhinaler Fasern in die Fascia dentata? In mehreren Studien konnte gezeigt werden, dass Reelin synthetisierende Cajal-Retzius Zellen für das korrekte Einwachsen entorhinaler Fasern in die äußere Molekularschicht verantwortlich sind; (Supèr et al., 1998; Del Rio et al., 1997; zur Übersicht: Frotscher, 1998). Diese Zellen finden sich während der Entwicklung in der äußeren Molekularschicht und einwachsende entorhinale Fasern bilden vorübergehend Synapsen mit Ihnen aus, bevor sie Kontakte mit Ihren endgültigen Zielzellen in der Fascia dentata herstellen. Da die Axone von Cajal-Retzius Zellen während der Hirnentwicklung zum entorhinalen Kortex projizieren bevor die entorhinalen Afferenzen zum Hippokampus einwachsen, wurde vorübergehende vorgeschlagen, Projektion als dass die Leitschiene entorhinalen benutzen, Fasern um die diese äußere Molekularschicht der Fascia dentata zu erreichen (Ceranik et al., 1999). Obwohl die molekularen Mechanismen der Interaktion von Cajal-Retzius Zellen mit entorhinalen Fasern noch nicht bekannt sind, so machen die Ergebnisse der hier vorliegenden Arbeit deutlich, dass dafür Reelin und der Reelin-Rezeptor Komplex nicht notwendig sind. Weder die Abwesenheit von Reelin, noch Mutationen im Reelin-Rezeptor Komplex führten zu einer Störung des normalen Einwachsens entorhinaler Fasern in die äußere Molekularschicht. In allen Mutanten fanden sich Calretinin-positive Cajal-Retzius Zellen in der äußeren Molekularschicht, die entorhinale Fasern dorthin leiten können. Neue Untersuchungen legen außerdem den Schluss nahe, dass es noch deutlich mehr Wegfindungssignale für Fasern aus dem EC gibt (zur Übersicht: Skutella and Nitsch, 2001). Zum Beispiel scheint ephrin-A3 auf Fasern des Tractus perforans abstoßend zu wirken (Stein et al., 1999). In einer anderen Untersuchung wurden organotypische Schnittkulturen mit Hyaluronidase behandelt, was sowohl einen Verlust der schichtenspezifischen Adhäsion als auch einen Verlust des schichtenspezifischen Wachstums entorhinaler Fasern nach sich zog (Förster et al., 2001). Die molekularen Interaktionspartner sind zwar noch unbekannt, jedoch lassen diese Beobachtungen vermuten, dass Hyaluronsäure-assoziierte Moleküle eine wichtige Rolle für die schichtenspezifische Termination der entorhino-hippokampalen Projektion spielen. 46 IV-3 Die geschichtete Termination kommissuraler Fasern hängt von der Anordnung der Körnerzellen ab Wie mittels anterogradem Tracing und Calretinin Immunhistochemie gezeigt werden konnte, korreliert die Verteilung kommissuraler/assoziativer Fasern mit der Verteilung der Körnerzellen in der Fascia dentata. So finden sich in vldlr -/- Mäusen nur wenige ektope Körnerzellen, vor allem in der inneren Molekularschicht und dem Hilus. Entsprechend sieht man nach PHAL-Injektion in den kontralateralen Hilus nur wenige ektope kommissurale Fasern unterhalb der Körnerzellschicht und in der inneren Molekularschicht, wo sie an den proximalen Dendriten falsch positionierter Körnerzellen enden (Synopsis siehe Abbildung 12). In apoER2 -/- Mäusen finden sich viele ektope Körnerzellen im Hilus. Entsprechend sieht das Bild in der Calretininund PHAL-Färbung aus: Zahlreiche PHAL-markierte kommissurale Fasern finden sich im Hilus, ebenso wie viele Calretinin reaktive puncta (Synopsis siehe Abbildung 12). In rl -/- Mäusen sind die Körnerzellen beinahe zufällig im ganzen Zentrum der Fascia dentata verteilt, genauso wie die kommissuralen Fasern: PHAL markierte Fasern bilden ein lockeres Netzwerk in der Mitte der Fascia dentata und Calretininpositive puncta sind in der gesamten Körnerzellzone zu finden (Synopsis siehe Abbildung 12). In rl -/- Mäusen findet sich kein abgrenzbarer Plexus kommissuraler Fasern, ebenso wenig wie man dort eine geordnete Körnerzellschicht erkennen kann. Hingegen bilden die kommissuralen Fasern in vldlr -/- und apoER2 -/- Tieren noch einen Plexus aus, genauso wie diese Tiere noch eine geordnete Körnerzellschicht erkennen lassen. Die Daten dieser Studie zeigen einen sehr engen Zusammenhang zwischen der Verteilung der Körnerzellen und dem Terminationsgebiet kommissuraler Fasern und liefern weitere Unterstützung für die Hypothese, dass Signale auf Körnerzellen den einwachsenden kommissuralen Fasern als Wegfindungssignale dienen. Unsere Daten sprechen also gegen die in der Einleitung erwähnte Vermutung, dass GABAerge Pionierneurone den einwachsenden kommissuralen Fasern als Leitschiene dienen (Borrell et al., 1999). In dieser Arbeit wurde auch vermutet, dass kommissurale Fasern in der äußeren Molekularschicht ein Merkmal einer aberranten kommissuralen Projektion in reeler Mäusen sind. Jedoch konnte bereits vor einiger 47 Zeit demonstriert werden, dass solche Fasern ein normales Merkmal von Nagetieren sind (Deller et al., 1999a; Deller et al., 1995; diese Studie). Zusätzlich zu unseren Daten konnte vor kurzem gezeigt werden, dass GABAerge Interneurone für die geschichtete Termination hippokampaler Afferenzen nicht erforderlich sind (Pleasure et al., 2000). In Ihrer eleganten Studie stellten Pleasure und Kollegen Dlx1/2 Mutanten her, denen die GABAerge Zellpopulation im Hippokampus fehlt, also eben die Zellen, die als Pionierneurone für einwachsende entorhinale Fasern dienen sollten. Die Untersuchung entorhinaler und kommissural/assoziativer Fasern in Dlx1/2 Mäusen zeigte, dass die Afferenzen zum Hippokampus trotz der Abwesenheit GABAerger Neurone normal enden. Dies zeigt, dass GABAerge Hauptafferenzen Neurone zum nicht für Hippokampus die nötig normale sind. Entwicklung Zusammen mit der zwei unseren Untersuchungen liegt folglich der Schluß nahe, dass Körnerzellen die nötigen Signale für einwachsende entorhinale Fasern während der Entwicklung liefern. 48 Abbildung 12: Die Zyto- und Faserarchitektur der Fascia dentata von Kontrolltieren (+/+), VLDLR- (vldlr -/-), ApoER2 defizienten Mäusen (apoER2 -/-) und reeler Mäusen (rl -/-). Zusammenfassung der Verteilung von Körnerzellen (KZ), dem Terminationsmuster kommissuraler Fasern (COM) und dem Terminationsmuster entorhinaler Fasern (EC) in der Fascia dentata. In Kontrolltieren sind die Körnerzellen in einer dichtgepackten Schicht organisiert. Dieses Muster ist in vldlr -/- Mäusen leicht, in apoER2 -/- Mäusen etwas mehr und in rl -/- Mäusen stark gestört. Diese Veränderungen in der Zytoarchitektur werden von der Verteilung kommissuraler Afferenzen in den drei Mutanten widergespiegelt: ektop endende Fasern finden sich dort, wo auch ektope KZ zu finden sind. Im Gegensatz dazu wird das Terminationsmuster entorhinaler Fasern kaum von der gestörten Verteilung der KZ beeinflusst. Also beeinträchtigt die Fehlverteilung von Körnerzellen in diesen Mutanten die Termination kommissuraler Fasern, nicht aber die entorhinaler Afferenzen. KZS, Körnerzellschicht; H, Hilus; IMS, innere Molekularschicht; ÄMS, äußere Molekularschicht; MS, Molekularschicht; KZZ, Körnerzellzone. 49 IV-4 Die Reelin-Signaltransduktion und die Entwicklung des Hippokampus Reeler Mäuse sind seit Jahrzehnten für die Forschung verfügbar und haben unser Denken über Gene und Moleküle, die die Positionierung während der Gehirnentwicklung steuern, bestimmt (Rice and Curran, 1999; D'Arcangelo and Curran, 1998; Rakic and Caviness, 1995). Reelin selbst (D'Arcangelo et al., 1995) und die Komponenten des Reelin-Rezeptor-Komplexes (Trommsdorff et al., 1999; Hiesberger et al., 1999; D'Arcangelo et al., 1999; zur Übersicht: Herz, 2001) wurden erst vor kurzem entdeckt. Interessanterweise führt nur das Fehlen beider Teile des Reelin-Rezeptor-Komplexes zum reeler Phänotyp (Trommsdorff et al., 1999). Fehlt entweder der ApoE-Rezeptor 2, oder der VLDL-Rezeptor kommt es zu eigenen, vom reeler Phänotyp unterschiedlichen morphologischen Defekten (Trommsdorff et al., 1999; diese Studie). Dies lässt vermuten, dass VLDLR und ApoER2 unterschiedliche Funktionen in verschiedenen Regionen während der Hirnentwicklung haben und dass bestimmte Aspekte neuronaler Migration über die örtliche Verfügbarkeit dieser beiden Rezeptoren gesteuert werden. In unseren Untersuchungen konnten wir zeigen, dass die Migrationstörungen von Körnerzellen in vldlr -/- Mäusen vor allem den Bereich nahe der Körnerzellschicht betreffen. Falsch positionierte Körnerzellen finden sich nur selten in der polymorphen Schicht der Fascia dentata. Es scheint also, dass die Abwesenheit von VLDLR vor allem mit einer unscharfen Grenze der Körnerzellschicht einhergeht und nicht mit einer generellen Störung der Körnerzellpositionierung in der Fascia dentata. Beim Fehlen von ApoER2 hingegen finden sich falsch lokalisierte Körnerzellen in einem größeren Gebiet. Sie lassen sich in der Molekularschicht und in großer Zahl im Hilus nachweisen. Es kommt also in apoER2 -/- Tieren zu einer ausgeprägten Störung der Körnerzellmigration und Positionierung. Man darf allerdings nicht vernachlässigen, dass nicht nur ApoER2 und VLDLR Rezeptoren für Reelin sind, sondern zum Beispiel auch α3β1 Integrin (Dulabon et al., 2000). Dulabon und Kollegen konnten zeigen, dass Reelin durch Bindung an α3β1 50 Integrin zumindest in vitro neuronale Migration hemmt und Nervenzellen dazu befähigt, sich von radialen Gliafasern zu lösen. Es könnten durchaus noch weitere Moleküle als Rezeptoren oder Korezeptoren für Reelin hinzukommen, so dass unsere Erklärungsversuche bezüglich der Unterschiede zwischen ApoER2- und VLDLR-defizienten Mäusen sowie reeler Mäusen nur vorläufiger Natur sein können. Dennoch ist es sinnvoll diese Beobachtungen mit den Migrationprozessen in normalen und reeler Mäusen zu vergleichen (Stanfield and Cowan, 1979a). In normalen Mäusen werden Körnerzellen entlang der tiefen Anteile des suprapyramidalen Blattes und in einem Proliferationszentrum am Rand des zukünftigen infrapyramidalen Blattes gebildet. Diese Zellen wandern daraufhin radiär in oberflächlichere Bereiche der Körnerzellschicht, beziehungsweise in das infrapyramidale Blatt. oberflächlichen Anteile In rl des -/- Mäusen werden suprapyramidalen Körnerzellen Blattes entlang gebildet und der ein Proliferationszentrum ist nicht erkennbar. Die Wanderung der Körnerzellen verläuft umgekehrt und Körnerzellen wandern radiär in den Hilus. Es wäre möglich, dass VLDLR und ApoER2 diese Prozesse unterschiedlich regulieren und sich so die Unterschiede zwischen apoER2 -/- und vldlr -/- Mäusen erklären ließen. Zum Beispiel könnte ApoER2 die radiale Wanderung zur Oberfläche der Körnerzellschicht steuern, während VLDLR eine Rolle zusammen mit α3β1 Integrin beim Loslösen der Nervenzellen von radialen Gliafasern spielen könnte. Weitere Experimente an vldlr -/und apoER2 -/- Mäusen sind in jedem Falle nötig, um die Rolle von ApoER2 und VLDLR bei der Steuerung neuronaler Migration während der Entwicklung aufzuklären. 51 V Zusammenfassung Die Aufklärung von Entwicklungsprozessen, die zu spezifischen Verbindungen zwischen Nervenzellen führen, ist ein fundamentales Ziel der modernen Entwicklungsneurobiologie. Für diese Untersuchungen ist die Fascia dentata der Hippokampusformation aufgrund ihrer überschaubaren Struktur und Konnektivität besonders geeignet. Im Rahmen der vorliegenden Arbeit wurde daher untersucht, welche Signale zur Entstehung spezifischer Verbindungen in der Fascia dentata beitragen. Die Fascia dentata ist gekennzeichnet durch die geschichtete Termination von zwei afferenten glutamatergen Fasersystemen: Fasern aus dem entorhinalen Kortex und kommissural/assoziativen Fasern aus dem kontralateralen Hippokampus. Die entorhinalen Fasern enden in den äußeren zwei Dritteln der Molekularschicht, die kommissural/assoziativen Fasern enden im inneren Drittel. Es wird vermutet, dass diese Faserschichtung von der Anwesenheit eines spezifischen postsynaptischen Partners zur Zeit des Fasereinwachsens während der Gehirnentwicklung abhängt. Eine Hypothese vermutet, dass molekulare Signale auf Körnerzellen die Fasersysteme in ihre jeweilige Schicht lenken. Um die Rolle von Körnerzellen beim schichtenspezifischen Einwachsen der Afferenzen zu untersuchen, wurden daher die Zyto- und Faserarchitektur von drei verschieden Mausmutanten (very-low-density Lipoproteinrezeptor defizienten, Apolipoprotein E Rezeptor 2 defizienten und reeler Mäusen) mit unterschiedlich stark ausgeprägten Körnerzellverteilungsstörungen untersucht. Die afferenten Fasersysteme wurden mit dem anterograden Tracer Phaseolus vulgaris-Leukoagglutinin dargestellt. In Kontrolltieren bilden Körnerzellen eine kompakte Schicht. Diese Zellschichtung ist in vldlr -/- Mäusen leicht verändert, in apoER2 -/- Mäusen stark gestört und in rl -/- Mäusen aufgehoben. Die Veränderungen der Körnerzellanordnung spiegeln sich im Terminationsmuster kommissuraler Fasern wider. Während diese Fasern im Kontrolltier geschichtet enden, finden sie sich in den Mutanten über die Fascia dentata verteilt. Im Gegensatz hierzu enden entorhinale Fasern in allen Mutanten innerhalb der äußeren Molekularschicht. Zusammen mit früheren Befunden der Arbeitsgruppe legen diese Ergebnisse nahe, dass die Schichtung kommissural/assoziativer Fasern von molekularen Signalen auf Körnerzellen gesteuert wird, während die Schichtung entorhinaler Fasern unabhängig von der Anordnung der Körnerzellen reguliert wird. 52 VI Zitierte Literatur 1. Alcantara S, Ruiz M, D´Arcangelo G, Ezan F, de Lecea L, Curran T, Sotelo C, Soriano E (1998) Regional and cellular patterns of reelin mRNA expression in the forebrain of the developing and adult mouse. J Neurosci 18: 7779-7799. 2. Amaral DG, Witter MP (1995) Hippocampal Formation. In: The Rat Nervous System (Paxinos G, ed), pp 443-494. San Diego: Academic Press. 3. Amaral DG (1978) A golgi study of cell types in the hilar region of the hippocampus in the rat. J Comp Neurol 182: 851-914. 4. Andressen C, Blumcke I, Celio MR (1993) Calcium-binding proteins: selective markers of nerve cells. Cell Tissue Res 271: 181-208. 5. Baimbridge KG, Celio MR, Rogers JH (1992) Calcium-binding proteins in the nervous system. Trends Neurosci 15: 303-308. 6. Baimbridge KG, Miller JJ (1982) Immunohistochemical localization of calciumbinding protein in the cerebellum, hippocampal formation and olfactory bulb of the rat. Brain Res 245: 223-229. 7. Baimbridge KG, Miller JJ, Parkes CO (1982) Calcium-binding protein distribution in the rat brain. Brain Res 239: 519-525. 8. Bar I, Lambert dR, Goffinet AM (2000a) The evolution of cortical development. An hypothesis based on the role of the Reelin signaling pathway. Trends Neurosci 23: 633-638. 9. Bar I, Lambert dR, Goffinet AM (2000b) The Reelin-signaling pathway and mouse cortical development. Results Probl Cell Differ 30: 255-276. 10. Bayer SA, Altman J (1987) Directions in neurogenetic gradients and patterns of anatomical connections in the telencephalon. Prog Brain Res 29: 57-106. 11. Blackstad TW (1958) On the termination of some afferents to the hippocampus and fascia dentata: an experimental study in the rat. Acta Anat (Basel) 35: 202-214. 12. Blackstad TW (1956) Commissural connections of the hippocampal region of the rat, with special reference to their mode of termination. J Comp Neurol 105: 417-537. 13. Blasco-Ibanez JM, Freund TF (1997) Distribution, ultrastructure and connectivity of calretinin-immunoreactive mossy cells of the mouse dentate gyrus. Hippocampus 7: 307-320. 14. Bliss TVP, Chung SH (1974) An electrophysiological study of the hippocampus of the reeler mutant mouse. Nature 252: 153-155. 53 15. Borrell V, Ruiz M, Del Rio JA, Soriano E (1999) Development of commissural connections in the hippocampus of reeler mice: evidence of an inhibitory influence of Cajal-Retzius cells. Exp Neurol 156: 268-282. 16. Cajal R (1911) Histologie du systéme nerveux de l'homme et des vertébrés. Paris: A. Maloine. 17. Caviness VS, Jr. (1982) Neocortical histogenesis in normal and reeler mice: a developmental study based upon [3H]thymidine autoradiography. Brain Res 256: 293-302. 18. Caviness VSJ, Rakic P (1978) Mechanismus of cortical development: a view from mutations in mice. Annu Rev Neurosci 1: 297-326. 19. Caviness VSJ, Sidman RL (1973) Retrohippocampal, hippocampal and related structures of the forebrain in the reeler mutant mouse. J Comp Neurol 147: 235-254. 20. Ceranik K, Zhao S, Frotscher M (2000) Development of the entorhinohippocampal projection: guidance by Cajal-Retzius cell axons. Ann N Y Acad Sci 911: 43-54. 21. Ceranik K, Deng J, Heimrich B, Lubke J, Zhao S, Forster E, Frotscher M (1999) Hippocampal Cajal-Retzius cells project to the entorhinal cortex: retrograde tracing and intracellular labelling studies. Eur J Neurosci 11: 42784290. 22. Chae T, Kwon YT, Bronson R, Dikkes P, Li E, Tsai LH (1997) Mice lacking p35, a neuronal specific activator of Cdk5, display cortical lamination defects, seizures, and adult lethality. Neuron 18: 29-42. 23. Coulin C, Drakew A, Frotscher M, Deller T (2001) Stereological estimates of total neuron numbers in the hippocampus of adult reeler mutant mice: Evidence for an increased survival of Cajal- Retzius cells. J Comp Neurol 439: 19-31. 24. Cowan WM, Cuénod M (1975) The use of axonal transport for the study of neuronal connections: a retrospective stuy. In: The use of axonal transport for studies of neuronal connectivity (Cowan WM, Cuénod M, eds), pp 1-24. Amsterdam: Elsevier. 25. Cowan WM, Gottlieb DI, Hendrickson AE, Price JL, Woolsey TA (1972) The autoradiographic demonstration of axonal connections in the central nervous system. Brain Res 37: 21-51. 26. Curran T, D´Arcangelo G (1998) Role of reelin in the control of brain development. Brain Res Rev 26: 285-294. 27. D'Arcangelo G, Homayouni R, Keshvara L, Rice DS, Sheldon M, Curran T (1999) Reelin is a ligand for lipoprotein receptors. Neuron 24: 471-479. 28. D'Arcangelo G, Curran T (1998) Reeler: new tales on an old mutant mouse. Bio Ess 20: 235-244. 54 29. D'Arcangelo G, Miao GG, Curran T (1996) Detection of reelin breakpoint in reeler mice. Mol Brain Res 39: 234-236. 30. D'Arcangelo G, Miao GG, Chen SC, Soares HD, Morgan JI, Curran T (1995) A protein related to extracellular matrix proteins deleted in the mouse mutant reeler. Nature 374: 719-723. 31. de No L (1934) Studies on the Structure of the cerebral cortex. II. Continuation of the study of the Ammonic System. J Psychol Neurol 46: 113-177. 32. Del Rio JA, Heimrich B, Borrell V, Forster E, Drakew A, Alcantara S, Nakajima K, Miyata T, Ogawa M, Mikoshiba K, Derer P, Frotscher M, Soriano E (1997) A role for Cajal-Retzius cells and reelin in the development of hippocampal connections. Nature 385: 70-74. 33. Del Rio JA, Martinez A, Fonseca M, Auladell C, Soriano E (1995) Glutamatelike immunoreactivity and fate of cajal-retzius cells in the murine cortex as identified with calretinin antibody. Cereb Cortex 5: 13-21. 34. Deller T, Naumann T, Frotscher M (2000) Retrograde and anterograde tracing combined with transmitter identification and electron microscopy. J Neurosci Methods 103: 117-126. 35. Deller T, Drakew A, Frotscher M (1999a) Different primary target cells are important for fiber lamination in the fascia dentata: a lesson from reeler mutant mice. Exp Neurol 156: 239-253. 36. Deller T, Drakew A, Heimrich B, Forster E, Tielsch A, Frotscher M (1999b) The hippocampus of the reeler mutant mouse: fiber segregation in area CA1 depends on the position of the postsynaptic target cells. Exp Neurol 156: 254267. 37. Deller T (1998) The anatomical organization of the rat fascia dentata: new aspects of laminar organization as revealed by anterograde tracing with Phaseolus vulgaris-Luecoagglutinin (PHAL). Anat Embryol (Berl) 197: 89-103. 38. Deller T, Haas CA, Naumann T, Joester A, Faissner A, Frotscher M (1997) Up-regulation of astrocyte-derived tenascin-C correlates with neurite outgrowth in the rat dentate gyrus after unilateral entorhinal cortex lesion. Neuroscience 81: 829-846. 39. Deller T, Nitsch R, Frotscher M (1995) Phaseolus vulgaris-leucoagglutinin tracing of commissural fibers to the rat dentate gyrus: evidence for a previously unknown commissural projection to the outer molecular layer. J Comp Neurol 352: 55-68. 40. Deller T, Leranth C (1990) Synaptic connections of neuropeptide Y (NPY) immunoreactive neurons in the hilar area of the rat hippocampus. J Comp Neurol 300: 433-447. 41. DeSilva U, D'Arcangelo G, Braden VV, Chen J, Miao GG, Curran T, Green ED (1997) The human reelin gene: isolation, sequencing, and mapping on chromosome 7. Genome Res 7: 157-164. 55 42. Dolleman-Van der Weel MJ, Wouterlood FG, Witter MP (1994) Multiple anterograde tracing, combining Phaseolus vulgaris leucoagglutinin with rhodamine- and biotin-conjugated dextran amine. J Neurosci Methods 51: 921. 43. Drakew A, Frotscher M, Deller T, Ogawa M, Heimrich B (1998) Developmental distribution of a reeler gene-related antigen in the rat hippocampal formation visualized by CR-50 immunocytochemistry. Neuroscience 82: 1079-1086. 44. Dulabon L, Olson EC, Taglienti MG, Eisenhuth S, McGrath B, Walsh CA, Kreidberg JA, Anton ES (2000) Reelin binds alpha3beta1 integrin and inhibits neuronal migration. Neuron 27: 33-44. 45. Falconer DS (1951) Two new mutants, trembler and reeler with neurological actions in the house mouse.( m. musculus l. ). J Genet 50: 192-201. 46. Fink RP, Heimer L (1967) Two methods for selective silver impregnation of degenerating axons and their synaptic endings in the central nervous system. Brain Res 4: 369-374. 47. Flaherty L, Messer A, Russell LB, Rinchik EM (1992) Chlorambucil-induced mutations in mice recovered in homozygotes. Proc Natl Acad Sci U S A 89: 2859-2863. 48. Förster E, Zhao S, Frotscher M (2001) Hyaluronan-associated adhesive cues control fiber segregation in the hippocampus. Development 128: 3029-3039. 49. Franklin KB, Paxinos G (1997) The mouse brain in stereotaxic coordinates. New York: Academic Press. 50. Freund TF, Buzsàki G (1996) Interneurons of the hippocampus. Hippocampus 6: 345-470. 51. Frost DO, Edwards MA, Sachs GM, Caviness VS, Jr. (1986) Retinotectal projection in reeler mutant mice: relationships among axon trajectories, arborization patterns and cytoarchitecture. Brain Res 393: 109-120. 52. Frotscher M (1998) Cajal-Retzius cells, Reelin, and the formation of layers. Curr Opin Neurobiol 8: 570-575. 53. Frotscher M, Heimrich B, Deller T (1997) Sprouting in the hippocampus is layer-specific. Trends Neurosci 20: 218-223. 54. Frotscher M, Heimrich B, Deller T, Nitsch R (1995) Understanding the cortex through the hippocampus: lamina-specific connections of the rat hippocampal neurons. J Anat 187 ( Pt 3): 539-545. 55. Frotscher M (1992) Specificity of interneuronal connections. Anat Anz 174: 377-382. 56. Frotscher M (1991) Target cell specificity of synaptic connections in the hippocampus. Hippocampus 1: 123-130. 56 57. Frotscher M, Seress L, Schwerdtfeger WK, Buhl E (1991) The mossy cells of the fascia dentata: a comparative study of their fine structure and synaptic connections in rodents and primates. J Comp Neurol 312: 145-163. 58. Frotscher M, Kugler P, Misgeld U, Zilles K (1988) Neurotransmission in the hippocampus. Adv Anat Embryol Cell Biol 111: 1-103. 59. Frotscher M (1988) Neuronal elements in the hippocampus and their synaptic connections. Adv Anat Embryol 111: 2-17. 60. Frykman PK, Brown MS, Yamamoto T, Goldstein JL, Herz J (1995) Normal plasma lipoproteins and fertility in gene-targeted mice homozygous for a disruption in the gene encoding very low density lipoprotein receptor. Proc Natl Acad Sci U S A 92: 8453-8457. 61. Fujise N, Liu Y, Hori N, Kosaka T (1998) Distribution of calretinin immunoreactivity in the mouse dentate gyrus: II. mossy cells, with special reference to their dorsoventral difference in calretinin immunoreactivity. Neuroscience 82: 181-200. 62. Gähwiler BH, Capogna M, Dabanne D, McKinney RA, Thompson SM (1997) Organotypic slice cultures: a technique has come af age. Trends Neurosci 20: 471-477. 63. Gerfen CR, Sawchenko PE (1984) An anterograde neuroanatomical tracing method that shows the detailed morphology of neurons, their axons and terminals: immunohistochemical localization of an axonally transported plant lectin, phaseolus vulgaris leucoagglutinin ( PHAL ). Brain Res 290: 219-238. 64. Germroth P, Schwerdtfeger WK, Buhl EH (1991) Ultrastructure and aspects of functional organization of pyramidal and nonpyramidal entorhinal projection neurons contributing to the perforant path. J Comp Neurol 305: 215-231. 65. Germroth P, Schwerdtfeger WK, Buhl EH (1989) GABAergic neurons in the entorhinal cortex project to the hippocampus. Brain Res 494: 187-192. 66. Goffinet AM (1990) Cerebellar phenotype of two alleles of the 'reeler' mutation on similar backgrounds. Brain Res 519: 355-357. 67. Goffinet AM, So KF, Yamamoto M, Edwards M, Caviness VS, Jr. (1984) Architectonic and hodological organization of the cerebellum in reeler mutant mice. Brain Res 318: 263-276. 68. Goldschmidt RB, Steward O (1992) Fate of afferents to the dentate gyrus following destruction of granule cells with colchicine. Restor Neurol Neurosci 3: 321-334. 69. Golgi C (1879) Di una nuova reazione apparentemente nera delle cellule nervose cerebrali ottenuta col bicloruro di mercurio. Arch Sci Med 3: 1-7. 70. Goodman JH, Sloviter RS (1992) Evidence for commissurally projecting parvalbumin-immunoreactive basket cells in the dentate gyrus of the rat. Hippocampus 2: 13-22. 57 71. Guenet JL (1961) A new allele of reeler. Mouse News. 72. Heimrich B, Frotscher M (1993) Slice cultures as a model to study entorhinalhippocampal interaction. Hippocampus 3 Spec No: 11-17. 73. Herz J (2001) The LDL receptor gene family: (un)expected signal transducers in the brain. Neuron 29: 571-581. 74. Hiesberger T, Trommsdorff M, Howell BW, Goffinet AM, Mumby MC, Cooper JA, Herz J (1999) Direct binding of reelin to VLDL receptor and ApoE receptor 2 induces tyrosine phosphorylation of disabled-1 and modulates tau phosphorylation. Neuron 24: 481-489. 75. Hirotsune S, Takahare T, Sasaki N, Hirosè K, Yoshiki A, Ohashi T, Kusakabe M, Murakami Y, Muramatsu M, Watanabe S, Nakao K, Katsuki M, Hayashizaki Y (1995) The reeler gene encodes a protein with an EGF-like motif expressed by pioneer neurons. Nat Genet 10: 77-83. 76. Howell BW, Herrick TM, Cooper JA (1999) Reelin-induced tryosine phosphorylation of disabled 1 during neuronal positioning. Genes Dev 13: 643-648. 77. Howell BW, Hawkes R, Soriano P, Cooper JA (1997) Neuronal position in the developing brain is regulated by mouse disabled-1. Nature 389: 733-737. 78. Hsu SM, Raine L, Fanger H (1981) Use of avidin-biotin-peroxidase complex (ABC) in immunoperoxidase techniques: a comparison between ABC and unlabeled antibody (PAP) procedures. J Histochem Cytochem 29: 577-580. 79. Keshvara L, Benhayon D, Magdaleno S, Curran T (2001) Identification of reelin-induced sites of Tyrosyl phosphorylation on disabled 1. J Biol Chem 276: 16008-16014. 80. Kosaka T, Wu JY, Benoit R (1988) GABAergic neurons containing somatostatin-like immunoreactivity in the rat hippocampus and dentate gyrus. Exp Brain Res 71: 388-398. 81. Köhler C (1985) A projection from the deep layers of the entorhinal area to the hippocampal formation in the rat. Neuroscience Letters 56: 13-19. 82. Kristensson K, Olsson Y (1971) Retrograde axonal transport of protein. Brain Res 29: 363-365. 83. Lambert dR, Goffinet AM (1998) The reeler mouse as a model of brain development. Adv Anat Embryol Cell Biol 150: 1-106. 84. Laurberg S, Hjorth-Simonsen A (1977) Growing central axons deprived of normal target neurones by neonatal X-ray irradiation still terminate in a precisly laminated fashion. Nature 269: 158-160. 85. Leavitt RD, Felsted RL, Bachur NR (1977) Biological and biochemical properties of Phaseolus vulgaris isolectins. J Biol Chem 252: 2961-2966. 58 86. Legendre DI, Vietje BP, Wells J (1994) Traumatic lesions and transplants of granule cells in the dentate gyrus alter the distribution of afferent fibers in the molecular layer. J Neurotraum 11: 333-344. 87. Leranth C, Frotscher M (1987) Cholinergic innervation of hippocampal GADand somatostatin-immunoreactive commissural neurons. J Comp Neurol 261: 33-47. 88. Liu Y, Fujise N, Kosaka T (1996) Distribution of calretinin immunoreactivity in the mouse dentate gyrus.I. general description. Exp Brain Res 108: 389-403. 89. Marin-Padilla M (1998) Cajal-retzius cells and the development of the neocortex. Trends Neurosci 21: 64-71. 90. Miao GG, Smeyne RJ, D'Arcangelo G, Copeland NG, Jenkins NA, Morgan JI, Curran T (1994) Isolation of an allele of reeler by insertional mutagenesis. Proc Natl Acad Sci U S A 91: 11050-11054. 91. Mullen RJ, Buck CR, Smith AM (1992) NeuN, a neuronal specific nuclear protein in vertebrates. Development 116: 201-211. 92. Ogawa M, Miyata T, Nakajima K, Yagyu K, Seike M, Ikenaka K, Yamamoto H, Mikoshiba K (1995) The reeler gene-associated antigen on Cajal-Retzius neurons is a crucial molecule for laminar organization of cortical neurons. Neuron 14: 899-912. 93. Ohshima T, Ward JM, Huh CG, Longenecker G, Veeranna, Pant HC, Brady RO, Martin LJ, Kulkarni AB (1996) Targeted disruption of the cyclin-dependent kinase 5 gene results in abnormal corticogenesis, neuronal pathology and perinatal death. Proc Natl Acad Sci U S A 93: 11173-11178. 94. Pare D, Smith Y, Pare JF (1995) Intra-amygdaloid projections of the basolateral and basomedial nuclei in the cat: Phaseolus vulgarisleucoagglutinin anterograde tracing at the light and electron microscopic level. Neuroscience 69: 567-583. 95. Pinault D (1996) A novel single-cell staining procedure perfomed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or neurobiotin. J Neurosci Methods 65: 113-136. 96. Pleasure SJ, Anderson S, Hevner R, Bagri A, Marin O, Lowenstein DH, Rubenstein JL (2000) Cell migration from the ganglionic eminences is required for the development of hippocampal GABAergic interneurons. Neuron 28: 727740. 97. Rakic P, Caviness VSJ (1995) Cortical development: view from neurological mutants two decades later. Neuron 14: 1101-1104. 98. Rice DS, Curran T (1999) Mutant mice with scrambled brains: understanding the signaling pathways that control cell positioning in the CNS. Genes Dev 13: 2758-2773. 59 99. Ruth RE, Collier TJ, Routtenberg A (1988) Topography between the entorhinal cortex and the dentate septotemporal axis in rats.II. cells projecting from lateral entorhinal subdivisions. J Comp Neurol 270: 506-516. 100. Ruth RE, Collier TJ, Routtenberg A (1982) Topography between the entorhinal cortex and the dentate septotemporal axis in rats.I. medial and intermediate entorhinal projecting cells. J Comp Neurol 209: 69-78. 101. Scharfman HE (1995) Electrophysiological evidence that dentate hilar mossy cells are excitatory and innervate both granule cells and interneurons. J Neurophys 74: 179-194. 102. Schwab MH, Bartholomae A, Heimrich B, Feldmeyer D, Druffel-Augustin S, Goebbels S, Naya FJ, Zhao S, Frotscher M, Tsai MJ, Nave KA (2000) Neuronal basic helix-loop-helix proteins (NEX and BETA2/Neuro D) regulate terminal granule cell differentiation in the hippocampus. J Neurosci 20: 37143724. 103. Sheldon M, Rice DS, d`Arcangelo G, Yoneshima H, Nakajima K, Mikoshiba K, Howell BW, Cooper JA, Goldowitz D, Curran T (1997) Scrambler and yotari disrupt the disabled gene and produce a reeler-like phenotype in mice. Nature 389: 730-733. 104. Skutella T, Nitsch R (2001) New molecules for hippocampal development. Trends Neurosci 24: 107-113. 105. Sloviter RS (1989a) Calcium-binding protein (calbindin-D28k) and parvalbumin immunocytochemistry: localization in the rat hippocampus with specific reference to the selective vulnerability of hippocampal neurons to seizure activity. J Comp Neurol 280: 183-196. 106. Sloviter RS (1989b) Chemically defined hippocampal interneurons and their possible relationship to seizure mechanismus. Hippocampus 443-461. 107. Sloviter RS, Nilaver G (1987) Immunocytochemical localization of GABA-, choleystokinin, vasoactive intestinal polypeptide, and somatostatin-like immunoreactivity in the area dentata and hippocampus of the rat. J Comp Neurol 256: 42-60. 108. Soriano E, Del Rio JA, Martinez A, Super H (1994) Organization of the embryonic and early postnatal murine hippocampus.I. immunocytochemical characterization of neuronal populations in the subplate and marginal zone. J Comp Neurol 342: 571-595. 109. Soriano E, Frotscher M (1994) Mossy cells of the rat fascia dentata are glutamate-immunoreactive. Hippocampus 4: 65-69. 110. Stanfield BB, Caviness VSJ, Cowan WM (1979) The organization of certain afferents to the hippocampus and dentate gyrus in normal and reeler mice. J Comp Neurol 185: 461-483. 111. Stanfield BB, Cowan WM (1979a) The development of the hippocampus and dentate gyrus in normal and reeler mice. J Comp Neurol 185: 423-460. 60 112. Stanfield BB, Cowan WM (1979b) The morphology of the hippocampus and dentate gyrus in normal and reeler mice. J Comp Neurol 185: 393-422. 113. Stein E, Savaskan NE, Ninnemann O, Nitsch R, Zhou R, Skutella T (1999) A role for the Eph ligand ephrin-A3 in entorhino-hippocampal axon targeting. J Neurosci 19: 8885-8893. 114. Steward O, Scoville SA (1976) Cells of origin of entorhinal cortical afferents to the hippocampus and fascia dentata of the rat. J Comp Neurol 169: 347-370. 115. Stirling RV, Bliss TVP (1978) Observations on the commissural projection to the dentate gyrus in the reeler mutant mouse. Brain Res 150: 447-465. 116. Supèr H, Martinez A, Del Rio JA, Soriano E (1998) Involvement of distinct pioneer neurons in the formation of layer-specific connections in the hippocampus. J Neurosci 18: 4616-4626. 117. Tonder N, Sorensen T, Zimmer J (1989) Enhanced host perforant path innervation of neonatal dentate tissue after grafting to axon sparing, ibotenic lesions in adult rats. Exp Brain Res 75: 483-496. 118. Trommsdorff M, Gotthardt M, Hiesberger T, Shelton J, Stockinger W, Nimpf J, Hammer RE, Richardson JE, Herz J (1999) Reeler/disabled-like disruption of neuronal migration in knockout mice lacking the VLDL receptor and ApoE receptor 2. Cell 97: 689-701. 119. Vercelli A, Repici M, Garbossa D, Grimaldi A (2000) Recent techniques for tracing pathways in the central nervous system of developing and adult mammals. Brain Res Bull 51: 11-28. 120. VonHaebler D, Stabel J, Draguhn A, Heinemann U (1993) Properties of horizontal cells transiently appearing in the rat dentate gyrus during ontogenesis. Exp Brain Res 94: 33-42. 121. Walsh CA (1999) Genetic malformations of the human cerebral cortex. Neuron 23: 19-29. 122. Ware ML, Fox JW, Gonzalez JL, Davis NM, Lambert dR, Russo CJ, Chua SC, Jr., Goffinet AM, Walsh CA (1997) Aberrant splicing of a mouse disabled homolog, mdab1, in the scrambler mouse. Neuron 19: 239-249. 123. Weber TH, Aro H, Nordman CT (1972) Characterization of lymphocytestimulating blood cell-agglutinating glycoproteins from red kidney beans (Phaseolus vulgaris). Biochim Biophys Acta 263: 94-105. 124. Wouterlood FG, Goede PH, Groenewegen HJ (1990) The in situ detectability of the neuroanatomical tracer Phaseolus vulgaris-leucoagglutinin (PHA-L). J Chem Neuroanat 3: 11-18. 125. Zappone CA, Sloviter RS (2001) Commissurally projecting inhibitory interneurons of the rat hippocampal dentate gyrus: a colocalization study of neuronal markers and the retrograde tracer Fluoro-gold. J Comp Neurol 441: 324-344. 61 126. Zimmer J, Laurberg S, Sunde N (1986) Non-cholinergic afferents determine the distribution of the cholinergic septohippocampal projection: a study of the AChE staining pattern in the rat fascia dentata and hippocampus after lesions, x-irradiation, and intracerebral grafting. Exp Brain Res 64: 158-168. 62 Danksagung Mein besonderer Dank gilt meinem Doktorvater, Herrn Prof. Dr. med. Thomas Deller, für die stets herzliche und freundliche Unterstützung sowie die Überlassung des Themas. Ohne sein Engagement und die gern und oft gewährte Hilfe wäre diese Arbeit nicht möglich gewesen. Ebenso möchte ich Herrn Prof. Dr. med. Michael Frotscher für seinen Rat und seine oft strapazierte Geduld danken. Bei Herrn Prof. Dr. med. Stefan Pollak möchte ich mich für die Korrektur und Begutachtung meiner Arbeit bedanken. Für viele freundliche und geduldige Ratschläge sowie das Nahebringen neuer Techniken danke ich Herrn Dipl. Biol. Domenico Del Turco und Herrn Tobias Merten. Für viele Ratschläge, Organisationstalent und Hilfe bei der Zucht der Mausmutanten möchte ich den Herren Dr. med. Alexander Drakew und Dipl. Chem. Albrecht Tielsch danken. Ganz besonders bedanke ich mich bei Herrn Andreas Haaf und Frau Anikó Schneider für die exzellente und ausdauernde technische Beratung und Unterstützung. 63 Lebenslauf • Geboren am 15.10.1975 in Ulm; Eltern: MUDr Eva Gebhardt und Dr. med. Klaus Gebhardt • 1981-1995 Schullaufbahn in Göppingen • 1995 Abitur • 1995-1996 Zivildienst im St. Josephskrankenhaus in Freiburg • 1996 Beginn des Medizinstudiums in Freiburg • 1998 Ärztliche Vorprüfung • 1998 Beginn der Doktorarbeit im Anatomischen Institut I (Direktor: Prof. Dr. med. M. Frotscher), in der Arbeitsgruppe von Herrn PD Dr. med. T. Deller • 1999 1.Staatsexamen • 2000 Aufnahme in die Studienstiftung des deutschen Volkes • 2001 6-monatige Forschungstätigkeit in Frankfurt/Main. Dort Abschluss der experimentellen Arbeiten. • 2002 2.Staatsexamen Freiburg, den 18.5.2003 64 Schriftenverzeichnis • 25.3.2002: Vortrag im Rahmen der 97. Versammlung der Anatomischen Gesellschaft in Halle / Saale: C. Gebhardt, D. Del Turco, A. Drakew, A. Tielsch, J. Herz, M. Frotscher, and T. Deller, Frankfurt/M, Freiburg, and Dallas, Texas, USA “Malpositioning of granule cells alters the laminar organization of afferents to the mouse fascia dentata: Morphological evidence from reeler, apoE receptor 2, and VLDL receptor knockout mice”. • Gebhardt C, Del Turco D, Drakew A, Tielsch A, Herz J, Frotscher M, and Deller T (2002) Abnormal positioning of granule cells alters afferent fiber distribution in the mouse fascia dentata: morphologic evidence from reeler, apolipoprotein E receptor 2-, and very low density lipoprotein receptor knockout mice. J Comp Neurol, 445: 278-292 • Drakew A, Deller T, Heimrich B, Gebhardt C, Del Turco D, Tielsch A, Forster E, Herz J, and Frotscher M (2002) Dentate granule cells in reeler mutants and VLDLR and ApoER2 knockout mice. Exp Neurol, 176: 12-24 • Deller T, Haas CA, Deissenrieder K, Del Turco D, Coulin C, Gebhardt C, Drakew A, Schwarz K, Mundel P, and Frotscher M (2002) Laminar distribution of synaptopodin in normal and reeler mouse brain depends on the position of spine-bearing neurons. J Comp Neurol, 453: 33-44 • D. Del Turco, C. Gebhardt, A. G. Woods, J. P. Kapfhammer, T. Naumann, M. Frotscher, P. Caroni, and T. Deller (2001) Overexpression of the growth associated protein CAP-23 results in translaminar commissural sprouting in the hippocampus after entorhinal cortex lesion in adult mice. Soc. Neurosci. Abstr. 27:698.12 • D. Del Turco, C. Gebhardt, A. G. Woods, J. P. Kapfhammer, M. Frotscher, P. Caroni, and T. Deller (2001) Mice overexpressing the growth associated protein CAP23 show translaminar commissural sprouting in the hippocampus after entorhinal cortex lesion. Acta Neuropathol. 102:523 • T. Deller, C. Gebhardt, C. Coulin, P. Mundel und M. Frotscher (2000) Das aktin-assoziierte Protein Synaptopodin im Gehirn der normalen und der Reeler-Maus: Lokalisation im Dornhals und Assoziation mit dem Dornapparat von Prinzipalzellen. Ann. Anat. 183, S. 226