3. Struktur und Geometrie von Komplexverbindungen
Werbung

3. Struktur und Geometrie von
Komplexverbindungen
Koordinationszahl (KOZ, CN): Zahl der vom
Zentralatom gebundenen Ligandenatome.
Koordinationspolyeder: geometrische Figur, die die
Ligandenatome um das Zentralatom bilden
niedrigste CN 2, höchste CN 9 (12),
wichtigste CN 6 (4)
3. Struktur und Geometrie von
Komplexverbindungen
CN wird bestimmt durch:
die Größe des Zentralatoms
sterische Wechselwirkungen zwischen den Liganden
(Größe der Liganden ); sterisch anspruchsvolle Liganden
begünstigen kleine Koordinationszahlen
elektronische Wechselwirkungen zwischen Zentralatom
und
Ligand
(Hybridisierungsmöglichkeiten
am
Zentralatom, LFSE-Ligandenfeldstabilisierung); höhere
CN bei frühen und niedere CN bei späten ÜM
Radienverhältnisse
CN
Kleinstes Radienverhältnis
Metallion/Donoratom
Koordinationspolyeder
4
0.225
Tetraeder
6
0.414
0.528
Oktaeder
Trigonales Prisma
7
0.592
Oktaeder mit einem siebenten
Liganden über einer Fläche
8
0.645
0.668
0.732
Quadratisches Antiprisma
Dodekaeder (Bisdisphenoid)
Würfel
9
0.732
Trigonales Prisma mit je einem
Liganden über den drei
Prismenflächen
10
0.902
1.000
Ikosaeder
Kuboktaeder
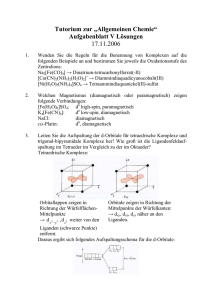
CN2:
selten; nur mit den einwertigen Metallionen der ersten Nebengruppe
und HgII (d10) oder mit sperrigen Liganden
Komplexe sind weitgehend linear gebaut
können mit weiteren Liganden reagieren und dabei höher
koordinierte Komplexe bilden: [Ag( NH 3 ) 2 ] + + 2 NH 3 → [Ag( NH 3 ) 4 ] +
H3N─Ag─ NH3
[Ag(NH3)2]+
Cl─Cu─Cl
[CuCl2]-
NC─Au─CN
[Au(CN)2]-
Me3P─Au─PMe3
[Au(PMe3)2]+
[Mn{N(SiMePh2)2}2]
[Pd{P(NC12H8)3}2]
Bis{di(methyldiphenylsilyl)amido}mangan(II)
Bis{tris(carbazolyl)phosphan}palladium(O)
Für die Koordinationszahl 2 erwartet man eine lineare
Geometrie, einfach auf der Grundlage elektrostatischer
Abstoßung der Liganden oder der Valenzelektronen (es gibt
jedoch Ausnahmen). Bei linearer Geometrie kann man dem
Metall die Verwendung von sp-Hybridorbitalen zuschreiben.
Wenn die Energie dieser ns- und np-Orbitale aber ähnlich der
der (n-1) d-Orbitale ist, kann sich das d z 2 -Orbital an der
Hybridisierung beteiligen und damit Elektronendichte von
dem Liganden abziehen.
Schematische Darstellung der Hybridorbitale aus einer besetzten 3 d z 2
und einer freien 4s-Bahnfunktion, und der Kombinationen ψ3 und ψ4,
die aus ψ2 und einer freien 4pz-Funktion gebildet werden können. In
jeder Darstellung ist die z-Achse senkrecht, und die tatsächliche
Bahnfunktion ist durch die Drehung obiger Darstellung um die z-Achse
erzeugte Figur charakterisiert:
CN3:
selten; nur mit sperrigen Liganden oder mit Metallzentren hoher
Elektronenzahl
Struktur trigonal planar, sp2- oder sd2-Hybridorbitale
Tris(trimethylthiophosphoran)kupfer(I)
[Cu(SPMe3)3]+
Chem. Commun. 1971, 105.
Tris(t-buthylthiolato)mercurat(II)
[Hg(StBu)3]J. Am. Chem. Soc. 1990, 119, 2824.
CN4:
Die Koordinationszahl 4 tritt häufig auf. Eine tetraedrische und eine
quadratisch planare Koordinationsgeometrie sind möglich.
Die tetraedrische Anordnung ist sterisch begünstigter als die
quadratisch planare (geringere elektrostatische Abstoßung zwischen
geladenen Liganden und van-der-Waals-Abstoßung zwischen großen
Liganden).
Aus der Ligandenfeld- und Molekülorbital-Theorie ergibt sich, dass
tetraedrische Strukturen im allgemeinen nicht durch große
Ligandenfeldstabilisierungsenergien (LFSE) begünstigt werden.
Tetraedrische Komplexe werden bevorzugt gebildet, wenn folgende
Bedingungen vorliegen:
Große Liganden (wie Cl-, Br- oder I-) und kleine Metallionen
CN4:
Bei diesen sind drei verschiedene Arten zu unterscheiden:
(1) Ionen mit Edelgaskonfiguration etwa Be2+ (ns0);
(2) Ionen mit Pseudo-Edelgaskonfiguration, etwa Zn2+ oder Ga3+ [(n-1)
d10 ns0 np0];
(3) Ionen von Übergangsmetallen, die nicht in der Lage sind, über
Ligandenfeld-Stabilisierungsenergien andere Strukturen zu
begünstigen, etwa Co2+ (d7)
[NiIICl4]2Tetrachloronickelat
[Zn(NH3)2]2+
Tetraamminzink(II)
Ni(CO)4
Tetracarbonylnickel(0)
[CuBr4]2Tetrabromocuprat(II)
[Co(NCS)4]2Tetraisothiocynatocobaltat(II)
Quadratisch-planare Komplexe sind sterisch ungünstiger als
tetraedrische. Große Liganden verhindern durch ihren
Raumbedarf die Entstehung dieser Geometrie.
Quadratisch-planare Komplexe werden nur von wenigen
Metallionen gebildet. Die bekanntesten sind die d8-Ionen Ni2+,
Pd2+, Pt2+ und Au3+. Auch vom Cu2+ (d9), Co2+ (d7), Cr2+ (d4)
und selbst vom Co3+ (d6) gibt es einige planar-quadratische
Komplexe, aber dies sind eher Ausnahmen. Die
Voraussetzung für die Stabilität dieser planar-quadratischen
Komplexe ist das Vorhandensein starker, nicht zu sperriger
Liganden, die eine ausreichend starke π-Bindung zum Metall
eingehen. Ni2+ bildet beispielsweise mit Cyanidionen einen
planar-quadratischen Komplex, während mit Ammoniak und
Wasser oktaedrische und mit Chlorid, Bromid und Iodid
tetraedrische Komplexe entstehen.
Bei den großen 4d und 5d-Metallionen sind die sterischen
Anordnungen nicht mehr so ausgeprägt und außerdem ist die
effektive Feldstärke für alle Liganden größer. Unter diesen
Bedingungen sind sogar die Anionen Tetrachloropalladat(II),
Tetrachloroplatinat(II) und Tetrachloroaurat(III) quadratisch
planar.
z.B. [AuCl4]-, [Ni(CN)4]-, [PtCl4]2-, [PtCl2(NH3)2], [Pt(NH3)4]2+
[PtCl4]2Tetrachloroplatinat(II)
[Pt(NH3)4]2+
Tetraamminplatin(II)
cis-[PtCl2(NH3)2]
cis-Diammindichloroplatin(II)
[Cd(OAr)2(THF)2]2+
Bis[2,6-di-(tert-butyl)phenoxido]-bis(tetrahydrofuran)cadmium(II)
J. Am. Chem. Soc. 1990, 112.
[AuCl4]Tetrachloroaurat(III)
CN5:
Die Koordinationszahl 5 ist weniger häufig als 4, aber doch bedeutend.
Allgemein ist die Stabilität von fünffach koordinierten Komplexen
nicht sehr groß. Sie dismutieren leicht in vier- und sechsfach
koordinierte Komplexe.
Liegen tatsächlich monomere Komplexe vor, gibt es zwei reguläre
Strukturtypen, die trigonale Bipyramide und die quadratische
Pyramide. Man beobachtet jedoch viele Molekülgeometrien, die sich,
durch mehr oder weniger starke Verzerrung, als eine der beiden
Idealgeometrien verstehen lassen.
[Cu(Cl)5]3Pentachlorocuprat(II)
Inorg. Chem. 1968, 7, 1111.
[Ni(CN)5]3Pentacyanonickelat(II)
Inorg. Chem. 1968, 7, 1362.
[CoBr(Me6tren)]Br
Bromotris(2-dimethylaminoethyl)amincobalt(II)-bromid
Inorg. Chem. 1967, 6, 955.
[VO(acac)2]
Bis(acetylacetonato)oxovanadium(IV)
Berry-Pseudorotation
Da beide Grenzstrukturen der CN5 (trigonale Bipyramide und
tetragonale Pyramide) fast die gleiche Energie besitzen, können sie sich
über eine Pseudorotation (Berry-Mechanismus) in Lösung rasch
ineinander umwandeln.
trigonale Bipyramide
quadratische Pyramide
trigonale Bipyramide
CN6:
Die Koordinationszahl 6 ist die häufigste Koordinationszahl für die
d-Block Metalle. Mit bestimmten Ionen wie z. B. CrIII und CoIII
werden fast ausschließlich sechsfach koordinierte Komplexe gebildet.
mögliche geometrische Anordnungen:
Oktaeder (Symmetrie Oh) trigonales Prisma trigonales Antiprisma
Das trigonale Antiprisma ist dabei eine trigonale Verzerrung des
Oktaeders, d.h. die Metall-Ligand-Abstände werden entlang einer der
dreizähligen Achsen gestaucht oder gestreckt.
Trigonal, Oh
D3h
Tetragonale Verzerrung (Streckung und Stauchung)
Tetragonal, Oh
D4h
trigonales Prisma:
[Re(S2C2Ph2)3]
Tris(cis-1,2-diphenylethen-1,2-dithiolato)rhenium(VI)
J. Am. Chem. Soc. 1965, 87, 3776.
Inorg. Chem. 1966, 5, 411.
[W(CH3)6]
Science 1996, 271, 626.
CN7:
Die Koordinationsgeometrie ist selten für 3d Metalle, häufiger für 4d
und 5d Metalle und relativ instabil (Abstoßung der Liganden,
allgemein reduzierte Ligandenfeld-Stabilisierungsenergie).
mögliche geometrische Anordnungen:
Pentagonale Bipyramide
überkapptes Oktaeder überkapptes trigonales
Prisma
pentagonal bipyramidal:
J. Am. Chem. Soc. 1967, 89, 720.
überkappt trigonal prismatisch:
[NbF7]2Heptafluoroniobat(V)
J. Am. Chem. Soc. 1939, 61, 1252.
überkappt oktaedrisch:
Aquatris(1,3-diphenyl-1,3-dionatopropan)holmium(III)
Inorg. Chem. 1969, 8, 2680.
CN8:
Die Koordinationszahl 8 kommt nach 6 und 4 am häufigsten vor. Sie
tritt meist bei großen Metallatomen (Metalle der zweiten und dritten
Übergangsreihe, der Lanthanoiden und Actinoiden in höheren
Oxidationszuständen; Zr, Hf, Nb, Ta, Mo, W) und mit kleinen
(elektronegativen) Liganden (F, N, O, C) auf.
Die typischen Koodinationspolyeder sind:
Würfel
quadratisches Antiprisma trigonales Dodekaeder
Quadratisches Antiprisma:
[Zr(ox)4]
Trigonales Dodekaeder:
[Mo(CN)8]3-
Würfel:
CsCl
[U(NCS)8]4-
S1
S2
S3
S4
Ag
S3’
S1’
S2’
S4’
Holdt et al. Eur. J. Inorg. Chem. 2006, 12, 2377-2384.
CN9:
Die Koordinationszahl 9 tritt für große f-Block Elemente oder für
Übergangsmetalle mit sehr kleinen Liganden auf.
Es sind zwei Koordinationspolyeder bekannt:
[ReH9]2Nonahydridorhenat(VII)
Inorg. Chem. 1964, 3, 558.
dreifach überkapptes trigonales Prisma
Koordinationsgeometrie um
das Lanthanoid-Ion
{Ln[N(CH2CH2OH)3]2}3+ · THF
[Ln(triethanolamin)2(THF)]3+
Chem. Ber. 1990, 123, 481.
überkapptes quadratisches Antiprisma
CN>9:
Koordinationszahlen >9 sind für einzähnige Liganden nicht bekannt.
Zum Aufbau derartiger Koordinationspolyeder werden große,
hochgeladene Metallionen und bidentate Liganden mit kleinem "bite
angle" benötigt.
CN10:
CN12:
Pentanitratocerat(III)-Anion
(PPh3Et)2[CeIII(NO3)5]
J. Chem. Soc. Chem. Comm. 1970, 135.
Hexanitratocerat(II)-Anion
(NH4)2[CeIV(NO3)6]
Inorg. Chem. 1968, 7, 715.
Realisierung niedriger Koordinationszahlen:
Weiche Liganden und Metalle in niedrigen Oxidationszahlen (πRückbindungen)
große sperrige Liganden
Gegenionen geringer Basizität (CF3SO3-, BF4-, PF6-)
Realisierung hoher Koordinationszahlen:
Zentralatom mit hoher Oxidationsstufe
harte Liganden (F, O, N...), geringer Raumbedarf
große nicht-acide Kationen [As(Ph4)]+